Журнал «Боль. Суставы. Позвоночник» Том 11, №1, 2021
Вернуться к номеру
Ревматическая полимиалгия в клинических рекомендациях 2018–2020 гг. Часть II: диагностика васкулита
Авторы: Пузанова О.Г.(1), Лызиков А.А.(2)
(1) — ЧВУЗ «Киевский медицинский университет», г. Киев, Украина
(2) — УО «Гомельский государственный медицинский университет», г. Гомель, Республика Беларусь
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Вдосконалення діагностики ревматичних хвороб у літніх людей та хвороб аорти — актуальні завдання медицини. У патогенезі аневризм, розшарувань, розривів аорти значущими є запалення та структурні зміни її стінки, для виявлення яких застосовують візуалізуючі методи. Веденню ревматичної поліміалгії, гігантоклітинного артеріїту, аневризм аорти присвячено низку міжнародних настанов. З аортитом пов’язано до 40 % випадків ревматичної поліміалгії. Клінічна підозра на нього виникає за виявлення асиметрії артеріального тиску й пульсу, шуму аортальної регургітації, судинних шумів, персистенції ревматичної поліміалгії, запального болю у спині, ділянці тазу, нижніх кінцівках. У 2020 році саме позитронно-емісійна томографія/комп’ютерна томографія схвалені Італійським товариством ревматологів для діагностики васкуліту при ревматичній поліміалгії на етапі вторинної допомоги та Європейською федерацією головного болю для діагностики великосудинного гігантоклітинного артеріїту в неврологічній практиці. Наведено огляд настанови Європейської асоціації ядерної медицини, Товариства ядерної медицини і молекулярної візуалізації та Американського товариства ядерної кардіології щодо використання позитронно-емісійної томографії з фтордеоксиглюкозою в поєднанні з комп’ютерною томографією (ангіографією) при васкулітах великих судин і ревматичній поліміалгії (2018). Її співставлено з клінічними настановами, іншими настановами товариств ядерної медицини й новими науковими даними. Описано процедуру дослідження та підготовку до неї. Розглянуто критерії оцінки васкуліту, запропоновані для клінічної практики та клінічних досліджень, а також чинники, що впливають на результати тесту та їх інтерпретацію (атеросклероз, діабет, вік, індекс маси тіла, рівні глікемії та маркерів гострої фази). У настанові обґрунтовано користь застосування позитронно-емісійної томографії та її поєднання з комп’ютерною томографією для виявлення екстракраніального васкуліту, а також цінність комп’ютерної томографії-ангіографії на різних стадіях хвороби. Слід зміцнити доказову базу стандарту часу експозиції фтордеоксиглюкози та користі поєднання позитронно-емісійної томографії з комп’ютерною томографією-ангіографією, зокрема для виявлення рецидивів васкуліту та моніторингу терапії. Необхідні консенсус щодо раннього виконання тесту, стандартизація оцінок його результатів, забезпечення реімбурсації, впровадження нових методик візуалізації судин черепа. У перспективі доказовий підхід до ведення васкуліту доповнить терагностика.
Совершенствование диагностики ревматических болезней пожилых людей и заболеваний аорты — актуальные задачи медицины. В патогенезе аневризм, расслоений, разрывов аорты важна роль воспаления и структурных изменений ее стенки, которые выявляют с помощью визуализирующих методов. Ведению ревматической полимиалгии, гигантоклеточного артериита, аневризм аорты посвящен ряд международных рекомендаций. С аортитом сопряжено до 40 % случаев ревматической полимиалгии. Клиническое подозрение на него основано на выявлении асимметрии артериального давления и пульса, шума аортальной регургитации, сосудистых шумов, персистенции ревматической полимиалгии, воспалительной боли в спине, области таза и нижних конечностях. В 2020 году именно позитронно-эмиссионная томография/компьютерная томография рекомендована Итальянским обществом ревматологов для диагностики васкулита при ревматической полимиалгии во вторичном звене и Европейской федерацией головной боли для диагностики крупнососудистого гигантоклеточного артериита в неврологической практике. Приведен обзор рекомендаций Европейской ассоциации ядерной медицины, Общества ядерной медицины и молекулярной визуализации и Американского общества ядерной кардиологии по применению позитронно-эмиссионной томографии с фтордеоксиглюкозой в сочетании с компьютерной томографией (ангиографией) при васкулитах крупных сосудов и ревматической полимиалгии (2018). Они сопоставлены с клиническими руководствами, другими рекомендациями обществ ядерной медицины и новыми научными данными. Описана процедура исследования и подготовка к нему. Рассмотрены критерии оценки васкулита, предложенные для клинической практики и для клинических исследований, а также факторы, влияющие на результаты теста и их интерпретацию (атеросклероз, диабет, возраст, индекс массы тела, уровни гликемии и маркеров острой фазы). В рекомендациях обоснована польза применения позитронно-эмиссионной томографии и ее сочетания с компьютерной томографией для выявления экстракраниального васкулита и ценность компьютерной томографии-ангиографии на разных стадиях болезни. Требует усиления доказательная база стандарта времени экспозиции фтордеоксиглюкозы и пользы сочетания позитронной эмиссионной томографии с компьютерной томографией-ангиографией, в том числе для выявления рецидивов васкулита и мониторинга терапии. Необходим консенсус по раннему выполнению исследования, стандартизация оценок его результатов, обеспечение реимбурсации, внедрение новых методик визуализации сосудов черепа. В перспективе доказательный подход к ведению васкулита дополнит терагностика.
The issue of improved diagnosis of both rheumatic diseases of the elderly and aortic diseases does not lose its relevance. In terms of aortic aneurysms, dissection and ruptures and their attended pathogenesis, both inflammation and structural wall damages may be detected with imaging methods whose role is vital. A number of international guidelines deal with the management of polymyalgia rheumatica, giant cell arteritis, or aortic aneurysms. Aortitis is associated with up to 40 % of polymyalgia rheumatica’s cases. The clinical suspicion of aortitis is based on the detection of blood pressure and pulse asymmetry, aortic regurgitation murmur, vascular bruits, as well as persistent polymyalgia rheumatica or inflammatory dorsalgia, pelvis or leg pain. In 2020, the positron emission tomography/computed tomography’s use is approved by the Italian Society for Rheumatology for the diagnosis of vasculitis attended by polymyalgia rheumatica at the secondary healthcare level and by the European Headache Federation for the diagnosis of large vessel giant cell arteritis in the neurological practice. A review of the guideline by the European Association of Nuclear Medicine, the Society of Nuclear Medicine and Molecular Imaging, and the American Society of Nuclear Cardiology (2018) was performed in terms of positron emission tomography with fluorodesoxyglucose combined with computed tomography (angiography) imaging in large vessel vasculitis and polymyalgia rheumatica. It is further compared with the clinical guidelines, other guidelines by the societies of nuclear medicine and new scientific data. Both procedure and patient’s preparation for examination are decribed. The criteria for assessing vasculitis proposed for either clinical practice or clinical studies are considered, as well as the factors influencing the test results and their interpretation (such as atherosclerosis, diabetes, age, body mass index, glucemia’s and acute phase markers’ levels). The guideline substantiates the benefit of both positron emission tomography’s use and its combination with computed tomography to detect extracranial vasculitis, as well as the value of performing computed tomography-angiography at different stages of the disease. There is a need to strengthen evidence on both standard time of fluorodesoxyglucose exposure and the benefit of combining positron emission tomography with computed tomography-angiography, in particular for detection of vasculitis relapses. Finding a consensus for early test’s performing is needed, as well as its score standardization, ensuring reimbursement and implementation of new imaging techniques for the cranial vessels. In the future, the evidence-based approach to managing vasculitis will be supplemented by teranostics.
ревматична поліміалгія; гігантоклітинний артеріїт; аортит; візуалізуюча діагностика; стандарти; огляд
ревматическая полимиалгия; гигантоклеточный артериит; аортит; визуализирующая диагностика; стандарты; обзор
polymyalgia rheumatica; giant-cell arteritis; aortitis; imaging diagnostics; standards; review
Введение
Современные рекомендации, посвященные РП, ГКА и болезням аорты
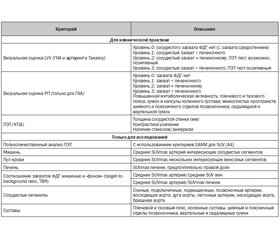
Рекомендации EANM/SNMMI/PIG/ASNC (2018) по применению ФДГ-ПЭТ/КТ(A) при васкулитах крупных сосудов и РП
Заключение
- Bunchuk N.V. Revmaticheskije zabolevaniya pozhilyih (Izbrannyie) [Rheumatic diseases of the elderly (Selected)]. Moscow: MEDpress-inform, 2010. 272 p. (in Russian).
- Mansalis K. Myalgias and Myopathies: Polymyalgia rheumatica and Giant Cell Arteritis. FP Essent. 2016. 440. 16-22. PMID: 26734832.
- Pioro M.H. Primary Care Vasculitis: Polymyalgia rheumatica and Giant Cell Arteritis. Prim. Care. 2018. 45 (2). 305-323. doi: 10.1016/j.pop.2018.02.007.
- Matteson E.L., Buttgereit F., Dejaco C., Dasgupta B. Glucocorticoids for Management of Polymyalgia Rheumatica and Giant Cell Arteritis. Rheum. Dis. Clin. North. Am. 2016. 42 (1). 75-90. doi: 10.1016/j.rdc.2015.08.009.
- Hellmich B. Management of polymyalgia rheumatica and large vessel vasculitis. Internist. 2016. 57 (11). 1069-1078. doi: 10.1007/s00108-016-0131-x. (in German).
- Hamrin B., Jonsson N., Hellstein S. «Polymyalgia arteritica». Further clinical and histopathological studies with a report of six autopsy cases. Ann. Rheum. Dis. 1968. 27. 397-405. doi: 10.1136/ard.27.5.397. Available from: https. //ard/bmj.com/content/annrheumdis/27/5/397.full.pdf. Accessed: 07.11.2020.
- Сimmino M.A., Camellino D. Large vessel vasculitis: which imaging method? Swiss Med. Wkly. 2017. 147. w14405. doi: 10.4414/smw.2017.14405.
- Smiyan S.I., Holovach І.Yu., Komorovsky R.R., Kmetyuk Ya.V., Ashykhmin A.V. Role of PET/CT in the diagnosis of large vessel vasculitis in a patient with systemic inflammatory response syndrome. Eur. J. Rheumatol. 2014. 1 (4). 174-175. doi: 10.5152/eurjrheumatol.2014.140078.
- Camellino D., Сimmino M.A. Imaging of polymyalgia rheumatica: indications on its pathogenesis, diagnosis and prognosis. Rheumatology. 2012. 51 (1). 77-86. doi: 10.1093/rheumatoloy/keq450.
- Liozon E., de Boysson H., Dalmay F. et al. Development of Giant Cell Arteritis after Treating Polymyalgia or Peripheral Arthritis: a Retrospective Case-control study. J. Rheumatol. 2018. 45 (5). 678-685. doi: 10.3899/j.rheum.170455.
- Lensen K.D., Voskuyl A.E., Comans E.F., van der Laken C.J., Smulders Y.M. Extracranial giant cell arteritis: A narrative review. Neth. J. Med. 2016. 74 (5). 182-192. PMID: 27323671.
- Netiazhenko V.Z., Puzanovа О.G. Gigantokletochnyj arteriit: epidemiologija, diagnostikа, prognoz [Giant cell arteritis: epidemiology, diagnosis, prognosis]. Pain Joints Spine. 2019. 9 (2). 90-107. doi: 10.22141/2224-1507.9.2.2019.172121. (in Russian).
- Lyzikov A.N., Puzanova O.G., Lyzikov A.A. Gigantokletochnyj arteriit: dokazannye i diskussionnye aspekty lechenija [Giant cell arteritis: proven and debatable aspects of treatment]. Pain Joints Spine. 2020. 1. 17-38. doi: 10.22141/2224-1507.10.1.2020.199720. (in Russian).
- Niinimaki E., Kajander H., Paavonen T., Sioris T., Mennander A. Aiming at One-Stage Corrective Surgery for Extended Thoracic Aortic Dilation. Int. J. Angiol. 2014. 23. 101-106. doi: 10.1055/s-0034-1370887.
- Sato O., Takagi A., Miyata T., Takayama Y. Aortic aneurysm in patients with autoimmune disorders treated with corticosteroids. Eur. J. Vasc. Endovasc. Surg. 1995. 10. 366-369. Available from: https://www.ejves.com/article/S1078-5884 (05)80059-0/pdf. Accessed: 08.11.2020.
- Erbel R., Aboyans V., Boileau C. et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur. Heart J. 2014. 35 (41). 2873-2926. doi. 10.1093/eurheart/ehu281.
- Kuznechevskii F.V., Osipov А.Kh., Yevsikov Е.М., Abramov I.S., Otarova S.M. Rasprostranyonnost’ i priroda anevrizm i rasslojenij aorty po dannym analiza posledovatel’nyh patologoanatomicheskih vskrytij v techenije desyati let v GKB № 15 im. О.М. Filatova [Prevalence and nature of aortic aneurysms and dissections according to sequential postmortem autopsies over ten years at the Filatov city clinical hospital]. Russ. Cardiol. J. 2004. 6 (50). 5-13. Available from: https://russjcardiol.elpub.ru/jour/article/download/2307/1961. Accessed: 07.11.2020. (in Russian).
- Robson J.C., Kiran A., Maskell J. et al. The relative risk of aortic aneurysm in patient with giant cell arteritis compared with the general population of the UK. Ann. Rheum. Dis. 2015. 74 (1). 129-135. doi: 10.1136/annrheumdis-2013-204113.
- National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. 2020. 49. Available from: https://www.nice.org.uk/gui–dance/ng156/recources/abdominal-aortic-aneurysm-diagnosis-and-management-pdf-66141843642565. Accessed: 07.11.2020.
- Stone J.R., Bruneval P., Angelini A. et al. Consensus statement on surgical pathology of the aorta from the Society for Cardiovascular Pathology and the Association for European Cardiovascular Pathology: I. Inflammatory diseases. Cardiovasc. Pathol. 2015. 24 (5). 267-278. doi: 10.1016/jcarpath.2015.05.001.
- Canadian Task Force on Preventive Health Care. Recommendations on screening for abdominal aortic aneurysm in primary care. CMAJ. 2017. 189. E1137-1145. doi: 10.1503/cmaj.170118.
- Kuzmik G.A., Sang A.X., Elefteriades J.A. Natural history of thoracic aortic aneurysms. J. Vasc. Surg. 2012. 56. 565-571. doi: 10.1016/j/jvs.2012.04.053.
- Kozlov B.N., Panfilov D.S., Gutor S.S. et al. Morfologicheskoje sostojanije arterial’noj stenki pri anevrizme voskhodyashchej aorty [Morphological state of the aortic wall in ascending aortic aneurysm]. Clin. Experiment Surg. Petrovsky J. 2018. 6 (4). 43-48. (in Russian).
- Lariviere D., Benali K., Coustet B. et al. Positron emission tomography and computed tomography for the diagnosis of giant cell arteritis. A real-life prospective study. Medicine. 2016. 95 (30). e4146. doi: 10.1097/MD.0000000000004146.
- Saeyeldin A.A., Velasques C.A., Mahmood S.U.B. et al. Thoracic aortic aneurysm: unlocking the «silent killer» secrets. Gen. Thorac. Cardiovasc. Surg. 2019. 67 (1). 1-11. doi: 10.1007/s11748-017-0874-x.
- Koster M.J., Matteson E.L., Warrington K.J. Large-vessel giant cell arteritis: diagnosis, monitoring and management. Rheumatology. 2018. 57. ii32-ii42. doi: 10.1093/rheumatology.kex424.
- Löffler C., Hoffend J., Bemck U., Krämer B.K., Bergner R. The value of ultrasound in diagnosing large vessel vasculitis compared to FDG-PET/CT: a retrospective study. Clin. Rheumatol. 2017. 36 (9). 2070-2086. doi: 10.1007/s10067-017-3669-7.
- Quinn K.A., Grayson P.C. The role of vascular imaging to advance clinical care and research in large-vessel vasculitis. Curr. Treatm. Opt. Rheumatol. 2019. 5 (1). 20-35. doi: 10.1007/s40674-019-00114-0.
- Villiger P.M. Large vessel vasculitis. Giant cell arteritis and Takayasu arteritis. Z. Rheumatol. 2017. 76. 509-523. doi: 10.1007/s00393-017-0331-3. (in German).
- Nielsen B.D., Gormsen L.C., Hansen I.T., Keller K.K., Therkildsen P., Hauge E.M. Three days of high-dose glucocorticoid treatment attenuates large-vessel 18-F-FDG uptake in large vessel giant cell arteritis but with a limited impact on diagnostic accuracy. Eur. J. Nucl. Med. Mol. Imaging. 2018. 45 (7). 1119-1128. doi: 10.1007/s00259-018-4021-4.
- Mollan S.P., Paermeleire K., Versijpt J., Luqmani R., Sinclair A.J. European Headache Federation recommendations for neurologists managing giant cell arteritis. J. Headache Pain. 2020. 21. 28. doi: https://doi.org/10.1186/s10194-020-01093-7.
- Dasgupta B., Cimmino M.A., Maradit-Kremers H. et al. 2012 provisional criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann. Rheum. Dis. 2012. 71. 484-492. doi: 10.1136/annrheumdis-2011-200329.
- Dejaco C., Singh Y.P., Perel P. et al.; European League Against Rheumatism; American College of Rheumatology. 2015 Recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann. Rheum. Dis. 2015. 74. 1799-1807. doi: 10.1136/annrheumdis-2015-207492.
- Dejaco C., Ramiro S., Duftner C. et al. EULAR recommendations for the use of imaging in large vessels vasculitis in clinical practice. Ann. Rheum. Dis. 2018. 77 (5). 636-643. doi: 10.1136/annrheumdis-2017-212649.
- Dasgupta B., Borg F.A., Hassan N. et al. BSR and BHPR guidelines for the management of giant cell arteritis. Rheumatology. 2010. 49. 1594-1597. doi: 10.1093/rheumatology/keq039a.
- Bienvenu B., Ly K.H., Lambert M. et al. Management of giant cell arteritis: Recommendations of the French Study Group for Large Vessel Vasculitis (GEFA). Rev. Med. Intern. 2016. 37 (3). 154-165. doi: 10.1016/j.revmed.2015.12.015.
- Mackie S.L., Dejaco C., Appenzeller S. et al. British Society for Rheumatology guideline on diagnosis and treatment of giant cell arteritis. Rheumatology. 2020. 0. 1-23. doi: 10.1093/rheumatology/kez672.
- Buttgereit F., Brabant T., Dinges H. et al. S3 guideline on treatment of polymyalgia rheumatica: evidence based guideline of the German Society of Rheumatology (DGRh), the Austrian Society of Rheumatology and Rehabilitation (ÖGR) and the Swiss Society of Rheumatology (SGR) and participating medical scientific specialist societies and other organizations. Z. Rheumatol. 2018. 5. doi: 10.1007/s00393-018-0476-8. (in German).
- Ughi N., Sebastiani G.D., Gerli R. et al. The Itali–an Society of Rheumatology clinical practice guidelines for the management of polymyalgia rheumatica. Reumatismo. 2020. 72 (1). 1-15. doi: 10.4081/reumatismo.2020.1268.
- Schirmer J.H., Aries P.M., Balzer K. et al. S2k Guideline on the management of large vessel vasculitis (Guideline report). Available from: https://www.awmf.org/uploads/tx_szleitlinien/060-007m_S2k_Management_ Großgefäßvaskulitiden_2020-08.pdf. Accessed: 14.10.2020. (in German).
- Puzanova О.G., Moshkovska Yu.O., Sobol V.O. Revmaticheskaja polimialgija: ob’jedinyaja usilija jevropejskich revmatologicheskich obshchestv [Polymyalgia rheumatica: concerted efforts of the European rheumatological societies]. Pain Joints Spine. 2020. 3. 118-126. doi: 10.22141/2224-1507.10.3.2020.212033. (in Russian).
- Slart RHJA, Writing Group, Reviewer Group. FDG-PET/CT (A) imaging in large vessel vasculitis and polymyalgia rheumatica: joint procedural recommendation of the EANM, SNMMI, and the PET Interest Group (PIG), and endorsed by the ASNC. Eur. J. Nucl. Med. Mol. Imaging. 2018. 45 (7). 1250-1269. doi: https://doi.org/10.1007/s00259-018-3973-8.
- Jamar F., Buscombe J., Chiti A. et al. EANM/SNMMI guideline for 18F-FDG use in inflammation and infection. J. Nucl. Med. 2013. 54 (4). 647-658. doi: 10.2967/jnumed.112.112524.
- Boellaard R., Delgado-Bolton R., Oyen W.J. et al.; European Association of Nuclear Medicine (EANM). FDG-PET/CT: EANM procedure guidelines for tumor imaging: version 2.0. Eur. J. Nucl. Med. Mol. Imaging. 2015. 42 (2). 328-354. doi: 10.1007/s00259-014-2961-x.
- Dorbala S., Di Carli M.F., Delbeke D. et al. SNMMI/ASNC/SCCT guideline for cardiac SPECT/CT and PET/CT 1.0. J. Nucl. Med. 2013. 54 (8). 1485-1507. doi: 10.2967/jnumed.112.105155.
- Chareonthaitawee P., Beanlands R.S., Chen W. et al.; NAME OF COLLAB GROUP. Joint SNMMI-ASNC expert consensus document on the role of 18F-FDG-PET/CT in cardiac sarcoid detection and therapy monitoring. J. Nucl. Cardiol. 2017. 58 (8). 1341-1353. doi: 10.2967/jnumed.117196287.
- Bucerius J., Hyafil F., Verberne H.J. et al.; Cardiovascular Committee of the European Association of Nuclear Medicine. Position paper of the Cardiovascular Committee of the European Association of Nuclear Medicine (EANM) on PET imaging of atherosclerosis. Eur. J. Nucl. Med. Mol. Imaging. 2016. 43 (4). 780-792. doi: 10.1007/s00259-015-3259-3.
- American College of Radiology, North American Society for Cardiovascular Imaging, Society of Interventional Radiology, Society for Pediatric Radiology. ACR-NASCI-SIR-SPR practice parameter for the performance and interpretation of body computed tomography angiography (CTA). Available from: https. //www.acr.org/-/media/ACR/Files/Practice-Parameters/Body-CTA.pdf?la = en. Accessed: 25.10.2020.
- Hyafil F., Vigne J. Nuclear Imaging. Focus on Vascular Probes. Arteriosclerosis Thrombosis Vasc. Biol. 2019. 39. 1369-1378. doi: https://doi.org/10.1161/ATVBAHA.119.312586.
- Ernst D., Baerlecken N.T., Schmidt R.E., Witte T. Large vessel vasculitis and spondyloarthritis: coincidence or associated disease? Scand. J. Rheumatol. 2012. 43 (3). 246-248. doi: 10.3109/03009742.2013.850737.
- Yamashita H., Kubota K., Takahashi Y. et al. Whole-body fluorodeoxyglucose positron emission tomography/computed tomography in patients with active polymyalgia rheumatica: evidence for distinctive bursitis and large-vessel vasculitis. Mod. Rheumatol. 2012. 22 (5). 705-711. doi: 10.1007/s10165-011-0581-x.
- Kubota K., Yamashita H., Mimori A. Clinical Value of FDG-PET/CT for the Evaluation of Rheumatic Diseases: Rheumatoid Arthritis, Polymyalgia Rheumatica, and Relapsing Polychondritis. Semin. Nucl. Med. 2017. 47 (4). 408-424. doi: 10.1053/j.semnuclmed.2017.02.005.
- Yuge S., Nakatani K., Yoshino K., Koyama T. Diagnosing polymyalgia rheumatica on 18F-FDG-PET/CT: typical uptake patterns. Ann. Nucl. Med. 2018. 32 (8). 573-577. doi: 10.1007/s12149-018-1269-5.
- Bakos A., Besenyi Z., Sipka G., Urbán S., Hemelein R., Kovács L., Pávics L. 18F-FDG-PET/CT in the evaluation and differential diagnosis of active large-vessel vasculitis. A prospective study. Orv. Hetil. 2020. 161 (20). 829-838. doi: 10.1556/650.2020.31710. (in Hungarian).
- Сimmino M.A., Camellino D., Paparo F. et al. High frequency of capsular knee involvement in polymyalgia rheumatica/giant cell arteritis patient studied by positron emission tomography. Rheumatology. 2013. 52. 1865-1872. doi: 10.1093/rheumatology/ket229.
- Malik D., Verma R., Gupta V. et al. Semiquantitative interpretation criteria fluorodeoxyglucose-positron emission tomography/computed tomography in large-vessel vasculitis: pattern recognition and correlation with polymyalgia rheumatica. Indian. J. Nucl. Med. 2020. 35 (1). 6-12. doi: 10.4301/ijnm.IJNM_136_19.
- Lavado-Pérez C., Martínez-Rodríguez I., Martínez-Amador N. et al. (18)F-FDG-PET/CT for the detection of large vessel vasculitis in patients with polymyalgia rheumatica. Rev. Esp. Med. Nucl. Imagen. Mol. 2015. 34 (5). 275-281. doi: 10.1016/j.remn.2015.05.011.
- Rehak Z., Vasina J., Nemec P. et al. Various forms of (18)F-FDG-PET/CT and PET/CT findings in patients with polymyalgia rheumatica. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub. 2015. 159 (4). 629-636. doi: 10.5507/bp.2015.026.
- Einspieler I., Thürmel K., Pyka T. et al. Imaging large vessel vasculitis with fully intergrated PET/MRI: a pilot study. Eur. J. Nucl. Med. Mol. Imaging. 2015. 42 (7). 1012-1024. doi: 10.1007/s00259-015-3007-8.
- De B.H., Dumont A., Liozon E., Lambert M. et al. Giant-cell arteritis: concordance study between aortic CT angiography and FDG-PET/CT in detection of large-vessel involvement. Eur. J. Nucl. Med. Mol. Imaging. 2017. 4 (13). 2274-2279. doi: 10.1007/s00259-017-3774-5.
- Einspieler I., Thürmel K., Eiber M. Fully intergrated whole-body [18F]-fludeoxyglucose positron emision tomography/magnetic resonance imaging in therapy monitoring of giant cell arteritis. Eur. Heart J. 2016. 37 (6). 576. doi: 10.1093/eurheartj/ehv607.
- Prieto-Peña D., Martínez-Rodriguez I., Loricera J. et al. Predictors of positive 18F-FDG-PET/CT-scan for large vessel vasculitis in patients with persistent polymyalgia rheumatica. Semin. Arthritis Rheum. 2019. 48. 720-727. doi: https://doi.org/10.1016/j.semarthrit.2018.05.007.
- Bucerius J., Mani V., Moncrieff C. et al. Optimising 18F-FDG-PET/CT imaging of vessel wall inflammation: the impact of 18F-FDG circulation time, injected dose, and fasting blood glucose level. Eur. J. Nucl. Med. Mol. Imaging. 2014. 41 (2). 369-383. doi: 10.1007/s00259-013-2569-6.
- Huet P., Burg S., Le G.D., Hyafil F., Buvat I. Variability and uncertainty of 18F-FDG-PET imaging protocols for assessing inflammation in atherosclerosis: suggestions for improvement. J. Nucl. Med. 2015. 56 (4). 552-559. doi: 10.2967/jnumed.114.142596.
- Rosenblum J.S., Quinn K.A., Rimland C.A., Mehta N.N., Ahlman M.A., Grayson P.C. Clinical factors associated with time-specific distribution of 18F-fluorodeoxyglucose in large-vessel vasculitis. Sci Rep. 2019. 9 (1). 15180. doi: 10.1038/s41598-019-51800-x.
- Watanabe R., Hilhorst M., Zhang H. et al. Glucose metabolism controls disease-specific signatures of macrophage effector functions. JCI Insight. 2018. 3 (20). e123047 doi: http://doi.org/10.1172/jci.insight.123047.
- Lai L.Y.H., Harris E., West R.M., Mackie S.L. Association between glucocorticoids therapy and incidence of diabetes mellitus in polymyalgia rheumatica and giant cell arteritis: a systematic review and meta-analysis. RMD Open. 2018. 4. e000521. doi: 10.1136/rmdopen-2017-000521.
- Halliburton S.S., Abbara S., Chen M.Y. et al. SCCT guidelines on radiation dose and dose-optimization strategies in cardiovascular CT. J. Cardiovasc. Comput. Tomogr. 2011. 5. 198-224. doi: 10.1016/j.jcct.2011.06.001.
- Agard C., Barrier J.H., Dupas B. et al. Aortic involvement in recent-onset giant cell (temporal) arteritis: a case-control prospective study using helical aortic computed tomodensitometric scan. Arthritis Rheum. 2008. 59 (5). 670-676. doi: 10.1002/art.23577.
- Prieto-González S., Arguis P., Garsia-Martinez A. et al. Large vessel involvement in biopsy-proven giant cell arteritis: prospective study in 40 newly diagnosed patients using CT angiography. Ann. Rheum. Dis. 2012. 71 (7). 1170-1176. doi: 10.1136/annrheumdis-2011-200865.
- Prieto-González S., Garsia-Martinez A., Tavera-Bahillo I. et al. Effect of glucocorticoid treatment on computer tomography angiography detected large vessel inflammation in giant cell arteritis. A prospective, longitudinal study. Medicine. 2015. 94 (5): e486. doi: 10.1097/MD.0000000000000486.
- Lensen K.D., Comans E.F., Voskuyl A.E. et al. Large vessel vasculitis: interobserver and diagnostic accuracy of 18-FDG-PET/CT. Biomed. Res. Int. 2015. 2015. 914692. doi: 10.1155/2015/914692.
- Soussan M., Nicolas P., Schramm C. et al. Management of large-vessel vasculitis with FDG-PET: a systematic literature review and meta-analysis. Medicine. 2015. 94. e622. doi: 10.1097/MD.0000000000000622.
- Rehak Z., Szturz P. Comment on: FDG-PET in the early diagnosis of large-vessel vasculitis. Eur. J. Nucl. Med. Mol. Imaging. 2014. 41 (3). 579-580. doi: 10.1007/s00259-013-2662-x.
- Lehmann P., Buchtala S., Achajew N. et al. 18-FGD-PET as a diagnostic procedure in large vessel vasculitis — a controlled blinded re-examination of routine CT scans. Clin. Rheumatol. 2011. 30. 37-42. doi: 10.1007/s10067-010-1598-9.
- Besson F.L., de Boysson H., Parienti J.J., Bouvard G., Bienvenu B., Agostini D. Towards an optimal semiquantitative approach in giant cell arteritis: an (18)F-FDG-PET/CT case-control study. Eur. J. Nucl. Med. Mol. Imaging. 2014. 41 (1). 155-166. doi: 10.1007/s00259-013-2545-1.
- Stellingwerff M.D., Brouwer E., Lensen K.J. et al. Different Scoring Methods of FDG PET/CT in Giant Cell Arteritis: Need for Standardization. Medicine. 2015. 94 (37). e1542. doi: 10.1097/MD.0000000000001542.
- Bai B., Bading J., Conti P.S. Tumor quantification in clinical positron tomography. Theranostics. 2013. 3 (10). 787-801. doi: 10.7150/thno.5629.
- Gholami S., Salavati A., Houshmand S., Werner T.J., Alavi A. Assessment of atherosclerosis in large vessel walls: A comprehensive review of FDG-PET/CT image acquisition protocols and methods for uptake quantification. J. Nucl. Cardiol. 2015. 22 (3). 468-479. doi: 10.1007/s12350-015-0069-8.
- Lensen K.D., van Sijl A.M., Voskuyl A.E. et al. Variability in quantitative analysis of atherosclerotic plaque inflamation using 18-FDG-PET/CT. PLoS One. 2017. 12 (8). e0181847. doi: 10.1371/journal.pone.0181847.
- Lee Y.H., Choi S.J., Ji J.D., Song G.G. Diagnostic accuracy of 18F-FDG-PET or PET/CT for large vessel vasculitis: a meta-analysis. Z. Rheumatol. 2016. 75 (9). 924-931. doi: 10.1007/s00393-015-1674-2. (in German).
- Moosig F., Czech N., Mehl C. et al. Correlation between 18-fluorodeoxyglucose accumulation in large vessels and serological markers of inflammation in polymyalgia rheumatica: a quantitative PET study. Ann. Rheum. Dis. 2004. 63 (7). 870-873. doi: 10.1136/ard.2003.011692.
- Castellani M., Vadrucci M., Florimonte L., Caronni M., Benti R., Bonara P. 18-FDG uptake in main arterial branches of patients with large vessel vasculitis: visual and semiquantative analysis. Ann. Nucl. Med. 2016. 30. 409-420. doi: 10.1007/s12149-016-1075-x.
- Kitajima K., Suenaga Y., Sugimura K. Present and future role of FDG-PET/CT imaging in the management of head and neck carcinoma. Jpn. J. Radiol. 2015. 33 (12). 776-789. doi: 10.1007/s11604-015-0495-1.
- Nielsen B.D., Hansen I.T., Kramer S. et al. Simple dichotomous assessment of cranial artery inflammation by conventional 18F-FDG PET/CT shows high accuracy for the diagnosis of gianr cell arteritis: a case-control study. Eur. J. Nucl. Med. Mol. Imaging. 2019. 46 (1). 184-193. doi: 10.1007/s00259-018-4106-0.
- Sammel A.M., Hsiao E., Schembri G. et al. Diagnostic accuracy of PET/CT scan of the head, neck and chest for Giant cell arteritis: the double blind Giant cell arteritis and PET scan (GAPS) study. Arthritis Rheumatol. 2019. 71 (8). 1319-1328. doi: 10.1002/art.40864.
- Salvatori M., Rizzo A., Rovera G., Indovina L., Schillaci O. Radiation dose in nuclear medicine: the hybrid imaging. Radiol. Med. 2019. 124 (8). 768-776. doi: 10.1007/s11547-019-00989-y.

/8.jpg)
/9.jpg)
/11.jpg)
/15.jpg)