Международный эндокринологический журнал Том 16, №8, 2020
Вернуться к номеру
Ренін-ангіотензинова система в регуляції екскреторної функції нирок за експериментального цукрового діабету
Авторы: Оленович О.А.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
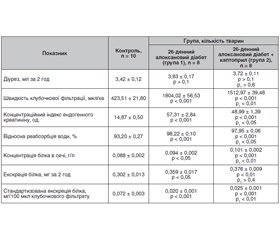
Метою дослідження було вивчення ролі ренін-ангіотензинової системи в порушенні екскреторної функції нирок у динаміці алоксан-індукованого експериментального цукрового діабету. Матеріали та методи. Дослідження виконані на 78 нелінійних статевозрілих самцях білих щурів з 11-, 26- та 46-денним експериментальним цукровим діабетом, викликаним внутрішньоочеревинним введенням алоксану (160 мг/кг), на тлі фармакологічної блокади внутрішньониркової ренін-ангіотензинової системи, індукованої внутрішньоочеревинним введенням каптоприлу (10 мг/кг). Вивчення екскреторної функції нирок здійснювали кліренс-методом за умов водного індукованого 2-годинного діурезу з визначенням кліренсу ендогенного креатиніну, швидкості клубочкової фільтрації, відносної реабсорбції води, умісту білка в сечі, його екскреції. Результати. Аналіз змін функції нирок після фармакологічної блокади ренін-ангіотензинової системи у щурів на 11-й день алоксанового діабету показав вірогідне зростання діурезу, швидкості клубочкової фільтрації, концентраційного індексу ендогенного креатиніну, а також екскреції білка. При цьому фармакологічна блокада ренін-ангіотензинової системи практично не впливала на інтенсивність відносної реабсорбції води в алоксан-діабетичних щурів. На 26-й день розвитку алоксанового діабету після введення каптоприлу спостерігалося незначне зменшення об’єму кінцевої сечі, інтенсивності гломерулярної фільтрації, відносної реабсорбції води, концентраційного індексу ендогенного креатиніну. Разом із тим каптоприл не викликав антипротеїнуричного ефекту, а екскреція білка навіть виявила тенденцію до зростання. На 46-й день алоксан-індукованого діабету після введення каптоприлу вірогідно зменшувалися діурез щурів, кліренс ендогенного креатиніну та швидкість клубочкової фільтрації, а також концентрація білка в сечі та його екскреція. Висновки. Результати дослідження дозволяють дійти висновку, що початковий етап формування ренальних порушень за алоксан-індукованого експериментального діабету пов’язаний із гемодинамічно-гіперперфузійним характером функціонування нирок за збереженого ниркового функціонального резерву та структури клубочково-канальцевого апарату нирки, авторегуляторних механізмів. Зазначені компенсаторно-функціональні зміни функцій нирок поступово ускладнюються виснаженням ниркового функціонального резерву та патологічною активацією внутрішньониркової ренін-ангіотензинової системи з подальшим прогресуванням гіперперфузійно-ішемічного ураження нирок, зменшенням маси функціонуючих нефронів.
Целью исследования было изучение роли ренин-ангиотензиновой системы в нарушении экскреторной функции почек в динамике аллоксан-индуцированного экспериментального сахарного диабета. Материалы и методы. Исследования выполнены на 78 нелинейных половозрелых самцах белых крыс с 11-, 26- и 46-дневным экспериментальным сахарным диабетом, вызванным внутрибрюшинным введением аллоксана (160 мг/кг), на фоне фармакологической блокады внутрипочечной ренин-ангиотензиновой системы, индуцированной внутрибрюшинным введением каптоприла (10 мг/кг). Изучение экскреторной функции почек осуществляли клиренс-методом в условиях водного индуцированного 2-часового диуреза с определением клиренса эндогенного креатинина, скорости клубочковой фильтрации, относительной реабсорбции воды, содержания белка в моче, его экскреции. Результаты. Анализ изменений функции почек после фармакологической блокады ренин-ангиотензиновой системы у крыс на 11-й день аллоксанового диабета показал достоверное возрастание диуреза, скорости клубочковой фильтрации, концентрационного индекса эндогенного креатинина, а также экскреции белка. При этом фармакологическая блокада ренин-ангиотензиновой системы практически не влияла на интенсивность относительной реабсорбции воды у аллоксан-диабетических крыс. На 26-й день развития аллоксанового диабета после введения каптоприла наблюдалось незначительное уменьшение объема конечной мочи, интенсивности гломерулярной фильтрации, относительной реабсорбции воды, концентрационного индекса эндогенного креатинина. Вместе с тем каптоприл не вызывал антипротеинурического эффекта, а экскреция белка даже продемонстрировала тенденцию к увеличению. На 46-й день аллоксан-индуцированного диабета после введения каптоприла достоверно снижались диурез крыс, клиренс эндогенного креатинина и скорость клубочковой фильтрации, а также концентрация белка в моче и его экскреция. Выводы. Результаты исследования позволяют сделать вывод о том, что начальный этап формирования ренальных нарушений при аллоксан-индуцированном экспериментальным сахарным диабетом связан с гемодинамически-гиперперфузионным характером функционирования почек при сохранном почечном функциональном резерве и структуре клубочково-канальцевого аппарата почки, авторегуляторных механизмов. Указанные компенсаторно-функциональные изменения функций почек постепенно осложняются истощением почечного функционального резерва и патологической активацией внутрипочечной ренин-ангиотензиновой системы с последующим прогрессированием гиперперфузионно-ишемического поражения почек, уменьшением массы функционирующих нефронов.
Background. The purpose of the study was to explore the role of the renin-angiotensin system in the disturbance of renal excretory function in the dynamics of alloxan-induced experimental diabetes mellitus. Materials and methods. The experiments were carried out on 78 white non-linear mature male rats with 11-, 26- and 46-day long experimental diabetes mellitus caused by intraperitoneal administration of alloxan (160 mg/kg), against the background of pharmacological blockade of intrarenal renin-angiotensin system, induced by intraperitoneal administration of сaptopril (10 mg/kg). The study of excretory function of the kidneys was provided by the clearance method under the condition of induced water 2-hour diuresis to determine the clearance of endogenous creatinine, glomerular filtration rate, relative water reabsorption, protein content in urine, its excretion. Results. Analysis of changes in renal function after pharmacological blockade of the renin-angiotensin system in rats on day 11 of alloxan diabetes showed a significant increase in diuresis, glomerular filtration rate, endogenous creatinine concentration index, and protein excretion. The pharmacological blockade of the renin-angiotensin system had practically no effect on the intensity of the relative reabsorption of water in alloxan-diabetic rats. On day 26 of alloxan diabetes after captopril administration, there was a slight decrease in final urine volume, glomerular filtration rate, relative water reabsorption, and endogenous creatinine concentration index. At the same time, captopril did not cause an antiproteinuric effect, and protein excretion even demonstrated a tendency to increase. On day 46 of alloxan-induced diabetes after administration of captopril, there was a significant reduction in diuresis, endogenous creatinine clearance and glomerular filtration rate of rats, as well as in urinary protein concentration and excretion. Conclusions. The results of the study allow us to conclude that the initial stage of renal disorders formation in alloxan-induced experimental diabetes is associated with hemodynamic-hyperperfusion nature of renal functioning with preserved renal functional reserve and the structure of the glomerular-tubular apparatus of the kidney, autoregulatory mechanisms. Mentioned compensatory-functional changes in renal function are gradually complicated by an exhaustion of renal functional reserve and pathological activation of intrarenal renin-angiotensin system with subsequent progression of hyperperfusion-ischemic kidney damage, a decrease in the number of functioning nephrons.
експериментальний цукровий діабет; алоксан; каптоприл; екскреторна функція нирок; внутрішньониркова ренін-ангіотензинова система
экспериментальный сахарный диабет; аллоксан; каптоприл; экскреторная функция почек; внутрипочечная ренин-ангиотензиновая система
experimental diabetes mellitus; alloxan; сaptopril; excretory renal function; intrarenal renin-angiotensin system
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Radchenko G.D., Torbas O.O., Sirenko Y.M. Predictors of high central blood pressure in young with isolated systolic hypertension. Vasc. Health Risk Manag. 2016. 12. 321-8. doi: 10.2147/VHRM.S97304.
- Meyrier A. Nephrosclerosis: a term in quest of a disease. Nephron. 2015. 129(4). 276-82. doi: 10.1159/000381195.
- Tomino Y. Pathogenesis and treatment of chronic kidney disease: a review of our recent basic and clinical data. Kidney Blood Press Res. 2014. 39(5). 450-89. doi: 10.1159/000368458.
- Cerquozzi S., Tefferi A. Blast transformation and fibrotic progression in polycythemia vera and essential thrombocythemia: a literature review of incidence and risk factors. Blood Cancer J. 2015. 5(11). e366. doi: 10.1038/bcj.2015.95.
- Meyer K.C. Diagnosis and management of interstitial lung disease. Transl. Respir. Med. 2014. 2. 4. doi: 10.1186/2213-0802-2-4.
- Hannedouche T., Krummel T., Parvez-Braun L. Nephroprotection: how to slow the progression of chronic renal insufficiency? Nephrol. Ther. 2005. 1(2). 135-44. (in French). doi: 10.1016/j.nephro.2005.05.003.
- Atlas S.A. The renin-angiotensin aldosterone system: pathophysiological role and pharmacologic inhibition. J. Manag. Care Pharm. 2007. 13. 9-20. doi: 10.18553/jmcp.2007.13.s8-b.9.
- Park Y.S. Renal scar formation after urinary tract infection in children. Korean J. Pediatr. 2012. 55(10). 367-70. doi: 10.3345/kjp.2012.55.10.367.
- Ihm C.G. Hypertension in Chronic Glomerulonephritis. Electrolyte Blood Press. 2015. 13(2). 41-5. doi: 10.5049/EBP.2015.13.2.41.
- Sulaiman M.K. Diabetic nephropathy: recent advances in pathophysiology and challenges in dietary management. Diabetol. Metab. Syndr. 2019 Jan 23. 11. 7. doi: 10.1186/s13098-019-0403-4.
- Alicic R.Z., Rooney M.T., Tuttle K.R. Diabetic Kidney Disease: Challenges, Progress, and Possibilities. Clin. J. Am. Soc. Nephrol. 2017. 12(12). 2032-2045. doi: 10.2215/CJN.11491116.
- Bryukhanov V.M., Zverev Y.F., Lampatov V.V., Zharikov A.Yu. Methodical approaches to the study of renal function in animal experiments. Nephrology (Saint-Petersburg). 2009. 13(3). 52-62. (in Russian). https://doi.org/10.24884/1561-6274-2009-13-3-52-62
- Modern methods of experimental and clinical studies of the central research laboratory of Bukovinian State Medical Academy. Chernivtsi: Medical Academy, 2001. 42 p. (in Ukrainian).
- Pressler B.M. Clinical approach to advanced renal function testing in dogs and cats. Vet. Clin. North Am. Small Anim. Pract. 2013. 43(6). 1193-208. doi: 10.1016/j.cvsm.2013.07.011. Epub 2013 Aug 1. PMID: 24144085.
- Boychuk T.M., Olenovych O.A., Gozhenko A.I. Peculiarities of excretory renal function in the early period of alloxan-induced experimental diabetes. Herald of Marine Medicine. 2018. 3(80). 102-9. doi: http://dx.doi.org/10.5281/zenodo.1450849/
- Fu H., Liu S., Bastacky S.I., Wang X., Tian X.J., Zhou D. Diabetic kidney diseases revisited: A new perspective for a new era. Mol. Metab. 2019. 30. 250-263. doi: 10.1016/j.molmet.2019.10.005.
- Lin Y.C., Chang Y.H., Yang S.Y., Wu K.D., Chu T.S. Update of pathophysiology and management of diabetic kidney disease. J. Formos Med. Assoc. 2018. 117(8). 662-675. doi: 10.1016/j.jfma.2018.02.007.
- Li L., Chen L., Zang J. et al. C3a and C5a receptor antagonists ameliorate endothelial-myofibroblast transition via the Wnt/β-catenin signaling pathway in diabetic kidney disease. Metabolism. 2015. 64(5). 597-610. doi: 10.1016/j.metabol.2015.01.014.
- Bomsztyk K., Denisenko O., Wang Y. DNA methylation yields epigenetic clues into the diabetic nephropathy of Pima Indians. Kidney Int. 2018. 93(6). 1272-1275. doi: 10.1016/j.kint.2018.02.015.
- Colombo M., Looker H.C. et al.; SUMMIT Investigators. Serum kidney injury molecule 1 and β2-microglobulin perform as well as larger biomarker panels for prediction of rapid decline in renal function in type 2 diabetes. Diabetologia. 2019. 62(1). 156-168. doi: 10.1007/s00125-018-4741-9.

/48.jpg)
/49.jpg)
/50_2.jpg)