Журнал «Медицина неотложных состояний» Том 16, №7, 2020
Вернуться к номеру
Особливості ведення хворих на негоспітальну пневмонію із супутньою патологією: обґрунтування доцільності використання антигіпоксантів на прикладі етилметилгідроксипіридину сукцинату
Авторы: Чурсіна Т.Я.(1), Міхалєв К.О.(2)
(1) — Буковинський державний медичний університет, м. Чернівці, Україна
(2) — Державна наукова установа «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
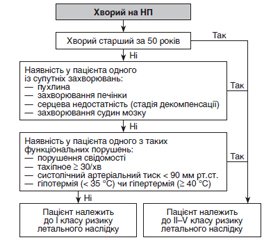
Негоспітальна пневмонія належить до найбільш поширених інфекційних захворювань ХХI століття і залишається важливою медико-соціальною проблемою через достатньо високі показники інвалідизації та смертності, а також значні економічні втрати. Супутні хронічні захворювання та стани, кількість яких збільшується з віком, сприяють посиленню тяжкості та несприятливому прогнозу пневмонії. Поєднання патологій, патогенез яких включає гіпоксичний компонент, в одного хворого визначає виключну важливість і необхідність розуміння механізмів гіпоксії (у тому числі на клітинному рівні), а також соціальну значущість проблеми захисту організму від кисневої недостатності й супутнього енергодефіциту, у тому числі за допомогою антигіпоксантів з антиоксидантною та мембраностабілізуючою дією. У численних експериментальних та клінічних дослідженнях отримані дані щодо плейотропних ефектів сукцинату та сукцинатвмісних антигіпоксантів у хворих із захворюваннями і станами, які супроводжуються гіпоксичними розладами. Створена достатня доказова база клінічних досліджень, в яких встановлено доцільність використання етилметилгідроксипіридину сукцинату в складі комплексної терапії у хворих із гострими та хронічними порушеннями мозкового кровообігу, тривожними розладами, у пацієнтів зі стабільною стенокардією, гострим коронарним синдромом, серцевою недостатністю, артеріальною гіпертензією. Раннє додавання препарату до складу комбінованої терапії на догоспітальному етапі лікування пневмонії сприятиме зменшенню виникнення гострих ускладнень або декомпенсації перебігу супутніх хронічних станів, прискоренню регресу проявів післяінфекційної астенії, вегетативної лабільності, когнітивного дефіциту.
Внебольничная пневмония относится к наиболее распространенным инфекционным заболеваниям ХХI века и остается важной медико-социальной проблемой из-за достаточно высоких показателей инвалидизации и смертности, а также значительных экономических потерь. Сопутствующие хронические заболевания и состояния, количество которых увеличивается с возрастом, способствуют усилению тяжести и неблагоприятному прогнозу пневмонии. Сочетание патологий, патогенез которых включает гипоксический компонент, у одного больного определяет исключительную важность и необходимость понимания механизмов гипоксии (в том числе на клеточном уровне), а также социальную значимость проблемы защиты организма от кислородной недостаточности и сопутствующего энергодефицита, в том числе с помощью антигипоксантов с антиоксидантным и мембраностабилизирующим действием. В многочисленных экспериментальных и клинических исследованиях получены данные о плейотропных эффектах сукцината и сукцинатсодержащих антигипоксантов у больных с заболеваниями и состояниями, которые сопровождаются гипоксическими расстройствами. Создана достаточная доказательная база клинических исследований, в которых установлена целесообразность использования этилметилгидроксипиридина сукцината в составе комплексной терапии у больных с острыми и хроническими нарушениями мозгового кровообращения, тревожными расстройствами, у пациентов со стабильной стенокардией, острым коронарным синдромом, сердечной недостаточностью, артериальной гипертензией. Раннее добавление препарата в состав комбинированной терапии на догоспитальном этапе лечения пневмонии будет способствовать уменьшению возникновения острых осложнений или декомпенсации течения сопутствующих хронических состояний, ускорению регресса проявлений постинфекционной астении, вегетативной лабильности, когнитивного дефицита.
Community-acquired pneumonia is one of the most common infectious diseases of the 21st century and remains an important medical and social problem due to the relatively high rates of disability and mortality, as well as significant economic losses. Concomitant chronic diseases and conditions, the number of which increases with age, determine the severity and unfavorable prognosis of pneumonia. The combination of pathologies, the pathogenesis of which includes a hypoxic component, in one patient determines the crucial importance and need to understand the mechanisms of hypoxia (including at the cellular level), as well as the social significance of the problem of protecting the body from oxygen deficiency and concomitant energy deficiency, in particular with the help of antihypoxants with antioxidant and membrane-stabilizing action. Numerous experimental and clinical studies have shown data on the pleiotropic effects of succinate and succinate-containing antihypoxants in patients with diseases and conditions that are accompanied by hypoxic disorders. A sufficient evidence base of clinical studies has been created, in which the expediency of using ethylmethylhydroxypyridine succinate as a part of comprehensive therapy in patients with acute and chronic cerebrovascular disorders, anxiety disorders, stable angina, acute coronary syndrome, heart failure, arterial hypertension has been established. Early addition of the drug to the combination therapy at the prehospital stage of pneumonia treatment will help reduce the occurrence of acute complications or decompensation of concomitant chronic conditions, accelerate the regression of post-infectious asthenia, autonomic lability, cognitive deficits.
негоспітальна пневмонія; гіпоксія; етилметилгідроксипіридину сукцинат
внебольничная пневмония; гипоксия; этилметилгидроксипиридина сукцинат
community-acquired pneumonia; hypoxia; ethylmethylhydroxypyridine succinate
/38.jpg)
- Негоспітальна пневмонія у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія та профілактика. Режим доступу: http://www.ifp.kiev.ua/doc/staff/pneumonia_guidelines_2016.pdf. Назва з екрану.
- Негоспітальна пневмонія у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія та профілактика. Режим доступу: http://www.ifp.kiev.ua/ftp1/metoddoc/pneumonia_guidelines_2019_%5Brev29%5D.pdf. Назва з екрану.
- Metlay J.P., Waterer G.W., Long A.C. et al. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. Am. J. Respir. Crit. Care Med. 2019. V. 200. № 7. P. e45-e67. DOI: 10.1164/rccm.201908-1581ST.
- Чучалин А.Г. Респираторная медицина: В 3 т. Т. 2: Руководство. Под ред. А.Г. Чучалина. М.: ГЭОТАР-Медиа, 2017. 544 с.
- Brown J.S. Community-acquired pneumonia. Clin. Med. 2012. V. 12. № 6. P. 538-643. DOI: 10.7861/clinmedicine.12-6-538.
- Torres A., Peetermans W.E., Viegi G. еt al. Risk factors for community-acquired pneumonia in adults in Europe: a literature review. Thorax. 2013. V. 68. № 11. P. 1057-1065. DOI: 10.1136/thoraxjnl-2013-204282.
- Steel H.C., Cockeran R., Anderson R. еt al. Over view of community-acquired pneumonia and the role of inflammatory mechanisms in the immunopathogenesis of severe pneumococcal disease. Mediators Inflamm. 2013. V. 2013. P. 490346. DOI: 10.1155/2013/490346.
- Gau J., Acharya U., Khan S. et al. Pharmacotherapy and the risk for community-acquired pneumonia. BMC Geriatr. 2010. V. 10. P. 45. DOI: 10.1186/1471-2318-10-45.
- Sopena N., Pedro-Botet L., Mateu L. еt al. Community-acquired legionella pneumonia in elderly patients: characteristics and outcome. J. Am. Geriatr. Soc. 2007. V. 55. № 1. P. 114-119. DOI: 10.1111/j.1532-5415.2006.01021.x.
- Александрович Ю.С., Гордеев В.И. Оценочные и прогностические шкалы в медицине критических состояний. СПб.: ЭЛБИ-СПб, 2015. 320 с.
- Hespanhol V., Bárbara C. Pneumonia mortality, comorbidities matter? Pulmonology. 2020. V. 26. № 3. Р. 123-129. DOI: 10.1016/j.pulmoe.2019.10.003.
- Atamna A., Shiber S., Yassin M. et al. The accuracy of a diagnosis of pneumonia in the emergency department. Int. J. Infect. Dis. V. 89. 2019. P. 62-65. DOI: https://doi.org/10.1016/j.ijid.2019.08.027.
- Yeh J.-J., Lin C.-L., Kao C.-H. Relationship between pneumonia and cardiovascular diseases: A retrospective cohort study of the general population. Eur. J. Intern. Med. 2019. Vol. 59. P. 39-45. DOI: 10.1016/j.ejim.2018.08.003.
- Чучалин А.Г., Синопальников А.И., Страчунский Л.С. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. Клиническая микробиология и антимикробная химиотерапия. 2006. T. 8. № 1. С. 54-86.
- Maisel A., Neath S.X., Landsberg J. et al. Use of procalcitonin for the diagnosis of pneumonia in patients presenting with a chief complaint of dyspnoea: results from the BACH (Biomarkersin Acute Heart Failure) trial. Eur. J. Heart Fail. 2012. V. 14. № 3. 278-286. DOI: 10.1093/eurjhf/hfr177.
- Mueller C., Scholer A., Laule-Kilian K. et al. Use of B-type natriuretic peptide in the evaluation and management of acute dyspnea. N. Engl. J. Med. 2004. Vol. 350. P. 647-654. DOI: 10.1056/NEJMoa031681.
- Зайчик А.Ш., Чурилов Л.П. Основы общей патологии. Часть I. Основы общей патофизиологии. СПб.: ЭЛБИ-СПб, 1999. 624 с.
- Евсеева М.А., Евсеев А.В., Правдивцев В.А., Шабанов П.Д. Механизмы развития острой гипоксии и пути ее фармакологической коррекции. Обзоры по клинической фармакологии и лекарственной терапии. 2008. Т. 6. № 1. С. 3-25.
- Гипоксия. Адаптация, патогенез, клиника. Отв. ред. Ю.Л. Шевченко. СПб.: ЭЛБИ-СПб, 2000. 384 с.
- Kolditz M., Ewig S., Schutte H. et al. Assessment of oxygenation and comorbidities improves outcome prediction in patients with community-acquired pneumonia with a low CRB-65 score. J. Int. Med. V. 278. № 2. Р. 193-202. DOI: https://doi.org/10.1111/joim.12349.
- Corrales-Medina V., Musher D., Wells G. et al. Cardiac complications in patients with community-acquired pneumonia: incidence, timing, risk factors, and association with short-term mortality. Circulation. 2012. V. 125. P. 773-781. DOI: 10.1161/CIRCULATIONAHA.111.040766.
- Lee J.W., Ko J., Ju C. et al. Hypoxia signaling in human diseases and therapeutic targets. Exp. Mol. Med. 2019. V. 51. P. 1-13. DOI: https://doi.org/10.1038/s12276-019-0235-1.
- Chen P.S., Chiu W.T., Hsu P.L. et al. Pathophysiological implications of hypoxia in human diseases. J. Biomed. Sci. 2020. Vol. 27. P. 63. DOI: https://doi.org/10.1186/s12929-020-00658-7.
- Маньковська І.М., Серебровська Т.В. Мітохондрії як мішень інтервальної гіпоксії. Фізіологічний журнал. 2014. Т. 60. № 6. С. 75-87.
- Sheu S.S., Dirksen R.T., Pugh E.N. The 65th Symposium of the Society for General Physiologists: Energizing research in mitochondrial physiology and medicine. J. Gen. Physiol. 2011. Vol. 138. № 6. Р. 563-567. DOI: 10.1085/jgp.201110739.
- Lukyanova L.D., KirovaYu.I., Germanova E.L. Energotropic Effects of Intermittent Hypoxia: Role of Succinate-Dependent Signaling. In: Lei Xi & Tatiana V. Serebrovskaya (Eds). Intermittent Hypoxia and Human Diseases. Springer, UK, 2012. Chapter 20. P. 239-252.
- Vladimirov Ju.A. Deregulation of mitochondrial membrane permeability, necrosis and apoptosis. Deregulation pathology: A guide for doctors and biologists (ed. G.N. Kryzhanovsky). M.: Medicine, 2002. P. 127-156.
- Лукьянова Л.Д. Сигнальные механизмы гипоксии. М.: РАН, 2019. 215 с.
- Nelson D.L., Cox M. Lehninger Principles of Biochemistry: 7th ed. W.H. Freeman, 2017. 2656 p.
- Cadenas E., Boveris A. Mitochondrial Free Radical Production, Antioxidant Defenses and Cell Signaling. In: Grune T. (eds) Reactions, Processes. The Handbook of Environmental Chemistry. Springer, Berlin, Heidelberg, 2005. V. 20. DOI: https://doi.org/10.1007/b101153.
- Sazontova T.G., Anchishkina N.A., Zhukova A.G. et al. Reactive oxygen species and redox-signaling during adaptation to changes of oxygen level. Fiziol. Zh. 2008. V. 54. № 2. Р. 18-32. Review. [Russian].
- Krebs H.A. Some aspects of the energy transformation in living matter. Br. Med. Bull. 1953. V. 9. № 2. Р. 97-104. DOI: 10.1093/oxfordjournals.bmb.a074347.
- Rustin P., Munnich A., Rötig A. Succinate dehydrogenase and human diseases: new insights into a well-known enzyme. Eur. J. Hum. Genet. 2002. V. 10. P. 289-291. DOI: https://doi.org/10.1038/sj.ejhg.5200793.
- Воронина Т.А. Мексидол: спектр фармакологических эффектов. Журнал неврологии и психиатрии. 2012. № 12. С. 86-90.
- Оковитый С.В., Суханов Д.С., Заплутанов В.А., Смагина А.Н. Антигипоксанты в современной клинической практике. Клиническая медицина. 2012. № 9. С. 63-68.
- Виноградов В.М., Бобков Ю.Г. Фармакологическая стратегия адаптации. В кн.: Фармакологическая регуляция состояний дезадаптации. Под ред. Ю.Г. Бобкова. М., 1986. С. 3-11.
- Левченкова О.С., Новиков В.Е., Пожилова Е.В. Фармакодинамика и клиническое применение антигипоксантов. Обзоры по клинической фармакологии и лекарственной терапии. 2012. Т. 10. № 3. С. 3-12.
- Галенко-Ярошевский П.А., Чекман И.С., Горчакова Н.А. Очерки фармакологии средств метаболической терапии. М.: Медицина, 2001. 238 с.
- Горчакова Н.А., Гудивок Я.С., Гунина Л.М. и др.; под. общ. ред. С.А. Олейника, Л.М. Гуниной, Р.Д. Сейфуллы. Фармакология спорта. К.: Олимп. л-ра, 2010. 640 с.
- Кондрашова М.Н. Метаболические состояния митохондрий и основные физиологические состояния живой ткани. Свойства и функции макромолекул и макромолекулярных систем: Сборник статей. М., 1969. С. 135-160.
- Кондрашова М.Н., Маевский Е.И. Активация сукцинатдегидрогеназы как основа «анаэробной» работы и устойчивости к гипоксии. Митохондриальные процессы во временной организации жизнедеятельности. Под ред. М.Н. Кондрашовой. Пущино: НЦБИ АН СССР, 1978. С. 6-12.
- Лукьянова Л.Д., Германова Э.Л., Цыбина Т.А., Чернобаева Г.Н. Энерготропное действие сукцинатсодержащих производных 3-оксипиридина. 2009. Бюлл. экспер. биол. и мед. Т. 148. № 10. С. 388-392.
- Ерофеева С.Б. Место препарата мексидол в профилактике и лечении цереброваскулярных заболеваний. Фарматека. 2009. № 11. С. 34-38.
- Жердев В.П., Сариев А.К., Дворянинов А.А. Фармакокинетика водорастворимого антиоксиданта из класса 3-оксипиридина. Бюлл. экспер. биол. и мед. 1986. № 3. С. 325-327.
- Скворцова В.И., Стаховская Л.В., Нарциссов Я.Р. и др. Рандомизированное двойное слепое плацебо-контролируемое исследование эффективности и безопасности мексидола в комплексной терапии ишемического инсульта в остром периоде. Инсульт. 2006. № 18. С. 47-54.
- Эрлих А.Д., Грацианский Н.А. Изучение доказательной базы использования препаратов, содержащих этилметилгидроксипиридина сукцинат, у пациентов с инсультом и его последствиями. Рациональная фармакотерапия в кардиологии. 2014. Т. 10. № 4. С. 448-456.
- Смирнова И.Н., Федорова Т.Н., Танашян М.М., Суслина З.А. Клиническая эффективность и антиоксидантная активность Мексидола при хронических цереброваскулярных заболеваниях. Нервные болезни. 2006. № 1. С. 33-36.
- Янишевский С.Н. Опыт применения препарата Мексидол в лечении хронической недостаточности мозгового кровообращения у пациентов со стенозирующе-окклюзирующим поражением магистральных брахицефальных сосудов. Бюлл. эксперим. биол. мед. 2006. Приложение 1. С. 159-163.
- Дронов С.Н. Фармакология мексидола и его применение в психоневрологической практике. Актуальні проблеми сучасної медицини: Вісник української медичної стоматологічної академії. 2015. Т. 15. № 1–3(51). С. 328-335.
- Оганов Р.Г. Положительный опыт применения этилметилгидроксипиридина сукцината в лечении кардиологических больных. Кардиоваскулярная терапия и профилактика. 2017. Т. 16. № 5. С. 91-94. DOI: https://doi.org/10.15829/1728-8800-2017-5-91-94.
- Романова О.М., Талаєва Т.В., Третяк І.В. та ін. Метаболічна фармакотерапія у лікуванні пацієнтів з ішемічною хворобою серця та порушеннями ритму серця. Укр. мед. часопис. Т. 1. № 6(134) — XI/XII. C. 1-5.
- Громова О.А., Торшин И.Ю., Стаховская Л.В. и др. Опыт применения мексидола в неврологической практике. Журнал неврологии и психиатрии. 2018. Т. 118. № 10. С. 97-107.
- Воронина Т.А. Антиоксидант мексидол. Основные нейропсихотропные эффекты и механизм действия. Психофармакология и биологическая наркология. 2001. Т. 1. № 1. С. 2-12.
- Інструкція для медичного застосування лікарського засобу «ЕЛФУНАТ». Режим доступу: http://likicontrol.com.ua/%D1%96%D0%BD%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%86%D1%96%D1%8F/?[13929].
- Валеев В.В., Коваленко А.Л., Таликова Е.В. и др. Биологические функции сукцината (обзор зарубежных экспериментальных исследований). Антибиотики и химиотерапия. 2015. Т. 60. № 9–10. С. 33-37.
- ДудченкоА.М., Лукьянова Л.Д. Триггерная роль энергетического обмена в каскаде функционально-метаболических нарушений при гипоксии. В моногр.: Проблемы гипоксии: молекулярные, физиологические и клинические аспекты. Под ред. Л.Д. Лукьяновой, И.Б. Ушакова. М.: Истоки, 2004. С. 51-83.