Введение [1, 2]
Преэклампсия характеризуется появлением ранее отсутствовавших гипертензии и протеинурии на ≥ 20-й неделе гестации. При отсутствии протеинурии для постановки диагноза требуется наличие гипертензии вместе с признаками системного процесса (тромбоцитопения, повышенные уровни печеночных трансаминаз, почечная недостаточность, отек легких, зрительные или церебральные нарушения). Этот гестационно-специфический синдром встречается с частотой 3–5 % и является лидирующей причиной материнской и перинатальной заболеваемости и смертности. Преэклампсия может прогрессировать в эклампсию, характеризующуюся появлением больших судорожных приступов и поражающую 2,7–8,2 женщины на 10 000 родов. Осложнения преэклампсии и эклампсии включают церебральные инсульты, разрыв печени, отек легких, острую почечную недостаточность, что может привести к смерти матери. Неблагоприятные перинатальные исходы преэклампсии и эклампсии включают главным образом преждевременные роды, которые развиваются вторично относительно материнских и фетальных осложнений, задержку развития плода и смерть плода.
Существует множество физиологических механизмов, ответственных за поддержание нормального артериального давления в организме беременной. В настоящем кратком обзоре мы бы хотели остановиться лишь на одном из них — пути L-аргинин — NO. Как известно, эндотелиальная NO-синтаза (eNOS) взаимодействует с аминокислотой L-аргинин и образует из нее оксид азота (NO). Последний является мощным вазодилататором за счет взаимодействия с циклическим гуанозинмонофосфатом (цГМФ) (NO активирует цГМФ, и это ведет к снижению внутриклеточной концентрации ионов Са2+, что обусловливает расслабление гладкомышечных клеток; в результате сосуды расширяются).
Современные научные данные свидетельствуют о том, что нарушение работы пути L-аргинин — NO вносит важнейший вклад в развитие преэклампсии. Ниже мы рассмотрим, как снижение концентрации или функциональной способности NO негативно отображается на системной и местной адаптации к беременности, а также то, как экзогенное введение L-аргинина позволяет исправить эту ситуацию.
Нарушение системной адаптации [2]
Беременность является нормальным физиологическим процессом, сопровождающимся перестройкой множества систем организма. К гемодинамическим и гематологическим перестройкам относят увеличение объема циркулирующей крови (+ 40 %), частоты сердечных сокращений, сердечного выброса (+ 30–40 %), повышение содержания эритроцитов (+ 25 %), снижение общего периферического сопротивления сосудов (ОПСС).
Снижение ОПСС достигается за счет как периферической вазодилатации, так и уменьшения вязкости крови. Вазодилатация является результатом того, что эндотелиальные клетки сосудов продуцируют сосудорасширяющие молекулы: оксид азота, простациклин, эндотелиальный гиперполяризующий фактор и др.
О важности вклада NO в периферическую вазодилатацию свидетельствует тот факт, что у здоровых беременных женщин по сравнению с небеременными женщинами:
- увеличивается продукция NO, о чем свидетельствуют соответствующие цифры в плазме и сыворотке крови;
- увеличивается биоактивность NO, так как повышается уровень цГМФ в биологических жидкостях и тромбоцитах.
В настоящее время не вызывает сомнения тот факт, что повышение продукции NO в эндотелии сосудов и повышение биоактивности NO являются ключевыми механизмами, благодаря которым осуществляется гемодинамическая адаптация во время беременности.
Наиболее характерным нарушением при преэклампсии является развитие генерализованной периферической вазоконстрикции (сужение сосудов). Было выдвинуто предположение, что именно нарушение продукции эндотелиального NO может быть причиной этой вазоконстрикции. В частности, при проведении исследований у животных ингибирование продукции NO приводит к появлению тех же признаков, что и при преэклампсии у людей: развивается гипертензия, протеинурия, наблюдается задержка внутри–утробного развития.
Рассмотрим некоторые нарушения пути L-аргинин — NO при преэклампсии:
1) преэклампсия с низкой продукцией NO:
- дефицит L-аргинина или нарушение его транспорта;
- дефицит кофакторов, необходимых для нормальной активности eNOS, таких как ионизированный кальций и тетрагидробиоптерин;
- избыточное накопление асимметричного диметиларгинина, являющегося эндогенным ингибитором eNOS;
- наличие генетического полиморфизма гена eNOS, что приводит к снижению ферментативной активности eNOS;
2) преэклампсия с нормальной или высокой продукцией NO:
- повышенная деградация NO вследствие быстрого связывания с О2– в условиях окислительного стресса.
Вначале исследователей сбивал с толку тот факт, что продукция NO может быть не только пониженной, но и нормальной или даже повышенной. Эти данные выглядели парадоксальными. Позже, однако, было выяснено, что во всех случаях концентрация цГМФ в плазме, моче и тромбоцитах была снижена. Это означает, что, хотя у женщин с преэклампсией продукция NO может быть повышенной, концентрация цГМФ будет снижена, и, таким образом, биоактивность NO все равно будет низкой.
Окислительный стресс также является одним из основных факторов, вовлеченных в развитие эндотелиальной дисфункции и преэклампсии. Высвобождаемые при этом свободные радикалы способны связываться с NO, вызывая его дефицит.
Некоторые из причин нарастания окислительного стресса и снижения биодоступности NO при преэклампсии:
- наличие антител к АТ1-рецепторам ангиотензина II;
- ранняя патологическая плацентация с ишемией и гипоксией плаценты;
- нарушения углеводного и липидного метаболизма, связанные с инсулинорезистентностью, избыточным весом и ожирением;
- субклинические инфекции влагалища, системы мочевыводящих путей, парадонтоз.
Примечательно, что во многих случаях, представленных выше, экзогенное введение L-аргинина в виде инфузионных или пероральных растворов способно предотвратить, устранить или ослабить проявления преэклампсии и ее осложнений. Об этом подробнее будет сказано ниже в данной статье.
Нарушение местной адаптации [1, 3–9]
Помимо системных изменений, нормальная беременность сопровождается также рядом локальных перестроек. В частности, спиральные артерии матки подвергаются ремоделированию, в ходе которого из узких артерий они превращаются в более широкие (рис. 1). Это связано в основном с исчезновением средней (мышечной) оболочки артерий. Через такие низкорезистентные сосуды больше крови притекает к плаценте, обеспечивая адекватное поступление кислорода и питательных веществ к формирующемуся плоду.
/6_u.jpg)
Наука продолжает выяснять, как именно происходит процесс ремоделирования. Выполненные исследования позволяют предположить два возможных варианта этого процесса. Одна часть данных свидетельствует о том, что трофобластные клетки плода проникают сначала в ткани матки, а оттуда — в спиральные артерии и вызывают гибель гладкомышечных клеток и утрату эластических волокон. В результате мышечная оболочка утрачивается, и диаметр спиральных артерий увеличивается. Другая группа данных говорит о том, что гладкомышечные клетки не гибнут — вместо этого происходит их временная молекулярная и структурная дедифференцировка с обратным возвращением в гладкомышечные клетки после завершения беременности.
Важно отметить, что как бы ни протекал процесс ремоделирования в норме, во время преэклампсии отмечают его нарушение. Спиральные артерии продолжают быть суженными (рис. 1), что вдет к развитию маточно-плацентарной ишемии. Ишемизированная плацента высвобождает токсины (отсюда название — «токсикоз беременности»), которые при попадании в системный кровоток вызывают эндотелиальную дисфункцию, внутрисосудистое воспаление и активацию гемостатической системы. В итоге развиваются клинические проявления преэклампсии, а позже — и эклампсии.
Дополнительно в нетрансформированных спиральных артериях наблюдается атероз, напоминающий атеросклеротические бляшки, что еще больше усугубляет маточно-плацентарную ишемию.
Современные данные свидетельствуют о том, что нарушение ремоделирования спиральных артерий, во-первых, не является специфичным для преэклампсии, во-вторых, само по себе является недостаточным для того, чтобы вызвать преэклампсию. Тем не менее нарушение ремоделирования спиральных артерий является одним из основных патогенетических событий при преэклампсии.
Если роль NO в системной адаптации к беременности определена достаточно хорошо, то роль этой молекулы в местной адаптации менее ясна. Тем не менее ряд исследований указывают на важность NO в регуляции ремоделирования спиральных артерий.
В одной из работ, включавшей 14 здоровых беременных и 20 беременных с преэклампсией, патологические данные допплеровского исследования маточных артерий беременных с преэклампсией наблюдались параллельно со сниженной активностью NO-синтазы на маточно-плацентарной площадке. Авторы заключили, что скомпрометированная продукция NO на маточно-плацентарной площадке может играть важную роль в нарушении маточно-плацентарного кровотока и некоторых патологических проявлениях преэклампсии, таких как образование межворсинчатых тромбов и задержка развития плода.
В следующем исследовании в липосомы, селективно связывающиеся с эндотелием спиральных артерий матки и плацентарным лабиринтом, был инкапсулирован SE175, являющийся донором NO. При введении этих липосом мышам с выключенным геном eNOS (метод gene knockout) наблюдалось увеличение среднего диаметра спиральных артерий матки, снижение массы плаценты, увеличение массы плода. Кроме того, липосомы с SE175 уменьшали плацентарную экспрессию 4-гидроксиноненала, циклооксигеназы-1 и циклооксигеназы-2, что свидетельствовало об уменьшении окислительного стресса в плаценте.
В еще одной работе введение L-аргинина мышам с преэклампсией приводило к уменьшению гиперплазии интимы и атероза, что, в свою очередь, уменьшало толщину спиральных артерий матки.
Таким образом, выполненные исследования указывают на то, что экзогенное введение L-аргинина потенциально может способствовать правильному ремоделированию спиральных артерий матки и, следовательно, поддержанию маточно-плацентарного кровотока на оптимальном уровне. Это, в свою очередь, может способствовать уменьшению клинических проявлений преэклампсии и ее осложнений.
Результаты нового клинического исследования «ПЛАЦЕНТА» [10]
В 2019 г. были опубликованы результаты исследования, выполненного в Республике Узбекистан. Его названием служит акроним «ПЛАЦЕНТА» — ПЛАцентарная Циркуляция и исходы прЕэклампсии под влияНием Терапии Аргинином (PLACENTA — PLAcental Circulation and pre-Eclampsia outcomes uNder the Treatment with Arginine).
В данное проспективное двойное слепое рандомизированное многоцентровое (2-я клиника Ташкентской медицинской академии и Республиканский перинатальный центр) контролируемое клиническое исследование в общей сложности были включены 535 беременных, имевшие:
1) преэклампсию легкой степени в сроке гестации 27–29 недель;
2) плацентарную дисфункцию, развившуюся на фоне сочетания хронических заболеваний (анемия и инфекция мочевого тракта).
В подавляющем большинстве случаев пациентки имели две патологии одновременно (1 + 2). Нарушение маточно-плацентарно-плодового кровотока соответствовало степени 1Б.
Все женщины были разделены на две группы:
- в I группу (n = 265) вошли беременные, ведение которых осуществлялось по общепринятой методике согласно национальному руководству;
- во II группе (n = 270) к лечению добавляли инфузионный раствор Тивортин® (L-аргинин) 4,2% 100 мл 1 раз в день в течение 7–10 дней. Тивортин® производится фармацевтической компанией «Юрия-Фарм», Украина.
Исследование проводили в три этапа: I этап — при выявлении преэклампсии на 27–29-й неделе гестации, до лечения; II этап — спустя 7 дней лечения; III этап — на 37-й неделе гестации.
До лечения (I этап) между женщинами обеих групп не было достоверных различий по демографическим показателям, паритету, экстрагенитальной патологии, показателям маточно-плацентарно-плодового кровотока, за исключением того, что беременные II группы в 1,7 раза чаще болели детскими инфекциями по сравнению с беременными I группы.
Однако спустя 7 дней лечения Тивортином® (II этап) в группе женщин, получавших данный препарат, индекс резистентности (ИР) в левой маточной артерии был снижен на 22 %, в правой маточной артерии — на 9 %, в артерии пуповины — на 21 % по сравнению с женщинами, не получавшими данный препарат. Аналогично было снижено и систолодиастолическое отношение (СДО) в средней мозговой артерии плода на 8 % (рис. 2–4). Все различия были достоверными и свидетельствуют об улучшении маточно-плацентарно-плодового кровотока на фоне терапии Тивортином® (допплерометрия выполнена с помощью аппарата Simens Sonoline verso Pro; индекс резистентности представляет собой разницу между максимальной систолической скоростью кровотока и конечной диастолической скоростью кровотока, разделенную на максимальную систолическую скорость кровотока; систоло-диастолическое отношение представляет собой отношение максимальной систолической скорости кровотока к конечной диастолической скорости кровотока).
Интересно, что высокий ИР в артерии пуповины авторы связывают с централизацией гемодинамики плода. Отмеченное выше снижение ИР в артерии пуповины на фоне лечения Тивортином® свидетельствует об улучшении кровотока и уменьшении централизации кровообращения плода.
На 37-й неделе гестации (III этап) состояние маточно-плацентарно-плодового кровотока по-прежнему было достоверно лучшим в группе женщин, получавших Тивортин®, по сравнению с женщинами, не получавшими данный препарат. В то время как у женщин, не получавших Тивортин®, нарушение маточно-плацентарно-плодового кровотока ухудшалось до 2-й степени, у женщин с Тивортином® ИР в артерии пуповины приближался к норме, а СДО в средней мозговой артерии становилось нормальным.
К концу исследования маловодие у беременных, получавших Тивортин®, наблюдалось в 2,5 раза реже, чем у беременных, не получавших препарат. Аналогично преждевременное созревание плаценты наблюдалось в 2 раза реже; гиперплазия плацентарной ткани и ее отечность определялась в 3,3 раза реже.
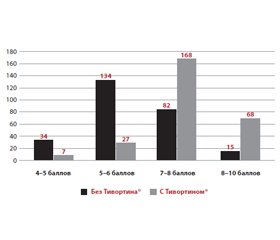
При анализе исхода родов в группе с Тивортином® соотношение вагинальных родов и родов путем кесарева сечения составило 2,7 : 1, в группе без Тивортина® — 1 : 2. При приеме Тивортина® масса новорожденных составила 3498,6 ± 64,5 г, без препарата — 2713,5 ± 72,4 г (p < 0,001). Данные для обеих групп по шкале Апгар представлены на рис. 5.
У рожениц, не получавших при наличии плацентарной дисфункции Тивортин®, в родах возникало большее число клинически значимых осложнений: атония матки — 5,6 %, кровотечение — 5,6 %, приращение плаценты — 5,6 %, дородовой разрыв плодных оболочек (ДРПО) — 44,4 %. Последний стал фоном для развития хорионамнионита (11 %), который, в свою очередь, способствовал развитию неубедительного состояния плода (11 %). Все это приводило к более частому рождению доношенных детей с легкой степенью асфиксии.
При сравнении некоторых из вышеприведенных данных с группой женщин, получавших Тивортин®, оказалось, что при приеме препарата ДРПО отмечался в 4,9 раза реже, чем в группе женщин, не получавших препарат. Средняя кровопотеря во всех исследуемых группах не превышала физиологическую, однако в группе, получавшей препарат, отмечалась тенденция к меньшей на 19,5 % кровопотере по сравнению с группой без препарата. Количество доношенных детей с низкой массой тела для гестационного срока при приеме Тивортина® было в 2,5 раза меньшим, чем в группе без препарата.
Сопоставление клинических и морфологических изменений показало, что дополнительное назначение к стандартной терапии Тивортина® в конце ІІ и начале ІІІ триместра беременности приводит:
- к предотвращению преждевременного созревания плаценты на 2,1 %;
- в 2 раза более редкому образованию в плацентарной ткани очагов некроза;
- в 10 раз более редкому возникновению признаков гипоксии;
- в 3,7 и 2,5 раза меньшему появлению очагов фиброза и дистрофических изменений соответственно.
Все перечисленное в конечном итоге положительно отразилось на перинатальных исходах в группе женщин, получавших Тивортин®, по сравнению с группой женщин, не получавших препарат.
Авторы исследования заключили, что своевременное лечение Тивортином® женщин с хроническими заболеваниями, осложненными плацентарной дисфункцией, в конце ІІ и начале ІІІ триместра беременности улучшает перинатальные исходы, приводит к снижению числа преждевременных родов и асфиксии новорожденных.
Применение в комплексной терапии преэклампсии и при коррекции выявленных нарушений в маточно-плодово-плацентарном комплексе Тивортина® значительно улучшает маточно-плацентарно-плодовый кровоток. Это позволяет пролонгировать беременность до оптимального срока родоразрешения.
Преимущества от назначения L-аргинина при беременности [10–13]
По состоянию на сегодняшний день было выполнено два базовых метаанализа, в которых оценивали эффективность L-аргинина у беременных женщин.
В первый из них, выполненный в 2013 г., было включено 5 плацебо-контролируемых исследований. Было установлено, что L-аргинин приводил к достоверному снижению диастолического артериального давления и пролонгированию гестационного возраста при беременности.
Во второй метаанализ, выполненный в 2014 г., было включено 7 рандомизированных контролируемых исследований (916 женщин с гестационной гипертензией). Было выяснено, что L-аргинин превосходит плацебо в отношении снижения диастолического артериального давления и пролонгирования беременности у пациенток с гестационной гипертензией с протеинурией или без нее. При этом влияние на снижение систолического артериального давления и увеличение веса новорожденных не было статистически достоверным.
В 2 рандомизированных контролируемых исследованиях, включенных в рассматриваемый метаанализ 2014 г. (524 женщины), было оценено влияние L-аргинина на частоту развития преэклампсии. Было выяснено, что L-аргинин более эффективен в снижении преэклампсии/эклампсии по сравнению с плацебо (отношение шансов 0,384; 95% доверительный интервал 0,25–0,58).
Таким образом, согласно результатам двух метаанализов, эффективность L-аргинина, по-видимому, не вызывает сомнений. Тем не менее авторы отмечают, что для окончательных выводов необходимо проведение более крупных многоцентровых рандомизированных контролируемых исследований.
В большинстве клинических исследований, включенных в два обсуждаемых метаанализа, L-аргинин назначали из расчета в среднем 25 г/день внутривенно или 8 г/день перорально в течение 10 дней (средняя доза 25 г/день означает, что диапазон доз мог колебаться приблизительно от 20 до 30 г/день; средняя доза 8 г/день означает, что диапазон доз мог колебаться приблизительно от 4 до 12 г/день; средняя длительность лечения 10 дней означает, что диапазон длительности лечения мог колебаться приблизительно от 5 до 15 дней).
Мы имели доступ к полнотекстовой версии метаанализа 2014 г., что вместе с рассмотренным выше исследованием PLACENTA позволило ответить на вопрос, в какие сроки врачи чаще всего назначали L-аргинин для борьбы с развившейся гестационной гипертензией (табл. 1). В основном это осуществлялось на 24–36-й неделе гестации. В то же время для профилактики гестационной гипертензии по данным одного исследования L-аргинин могли назначать с 14-й недели гестации до момента родов.
Кроме того, в руководстве Общества акушеров и гинекологов Канады (SOGS) по диагностике, оценке и лечению гипертонических расстройств в период беременности 2014 года отдельной рекомендацией отмечено, что полезным будет рассмотреть применение L-аргинина (IB).
Вопросы профилактики развития преэклампсии изучались также и отечественными учеными. В исследовании Ю.В. Давыдовой и соавт. 2019 года изучалась эффективность профилактики развития тяжелой преэклампсии при планируемой беременности путем коррекции эндотелиальной дисфункции с применением L-аргинина преконцепционно и в I триместре беременности у женщин с тяжелой преэклампсией в анамнезе. В качестве L-аргинина использовался препарат Тивортин® аспартат: за 3 месяца до настоящей беременности и в ранние сроки гестации (до 12 недель беременности) женщины получали перорально по 5 г (2,85 L-аргинина) в сутки. Было установлено, что достижение контроля над артериальной гипертензией в результате сочетания базовой гипотензивной терапии с эффективной терапией препаратом Тивортин® аспартат способствует снижению частоты акушерских осложнений (ятрогенных преждевременных родов, отслойки плаценты). Показано, что коррекция эндотелиальной дисфункции препаратом Тивортин® аспартат способствует адекватному увеличению клеток-предшественников эндотелиоцитов, что, в свою очередь, оптимизирует эндотелиальную функцию у женщин с преэклампсией в анамнезе и высоким риском ее повторения. Использование препарата Тивортин® аспартат в пероральной форме имело несколько преимуществ: удобство в применении, неинвазивный характер применения, высокий профиль безопасности, а также доказанная в ходе исследования эффективность. Таким образом, пероральное применение препарата Тивортин® аспартат рекомендовано для коррекции эндотелиальной дисфункции у женщин группы высокого риска преэклампсии.
Выводы
Данные патофизиологических исследований свидетельствуют о значимой роли нарушений пути L-аргинин — NO в развитии системных проявлений преэклампсии.
Кроме того, нарушения этого пути, по-видимому, вносят важный вклад в отсутствие полноценного ремоделирования спиральных артерий матки.
Борьба с развившейся гестационной гипертензией
По данным зарубежной литературы, для борьбы с развившейся гестационной гипертензией L-аргинин назначают в основном на 24–36-й неделе гестации в средней дозе 25 г/день внутривенно (допустимый диапазон доз — приблизительно 20–30 г/день) или 8 г/день перорально (допустимый диапазон доз — приблизительно 4–12 г/день) в среднем в течение 10 дней (диапазон — приблизительно 5–15 дней).
Возможно сочетание обоих путей введения L-аргинина, например, последовательная смена внутривенного пути введения на пероральный.
По данным исследования, выполненного в Узбекистане, для достижения клинического эффекта в те же сроки достаточно назначать 4,2 г/день внутривенного L-аргинина (Тивортин®).
Профилактика гестационной гипертензии
По данным одного зарубежного исследования, L-аргинин назначали с 14-й недели гестации до дня родов в дозе 6,6 г/день перорально.
По данным отечественного исследования, применение L-аргинина перорально по 5 г (2,85 L-аргинина) в сутки преконцепционно (за 3 месяца до зачатия) и в период ранней гестации (до 12 недель беременности) рекомендовано для женщин с тяжелой преэклампсией во время предыдущей беременности с целью снижения частоты акушерских осложнений в ходе текущей беременности (ятрогенных преждевременных родов, отслойки плаценты).

/6_u.jpg)
/8_u.jpg)
/8_u2.jpg)
/8_u3.jpg)