Журнал «Здоровье ребенка» Том 15, №6, 2020
Вернуться к номеру
Можливостi використання шкали Bronchitis Severity Score для оцiнки eфективностi лiкування гострого бронхiту в дiтей
Авторы: Абатуров O.Є., Токарєва Н.М.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Упродовж останніх майже ста років у структурі загальної захворюваності незалежно від вікового цензу гострі респіраторні вірусні інфекції (ГРВІ) посідають перше місце, що підтверджено інформаційними бюлетенями Всесвітньої організації охорони здоров’я й офіційними статистичними й епідеміологічними урядовими звітами різних країн із проблем здоров’я дитини. У світі, незалежно від рівня розвитку країни, рівень захворюваності на ГРВІ у дітей перевищує рівень усіх інших інфекцій у 7–7,5 раза, що в 1,5–3 рази більше, ніж у дорослих, а в когорті дітей до 3 років їх питома вага становить до 65,0 % від всіх зареєстрованих гострих інфекційних захворювань. За даними українських дослідників, у 20,0 % пацієнтів із ГРВІ реєструється гострий бронхіт (ГБ). У дітей віком від 1 до 3 років захворюваність на ГБ є досить сталою і коливається в межах 75–250 на 1000 дітей, а серед госпіталізованих в інфекційні відділення для дітей із респіраторною патологією в кожної другої або третьої дитини верифіковано діагноз ГБ, що становить від 50,0 до 75,0 % госпіталізованих. В етіологічній структурі ГРВІ кожні 15–20 років відбуваються суттєві зміни структури основних збудників, що, безумовно, суттєво впливає на існуючі діагностичні та лікувальні заходи щодо терапії ГРВІ. Останнім часом дослідження щодо етіології інфекцій верхніх дихальних шляхів показали, що найчастіше причинно-значущими чинниками є віруси, а використання сучасних методів діагностики дозволяє встановити етіологічний фактор ГРВІ у 56,0–80,0 % випадків. Мета дослідження: вивчити клініко-імунологічні особливості перебігу ГБ у дітей від 1 до 6 років з оцінкою тяжкості стану в гострому періоді захворювання та в періоді реконвалесценції за допомогою шкали Bronchitis Severity Score (ВSS); визначити клініко-анамнестичні та лабораторні предикти ризику розвитку тривалого перебігу ГБ у дітей від 1 до 6 років. Матеріали та методи. У роботі наведені матеріали клінічного спостереження, клініко-лабораторного й інструментального обстеження 122 дітей віком від 1 до 6 років із ГБ. Висновки. Установлено, що клініко-анамнестичні предикти (перинатальне ураження центральної нервової системи, низька маса тіла при народженні, паління матері), ступінь тяжкості ГБ (за показником загальної кількості балів за BSS) та фазові зміни концентрації антимікробних пептидів й інтерферонів визначають ризик розвитку тривалого перебігу захворювання. Визначення ступеня тяжкості стану в дітей із ГБ із використанням BSS дозволяє удосконалити терапевтичні заходи та надає можливість диференційованого вибору патогенетично обґрунтованого лікування на етапі стаціонарного ведення пацієнтів.
Актуальность. В течение последних почти ста лет в структуре общей заболеваемости острые респираторные вирусные инфекции (ОРВИ) занимают первое место, что подтверждено информационными бюллетенями Всемирной организации здравоохранения и официальными статистическими и эпидемиологическими правительственными отчетами различных стран по проблемам здоровья ребенка. В мире, независимо от уровня развития страны, уровень заболеваемости ОРВИ у детей превышает уровень всех инфекций в 7–7,5 раза, что в 1,5–3 раза больше, чем у взрослых, а в когорте детей до 3 лет их удельный вес составляет до 65,0 % от всех зарегистрированных острых инфекционных заболеваний. По данным украинских исследователей, у 20,0 % пациентов с ОРВИ регистрируется острый бронхит (ОБ). В возрасте от 1 до 3 лет заболеваемость ГБ достаточно постоянная и колеблется в пределах 75–250 на 1000 детей, а среди госпитализированных в инфекционные отделения для детей с респираторной патологией у каждого второго или третьего ребенка верифицирован диагноз ОБ, что составляет от 50,0 до 75,0 % госпитализированных. В этиологической структуре ОРВИ каждые 15–20 лет происходят изменения состава основных возбудителей, что, несомненно, влияет на существующие дигностические и лечебные мероприятия относительно терапии ОРВИ. В последнее время исследования относительно этиологии инфекций верхних дыхательных путей показали, что чаще всего причинно-значимыми факторами являются вирусы, а использование современных методов диагностики позволяет установить этиологический фактор ОРВИ в 56,0–80,0 % случаев. Цель исследования: изучить клинико-иммунологические особенности течения ОБ у детей от 1 до 6 лет с оценкой тяжести состояния в остром периоде заболевания и в периоде реконвалесценции с использованием шкалы Bronchitis Severity Score (ВSS); определить клинико-анамнестические и лабораторные факторы риска развития длительного течения ОБ у детей от 1 до 6 лет. Материалы и методы. В работе приведены материалы клинического наблюдения, клинико-лабораторного и инструментального обследования 122 детей в возрасте от 1 до 6 лет с ОБ. Выводы. Установлено, что клинико-анамнестические предикты (перинатальное поражение центральной нервной системы, низкая масса тела при рождении, курение матери), степень тяжести ОБ (по показателю общего количества баллов по BSS) и фазовые изменения концентрации антимикробных пептидов и интерферонов определяют риск развития длительного течения заболевания. Определение степени тяжести состояния у детей с ОБ с использованием BSS позволяет усовершенствовать терапевтические мероприятия и предоставляет возможность дифференцированного выбора патогенетически обоснованного лечения на этапе стационарного ведения пациентов.
Background. In the structure of the overall morbidity, acute respiratory viral infections (ARVI) occupy the first place, which is confirmed by the official statistical and epidemiological government reports of various countries on children health problems. The incidence of ARVI in children exceeds the level of all infections by 7–7.5 times, which is 1.5–3 times as much as in adults, and in the cohort of children under 3 years of age, their share is up to 65.0 % of all registered acute infectious diseases. According to Ukrainian researchers, acute bronchitis (AB) is recorded in 20.0 % of patients with ARVI. In the etiological structure of ARVI, changes in the composition of the main pathogens occur every 15–20 years, which certainly affects the existing diagnostic and therapeutic measures. Studies on the etiological structure of diseases of the upper respiratory tract have shown that causative agents are mostly viruses, and the use of modern diagnostic methods makes it possible to establish the etiological factor of ARVI in 56.0–80.0 % of cases. The purpose of the study: to investigate the clinical features of the course of AB in children from 1 to 6 years old with an assessment of the severity of the condition in the acute period of the disease and in the period of convalescence using the Bronchitis Severity Scale; to determine clinical anamnestic and laboratory risk factors for the development of a protracted course of AB in children from 1 to 6 years old. Materials and methods. The work presents materials of clinical observation, clinical laboratory and instrumental examination of 122 children aged 1 to 6 years with AB. Conclusions. It has been found that clinical and anamnestic predictors (perinatal lesion of the central nervous system, low birth weight, maternal smoking), the severity of AB (in terms of the total score on the Bronchitis Severity Scale) and phase changes in the concentration of antimicrobial peptides and interferons determine the risk of developing a protracted course of the disease. The determination of the severity of the condition in children with AB using the Bronchitis Severity Scale makes it possible to improve therapeutic measures and provides an opportunity for a differentiated choice of pathogenetically based treatment at the stage of inpatient management.
гострий бронхіт; діти; Bronchitis Severity Score
острый бронхит; дети; Bronchitis Severity Score
acute bronchitis; children; Bronchitis Severity Scale
Вступ
Матеріали та методи
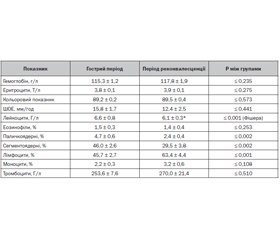
Результати та обговорення
Обговорення
Висновки
- Абатуров А.Е. Система неспецифической защиты респираторного тракта Хемокин ССL20/MIP-3a. Здоровье ребенка. 2011. 6(33). 150-155.
- Абатуров О.Є., Токарєва Н.М. Ефективність лікування респіраторних вірусних захворювань у дітей із використанням бактеріальних лізатів. Здоровье ребенка. 2015. 1(60). 21-24.
- Адаптована клінічна настанова, заснова на доказах. Грип та гострі респіраторні інфекції. 2014. http://mtd.dec.gov.ua/images/dodatki/ 2014_499_GRYP/2014_499AKN_ GRYP_ GRI.pdf
- Адаптована клінічна настанова, заснована на доказах. Ведення найбільш поширених станів у дітей віком до 5 років у контексті інтегрованого ведення хвороб дитячого віку. 2016. http://mtd.dec.gov.ua/images/dodatki/2016_438_IVHDV/2016_438_AKN_ IVHDV.pdf
- Антипкін Ю.Г., Волосовець О.П., Майданник В.Г. та ін. Стан здоров’я дитячого населення — майбутнє країни. Здоровье ребенка. 2018. 13(1). 1-11.
- Бекетова Г.В., Солдатова О.В. Комплексная терапия острых респираторных инфекций у детей. Современная педиатрия. 2016. 5(77). 34-41.
- Зайков С.В., Катилов А.В., Лайко Л.И., Дмитриев Д.В. Острый бронхит у детей, принципы диагностики и терапии. Mеdikal Nature. 2017, травень. 1(21). 2-6.
- Івахно О.П., Козярін І.П., Чорна В.В., Мазнюк В.М. Динаміка стану здоров’я дитячого населення за останні роки реформування медичної сфери України. Збірник наукових праць співробітників НМАПО ім. П.Л. Шупика. 2015. 24(3). 447-454.
- Крючко Т.О., Абатуров О.Є., Ткаченко О.Я., Токарєва Н.М. Пріоритетність застосування фітопрепаратів у лікуванні вірусних респіраторних інфекцій у дітей. Здоровье ребенка. 2018. 13(1). 59-65.
- Леженко Г.О., Пашкова О.Є., Крайня Г.В. Вміст антимікробних пептидів у дітей раннього віку, хворих на гострий бронхіт, залежно від етіологічного чинника. Здоровье ребенка. 2017. 12(1). 95-102.
- Майданник В.Г. Клинические рекомендации по диагностике и лечению осложнений острых респираторних инфекций у детей. Киев, 2016. 56 с.
- Майданник В.Г., Емчинская Е.А. Клинические рекомендации по диагностике и лечению острых бронхитов у детей с позиции доказательной медицины. Киев, 2014. 56 с.
- Марушко Ю.В., Шеф Г.Г. Гострий бронхіт у дітей. Дитячий лікар. 2015. 8(45). 28-36.
- Марушко Ю.В. Захворювання органів дихання у дітей. Невідкладні стани в дитячій пульмонології: Навчальний посібник. 2013. 216 с.
- Наказ МОЗ України від 13.01.2005 р. № 18 «Про затвердження Протоколів надання медичної допомоги дітям за спеціальністю «дитяча пульмонологія».
- Овчаренко Л.С., Бережний В.В., Лапшин В.Ф. та ін. Гострі бронхіти у дітей: Навчальний посібник. Запоріжжя: Просвіта, 2016. 131 с.
- Самсыгина Г.А. Кашель у детей. Москва: ГЭОТАР-Медиа, 2016. 182 с.
- Таточенко В.К. Болезни органов дыхания у детей: Практическое руководство. Москва: Педиатръ, 2012. 480 с.
- Уніфікований клінічний протокол первинної медичної допомоги «Інтегроване ведення хвороб дитячого віку». mtd.dec.gov.ua>dodatki>2016_438_IVHDV>2016_438_AKN_IVHDV
- Уніфікований клінічний протокол первинної медичної допомоги дорослим та дітям «Гострі респіраторні інфекції». Наказ МОЗ України від 16.07.2014 № 49.
- Berlutti F., Pantanella F., Natalizi T. et al. Antiviral properties of lactoferrin-a natural immunity molecule. Molecules. 2011, Aug. 16. Vol. 16(8). 6992-7018. doi: 10.3390/molecules16086992.
- Drajac C., Laubreton D., Riffault S., Descamps D. Pulmonary Susceptibility of Neonates to Respiratory Syncytial Virus Infection: A Problem of Innate Immunity. J. Immunol. Res. 2017. 87(34). 504. doi: 10.1155/2017/8734504.
- Jahani S., Shakiba А., Jahani L. The Antimicrobial Effect of Lactoferrin on Gram-Negative and Gram-Positive Bacteria. International Journal of Infection. 2015. Vol. 2(3). e27954. doi: 10.17795/iji27594.
- Kalayci S., Iyigundogdu Z.U., Yazici M.M. et al. Evaluation of Antimicrobial and Antiviral Activities of Different Venoms. Infect Disord Drug. Targets. 2016. Vol. 16(1). 44-53. PMID: 26743517.
- Kardos P., Lehrl S., Kamin W., Matthys H. Assessmentofthe effect of pharmacotherapy in commoncold/acutebronchitis — the Bronchitis Severity Scale. Pneumologie. 2014, Aug. Vol. 68(8). 542-546. doi: 10.1055/s-0034-137733223.1.
- Kearney S.C., Dziekiewicz М., Feleszko W. Immunoregulatory and immunostimulatoryresponses of bacterial lysates in respiratory infections and asthma Ann Allergy AsthmaImmunol. 2015, May. Vol. 114(5). 364-369. doi: 10.1016/j.anai.2015.02.008. Epub 2015, Mar 6.
- Lefevre M., Racedo S.M., Denayrolles M. et al. Safety assessment of Bacillus subtilis CU1 for use as a probiotic in humans. Regul. Toxicol. Pharmacol. 2017, Feb. Vol. 83. 54-65. doi: 10.1016/j.yrtph.2016.11.010.
- Lefevre M., Racedo S.M., Ripert G. et al. Probiotic strain Bacillus subtilis CU1 stimulates immune system of elderly during common infectious disease period: a randomized, double-blind placebo-controlled study. Immun. Ageing. 2015, Dec 3. 12. 24. doi: 10.1186/s12979-015-0051-y.
- Mishlanov V.Y. Defensins and other antimicrobial peptides and a role of neutrophil protein-synthesing function disorders for pathogenesis of respiratory diseases. Pulmonologiya. 2014. Vol. 3. 104-112. doi: 10.18093/0869-0189-2014-0-3-104-112.
- Moawad E.M., Рaron М.А., Maher M.R. Cross-sectional evaluation of the Bronchitis Severity Score in Egyptian children: A move to reduce antibiotics. S. Afr. Med. J. 2017, March 29. Vol. 107(4). 342345. doi: 10.7196/SAMJ.2017.v107i4.11428.
- Plusa T. Butamirate citrate in control of cough in respiratory tract inflammation. Pol. Merkur. Lekarski. 2017. Vol. 43(254). 69-74.
- Ragland S.A., Criss A.K. From bacterial killing to immune modulation: Recent insights into the functions of lysozyme. PLoS Pathog. 2017, Sep 21. Vol. 13(9). 35-38.
- Smith S.M., Fahey T., Smucny J., Becker L.A. Antibiotics for acute bronchitis. Cochrane Database of Systematic Reviews. 2017. 6. CD000245.
- Sumi C.D., Yang W., Yeo I.C., Hahm Y.T. Antimicrobial peptides of the genus Bacillus: a new era for antibiotics. Can. J. Microbiol. 2015, Feb.Vol. 61(2). 93-103. doi: 10.1139/cjm-2014-0613.

/31.jpg)
/32.jpg)
/33.jpg)
/34.jpg)