Международный неврологический журнал Том 16, №6, 2020
Вернуться к номеру
Настанова S3 «Реабілітаційне лікування парезу верхньої кінцівки після інсульту» Німецького товариства нейрореабілітації: повна версія
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
1. Класи доказовості, оцінка якості доказів і сили рекомендацій
Метою створення настанов S2e і S3 є формулювання рекомендацій, заснованих на доказах, для застосування в клінічній практиці на основі всебічного систематичного пошуку й критичної оцінки наявних даних.
Настанови S2e зазвичай розробляються однією групою спеціалістів. Настанови S3 розробляються різними групами спеціалістів відповідно до консенсусного методу настанов S2k (додатково до систематизованої доказової бази). Ця настанова є настановою S3. Цей документ наводить загальний план методу, який ґрунтується на інструкціях Асоціації наукових медичних товариств Німеччини (Arbeitsgemeinschaft wissenschaftlicher medizinischer Fachgesellschaften — AWMF) (https://www.awmf.org/leitlinien/awmf-regelwerk.html) і детально роз’яснюється авторами Platz і Quintern у 2009 році та Platz у 2017 році в контексті розробки рекомендацій Німецького товариства нейрореабілітації (DGNRL). Мета полягає в тому, щоб читач міг прослідкувати різні етапи оцінки й класифікацій, які є основою рекомендацій, заснованих на доказах. Створення настанов розподіляється на такі робочі етапи (від оцінки доказів до формулювання рекомендацій):
(I) для окремих джерел (оригінальні статті, систематичні огляди й метааналізи):
1) методологічна оцінка (на предмет валідності) окремих джерел;
2) класифікація окремих джерел з огляду на доказовість (від 1a до 5 відповідно до Oxford Centre for Evidence-based Medicine — Levels of Evidence («Оксфордський центр з доказової медицини — рівні доказів»), версія березня 2009 року, http://www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidence-march2009/);
3) резюме висновків, отриманого контенту та рекомендації з окремих джерел;
(II) резюме даних з усіх джерел, у яких обговорюється одне питання (наприклад, метод лікування) (оригінальні статті, систематичні огляди й метааналізи):
4) докази найвищого класу (за даними Центру доказової медицини (CEBM)), які в основному використовуються як доказова база для створення рекомендацій щодо лікування;
5) резюме оцінки контенту (за якістю й доказовістю) включених джерел із точки зору довіри до них з огляду на силу ефекту (лікування);
6) класифікація створених рекомендацій для практичного клінічного застосування.
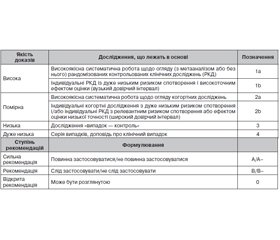
Класи доказів включених досліджень/робіт були узагальнені щодо кожного питання та/або цільового критерію. Зазначено найвищий клас доказів згідно з класифікацією CEBM, який в основному використовувався як доказова база для рекомендації щодо лікування, тобто від 1а (систематичний огляд) до 5 (відсутні докази, думка експерта).
Якість доказів щодо конкретного питання або цільового параметра настанов узагальнено й розподілено на чотири категорії, подібні до системи GRADE («Ступені рекомендацій, оцінка, розвиток та оцінка» (Grades of Recommendation, Assessment, Development and Evaluation»; www.gradeworkinggroup.org )) (Balshem et al., 2011):
— висока якість — ми впевнені, що реальний ефект близький до оціночного ефекту;
— помірна якість — ми маємо деяку довіру до оціночного ефекту: реальний ефект, ймовірно, близький до прогнозованого ефекту, але існує ймовірність того, що він має відповідні відмінності;
— низька якість — ми маємо обмежену довіру до оціночного ефекту: реальний ефект може дещо відрізнятися від оціночного ефекту;
— дуже низька якість — наша довіра до оціночного ефекту дуже мала: реальний ефект, ймовірно, відрізняється від оціночного ефекту.
Така система оцінки якості (GRADE) має на меті показати оцінений рівень стабільності даних для конкретної терапевтичної опції. Наприклад, висока якість превалює, коли метааналізи численних рандомізованих контрольованих досліджень з великою кількістю пацієнтів і низькою варіабельністю (неоднорідністю) результатів протягом усього дослідження дають підстави оцінювати терапевтичний ефект як дуже певний, і можна припустити, що подальші дослідження не сильно вплинуть на цю оцінку. На іншому боці спектра оцінювання знаходяться ситуації, коли не проводилося жодних контрольованих досліджень, які б дали певну визначеність, наприклад, при оцінці терапевтичного ефекту. У цьому випадку припускається дуже низька якість.
Якість може бути оцінена таким чином лише тоді, коли будуть відомі й оцінені всі дані клінічних досліджень, систематичних оглядів і метааналізів. У цьому випадку остаточне оцінювання якості є вирішальним для прийняття клінічного рішення, а отже, для формулювання рекомендації. Оцінка якості доказів відповідно до системи GRADE базується на методичному результаті. У цих настановах оцінка базувалася на терапевтичних ефектах щодо активних функцій верхньої кінцівки (на пошкодженому або активному рівні) і/або самооцінці можливості використовувати паралізовану верхню кінцівку, а не на потенційних додаткових ефектах щодо базових здібностей у повсякденному житті, участі в найбільш широкому сенсі, якості життя, записах про прийнятність лікування або шкоду, спричинену лікуванням (побічні ефекти).
Рекомендація щодо або проти певного втручання (відповідний цільовий критерій) визначається лише відповідно до вищенаведеної специфікації узагальненої якості доказів для запитання.
Відповідно до методу ступені рекомендацій встановлюються членами робочої групи як частина формального консенсусного процесу. Окрім критеріїв GRADE, чітко визначені додаткові критерії для клінічної оцінки застосовності й переміщення доказів (Guyatt et al., 2006; Andrews et al., 2013):
— оцінка використання проти ризику;
— сила ефекту результатів дослідження й довіра до їх оцінки;
— клінічна релевантність (наскільки можливо вимірювати показники ефективності щодо відповідності досліджуваних груп і застосованих доз);
— відповідність показників і переваг постраждалих осіб;
— патопсихологічні й клінічні ймовірності;
— практичність настанов щодо їх використання в актуальній терапевтичній практиці (включно з потребою в ресурсах і споживанням тощо, структурною якістю, якої ще не існує);
— етичні зобов’язання (необхідність діяти).
Класифікація рекомендацій у цих настановах відповідає нормам AWMF (AWMF 2012) — категорії: «повинно» (A), «слід» (B) або «можна» (0) і/або негативні рекомендації/відмови: «не повинно» (A–), «не слід» (B–) (табл. 4).
Докази високої якості із самого початку використовуються для створення сильних рекомендацій, докази помірної якості — для створення рекомендацій і докази низької якості — для створення відкритих рекомендацій. Додаткові критерії для клінічної оцінки застосовності й переміщення доказів, що зазначені вище, можуть призвести до відхилення від цього правила в межах розробки рекомендацій: на основі доказів можна сформулювати більш сильні або більш слабкі рекомендації, ніж були б у випадку, якщо єдиною основою була б якість доказів.
Також слід пам’ятати, що рекомендації ефективні в контексті індивідуальних цілей реабілітації пацієнта. Вони застосовуються в тих ситуаціях процесі лікування, коли покращання активної функції верхньої кінцівки (на пошкодженому або активному рівні) і/або самооцінка можливості використовувати паралізовану верхню кінцівку є індивідуальною метою лікування.
2. Актуальність
Парез верхньої кінцівки — це одне з найпоширеніших ушкоджень унаслідок пошкодження мозку, наприклад інсульту. Геміпарез (параліч лише однієї сторони тіла) є одним з найбільш значущих предикторів тривалої інвалідності. Порушення рухової функції враженої верхньої кінцівки можуть бути причиною до 50 % змін функціональної автономності хворих на інсульт (Mercier et al., 2001). Ступінь пошкодження функції верхньої кінцівки через кілька тижнів після інсульту асоціюється зі ступенем інвалідності через пів року (Hankey et al., 2002; Meijer et al., 2003). Це відображається, наприклад, у певних труднощах у повсякденній діяльності та потребі в допомозі в повсякденній активності й виконанні соціальних ролей (Desrosiers et al., 2003). Параліч верхньої кінцівки також впливає на можливості пацієнтів знову повернутися до повноцінного повсякденного життя після інсульту.
3. Симптоми
Тяжкість паралічу верхньої кінцівки після інсульту зазвичай не є поширеним явищем. У разі парезу верхньої кінцівки, швидше за все, має місце бімодальний розподіл численних пацієнтів із легкими або тяжкими обмеженнями функції верхньої кінцівки (Nakayama et al., 1994; Wade et al., 1983). Тобто в багатьох пацієнтів функціонування ураженої верхньої кінцівки відсутнє, і така ж кількість пацієнтів може виконувати численні функції верхньою кінцівкою, хоча й незграбно.
У пацієнтів із тяжким парезом верхньої кінцівки виконання повсякденних функцій цією кінцівкою часто є неможливим або функціонування паретичної руки здійснюється лише в дуже обмеженій мірі. Пацієнти мають істотні проблеми з активною руховою функцією із значними обмеженнями виконання рухів або стабілізації окремих сегментів кінцівок, їх координації, а також інтеграції динамічних аспектів руху та функції утримання будь-яких предметів. Симптоми порушеної активної рухової функції часто супроводжуються симптомами «спастичного» діапазону з патологічною реакцією м’язів на розтягнення, підвищеною резистентністю щодо пасивних рухів, неправильною поставою і скороченням м’яких тканин.
У пацієнтів із легким парезом верхньої кінцівки активні рухи в цій кінцівці збережені майже в повному обсязі, м’язова сила в ній значною мірою зберігається в межах норми, і, відповідно, такі пацієнти можуть користуватися паретичною рукою для виконання численних повсякденних справ. Однак рухи часто все ще повільні і, з клінічної точки зору, незграбні. У повсякденному житті рухові функції вимагають складних і різноманітних сенсомоторних навичок, таких як швидкість, фракціонованість сегментарних рухів у кінцівці, можливість виконання захоплення предметів та спритність при маніпулюванні предметами, цільова орієнтація рухів або точна координація комплексу «око — рука», наявність яких необхідна в різних комбінаціях при виконанні повсякденних завдань. Функціональний дефіцит у пацієнтів із легким парезом нижньої кінцівки проявляється в усіх цих сферах діяльності і, отже, при виконанні численних повсякденних завдань, що вимагають певної швидкості й точності.
Симптоми, які зазвичай асоціюються з паралічем, включають соматосенсорний дефіцит, який може вплинути на якість поверхневої чутливості (наприклад, естезія, алгезія, термаестезія, двоточкова дискримінаційна чутливість) і/або пропріоцепцію (відчуття пози, палестезія) і послідовний стереогноз. Також часто повідомляється про різні форми чутливої парестезії і нейрогенних больових синдромів.
Активність верхньої кінцівки в повсякденному житті також може бути обмежена через додатковий дефіцит, що часто виникає після інсульту. Наприклад, після інсульту в ділянці лівої півкулі апраксія часто може призвести до білатерального обмеження функції руки (Walker et al., 2004). Використання контралатеральної руки в повсякденному житті також може бути зменшене через неглект-синдром (однобічне просторове ігнорування) внаслідок пошкодження правої півкулі (Vanbellingen et al., 2017), яке можна покращати за допомогою лікування неглект-синдрому (Nyffeler et al., 2019).
Лікування порушень, що не спричинені парезом, таких як порушення чутливості, апраксія або неглект-синдром, не включені в цю настанову, але їх слід враховувати в комплексі з лікуванням порушеної функції верхньої кінцівки.
4. 6.28.6. Церебролізин
Церебролізин складається з низькомолекулярних нейропептидів, а також вільних амінокислот. Він є екстрактом протеїну мозку свиней і має нейропротекторні й нейротрофічні властивості. Препарат ліцензований в Австрії для лікування інсультів.
5. Рандомізовані контрольовані дослідження
Метою рандомізованого контрольованого дослідження хворих на гострий інсульт було встановити, чи сприяє Церебролізин відновленню рухових функцій, зокрема, верхньої кінцівки (Muresanu et al., 2016). 208 хворих лікувалися Церебролізином (в/в 30 мл/добу) або плацебо (фізіологічний розчин), а також отримували реабілітаційне лікування від 24 до 72 годин після інсульту протягом 21 доби. Не тільки одразу після лікування, але й під час подальшого періоду спостереження протягом 90 діб з моменту розвитку інсульту в пацієнтів групи лікування Церебролізином відмічено значно більш виражене покращання. Середні зміни від базового рівня до 90-ї доби з моменту розвитку інсульту за шкалою ARAT (первинна змінна) становили 30,7 ± 19,9 (MW ± SD) [медіана 32,0; IQR 36,5] після введення Церебролізину та 15,9 ± 16,8 [медіана 11,0; IQR 22,0] після введення плацебо.
«Глобальний статус», який оцінювався за 12 різними шкалами, також показав релевантну перевагу у відновленні в групі лікування Церебролізином (критерій Манна — Уїтні 0,62; 95% ДІ 0,58–0,65; Р < 0,0001). Отже, профіль безпеки Церебролізину був порівнянний з лікуванням плацебо.
Рекомендації
Використання Церебролізину може розглядатися при гострих (підгострих) інсультах із парезом верхньої кінцівки, коли цілями лікування є відновлення рухових функцій руки/кисті й загальне функціональне відновлення (рівень доказовості 1b, оцінка ефектів: помірна якість; ступінь рекомендацій 0; сильний консенсус).
Застосування препарату слід починати якомога швидше (від 24 до 72 годин після інсульту) і, якщо він добре переноситься, призначати протягом 21 доби, один раз на добу, внутрішньовенно на додаток до реабілітаційних заходів (рівень доказовості 1b, оцінка ефектів: помірна якість; ступінь рекомендацій B; сильний консенсус). Також при призначенні треба брати до уваги специфічні рекомендації виробника препарату.

/83.jpg)