Международный эндокринологический журнал Том 16, №5, 2020
Вернуться к номеру
Рівень вітаміну D і показники вуглеводного обміну у жінок із синдромом полікістозних яєчників
Авторы: Архипкіна Т.Л.(1), Бондаренко В.О.(1), Гончарова О.А.(2), Любимова Л.П.(1)
(1) — ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
(2) — Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
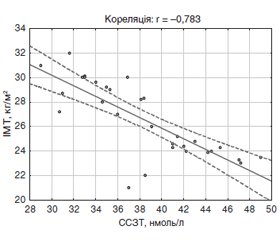
Актуальність. Синдром полікістозних яєчників (СПКЯ) залишається актуальною проблемою гінекологічної ендокринології, а його частота становить приблизно 11–17 % серед жінок репродуктивного віку та досягає 75 % у структурі ендокринної неплідності. Існують докази, що вітамін D впливає на обмін вуглеводів, а його недостатність або дефіцит підвищують ризик розвитку порушення толерантності до глюкози, інсулінорезистентності та цукрового діабету 2-го типу. Мета: визначити зв’язок між рівнем вітаміну D та показниками вуглеводного обміну в жінок із синдромом полікістозних яєчників. Матеріали та методи. Обстежено 60 жінок віком від 19 до 26 років: 30 жінок із діагнозом класичного фенотипу СПКЯ; 30 здорових жінок із нормальною менструальною та репродуктивною функцією. Досліджували вміст вітаміну D, сексстероїдзв’язуючого глобуліну (ССЗГ), імунореактивного інсуліну (ІРІ), індекс НОМА-IR, індекс маси тіла (ІМТ), окружність талії/окружність стегон (ОТ/ОС). Залежно від концентрації вітаміну D обстежених було розподілено на підгрупи: перша — 22 хворі на СПКЯ з вітаміном D ≤ 30 нг/мл (середній рівень — 12,9 ± 0,2 нг/мл); друга — 8 хворих із рівнем вітаміну D ≥ 30 нг/мл (31,4 ± 0,3 нг/мл); третя — 12 здорових жінок з вітаміном D ≤ 30 нг/мл (24,2 ± 0,3 нг/мл); четверта — 18 здорових обстежених із рівнем вітаміну D ≥ 30 нг/мл (35,6 ± 0,3 нг/мл). Результати. Встановлено, що в загальній групі хворих на СПКЯ середній рівень вітаміну D (21,4 ± 0,4 нг/мл) був вірогідно нижчим (Р < 0,001) порівняно з показником групи здорових жінок (29,6 ± 0,3 нг/мл). У хворих на СПКЯ низькі концентрації вітаміну D супроводжувались більш високими рівнями глюкози (Р < 0,001), ІРІ (Р < 0,001), індексу НОМА-IR (Р < 0,001) та зниженням ССЗГ (Р < 0,001). Встановлено негативний асоціативний зв’язок вітаміну D з ІМТ (r = –0,399; Р < 0,05), ОТ/ОС (r = –0,612; Р < 0,001), концентрацією ІРІ (r = –0,502; Р < 0,001), показником індексу НОМА-IR (r = –0,571; Р < 0,001), рівнем ССЗГ (r = –0,694; Р < 0,001). Висновки. Показано роль абдомінального ожиріння у формуванні дефіциту вітаміну D, який посилює порушення вуглеводного обміну, а саме збільшує гіперінсулінемію, інсулінорезистентність та знижує продукцію сексстероїдзв’язуючого глобуліну у хворих на СПКЯ.
Актуальность. Синдром поликистозных яичников (СПКЯ) остается актуальной проблемой гинекологической эндокринологии, а его частота составляет примерно 11–17 % среди женщин репродуктивного возраста и достигает 75 % в структуре эндокринного бесплодия. Существуют доказательства, что витамин D влияет на обмен углеводов, а его недостаточность или дефицит повышают риск развития нарушения толерантности к глюкозе, инсулинорезистентности и сахарного диабета 2-го типа. Цель: определить связь между уровнем витамина D и показателями углеводного обмена у женщин с синдромом поликистозных яичников. Материалы и методы. Обследовано 60 женщин в возрасте от 19 до 26 лет: 30 женщин с диагнозом классического фенотипа СПКЯ; 30 здоровых женщин с нормальной менструальной и репродуктивной функцией. Исследовали содержание витамина D, секcстероидсвязывающего глобулина (СССГ), иммунореактивного инсулина (ИРИ), индекс НОМА-IR, индекс массы тела (ИМТ), окружность талии/окружность бедер (ОТ/ОБ). В зависимости от концентрации витамина D обследованные были разделены на подгруппы: первая — 22 больные СПКЯ с витамином D ≤ 30 нг/мл (средний уровень — 12,9 ± 0,2 нг/мл); вторая — 8 больных с уровнем витамина D ≥ 30 нг/мл (31,4 ± 0,3 нг/мл); третья — 12 здоровых женщин с витамином D ≤ 30 нг/мл (24,2 ± 0,3 нг/мл); четвертая — 18 здоровых обследованных с уровнем витамина D ≥ 30 нг/мл (35,6 ± 0,3 нг/мл). Результаты. Установлено, что в общей группе пациенток с СПКЯ средний уровень витамина D (21,4 ± 0,4 нг/мл) был достоверно ниже (Р < 0,001) по сравнению с показателем группы здоровых женщин (29,6 ± 0,3 нг/мл). У больных с СПКЯ низкие концентрации витамина D сопровождались более высокими уровнями глюкозы (Р < 0,001), ИРИ (Р < 0,001), индекса НОМА-IR (Р < 0,001) и снижением СССГ (Р < 0,001). Установлена негативная ассоциативная связь витамина D с ИМТ (r = –0,399; Р < 0,05), ОТ/ОБ (r = –0,612; Р < 0,001), концентрацией ИРИ (r = –0,502; р < 0,001), показателем индекса НОМА-IR (r = –0,571; Р < 0,001), уровнем СССГ (r = –0,694; Р < 0,001). Выводы. Показана роль абдоминального ожирения в формировании дефицита витамина D, который усиливает нарушения углеводного обмена, а именно увеличивает гиперинсулинемию, инсулинорезистентность и снижает продукцию сексстероидсвязывающего глобулина у женщин с СПКЯ.
Background. Polycystic ovary syndrome (PCOS) remains an urgent problem of gynecological endocrinology, and its frequency is approximately 11–17 % among women of reproductive age and reaches 75 % in the structure of endocrine infertility. There is evidence that vitamin D impacts carbohydrate metabolism, and its insufficiency or deficiency increases the risk of impaired glucose tolerance, insulin resistance and type 2 diabetes mellitus (DM). The purpose of this study is to determine the relationship between vitamin D levels and indicators of carbohydrate metabolism in women with polycystic ovary syndrome. Materials and methods. Sixty women aged from 19 to 26 years were examined: 30 women with a diagnosis of the classical phenotype of PCOS; 30 healthy women with normal menstrual and reproductive function. We studied the content of vitamin D, sex steroid-binding globulin (SSBG), immunoreactive insulin (IRI), HOMA-IR index, body mass index (BMI), waist-hip ratio. Depending on the concentration of vitamin D, women were divided into subgroups: the first enrolled 22 patients with PCOS with vitamin D ≤ 30 ng/ml (average level 12.9 ± 0.2 ng/ml); the second included 8 patients with a level of vitamin D ≥ 30 ng/ml (31.4 ± 0.3 ng/ml); the third group consisted of 12 healthy women with vitamin D ≤ 30 ng/ml (24.2 ± 0.3 ng/ml); fourth group consisted of 18 healthy women with a level of vitamin D ≥ 30 ng/ml (35.6 ± 0.3 ng/ml). Results. It was found that in the basic group of PCOS patients, the average level of vitamin D (21.4 ± 0.4 ng/ml) was significantly lower (P < 0.001) compared to the group of healthy women (29.6 ± 0.3 ng/ml). In patients with PCOS, low concentrations of vitamin D were accompanied by higher levels of glucose (P < 0.001), IRI (P < 0.001), HOMA-IR index (P < 0.001), and a decreased level of SSBG (P < 0.001). A negative association of vitamin D with BMI (r = –0.399; P < 0.05), waist-hip ratio (r = –0.612; P < 0.001), IRI concentration (r = –0.502; P < 0.001), HOMA-IR index (r = –0.571; P < 0.001), the level of SSBG (r = –0.694; P < 0.001) was established. Conclusions. The results of the study demonstrate the role of abdominal obesity in the formation of vitamin D deficiency, which intensifies the carbohydrate metabolism disorders, increases hyperinsulinemia, insulin resistance and reduces the production of sex steroid-binding globulin in women with PCOS.
синдром полікістозних яєчників; вітамін D; інсулінорезистентність; сексстероїдзв’язуючий глобулін
синдром поликистозных яичников; витамин D; инсулинорезистентность; сексстероидсвязывающий глобулин
polycystic ovary syndrome; vitamin D; insulin resistance; sex steroid-binding globulin
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Дамдинова Л.В., Лещенко О.Я. Синдром поликистозных яичников — 80 лет исследований и новые направления в изучении данного вопроса (обзор литературы). Бюллетень ВСНЦ СО РАМН. 2016. 15(111). 181-185. doi.org/10.12737/23421.
- Мохорт Т.В., Велесевич Е.И., Юреня Е.В. и др. Синдром поликистозных яичников: что нового? (На основании рекомендаций Европейского общества эндокринологов). Медицинские новости. 2014. 12. 16-21.
- Marshall J.C., Dunaif A. Should all women with PCOS be treated for insulin resistance? Fertil. Steril. 2012. 97(1). 18-22. doi: 10.1016/j.fertnstert.2011.11.036.
- Сафи А.Т., Оразов М.Р., Калинченко С.Ю. Синдром поликистозных яичников и дефицит витамина D. Акушерство и гинекология Санкт-Петербурга. 2018. 2. 55-61.
- Lumme J., Sebert S., Pesonen P. et al. Vitamin D Levels in Women with Polycystic Ovary Syndrome: A Population-Based Study. Nutrients. 2019. 11(11). 2831. doi: 10.3390/nu11112831.
- Паньків І.В., Коритко О.О. Вміст вітаміну D, частота його недостатності й дефіциту в пацієнток із синдромом полікістозних яєчників. Міжнародний ендокринологічний журнал. 2018. 14(6). 585-589. doi: 10.22141/2224-0721.14.6.2018.146069.
- Niu Y.M., Wang Y.D., Jiang G.B. et al. Association Between Vitamin D Receptor Gene Polymorphisms and Polycystic Ovary Syndrome Risk: A Meta-Analysis. Front Physiol. 2019. 9. 1902. doi: 10.3389/fphys.2018.01902.
- Liu E., Meigs J.B., Pittas A.G. et al. Plasma 25-hydroxyvitamin D is associated with markers of the insulin resistant phenotype in nondiabetic adults. J. Nutr. 2009. 139(2). 329-334. doi: 10.3945/jn.108.093831.
- Larsson S., Jones H.A., Göransson O. et al. Parathyroid hormone induces adipocyte lipolysis via PKA-mediated phosphorylation of hormone-sensitive lipase. Cell Signal. 2016. 28(3). 204-213. doi: 10.1016/j.cellsig.2015.12.012.
- Chagas C.E., Borges M.C., Martini L.A., Rogero M.M. Focus on vitamin D, inflammation and type 2 diabetes. Nutrients. 2012. 4(1). 52-67. doi: 10.3390/nu4010052.
- Maestro B., Dávila N., Carranza M.C., Calle C. Identification of a Vitamin D Response Element in the Human Insulin Receptor Gene Promoter. J. Steroid Biochem. Mol. Biol. 2003. 84(2–3). 223-230. doi: 10.1016/s0960-0760(03)00032-3.
- Shojaeian Z., Sadeghi R., Latifnejad Roudsari R. Calcium and vitamin D supplementation effects on metabolic factors, menstrual cycles and follicular responses in women with polycystic ovary syndrome: A systematic review and meta-analysis. Caspian J. Intern. Med. 2019. 10(4). 359-369. doi: 10.22088/cjim.10.4.359.
- Plymate S.R., Matej L.A., Jones R.E., Friedl K.E. Inhibition of sex hormone-binding globulin production in the human hepatoma (Hep G2) cell line by insulin and prolactin. J. Clin. Endocrinol. Metabol. 1988. 67. 460-464. doi: 10.1210/jcem-67-3-460.
- He C., Lin Z., Robb S.W., Ezeamama A.E. Serum Vitamin D Levels and Polycystic Ovary syndrome: A Systematic Review and Meta-Analysis. Nutrients. 2015. 7(6). 4555-4577. doi: 10.3390/nu7064555.
- Pankiv V., Pankiv I. Association of vitamin D status with body mass index in adolescents in Ukraine. Romanian Journal of Diabetes, Nutrition and Metabolic Diseases. 2018. 25(4). 377-81. http://www.rjdnmd.org/index.php/rjdnmd/article/view/530.
- Conway G., Dewailly D., Diamanti-Kandarakis E. et al. Синдром поликистозных яичников. Официальное заявление Европейского Общества Эндокринологов (European Society of Endocrinology, ESE). Репpодуктивна ендокринологія. 2015. 5(25). 32-51. doi: http//dx.doi.org/10.18370/2309-4117.
- Holic M.F., Binkley N.C., Bischoff-Ferrary H.A. et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011. 96(7). 1911-1930. doi: 10.1210/jc.2011-0385.
- Matthews D.R., Hosker J.P., Rudenski A.S. et al. Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985. 28(7). 412-419. doi: 10.1007/bf00280883.
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi oblast (pilot project). Probl. Radiac. Med. Radiobiol. 2018. 23. 442-451. doi: 10.33145/2304-8336-2018-23-442-451.
- Гончарова О.А., Парцхаладзе В.И., Ильина И.М. Метаболическое ожирение при нормальной массе тела. Нерешенные вопросы диагностики. Эндокринология. 2013. 18(4). С. 50-54.
- Caserta D., Adducchio G., Picchia S. et al. Metabolic syndrome and polycystic ovary syndrome: an intriguing overlapping. Gynecol. Endocrinol. 2014. 30(6). 347-402. doi: 10.3109/ 09513590.2014.887673.
- Forouhi N.G., Luan J., Cooper A. et al. Baseline serum 25-hydroxyvitamin D is predictive of future glycemic status and insulin resistance: the Medical Research Council Ely Prospective Study 1990–2000. Diabetes. 2008. 57. 2619-26257. doi: 10.2337/db08-0593.
- Nikolova M.G., Boyanov M.A., Tsakova A.D. Correlations of Serum Vitamin D with Metabolic Parameters in Adult Outpatients with Different Degrees of Overweight / Obesity Coming from an Urban Community. Acta Endo (Buc.). 2018. 14(3). 375-383. doi: 10.4183/aeb.2018.
- Moran L.J., Teede H.J., Noakes M. et al. Sex hormone binding globulin, but not testosterone, is associated with the metabolic syndrome in overweight and obese women with polycystic ovary syndrome. J. Endocrinol. Invest. 2013. 36. 1004-1010. doi: 10.3275/9023.
- Deswal R., Yadav A., Dang A.S. Sex hormone binding globulin — an important biomarker for predicting PCOS risk: A systematic review and meta-analysis. J. Systems Biology in Reproductive Medicine. 2018. 64. 12-24. doi.org/10.1080/19396368.2017.1410591.

/17.jpg)
/18.jpg)