Журнал «Медицина неотложных состояний» Том 16, №5, 2020
Вернуться к номеру
Дексмедетомідин як ад’ювант до бупівакаїну при спінальній анестезії для артропластики кульшового суглоба
Авторы: Коломаченко В.І.(1), Фесенко В.С.(2)
(1) — Харківська медична академія післядипломної освіти, м. Харків, Україна
(2) — Львівський національний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
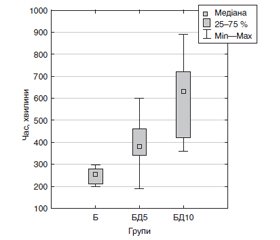
Актуальність. Спінальна анестезія є економічно ефективним методом для хірургії нижніх кінцівок. Одним із її недоліків є невелика тривалість післяопераційної аналгезії. Мета дослідження: виявити ефект від додавання 5 або 10 мкг дексмедетомідину до 12 мг бупівакаїну на характеристики блоку в пацієнтів, які підлягають артропластиці кульшового суглоба. Матеріали та методи. 45 пацієнтів були випадковим чином розподілені на три групи (по 15 у кожній): Б — введення лише бупівакаїну, БД5 — бупівакаїну і 5 мкг дексмедетомідину та БД10 — бупівакаїну і 10 мкг дексмедетомідину. Перед операцією та після неї оцінювався моторний блок за модифікованою шкалою Bromage. Після операції також реєструвався час до першої потреби в системній аналгезії. Результати. Перед операцією час настання повного моторного блоку (Me [25 %; 75 %]) у групі БД10 (6,5 [5,0; 10] хвилини) був незначуще меншим, ніж у групах БД5 (10,0 [7,0; 15,0] хвилини; p = 0,35) та Б (13,5 [10,0; 15,0] хвилини; p = 0,08). Після операції час часткового зникнення моторного блоку в групі БД10 (540 [360; 660] хвилин) був значуще (p < 0,001) більшим, ніж у групах БД5 (330 [300; 420] хвилин) та Б (200 [190; 240] хвилин); різниця між групами БД10 та БД5 також була великою (p = 0,015). Час до повного зникнення моторного блоку в групі БД10 (630 [420; 720] хвилин) був значуще (p < 0,001) більшим, ніж у групах БД5 (380 [340; 460] хвилин) та Б (255 [210; 280] хвилин); різниця між групами БД10 та БД5 також була значущою (p = 0,008). У післяопераційному періоді час до першої вимоги системної аналгезії в групі БД10 був більшим (720 [600; 860] хвилин), ніж у групах БД5 (450 [400; 540] хвилин; p = 0,0014) та Б (285 [230; 300] хвилин; p < 0,001); у групі БД5 час до першої вимоги системної аналгезії був більшим, ніж у групі Б (p < 0,001). Висновки. Додавання дексмедетомідину подовжує як моторний блок, так й аналгезію від спінальної анестезії.
Актуальность. Спинальная анестезия является экономически эффективным методом для хирургии нижних конечностей. Один из ее недостатков — небольшая длительность послеоперационной аналгезии. Цель исследования: выявить эффект от добавления 5 или 10 мкг дексмедетомидина к 12 мг бупивакаина на характеристики блока у пациентов, подвергающихся артропластике тазобедренного сустава. Материалы и методы. 45 пациентов были случайным образом разделены на три группы (по 15 в каждой): Б — введение лишь бупивакаина, БД5 — бупивакаин и 5 мкг дексмедетомидина и БД10 — бупивакаин и 10 мкг дексмедетомидина. Перед операцией и после нее оценивался моторный блок по модифицированной шкале Bromage. После операции также регистрировалось время до первой потребности в системной аналгезии. Результаты. Перед операцией время наступления полного моторного блока (Me [25 %; 75 %]) в группе БД10 (6,5 [5,0; 10] минуты) было незначительно меньше, чем в группах БД5 (10,0 [7,0; 15,0] минуты; p = 0,35) и Б (13,5 [10,0; 15,0] минуты; p = 0,08). После операции время частичного исчезновения моторного блока в группе БД10 (540 [360; 660] минут) было значительно (p < 0,001) большим, чем в группах БД5 (330 [300; 420] минут) и Б (200 [190; 240] минут); различие между группами БД10 и БД5 также было большим (p = 0,015). Время до полного исчезновения моторного блока в группе БД10 (630 [420; 720] минут) было значительно (p < 0,001) большим, чем в группах БД5 (380 [340; 460] минут) и Б (255 [210; 280] минут); различие между группами БД10 и БД5 также было большим (p = 0,008). В послеоперационном периоде время до первой потребности в системной аналгезии в группе БД10 было большим (720 [600; 860] минут), чем в группах БД5 (450 [400; 540] минут; p = 0,0014) и Б (285 [230; 300] минут; p < 0,001); в группе БД5 время до первой потребности системной аналгезии было большим, чем в группе Б (p < 0,001). Выводы. Добавление дексмедетомидина удлиняет как моторный блок, так и аналгезию от спинальной анестезии.
Background. Spinal anaesthesia is a cost-effective technique for lower extremity surgery. One of its drawbacks is the short duration of postoperative analgesia. The purpose was to find out the effect of adding dexmedetomidine 5 or 10 μg to isobaric bupivacaine 12 mg on block characteristics in patients undergoing elective hip arthroplasty. Materials and methods. Forty-five patients were randomly allocated to three groups, 15 people each: B group (bupivacaine only), BD5 group (bupivacaine and dexmedetomidine 5 μg), and BD10 group (bupivacaine and dexmedetomidine 10 μg). Motor block was assessed pre-operatively and post-operatively using modified Bromage scale. After surgery, time to the first need for systemic analgesia was registered. Results. Before surgery, time to the onset of complete motor block (Me [25 %; 75 %]) in BD10 group (6.5 [5.0; 10] min) was insignificantly shorter than in BD5 group (10.0 [7.0; 15.0] min; p = 0.35) and B group (13.5 [10.0; 15.0] min; p = 0.08). After surgery, time to the onset of partial disappearance of motor block in BD10 group (540 [360; 660] min) was significantly (p < 0.001) longer than in BD5 (330 [300; 420] min) and B (200 [190; 240] min) groups; the difference between BD10 and BD5 groups was significant (p = 0.015), too. Time to the complete disappearance of motor block in BD10 group (630 [420; 720] min) was significantly (p < 0.001) longer than in BD5 (380 [340; 460] min) and B (255 [210; 280] min) groups; the difference between BD10 and BD5 groups was also significant (p = 0.008). Postoperatively, BD10 group showed a longer time to first need for systemic analgesia (720 [600; 860] min) than BD5 group (450 [400; 540] min; p = 0.0014) and B group (285 [230; 300] min; p < 0.001); BD5 group showed a longer time to first need for systemic analgesia than B group (p < 0.001). Conclusions. Addition of dexmedetomidine prolongs both motor block and analgesia from spinal anaesthesia.
артропластика кульшового суглоба; спінальна анестезія; бупівакаїн; дексмедетомідин
артропластика тазобедренного сустава; спинальная анестезия; бупивакаин; дексмедетомидин
hip arthroplasty; spinal anaesthesia; bupivacaine; dexmedetomidine
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Shashikala T.K., Sagar S.S., Ramaliswamy P., Hudgi V.V. Comparing effects of intrathecal adjuvants fentanyl and dexmedetomidine with hyperbaric ropivacaine in patients undergoing elective infraumbilical surgeries: a prospective, double-blind, clinical study. Anesth. Essays Res. 2019. 13(4). Р. 654-662. DOI: 10.4103/aer.AER_183_18.
- Nwachukwu C., Idehen H.O., Edomwonyi N.P., Umeh B. Postoperative analgesic effect of intrathecal dexmedetomidine on bupivacaine subarachnoid block for open reduction and internal fixation of femoral fractures. Niger. J. Clin. Pract. 2020. 23(2). Р. 172-178. DOI: 10.4103/njcp.njcp_142_19.
- Omar H., Aboella W.A., Hassan M.M., Hassan A., Hassan P., Elshall A., Khaled D., Mostafa M., Tawadros P.Z., Hossam Eldin M., Wedad M., Abdelhamid B.M. Comparative study between intrathecal dexmedetomidine and intrathecal magnesium sulfate for the prevention of post-spinal anaesthesia shivering in uroscopic surgery. BMC Anesthesiol. 2019, Oct 24. 19(1). 190. DOI: 10.1186/s12871-019-0853-0.
- Tang Y., Yang M., Fu F., Huang X., Feng Y., Chen X. Comparison of the ED50 of intrathecal hyperbaric ropivacaine co-administered with or without intrathecal dexmedetomidine for cesarean section: A prospective, double-blinded, randomized dose-response trial using up-down sequential allocation method. J. Clin. Anesth. 2020, Feb 7. 62. 109725. DOI: 10.1016/j.jclinane.2020.109725.
- Sun S., Wang J., Wang J., Wang F., Xia H., Yao S. Fetal and maternal responses to dexmedetomidine intrathecal application during cesarean section: a meta-analysis. Med. Sci. Monit. 2020, Jan 29. 26. e918523. DOI: 10.12659/MSM.918523.
- Mostafa M.F., Herdan R., Fathy G.M., Hassan ZEAZ, Galal H., Talaat A., Ibrahim A.K. Intrathecal dexmedetomidine versus magnesium sulphate for postoperative analgesia and stress response after caesarean delivery; randomized controlled double-blind study. Eur. J. Pain. 2020. 24(1). Р. 182-191. DOI: 10.1002/ejp.1476.
- Dolma L., Salhotra R., Rautela R.S., Banerjee A. Isobaric ropivacaine with or without dexmedetomidine for surgery of neck femur fracture under subarachnoid block. J. Anaesthesiol. Clin. Pharmacol. 2018. 34(4). Р. 518-523. DOI: 10.4103/joacp.JOACP_226_18.
- Ganesh M., Krishnamurthy D. A comparative study of dexmedetomidine and clonidine as an adjuvant to intrathecal bupivacaine in lower abdominal surgeries. Anesth. Essays Res. 2018. 12(2). Р. 539-545. DOI: 10.4103/aer.AER_54_18.
- Zhang C., Li C., Pirrone M., Sun L., Mi W. Comparison of dexmedetomidine and clonidine as adjuvants to local anesthetics for intrathecal anesthesia: a meta-analysis of randomized controlled trials. J. Clin. Pharmacol. 2016. 56(7). Р. 827-34. DOI: 10.1002/jcph.666.
- Xu H., Zhao B., She Y., Song X. Dexmedetomidine ameliorates lidocaine-induced spinal neurotoxicity via inhibiting glutamate release and the PKC pathway. Neurotoxicology. 2018. 69. Р. 77-83. DOI: 10.1016/j.neuro.2018.09.004.
- Javahertalab M., Susanabadi A., Modir H., Kamali A., Amani A., Almasi-Hashiani A. Comparing intravenous dexmedetomidine and clonidine in hemodynamic changes and block following spinal anesthesia with ropivacaine in lower limb orthopedic surgery: a randomized clinical trial. Med. Gas. Res. 2020. 10(1). Р. 1-7. DOI: 10.4103/2045-9912.279977.

/102.jpg)
/102_2.jpg)
/103.jpg)