Журнал «Здоровье ребенка» Том 15, №4, 2020
Вернуться к номеру
Постбіотики і їх потенційне застосування в харчуванні дітей раннього віку
Авторы: Няньковський С.Л., Няньковська О.С., Яцула М.С., Городиловська М.І.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
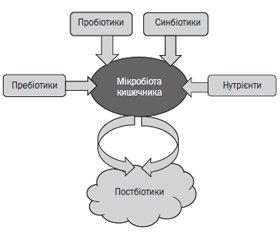
Термін «біотики» застосовується щодо харчових стратегій, які використовуються з метою видозміни мікробіоти кишечника для досягнення більш сприятливого стану здоров’я хазяїна. Термін «біотик» походить від грецького слова biōtikós, що означає «стосується життя», і вживається щодо біологічної екосистеми, яка складається з живих організмів разом із їхнім фізичним середовищем. Пребіотики, пробіотики й синбіотики можуть модулювати склад мікробіоти кишечника і її активність, а також мати прямий вплив на імунну відповідь. Найновіший член сімейства біотиків — це постбіотики. Вони належать до біоактивних сполук, що утворюються внаслідок мікробіологічної ферментації. До постбіотиків належать мікробні клітини, складові клітин і різні метаболіти. Ефективність постбіотиків базується на мікробних метаболітах — білках, ліпідах, вуглеводах, вітамінах, органічних кислотах, компонентах клітинної стінки або інших складних молекулах, що утворюються з матриці, яка ферментується. Постбіотики мають локальні й системні ефекти. До локальних ефектів належать імуномодулюючий, протизапальний, антимікробний, формування кишкового бар’єра, вплив на склад і активність мікробіоти, до системних — антиоксидантний, антигіпертензивний, гіпохолестеролемічний, антипроліферативний, зниження ризику розвитку ожиріння. Результати досліджень мікробіоти кишечника сприятимуть розробці індивідуальних рекомендацій щодо персоналізованого харчування або втручань для покращення стану здоров’я кожного індивіда. Постбіотики можуть бути безпечнішою альтернативою пробіотикам у дітей, зокрема імуноскомпрометованих або тяжко хворих.
Термин «биотики» применяется в отношении пищевых стратегий, которые используются с целью видоизменения микробиоты кишечника для достижения более благоприятного состояния здоровья хозяина. Термин «биотик» происходит от греческого слова biōtikós, что означает «касается жизни», и используется по отношению к биологической экосистеме, состоящей из живых организмов вместе с их физической средой. Пребиотики, пробиотики и синбиотики могут модулировать состав микробиоты кишечника и его активность, а также оказывать прямое влияние на иммунный ответ. Самый новый член семейства биотиков — это постбиотики. Они принадлежат к группе биоактивных соединений, которые образуются в результате микробиологической ферментации. К постбиотикам относятся микробные клетки, составляющие клеток и различные метаболиты. Эффективность постбиотиков базируется на микробных метаболитах — белках, липидах, углеводах, витаминах, органических кислотах, компонентах клеточной стенки или других сложных молекулах, образующихся из матрицы, которая ферментируется. Постбиотики имеют локальные и системные эффекты. К локальным эффектам относятся иммуномодулирующий, противовоспалительный, антимикробный, формирование кишечного барьера, влияние на состав и активность микробиоты, к системным — антиоксидантный, антигипертензивный, гипохолестеролемический, антипролиферативный, снижение риска развития ожирения. Результаты исследований микробиоты кишечника способствуют разработке индивидуальных рекомендаций по персонализированному питанию или вмешательствам для улучшения состояния здоровья каждого индивида. Постбиотики могут быть безопасной альтернативой пробиотикам у детей, в частности иммуноскомпрометированных или тяжело больных.
The term “biotics” refers to nutritional strategies that can be utilized to direct the gut microbiota towards a more favorable state for host health. The term “biotic” is derived from the Greek word biōtikós, meaning “pertaining to life”, and refers to the biological ecosystem made up of living organisms together with their physical environment. Prebiotics, probiotics and synbiotics can modulate the gut microbiota composition and its activity, and also have direct effects on the immune response. The newest member of the biotics family, postbiotics, are bioactive compounds produced by food-grade microorganisms during a fermentation process. Postbiotics include microbial cells, cell constituents and various metabolites. The effectiveness of postbiotics is based on microbial metabolites — proteins, lipids, carbohydrates, vitamins, organic acids, cell wall components or other complex molecules formed from the fermented matrix. Postbiotics have local and systemic effects. Local effects of postbiotics are immunomodulatory, anti-inflammatory, antimicrobial, intestinal barrier formation, effects on the microbiota composition and activity, systemic — antioxidant, antihypertensive, hypocholesterolemic, antiproliferative, anti-obesogenic. The results of gut microbiota research will help develop individual recommendations in terms of personalized nutrition or interventions to improve health. Postbiotics might be a safer alternative to probiotics in immunocompromised or severely ill children.
мікробіота; постбіотики; діти; дитяча ферментована суміш
микробиота; постбиотики; дети; детская ферментированная смесь
microbiota; postbiotics; children; fermented infant formula
Вступ
/30.jpg)
Пробіотики
Пребіотики
Синбіотики
Постбіотики
/32.jpg)
Вплив постбіотиків на взаємодію організму хазяїна й мікробіоти
Постбіотики в дитячому харчуванні
- Honda K., Littman D.R. The microbiota in adaptive immune homeostasis and disease. Nature. 2016. Vol. 535. P. 75. doi: 10.1038/nature18848.
- Fischbach M.A., Segre J.A. Signaling in host-associated microbial communities. Cell. 2016. Vol. 164. P. 1288-1300. doi: 10.1016/j.cell.2016.02.037.
- Lozupone C.A., Stombaugh J.I., Gordon J.I. et al. Diversity, stability and resilience of the human gut microbiota. Nature. 2012. Vol. 489. P. 220. doi: 10.1038/nature11550.
- Sommer F., Anderson J.M., Bharti R. et al. The resilience of the intestinal microbiota influences health and disease. Nat. Rev. Microbiol. 2017. Vol. 15. Р. 630. doi: 10.1038/nrmicro.2017.58.
- Skelly A.N., Sato Y., Kearney S., Honda K. Mining the microbiota for microbial and metabolite-based immunotherapies. Nat. Rev. Immunol. 2019. Vol. 19. P. 305-323. doi: 10.1038/s41577-019-0144-5.
- Zmora N., Suez J., Elinav E. You are what you eat: Diet, health and the gut microbiota. Nat. Rev. Gastroenterol. Hepatol. 2019. Vol. 16. P. 35-56. doi: 10.1038/s41575-018-0061-2.
- Dictionary.com. Biotic. URL: https://www.dictionary.com/browse/biotical.
- Wegh C.A.M., Geerlings S.Y., Knol J. et al. Postbiotics and Their Potential Applications in Early Life Nutrition and Beyond. Int. J. Mol. Sci. 2019. Vol. 20(19). P. 4673-4696.
- FAO/WHO Food and Agriculture Organization of the United Nations/World Health Organization Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria. URL: http://www.who.int/foodsafety/publications/fs_management/en/probiotics.pdf.
- Food and Agriculture Organization of the United Nations/World Health Organization (FAO/WHO) Joint Fao/Who Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food. WHO; London, ON, Canada: 2002. Guidelines for the Evaluation of Probiotics in Food.
- O’Toole P.W., Marchesi J.R., Hill C. Next-generation probiotics: The spectrum from probiotics to live biotherapeutics. Nat. Microbiol. 2017. Vol. 2. P. 17057. doi: 10.1038/nmicrobiol.2017.57.
- Collado M.C., Isolauri Е., Salminen S., Sanz Y. The impact of probiotic on gut health. Curr. Drug Metab. 2009. Vol. 10. P. 68-78. doi: 10.2174/138920009787048437.
- Hemarajata P., Versalovic J. Effects of probiotics on gut microbiota: Mechanisms of intestinal immunomodulation and neuromodulation. Ther. Adv. Gastroenterol. 2013. Vol. 6. P. 39-51. doi: 10.1177/1756283X12459294.
- Bermudez-Brito М., Plaza-Diaz J., Munoz-Quezada S. et al. Probiotic mechanisms of action. Ann. Nutr. Metab. 2012. Vol. 61. P. 160-174. doi: 10.1159/000342079.
- Sanders M.E., Merenstein D.J., Reid G. et al. Probiotics and prebiotics in intestinal health and disease: From biology to the clinic. Nat. Rev. Gastroenterol. Hepatol. 2019. Vol. 16. P. 605-616. doi: 10.1038/s41575-019-0173-3.
- Hotel A.C.P., Cordoba A. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Prevention. 2001. Vol. 5. P. 1-10.
- Thomas D.W., Greer F.R. Probiotics and prebiotics in pediatrics. Pediatrics. 2010. Vol. 126. P. 1217-1231. doi: 10.1542/peds.2010-2548.
- Gibson G.R., Hutkins R., Sanders M.E. et al. Expert consensus document: The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 2017. Vol. 14. P. 491. doi: 10.1038/nrgastro.2017.75.
- Vyas U., Ranganathan N. Probiotics, prebiotics, and synbiotics Gut and beyond. Gastroenterol. Res. Pract. 2012. Vol. 2012. P. 872716-872732. doi: 10.1155/2012/872716.
- Добрянський Д.О. Олігосахариди у грудному молоці і молочних сумішах — значення для передчасно народжених немовлят. Неонатологія, хірургія та перинатальна медицина. 2019. Т. IX. № 1(31). C. 67-77. doi: 10.24061/2413-4260.IX.1.31.2019.11.
- Giovannini M., Verduci E., Gregori D. et al. Prebiotic effect of an infant formula supplemented with galacto-oligosaccharides: Randomized multicenter trial. J. Am. Coll. Nutr. 2014. Vol. 33. P. 385-393. doi: 10.1080/07315724.2013.878232.
- Vandenplas Y., Zakharova I., Dmitrieva Y. Oligosaccharides in infant formula: More evidence to validate the role of prebiotics. Br. J. Nutr. 2015. Vol. 113. P. 1339-1344. doi: 10.1017/S0007114515000823.
- Sierra C., Bernal M.-J., Blasco J. et al. Prebiotic effect during the first year of life in healthy infants fed formula containing GOS as the only prebiotic: A multicentre, randomised, double-blind and placebo-controlled trial. Eur. J. Nutr. 2015. Vol. 54. Р. 89-99. doi: 10.1007/s00394-014-0689-9.
- Wegh C.A., Schoterman M.H., Vaughan E.E. et al. The effect of fiber and prebiotics on children’s gastrointestinal disorders and microbiome. Expert Rev. Gastroenterol. Hepatol. 2017. Vol. 11. P. 1031-1045. doi: 10.1080/17474124.2017.1359539.
- Bertelsen R.J., Jensen E.T., Ringel-Kulka T. Use of probiotics and prebiotics in infant feeding. Best Pract. Res. Clin. Gastroenterol. 2016. Vol. 30. P. 39-48. doi: 10.1016/j.bpg.2016.01.001.
- Macfarlane S., Macfarlane G., Cummings J.T. Prebiotics in the gastrointestinal tract. Aliment. Pharmacol. Ther. 2006. Vol. 24. P. 701-714. doi: 10.1111/j.1365-2036.2006.03042.x.
- Arslanoglu S., Moro G.E., Boehm G. Early Supplementation of Prebiotic Oligosaccharides Protects Formula-Fed Infants against Infections during the First 6 Months of Life. The Journal of Nutrition. 2007. Vol. 137. P. 2420-2424. doi: 10.1093/jn/137.11.2420.
- Roberfroid M., Gibson G.R., Hoyles L. et al. Prebiotic effects: Metabolic and health benefits. Br. J. Nutr. 2010. Vol. 104. P. S1-S63. doi: 10.1017/S0007114510003363.
- Gurry T. Synbiotic approaches to human health and well-being. Microb. Biotechnol. 2017. Vol. 10. P. 1070-1073. doi: 10.1111/1751-7915.12789.
- Burks A.W., Harthoorn L.F., Van Ampting M.T. et al. Synbiotics-supplemented amino acid-based formula supports adequate growth in cow’s milk allergic infants. Pediatr. Allergy Immunol. 2015. Vol. 26. P. 316-322. doi: 10.1111/pai.12390.
- Van der Aa L., Heymans H., Van Aalderen W. et al. Effect of a new synbiotic mixture on atopic dermatitis in infants: A randomized-controlled trial. Clin. Exp. Allergy. 2010. Vol. 40. P. 795-804. doi: 10.1111/j.1365-2222.2010.03465.x.
- Van der Aa L., Van Aalderen W., Heymans H. et al. Synbiotics prevent asthma-like symptoms in infants with atopic dermatitis. Allergy. 2011. Vol. 66. P. 170-177. doi: 10.1111/j.1398-9995.2010.02416.x.
- Chua M.C., Ben-Amor R., Lay C. et al. Effect of synbiotic on the gut microbiota of cesarean delivered infants: A randomized, double-blind, multicenter study. J. Pediatr. Gastroenterol. Nutr. 2017. Vol. 65. P. 102-106. doi: 10.1097/MPG.0000000000001623.
- Nikbakht E., Khalesi S., Singh I. et al. Effect of probiotics and synbiotics on blood glucose: A systematic review and meta-analysis of controlled trials. Eur. J. Nutr. 2018. Vol. 57. P. 95-106. doi: 10.1007/s00394-016-1300-3.
- Miller L.E., Ouwehand A.C., Ibarra A. Effects of probiotic-containing products on stool frequency and intestinal transit in constipated adults: Systematic review and meta-analysis of randomized controlled trials. Ann. Gastroenterol. 2017. Vol. 30. P. 629. doi: 10.20524/aog.2017.0192.
- Arumugam S., Lau C.S., Chamberlain R.S. Probiotics and synbiotics decrease postoperative sepsis in elective gastrointestinal surgical patients: A meta-analysis. J. Gastrointest. Surg. 2016. Vol. 20. P. 1123-1131. doi: 10.1007/s11605-016-3142-y.
- Umu O.C.O., Rudi K., Diep D.B. Modulation of the gut microbiota by prebiotic fibres and bacteriocins. Microb. Ecol. Health. Dis. 2017. Vol. 28. P. 1348886. doi: 10.1080/16512235.2017.1348886.
- Collado M.C., Isolauri E., Salminen S., Sanz Y. The impact of probiotic on gut health. Curr. Drug Metab. 2009. Vol. 10. P. 68-78. doi: 10.2174/138920009787048437.
- Sánchez B., Delgado S., Blanco-Míguez A. et al. Probiotics, gut microbiota, and their influence on host health and disease. Mol. Nutr. Food Res. 2017. Vol. 61. P. 1600240. doi: 10.1002/mnfr.201600240.
- O’Grady J., O’Connor E.M., Shanahan F. Review article: Dietary fibre in the era of microbiome science. Aliment. Pharmacol. Ther. 2019. Vol. 49. P. 506-515. doi: 10.1111/apt.15129.
- Slavin J. Fiber and prebiotics: Mechanisms and health benefits. Nutrients. 2013. Vol. 5. P. 1417-1435. doi: 10.3390/nu5041417.
- Markowiak P., Śliżewska K. Effects of probiotics, prebiotics, and synbiotics on human health. Nutrients. 2017. Vol. 9. P. 1021. doi: 10.3390/nu9091021.
- Konstantinov S.R., Kuipers E.J., Peppelenbosch M.P. Functional genomic analyses of the gut microbiota for CRC screening. Nat. Rev. Gastroenterol. Hepatol. 2013. Vol. 10. P. 741. doi: 10.1038/nrgastro.2013.178.
- Taverniti V., Guglielmetti S. The immunomodulatory properties of probiotic microorganisms beyond their viability (ghost probiotics: Proposal of paraprobiotic concept). Genes Nutr. 2011. Vol. 6. P. 261. doi: 10.1007/s12263-011-0218-x.
- Aguilar-Toalá J., Garcia-Varela R., Garcia H. et al. Postbiotics: An evolving term within the functional foods field. Trends Food Sci. Technol. 2018. Vol. 75. P. 105-114. doi: 10.1016/j.tifs.2018.03.009.
- Agostoni C., Goulet О., Kolacek S. et al. Fermented infant formulae without live bacteria. J. Pediatric Gastroenterol. Nutr. 2007. Vol. 44. P. 392-397. doi: 10.1097/01.mpg.0000258887.93866.
- Szajewska H., Skórka A., Pieścik-Lech M. Fermented infant formulas without live bacteria: A systematic review. Eur. J. Pediatr. 2015. Vol. 174. P. 1413-1420. doi: 10.1007/s00431-015-2629-y.
- Ouwehand A., Tölkkö S., Kulmala J. et al. Adhesion of inactivated probiotic strains to intestinal mucus. Lett. Appl. Microbiol. 2000. Vol. 31. P. 82-86. doi: 10.1046/j.1472-765x.2000.00773.x.
- Kataria J., Li N., Wynn J.L., Neu J. Probiotic microbes: Do they need to be alive to be beneficial? Nutr. Rev. 2009. Vol. 67. P. 546-550. doi: 10.1111/j.1753-4887.2009.00226.x.
- Deshpande G., Athalye-Jape G., Patole S. Para-probiotics for preterm neonates — the next frontier. Nutrients. 2018. Vol. 10. P. 871. doi: 10.3390/nu10070871
- Olle B. Medicines from microbiota. Nat. Biotechnol. 2013. Vol. 31. P. 309. doi: 10.1038/nbt.2548.
- Lahtinen S.J. Probiotic viability — does it matter? Microb. Ecol. Health Dis. 2012. Vol. 23. P. 18567. doi: 10.3402/mehd.v23i0.18567.
- De Almada C.N., Almada C.N., Martinez R.C.R., Sant’Ana A.S. Paraprobiotics: Evidences on their ability to modify biological responses, inactivation methods and perspectives on their application in foods. Trends Food Sci Technol. 2016. Vol. 58. P. 96-114. doi: 10.1016/j.tifs.2016.09.011.
- Gosálbez L., Ramón D. Probiotics in transition: Novel strategies. Trends Biotechnol. 2015. Vol. 33. P. 195-196. doi: 10.1016/j.tibtech.2015.01.006.
- Wang Y., Xie J., Wang N. et al. Lactobacillus casei Zhang modulate cytokine and toll-like receptor expression and beneficially regulate poly І: C-induced immune responses in raw264.7 macrophages. Microbiol. Immunol. 2013. Vol. 57. P. 54-62. doi: 10.1111/j.1348-0421.516.x.
- Kamiya T., Wang L., Forsythe P. et al. Inhibitory effects of Lactobacillus reuteri on visceral pain induced by colorectal distension in sprague-dawley rats. Gut. 2006. Vol. 55. P. 191-196. doi: 10.1136/gut.2005.070987.
- Imaoka A., Shima T., Kato K. et al. Anti-inflammatory activity of probiotic bifidobacterium: Enhancement of il-10 production in peripheral blood mononuclear cells from ulcerative colitis patients and inhibition of il-8 secretion in ht-29 cells. World J. Gastroenterol. 2008. Vol. 14. P. 2511-2516. doi: 10.3748/wjg.14.2511.
- Hoarau C., Lagaraine C., Martin L. et al. Supernatant of bifidobacterium breve induces dendritic cell maturation, activation, and survival through a toll-like receptor 2 pathway. J. Allergy Clin. Immunol. 2006. Vol. 117. P. 696-702. doi: 10.1016/j.jaci.2005.10.043.
- Menard S., Laharie D., Asensio C. et al. Bifidobacterium breve and Streptococcus thermophilus secretion products enhance t helper 1 immune response and intestinal barrier in mice. Exp. Biol. Med. 2005. Vol. 230. P. 749-756. doi: 10.1177/153537020523001008.
- Zagato E., Mileti E., Massimiliano L. et al. Lactobacillus paracasei CBA l74 metabolic products and fermented milk for infant formula have anti-inflammatory activity on dendritic cells in vitro and protective effects against colitis and an enteric pathogen in vivo. PLoS ONE. 2014. Vol. 9. P. e87615. doi: 10.1371/journal.pone.0087615.
- Korcz E., Kerenyi Z., Varga L. Dietary fibers, prebiotics, and exopolysaccharides produced by lactic acid bacteria: Potential health benefits with special regard to cholesterol-lowering effects. Food Funct. 2018. Vol. 9. P. 3057-3068. doi: 10.1039/C8FO00118A.
- Ahmadi Badi S., Moshiri А. et al. Microbiota-derived extracellular vesicles as new systemic regulators. Front. Microbiol. 2017. Vol. 8. P. 1610. doi: 10.3389/fmicb.2017.01610.
- Ryan P.M., Ross R.P., Fitzgerald G.F. et al. Sugar-coated: Exopolysaccharide producing lactic acid bacteria for food and human health applications. Food Funct. 2015. Vol. 6. P. 679-693. doi: 10.1039/C4FO00529E.
- Salazar N., Gueimonde M., de Los Reyes-Gavilan C.G., Ruas-Madiedo P. Exopolysaccharides produced by lactic acid bacteria and bifidobacteria as fermentable substrates by the intestinal microbiota. Crit. Rev. Food Sci. Nutr. 2016. Vol. 56. P. 1440-1453. doi: 10.1080/10408398.2013.770728.
- Zeidan A.A., Poulsen V.K., Janzen T. et al. Polysaccharide production by lactic acid bacteria: From genes to industrial applications. FEMS Microbiol. Rev. 2017. Vol. 41. P. 168-200. doi: 10.1093/femsre/fux017.
- Das D., Baruah R., Goyal A. A food additive with prebiotic properties of an alpha-d-glucan from Lactobacillus plantarum DM5. Int. J. Biol. Macromol. 2014. Vol. 69. P. 20-26. doi: 10.1016/j.ijbiomac.2014.05.029.
- Hongpattarakere T., Cherntong N., Wichienchot S. et al. In vitro prebiotic evaluation of exopolysaccharides produced by marine isolated lactic acid bacteria. Carbohyd. Polym. 2012. Vol. 87. P. 846-852. doi: 10.1016/j.carbpol.2011.08.085.
- Wang K., Li W., Rui X. et al. Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810. Int. J. Biol. Macromol. 2014. Vol. 63. P. 133-139. doi: 10.1016/j.ijbiomac.2013.10.036.
- Ellis T.N., Kuehn M.J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol. Mol. Biol. Rev. MMBR. 2010. Vol. 74. P. 81-94. doi: 10.1128/MMBR.00031-09.
- Chelakkot C., Choi Y., Kim D.-K. et al. Akkermansia muciniphila-derived extracellular vesicles influence gut permeability through the regulation of tight junctions. Exp. Mol. Med. 2018. Vol. 50. P. e450. doi: 10.1038/emm.2017.282.
- Fábrega M.J., Aguilera L., Giménez R. et al. Activation of immune and defense responses in the intestinal mucosa by outer membrane vesicles of commensal and probiotic Еscherichia coli strains. Front. Microbiol. 2016. Vol. 7. P. 705. doi: 10.3389/fmicb.2016.00705.
- Kang C.-S., Ban M., Choi E.-J. et al. Extracellular vesicles derived from gut microbiota, especially Аkkermansia muciniphila, protect the progression of dextran sulfate sodium-induced colitis. PLoS One. 2013. Vol. 8. P. e76520. doi: 10.1371/journal.pone.0076520.
- Morisset M., Aubert-Jacquin С., Soulaines Р. et al. A non-hydrolyzed, fermented milk formula reduces digestive and respiratory events in infants at high risk of allergy. European Journal of Clinical Nutrition. 2011. Vol. 65. P. 175-183. doi: 10.1038/ejcn.2010.250.
- Rodriguez-Herrera А., Ludwig Т., Bouritius H. et al. A Partly Fermented Infant Formula Combined with Scgos/Lcfos Resulted in a Lower Incidence of Investigator-Reported Infantile Colic in Healthy Term-Born Infants. Pediatrics, Cogent Medicine. 2017. Vol. 4. P. 1408251. DOI: https://doi.org/10.1080/2331205X.2017.1408251.
- Rodriguez-Herrera A., Kelly M., Bouritius H. et al. Gastrointestinal Tolerance, Growth and Safety of a Partly Fermented Formula with Specific Prebiotics in Healthy Infants: A Double-Blind, Randomized, Controlled Trial. Nutrients. 2019. Vol. 11. P. 1530. doi: 10.3390/nu11071530.
- Vandenplas Y., Ludwig T., Bouritius H. et al. Randomised controlled trial demonstrates that fermented infant formula with short-chain galacto-oligosaccharides and long-chain fructo-oligosaccharides reduces the incidence of infantile colic. Acta Pædiatrica. 2017. Vol. 106. P. 1150-1158. doi: 10.1111/apa.13844.
- Peng G.C., Hsu C.H. The efficacy and safety of heat-killed Lactobacillus paracasei for treatment of perennial allergic rhinitis induced by house-dust mite. Pediatric Allergy Immunol. 2005. Vol. 16. P. 433-438. doi: 10.1111/j.1399-3038.2005.00284.x.
- Rampengan N.H., Manoppo J., Warouw S.M. Comparison of efficacies between live and killed probiotics in children with lactose malabsorption. Southeast Asian J. Trop. Med. Public Health. 2010. Vol. 41. P. 474-481.