Журнал «Боль. Суставы. Позвоночник» Том 10, №2, 2020
Вернуться к номеру
Референтні рівні карбокситермінального телопептиду колагену I типу в сироватці крові в жителів України різного віку та статі
Авторы: Поворознюк В.В., Заверуха Н.В., Солоненко Т.Ю., Мусієнко А.С.
ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
Український науково-медичний центр проблем остеопорозу, м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
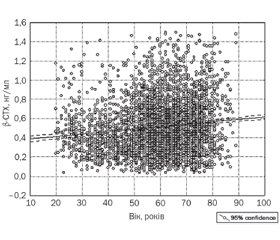
Метою дослідження є визначення референтного рівня карбокситермінального телопептиду колагену I типу (β-CTX) в сироватці крові у практично здорових чоловіків і жінок різного віку, які проживають на території України. Матеріали та методи. У дослідження були включені 4754 особи віком 20–89 років (4123 жінки (середній вік — 59,6 ± 13,6 року) та 631 чоловік (середній вік — 49,5 ± 16,3 року)). Усіх учасників розподілили за віком на 7 груп за десятиріччями (від 20 до 89 років), та три вікові групи — 40–49, 50–59 та 60–69 років — додатково розподілили на підгрупи за п’ятиріччями. Також розподіл пацієнтів проводили за геронтологічною класифікацією віку на 4 групи: молодий вік — 20–44 роки, середній — 45–59 років, літній — 60–74 роки та старечий вік — 75–89 років. Концентрацію β-CTX визначали методом електрохемілюмінесцентного імуноаналізу ECLIA на аналізаторі Сobas e 411. Результати. Виявлено вірогідний вплив віку на варіабельність β-CTX у сироватці крові: вірогідне підвищення рівня β-CTX з віком у жінок (p < 0,00001) та зниження в чоловіків (p < 0,00001). Вірогідно нижчий рівень β-CTX виявили в жінок віком 20–29 (p < 0,00001) та 30–39 років (p < 0,00001) порівняно з чоловіками цього ж віку. Проте у жінок 65–69 років (p = 0,001) виявили вірогідно вищий рівень β-CTX у сироватці крові порівняно з чоловіками цієї ж вікової групи. Висновки. Виявили зв’язок рівня β-CTX у сироватці крові з віком: у чоловіків він вірогідно знижується з віком, у жінок — вірогідно підвищується. У молодих чоловіків віком 20–44 роки та жінок віком 65–69 років концентрація β-CTX була вірогідно вищою порівняно з особами протилежної статі цього ж віку. Отримані нами результати щодо рівня β-CTX у практично здорових осіб різного віку, які проживають на території нашої країни, можуть бути використані як референтні показники для населення України.
Целью исследования является определение референтного уровня карбокситерминального телопептида коллагена I типа (β-CTX) в сыворотке крови у практически здоровых мужчин и женщин разного возраста, проживающих на территории Украины. Материалы и методы. В исследование были включены 4754 лица в возрасте 20–89 лет (4123 женщины (средний возраст — 59,6 ± 13,6 года) и 631 мужчина (средний возраст — 49,5 ± 16,3 года)). Всех участников распределили по возрасту на 7 групп по десятилетиям (от 20 до 89 лет), и три возрастные группы — 40–49, 50–59 и 60–69 лет — дополнительно разделили на подгруппы по пятилетиям. Также распределение пациентов проводили по геронтологической классификации возраста на 4 группы: молодой возраст — 20–44 года, средний — 45–59 лет, пожилой — 60–74 года и старческий возраст — 75–89 лет. Концентрацию β-CTX определяли в сыворотке крови методом электрохемилюминесцентного иммуноанализа ECLIA на анализаторе Сobas e 411. Результаты. Определено достоверное влияние возраста на вариабельность β-CTX в сыворотке крови: достоверное повышение уровня β-CTX с возрастом у женщин (p < 0,00001) и снижение у мужчин (p < 0,00001). Достоверно более низкий уровень β-CTX обнаружили у женщин в возрасте 20–29 (p < 0,00001) и 30–39 лет (p < 0,00001) по сравнению с мужчинами данного возраста. Однако у женщин 65–69 лет (p = 0,001) выявили достоверно более высокий уровень β-CTX в сыворотке крови по сравнению с мужчинами этой же возрастной группы. Выводы. Обнаружили связь уровня β-CTX в сыворотке крови с возрастом: у мужчин он достоверно снижается с возрастом, у женщин — достоверно повышается. У молодых мужчин в возрасте 20–44 года и женщин в возрасте 65–69 лет концентрация β-CTX была достоверно выше по сравнению с лицами противоположного пола этого же возраста. Полученные нами результаты в отношении уровня β-CTX у практически здоровых лиц разного возраста, проживающих на территории нашей страны, могут быть использованы как референтные показатели для населения Украины.
Background. The purpose of the study is to determine the reference intervals of carboxy-terminal telopeptide of type I collagen (β-CTX) in the blood serum of healthy males and females of various ages, residents of Ukraine. Materials and methods. The study included 4754 individuals aged 20–89 years (4123 women (mean age 59.6 ± 13.6) and 631 men (mean age 49.5 ± 16.3)). All participants were divided into 7 groups by the age decades (from 20 to 89 years), and three groups of 40–49, 50–59 and 60–69 year-olds were additionally divided into the subgroups by five years. Furthermore, the patients were divided according to the gerontological classification of age into 4 groups: young — 20–44 years, middle-age — 45–59 years, elderly — 60–74 years, and old — 75–89 years. The blood serum β-CTX concentration was determined by ECLIA electrochemiluminescence immunoassay on the cobas e 411 analyzer. Results. We have detected significant effect of age on serum β-CTX variability: a significant increase in β-CTX levels in women (F = 15.48, p < 0.00001), and a decrease in men (F = 11.73, p < 0.00001) with age. The significantly lower levels of β-CTX were found in the women aged 20–29 (F = 35.68, p < 0.00001) and 30–39 years (F = 19.47, p = 0.00001) compared to the men of similar ages. However, the women of 65–69 years (F = 10.50, p = 0.001) had a significantly higher serum β-CTX levels compared to men of the same age group. Conclusions. The serum β-CTX levels have been associated with age: in men they are decreasing significantly with age, in women — significantly increasing. In the young men aged 20–44 years and women aged 65–69 years, the β-CTX concentration was significantly higher compared with that of the opposite sex subjects of a similar age. The findings on β-CTX serum levels in the practically healthy men and women of various ages, who are residing in this country, may be used as the reference intervals for the Ukrainian population.
маркери метаболізму кісткової тканини; карбокситермінальний телопептид колагену I типу; вік; стать
маркеры метаболизма костной ткани; карбокситерминальный телопептид коллагена I типа; возраст; пол
bone turnover markers; carboxy-terminal telopeptide of type I collagen; age; sex
Вступ
Матеріали та методи
Результати
/17.jpg)
Обговорення
Висновки
1. Rathnayake H., Lekamwasam S., Wickramatilake C., Lenora J. Variation of urinary and serum bone turnover marker reference values among pre and postmenopausal women in Asia: a systematic review. Arch. Osteoporos. 2020. 15. 57. https://doi.org/10.1007/s11657-020-00722-7.
2. Shetty S., Kapoor N., Bondu J. et al. Bone turnover markers: Emerging tool in the management of osteoporosis. Indian J. Endocrinol. Metab. 2016. 20. 846-852. https://doi.org/10.4103/2230-8210.192914.
3. Ryabenko T.V. Modern Aspects of Bone Tissue Reparative Regeneration and Analysis of Bone Metabolism Indices. Ukr. J. Med. Biol. Sport. 2020. 5. 89-97. https://doi.org/10.26693/jmbs05.03.089.
4. Seibel M.J. Biochemical Markers of Bone Turnover. Part I: Biochemistry and Variability. Clin. Biochem. Rev. 2005. 26. 97-122.
5. Johansson H., Odén A., Kanis J.A. et al. A meta-analysis of reference markers of bone turnover for prediction of fracture. Calcif. Tissue Int. 2014. 94. 560-567. https://doi.org/10.1007/s00223-014-9842-y.
6. Vasikaran S., Eastell R., Bruyère O. et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: A need for international reference standards. Osteoporos. Int. 2011. 22. 391-420. https://doi.org/10.1007/s00198-010-1501-1.
7. Povoroznyuk V., Grigorieva N., Povoroznyuk V. Ultrasonic densitometry in the estimation of structural and functional state of bone tissue. Pain, Joints, Spine. 2013. 12. 5-12.
8. Hochberg M.C., Silverman S.L., Barr C.E., Miller P.D. The Utility of Changes in Serum Levels of C-Terminal Telopeptide of Type I Collagen in Predicting Patient Response to Oral Monthly Ibandronate Therapy. J. Clin. Densitom. 2010. 13. 181-189. https://doi.org/10.1016/j.jocd.2010.01.007.
9. Eastell R., Szulc P. Use of bone turnover markers in postmenopausal osteoporosis. Lancet Diabetes Endocrinol. 2017. 5. 908-923. https://doi.org/10.1016/S2213-8587(17)30184-5.
10. Szulc P., Naylor K., Hoyle N.R. et al. Use of CTX-I and PINP as bone turnover markers: National Bone Health Alliance recommendations to standardize sample handling and patient preparation to reduce pre-analytical variability. Osteoporos. Int. 2017. 28. 2541-2556. https://doi.org/10.1007/s00198-017-4082-4.
11. Ivaska K.K., Gerdhem P., Åkesson K. et al. Effect of fracture on bone turnover markers: A longitudinal study comparing marker levels before and after injury in 113 elderly women. J. Bone Miner. Res. 2007. 22. 1155-1164. https://doi.org/10.1359/jbmr.070505.
12. Yan J., Liu H.J., Li H. et al. Circulating periostin levels increase in association with bone density loss and healing progression during the early phase of hip fracture in Chinese older women. Osteoporos. Int. 2017. 28. 2335-2341. https://doi.org/10.1007/s00198-017-4034-z.
13. Chubb S.A.P., Byrnes E., Manning L. et al. Reference Intervals for Bone Turnover Markers and Their Association With Incident Hip Fractures in Older Men: The Health In Men Study. J. Clin. Endocrinol. Metab. 2015. 100. 90-99. https://doi.org/10.1210/jc.2014-2646.
14. Gossiel F., Finigan J., Jacques R. et al. Establishing reference intervals for bone turnover markers in healthy postmenopausal women in a nonfasting state. Bonekey Rep. 2014. 3. 1-7. https://doi.org/10.1038/bonekey.2014.68.
15. Povoroznyuk V.V., Pludowski P., Holick M. et al. 25-hydroxy vitamin D levels, vitamin D deficiency and insufficiency in patients with bone and musculoskeletal disorders. Pain Joints Spine. 2017. 7. 80-88. https://doi.org/10.22141/2224-1507.7.3.2017.116858.
16. Pludowski P., Grant W.B., Bhattoa H.P. et al. Vitamin D status in central Europe. Int. J. Endocrinol. 2014. https://doi.org/10.1155/2014/589587.
17. Povoroznyuk V., Balatska N. Deficiency of vitamin D among Ukrainian population: risk-factors of development. Reprod. Endocrinol. 2013. 5. 7-13.
18. Cashman K.D., Dowling K.G., Škrabáková Z. et al. Vitamin D deficiency in Europe: Pandemic? Am. J. Clin. Nutr. 2016. 103. 1033-1044. https://doi.org/10.3945/ajcn.115.120873.
19. Glover S.J., Gall M., Schoenborn-Kellenberger O. et al. Establishing a reference interval for bone turnover markers in 637 healthy, young, premenopausal women from the United Kingdom, France, Belgium, and the United States. J. Bone Miner. Res. 2009. 24. 389-397. https://doi.org/10.1359/jbmr.080703.
20. Schiellerup S.P., Skov-Jeppesen K., Windeløv J.A. et al. Gut hormones and their effect on bone metabolism. Potential drug therapies in future osteoporosis treatment. Front. Endocrinol. (Lausanne). 2019. 10. 1-13. https://doi.org/10.3389/fendo.2019.00075.
21. Verroken C., Zmierczak H.G., Goemaere S. et al. Bone Turnover in Young Adult Men: Cross-Sectional Determinants and Associations With Prospectively Assessed Bone Loss. J. Bone Miner. Res. 2018. 33. 261-268. https://doi.org/10.1002/jbmr.3303.
22. Michelsen J., Wallaschofski H., Friedrich N. et al. Reference intervals for serum concentrations of three bone turnover markers for men and women. Bone. 2013. 57. 399-404. https://doi.org/10.1016/j.bone.2013.09.010.
23. Nagy H., Feyt C., Chapurlat R., Szulc P. Familial resemblance of bone turnover rate in men aged 40 and over —the minos study. J. Bone Miner. Metab. 2013. 31. 222-230. https://doi.org/10.1007/s00774-012-0408-7.
24. Povoroznyuk V., Grigorieva N. Menopause and osteoporosis. Mystetstvo likuvannya. 2005. 26. 1-4. (In Ukrainian).
25. Jenkins N., Black M., Paul E. et al. Age-related reference intervals for bone turnover markers from an Australian reference population. Bone. 2013. 55. 271-276. https://doi.org/10.1016/j.bone.2013.04.003.
26. Li M., Li Y., Deng W. et al. Chinese Bone Turnover Marker Study: Reference ranges for C-terminal telopeptide of type i collagen and procollagen I N-terminal peptide by age and gender. PLoS One. 2014. 9. 5-11. https://doi.org/10.1371/journal.pone.0103841.

/16.jpg)
/17_2.jpg)
/18.jpg)
/19_2.jpg)
/19.jpg)