Журнал «Травма» Том 21, №1, 2020
Вернуться к номеру
Поражение опорно-двигательного аппарата при узелковом полиартериите
Авторы: Синяченко О.В., Помазан Д.В., Ермолаева М.В., Верзилов С.Н.
Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Актуальність. Ураження суглобів і періартикулярних тканин є однією з основних ознак усіх системних васкулітів (СВ). Зараз широко обговорюються зміни опорно-рухового апарату при дрібносудинних СВ, асоційованих з антинейтрофільними цитоплазматичними антитілами (мікроскопічний поліангіїт, гранулематоз з поліангіїтом Вегенера, еозинофільний гранулематозний поліангіїт Черджа — Стросса). Такі дослідження при середньосудинному вузликовому поліартеріїті (ВПА) відсутні. Мета: оцінити характер перебігу і чинники ризику патології суглобів та періартикулярних тканин при ВПА, виділити прогностичні критерії. Матеріали та методи. Під наглядом перебували 39 хворих на ВПА (62 % чоловіків і 38 % жінок) віком від 17 до 75 років (у середньому 44 роки). Тривалість захворювання становила в середньому 9 років, співвідношення гострого та хронічного перебігу патологічного процесу було 1 : 7, мінімального, помірного та високого ступеня активності хвороби — 1 : 2 : 2. Результати. Зміни опорно-рухового апарату встановлено в 97 % випадків ВПА. Периферичну нейропатію діагностовано у 82 % від числа хворих, периферійний артрит — у 63 %, міозит кінцівок — у 56 %, тендовагініти — у 28 %, ентезопатії — у 23 %, сакро-ілеїт і спондилопатію — відповідно у 21 %, альгодистрофію — у 8 %, що було пов’язано з системними проявами хвороби (в першу чергу з ураженням шкіри й серця), функцією нирок (з артритом гомілковостопних зчленувань і формуванням лігаментозу), ступенем активності патологічного процесу (з параметрами активності та тяжкості суглобового синдрому). Вираженість артропатії прямо корелює з рівнем середнього артеріального тиску, наявністю діастолічної дисфункції лівого шлуночка серця, тендовагінітів і ентезопатій, при цьому рівень периферійного судинного опору має прогностичну значущість відносно міозиту кінцівок. Висновки. Ураження опорно-рухового апарату спостерігається практично в усіх випадках ВПА, що вимагає подальшого вивчення патогенезу такої патології й розробки індивідуальної медикаментозної технології лікування хворих.
Актуальность. Поражение суставов и периартикулярных тканей является одним из основных признаков всех системных васкулитов (СВ). Сейчас широко обсуждаются изменения опорно-двигательного аппарата при мелкососудистых СВ, ассоциированных с антинейтрофильными цитоплазматическими антителами (микроскопический полиангиит, гранулематоз с полиангиитом Вегенера, эозинофильный гранулематозный полиангиит Черджа — Стросса). Такие исследования при среднесосудистом узелковом полиартериите (УПА) отсутствуют. Цель: оценить характер течения и факторы риска патологии суставов и периартикулярных тканей при УПА, выделить прогностические критерии. Материалы и методы. Под наблюдением находились 39 больных УПА (62 % мужчин и 38 % женщин) в возрасте от 17 до 75 лет (в среднем — 44 года). Длительность заболевания составила в среднем 9 лет, соотношение острого и хронического течения патологического процесса было 1 : 7, минимальной, умеренной и высокой степени активности болезни — 1 : 2 : 2. Результаты. Изменения опорно-двигательного аппарата установлены в 97 % случаев УПА. Периферическая нейропатия диагностирована у 82 % от числа больных, периферический артрит — у 63 %, миозит конечностей — у 56 %, тендовагиниты — у 28 %, энтезопатии — у 23 %, сакроилеит и спондилопатия — соответственно у 21 %, альгодистрофия — у 8 %, что было связано с системными проявлениями болезни (в первую очередь с поражением кожи и сердца), функцией почек (с артритом голеностопных сочленений и формированием лигаментоза), степенью активности патологического процесса (с параметрами активности и тяжести суставного синдрома). Тяжесть артропатии прямо коррелирует с уровнем среднего артериального давления, наличием диастолической дисфункции левого желудочка сердца, тендовагинитов и энтезопатий, при этом уровень периферического сосудистого сопротивления обладает прогностической значимостью в отношении миозита конечностей. Выводы. Поражение опорно-двигательного аппарата наблюдается практически во всех случаях УПА, что требует дальнейшего изучения патогенеза такой патологии и разработки индивидуальной медикаментозной технологии лечения больных.
Background. Lesion of the joints and periarticular tissues is one of the main features of all systemic vasculitis. Changes in the musculoskeletal system in small vessel vasculitis associated with antineutrophil cytoplasmic antibodies (microscopic polyangiitis, Wegener’s granulоmatosis with polyangiitis, eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome)) are now widely discussed. There are no such studies for medium-sized-vessel polyarteritis nodosa. The purpose and tasks of the study were to assess the nature of the course and risk factors for the pathology of the joints and periarticular tissues in polyarteritis nodosa, to identify prognostic criteria. Material and methods. There were 39 patients with polyarteritis nodosa under supervision: 62 % of men and 38 % of women aged 17–75 years (average of 44 years). The duration of the disease was on average 9 years, the ratio of acute and chronic course of the pathological process was 1 : 7, minimal, moderate and high degree of acti-vity of the disease — 1 : 2 : 2. Results. Changes in the locomotor system were detected in 97 % of cases of polyarteritis nodosa. Peripheral neuropathy was diagnosed in 82 % of patients, peripheral arthritis — in 63 %, limb myositis — in 56 %, tendovaginitis — in 28 %, enthesopathy — in 23 %, sacroiliitis and spondylopathy — in 21 %, respectively, algodystrophy — in 8 % that was associated with systemic manifestations of the disease (primarily, with da-mage to the skin and heart), kidney function (with arthritis of the ankle joints and the formation of ligamentosis), the degree of activity of the pathological process (with parameters of activity and severity of the articular syndrome). The severity of arthropathy is directly correlated with the level of mean blood pressure, the presence of left ventricular diastolic dysfunction, tendovaginitis and enthesopathy, while the level of peripheral vascular resistance has prognostic significance in relation to limb myositis. Conclusions. Lesion of the musculoskeletal system is observed in almost all cases of polyarteritis nodosa, which requires further study of the pathogenesis of this pathology and the development of an individualized drug treatment technology for such patients.
поліартеріїт вузликовий; опорно-руховий апарат
полиартериит узелковый; опорно-двигательный аппарат
polyarteritis nodosa; musculoskeletal system
Введение
Системные васкулиты (СВ) являются гетерогенной группой заболеваний, основным признаком которых считается иммунное воспаление с некрозом сосудистой стенки [1, 2]. Распространенность СВ ежегодно повсеместно увеличивается [5, 8], а их изучение относится к динамично развивающимся областям клинической медицины [7].
Поражение суставов и периартикулярных тканей является одним из основных признаков всех СВ [12]. Сейчас широко обсуждаются изменения опорно-двигательного аппарата при мелкососудистых СВ, ассоциированных с антинейтрофильными цитоплазматическими антителами, — микроскопическом полиангиите [13], гранулематозе с полиангиитом Вегенера [10, 11], эозинофильном гранулематозном полиангиите Черджа — Стросса [3, 9]. Такие исследования при среднесосудистом узелковом полиартериите (УПА) отсутствуют [4, 6].
Цель и задачи исследования: оценить характер течения и факторы риска патологии суставов и периартикулярных тканей при УПА, выделить прогностические критерии.
Материалы и методы
Под наблюдением находились 39 больных УПА (62 % мужчин и 38 % женщин) в возрасте от 17 до 75 лет (в среднем — 44,20 ± 1,88 года). Длительность заболевания составила в среднем 8,50 ± 1,30 года, соотношение острого и хронического течения патологического процесса было 1 : 7, минимальной, умеренной и высокой степени активности болезни — 1 : 2 : 2. Поражение кожи отмечено у 30,8 % от числа больных, легких — у 46,2 %, сердца — у 82,1 %, почек — у 61,5 %, печени — у 56,4 %, селезенки — у 12,8 %.
Рентгенологическое исследование периферических суставов, крестцово-подвздошных сочленений и позвоночника выполняли на аппарате Multix Compact Siеmens (Германия), ультразвуковое исследование суставов — на сонографе Envisor Philips (Нидерланды). Подсчитывали показатели суставного счета (JPN), индекса Лансбури (LI), активности артрита (DAS) и интегральной тяжести артикулярного синдрома (ASI) по формуле: ASI = √LI ´ DAS.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (М), их стандартные отклонения (SD) и ошибки (SE), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии однофакторного (D) и многофакторного Уилкоксона — Рао (WR) дисперсионного анализа, различий Стьюдента и достоверность статистических показателей (р). Подсчитывали степень прогнозирования предлагаемого результата модели (PPV).
Результаты и обсуждение
Поражение опорно-двигательного аппарата обнаружено у 97,4 % от числа больных УПА (основная группа), среди которых у 82,1 % от общего числа пациентов с таким вариантом СВ и 84,2 % основной группы диагностирована периферическая нейропатия (ПН), соответственно у 61,5 и 63,2 % — периферический артрит (ПА), у 56,4 и 57,9 % — миозит конечностей (МК), у 28,2 и 29,0 % — тендовагиниты (ТВ), у 23,1 и 23,7 % — энтезопатии (ЭП), по 20,5 и 21,1 % — сакроилеит (СИ) и спондилопатия (СП), у 7,7 и 7,9 % — альгодистрофия (АД). Общий индекс тяжести поражений опорно-двигательного аппарата (LWI) составил 3,080 ± 0,328 у.е.
Как показал многофакторный анализ Уилкоксона — Рао, на интегральные признаки изменений локомоторного аппарата оказывает влияние степень активности УПА (WR = 2,01; p = 0,048), но не пол больных, длительность патологического процесса и характер его течения. Интегральные проявления поражения опорно-двигательного аппарата тесно связаны с изменениями у больных УПА печени (WR = 2,34; p = 0,046) и селезенки (WR = 12,01; p < 0,001), а также с индексом тяжести висцеридов (DWI) (WR = 2,46; p < 0,001). С кардиальной патологией и функцией почек такая связь отсутствует. Обращала на себя внимание дисперсионная зависимость патологии опорно-двигательного аппарата с носительством антигена вирусного гепатита В (D = 10,42; p < 0,001), которое выявлено у 35,9 % больных УПА.
СИ во всех случаях был либо односторонним, либо двусторонним асимметричным. СП в виде остеохондроза позвоночника и спондилоартроза проявлялась болевым синдромом дисгемического, дисфиксационного, воспалительного и механического характера в соотношении 10 : 5 : 4 : 1. По результатам выполненного непараметрического корреляционного анализа Кендалла, имеет место прямая связь МК с уровнями среднего артериального давления (САД; τ = +0,235; p = 0,043) и периферического сосудистого сопротивления (ПСС; τ = +0,492; p = 0,018), а также обратная со скоростью клубочковой фильтрации (СКФ; τ = –0,250; p = 0,025), которую определяли по формуле Кокрофта — Голта. Сделано заключение, имеющее практическую направленность: наличие у больных УПА МК рекомендуется учитывать как фактор риска снижения функции почек (PPV = 77,3 %).
На следующем этапе нашей работы были отобраны параметры патологии опорно-двигательного аппарата у больных УПА и измененные системные показатели патологического процесса, которые одновременно имели между собой достоверные дисперсионные и прямые корреляционные связи. Оказалось, что СИ тесно связан с поражением печени (D = 4,18, p = 0,048; τ = +0,319, p = 0,004), СП — почек (D = 5,73, p = 0,022; τ = +0,251, p = 0,025), ТВ и ЭП — с наличием систолической дисфункции левого желудочка (соответственно D = 4,26, p = 0,046; τ = +0,322, p = 0,004 и D = 8,13, p = 0,007; τ = +0,270, p = 0,016). Кроме того, с DSI прямо соотносятся ПА (D = 7,06, p = 0,002; τ = +0,377, p = 0,001) и показатель LWI (D = 5,82, p = 0,021; τ = +0,271, p = 0,015).
Поражение периферических суставов в виде артрита или артралгий констатировано у 61,5 % от числа больных УПА. Согласно рис. 1, вовлечение в процесс коленных сочленений установлено в 38,5 % случаев, голеностопных — в 35,9 %, пястнофаланговых и плюснефаланговых — соответственно в 23,1 %, межфаланговых пальцев кистей — в 20,5 %, лучезапястных и локтевых — в 18,0 %, верхнечелюстных, плечевых, межфаланговых пальцев стоп и тазобедренных — соответственно в 15,5 %, грудиноключичных — в 5,1 %.
По результатам рентгеносонографического исследования (рис. 2), субхондральный склероз отмечен у 35,9 % от числа больных, изменения рогов менисков — у 30,8 %, остеокистоз — у 28,3 %, лигаментоз — у 23,9 %, эпифизарный остеопороз — у 20,5 %, артрокальцинаты — у 18,0 %, кисты Бейкера и тела Штайди — соответственно у 15,4 %, асептический остеонекроз и тела Гоффа — у 7,7 %, хондромные тела — у 5,1 %, остеоузуры — у 2,6 %.
Моноолигоартрит имел место у 12,5 % от числа больных УПА с ПА, показатель суставного счета (JPN) был равен 11,90 ± 2,68 абс. ед., активности артрита (DAS) — 2,90 ± 0,32 o.e., индекса Лансбури (LI) — 60,60 ± 9,30 балла, тяжести артикулярного синдрома (ASI) — 19,30 ± 4,25 у.е. С возрастом пациентов повышается степень тяжести артропатии, что демонстрируется прямым корреляционным анализом Пирсона (r = +0,458, p = 0,024). Общая степень активности заболевания позитивно коррелирует с DAS (r = +0,404, p = 0,047) и ASI (r = +0,524, p = 0,009), а уровень САД (рис. 3) — с параметрами ASI (r = +0,566, p = 0,004) и LI (r = +0,458, p = 0,024). Показатель LI дисперсионно связан с уровнем САД (D = 10,01, p = 0,041), LI и DAS — с ПСС (соответственно D = 10,73, p = 0,037 и D = 2,69, p = 0,047), JPN и ASI — со СКФ (D = 5,60, p = 0,007 и D = 8,29, p = 0,008). Необходимо отметить, что ASI прямо коррелирует со степенью диастолической дисфункции левого желудочка сердца (τ = +0,552, p < 0,001).
Все изученные показатели тяжести течения суставного синдрома имели корреляции Кендалла с уровнем кожного синдрома (c JPN — τ = +0,306, p = 0,036; c DAS — τ = +0,330, p = 0,024; c LI — τ = +0,348, p = 0,017; c ASI — τ = +0,309, p = 0,035), кардиального — только с JPN (τ = +0,343, p = 0,019), DAS (τ = +0,326, p = 0,026) и ASI (τ = +0,341, p = 0,020), а наличие спленомегалии — лишь с DAS (τ = +0,431, p = 0,003).
Как одновременно продемонстрировали однофакторный дисперсионный и непараметрический корреляционный анализы, с возрастом больных тесно связаны артрит верхнечелюстных сочленений (D = 26,77, p < 0,001; τ = +0,452, p = 0,002) и субхондральный склероз (D = 8,59, p = 0,008; τ = +0,473, p = 0,001), с почечной патологией у больных УПА — поражение голеностопных суставов (D = 5,62, p = 0,027; τ = +0,299, p = 0,041), с наличием и уровнем СДлж — артрит межфаланговых суставов пальцев кистей (D = 23,96, p < 0,001; τ = +0,364, p = 0,013) и пястнофаланговых (D = 10,98, p = 0,003; τ = +0,296, p = 0,043), с фиброзированием клапанного аппарата сердца — формирование эпифизарного остеопороза (D = 4,89, p = 0,038; τ = +0,296, p = 0,043) и остеокистоза (D = 6,11, p = 0,022; τ = +0,371, p = 0,011).
Обращала на себя внимание достоверная дисперсионная и корреляционная связь LWI c DSI (D = 5,11, p = 0,034; τ = +0,342, p = 0,019). В этой связи сформулирована практическая рекомендация: при УПА степень выраженности системных висцеральных признаков DSI > 7 у.е. (> M + SD таких больных) необходимо расценивать как прогнознегативный критерий тяжелого течения изменений опорно-двигательного аппарата (PPV = 74,1 %).
С распространенностью суставного синдрома достоверно не связаны экстраартикулярные признаки поражения опорно-двигательного аппарата. Вместе с тем с показателем DAS прямо коррелируют такие признаки, как СИ (τ = +0,298, p = 0,041), МК (τ = +0,440, p = 0,003), ТВ (τ = +0,388, p = 0,008), ЭП (τ = +0,358, p = 0,014) и АД (τ = +0,327, p = 0,025), с LI — СИ (τ = +0,428, p = 0,003), СП (τ = +0,401, p = 0,006), ТВ (τ = +0,577, p < 0,001) и ЭП (τ = +0,479, p = 0,001), c ASI — МК (τ = +0,430, p = 0,003), ТВ (τ = +0,398, p = 0,007), ЭП (τ = +0,378, p = 0,010) и АД (τ = +0,327, p = 0,025). Таким образом, только ПН не связана с суставным синдромом.
Если наличие МК и ПН не оказывает воздействия на артикулярные изменения при УПА, то по результатам выполненного многофакторного дисперсионного влияния Уилкоксона — Рао с СИ, СП, ТВ и ЭП тесно связаны так называемый суставной пейзаж (разнообразие локализаций артропатии) (соответственно WR = 4,44, p = 0,010; WR = 3,75, p = 0,018; WR = 4,96, p = 0,015; WR = 4,02, p = 0,014) и интегральные рентгено-сонографические признаки артикулярной патологии (WR = 15,14, p < 0,001; WR = 12,16, p < 0,001; WR = 12,60, p < 0,001; WR = 6,42, p = 0,001). Кроме того, ультразвуковые и рентгенологические признаки ПА зависят от наличия у больных АД (WR = 7,92, p < 0,001).
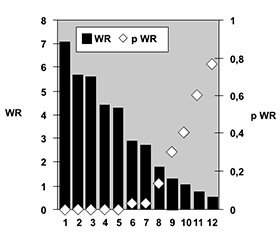
На экстраартикулярную патологию опорно-двигательного аппарата у больных УПА достоверно влияют (рис. 4 и 5) поражения локтевых и коленных суставов (соответственно WR = 12,31, p < 0,001 и WR = 2,95, p = 0,035), наличие таких рентгеносонографических признаков, как эпифизарный остеопороз (WR = 4,03, p = 0,010), остеоузуры (WR = 4,87, p = 0,004), лигаментоз (WR = 8,55, p < 0,001), асептический остеонекроз (WR = 2,70, p = 0,047), артрокальцинаты (WR = 24,66, p < 0,001), изменения рогов менисков (WR = 6,95, p = 0,001), кисты Бейкера (WR = 3,83, p = 0,012) и интраартикулярные тела Штайди (WR = 6,11, p = 0,001).
Выводы
1. Изменения опорно-двигательного аппарата наблюдаются у 97 % от числа больных УПА (преимущественно ПН, ПА, МК).
2. Эти признаки УПА связаны с системными проявлениями болезни (в первую очередь с поражением кожи и сердца), функцией почек (артрит голеностопных сочленений и формирование лигаментоза), степенью активности патологического процесса (параметры DAS и ASI).
3. Тяжесть артропатии при УПА прямо коррелирует с уровнем САД, наличием диастолической дисфункции левого желудочка сердца, ТВ и ЭП, при этом уровень ПСС обладает прогностической значимостью в отношении МК.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Demir S., Sonmez H.E., Özen S. Vasculitis: decade in review. Curr. Rheumatol. Rev. 2018. 25(7). 93731. doi: 10.2174/1573397114666180726093731.
2. Elefante E., Bond M., Monti S., Lepri G., Cavallaro E., Felicetti M. et al. One year in review 2018: systemic vasculitis. Clin. Exp. Rheumatol. 2018. 36(111). 12-32.
3. Gendelman S., Zeft A., Spalding S.J. Childhood-onset eosinophilic granulomatosis with polyangiitis (formerly Churg-Strauss syndrome): a contemporary single-center cohort. J. Rheumatol. 2013. 40(6). 929-35. doi: 10.4103/0973-1482.138133.
4. Itabashi M., Takei T., Moriyama T., Shiohira S., Shimizu A., Tsuruta Y. et al. Long-term damage assessment in patients with microscopic polyangiitis and renal-limited vasculitis using the Vasculitis Damage Index. Mod. Rheumatol. 2014. 24(1). 112-9. doi: 10.3109/14397595.2013.852836.
5. Jariwala M.P., Laxer R.M. Primary vasculitis in childhood: GPA and MPA in childhood. Front. Pediatr. 2018. 16(6). 226-9. doi: 10.3389/fped.2018.00226.
6. Jeleniewicz R., Suszek D., Majdan M. Musculoskeletal symptoms in a group of granulomatosis with polyangiitis patients. Wiad. Lek. 2018. 71(1). 17-20.
7. Lamprecht P., Kerstein A., Klapa S., Schinke S., Karsten C.M., Yu X. et al. Pathogenetic and clinical aspects of anti-neutrophil cytoplasmic autoantibody-associated vasculitides. Front. Immunol. 2018. 9(9). 680. doi: 10.3389/fimmu.2018.00680.
8. Mohammad A.J., Jacobsson L.T., Westman K.W., Sturfelt G. Incidence and survival rates in Wegener's granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and polyarteritis nodosa. Rheumatology. 2012. 48(12). 1560-5.
9. Oiwa H., Nishioka K. Janeway lesions in eosinophilic granulomatosis with polyangiitis. Intern. Med. 2016. 55(5). 549-50. doi: 10.3389/fimmu.01892.
10. Salazar-Exaire D., Ramos-Gordillo M., Vela-Ojeda J., Salazar-Cabrera C.E., Sanchez-Uribe M., Calleja-Romero M.C. Silent ischemic heart disease in a patient with necrotizing glomerulonephritis due to Wegener's granulomatosis. Cardiorenal. Med. 2012. 2(3). 218-24.
11. Soriano A., Lo Vullo M., Casale M., Quattrocchi C.C., Afeltra A. Meningeal involvement in Wegener granulomatosis: case report and review of the literature. Int. J. Immunopathol. Pharmacol. 2012. 25(4). 1137-41. doi: 10.1111/head.13277.
12. Syniachenko O., Khaniukov O., Yehudina Y., Taktashov H., Gashynova K. Characteristics of articular syndrome in systemic vasculitis. Georgian Med. News. 2017. 273(12). 69-75.
13. Tsuchiya N. Genetics of ANCA-associated vasculitis in Japan: a role for HLA-DRB1*09:01 haplotype. Clin. Exp. Nephrol. 2012. 23(11). 132-6. doi: 10.1007/s10157-012-0691-6.

/110-1.jpg)
/110-2.jpg)
/111-1.jpg)