Журнал «Почки» Том 9, №1, 2020
Вернуться к номеру
Гіперфосфатемія: ускладнення зниження функції нирок і ліміт для ренопротекції
Авторы: Кушніренко С.В.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Гіперфосфатемія у пацієнтів з хронічною хворобою нирок (ХХН) є важливим ускладненням зниження функції нирок і пов’язана з негативними клінічними наслідками, такими як серцево-судинна кальцифікація, захворювання кісток і вторинний гіперпаратиреоз, що призводить до збільшення серцево-судинних захворювань і смертності. Мета даного огляду полягала в обговоренні питань менеджменту гіперфосфатемії при ХХН. Розглянуті такі теми: гомеостаз фосфату, діагностика гіперфосфатемії, ефективність сучасного дієтичного і фармакологічного лікування із застосуванням фосфатних біндерів.
Гиперфосфатемия у пациентов с хронической болезнью почек (ХБП) является важным осложнением снижения функции почек и связана с негативными клиническими последствиями, такими как сердечно-сосудистая кальцификация, заболевания костей и вторичный гиперпаратиреоз, что приводит к увеличению сердечно-сосудистых заболеваний и смертности. Цель данного обзора состояла в обсуждении вопросов менеджмента гиперфосфатемии при ХБП. Рассмотрены следующие темы: гомеостаз фосфора, диагностика гиперфосфатемии, эффективность современного диетического и фармакологического лечения с использованием фосфатных биндеров.
Hyperphosphatemia in patients with chronic kidney disease (CKD) is an important complication of impaired renal function and is associated with negative clinical consequences such as cardiovascular calcification, bone disease and secondary hyperparathyroidism, which leads to a worsening of cardiovascular disease and mortality. The purpose of this review was to discuss the management of hyperphosphatemia in CKD. The following topics are considered: phosphorus homeostasis, diagnosis of hyperphosphatemia, the effectiveness of modern dietary and pharmacological treatment using phosphate binders.
гіперфосфатемія; хронічна хвороба нирок; фосфатні біндери; севеламеру гідрохлорид
гиперфосфатемия; хроническая болезнь почек; фосфатные биндеры; севеламера гидрохлорид
hyperphosphatemia; chronic kidney disease; phosphate binders; sevelamer hydrochloride
Гіперфосфатемія у пацієнтів із хронічною хворобою нирок (ХХН) є важливим ускладненням зниження функції нирок і пов’язана з негативними клінічними наслідками, такими як серцево-судинна кальцифікація, захворювання кісток і вторинний гіперпаратиреоз, що призводить до збільшення серцево-судинних захворювань і смертності [1]. Дієтичні фосфатні обмеження, адекватний діаліз і фосфатні біндери поєднуються для лікування гіперфосфатемії [2]. Проте досягнення цілей контролю фосфату є складним, і контроль може бути недосяжним у багатьох пацієнтів. Для ефективного менеджменту гіперфосфатемії у пацієнтів із ХХН важливо розуміння основних рекомендацій Керівництва KDIGO з клінічної практики з діагностики, визначення, запобігання та лікування ХХН із мінеральними та кістковими розладами (МКР) з метою грамотного і коректного ведення пацієнтів з гіперфосфатемією, а також запобігання розвитку кардіоваскулярних ускладнень і створення плацдарму для ефективної ренопротекції і нирково-замісної терапії (НЗТ) у пацієнтів з ХХН.
Фосфор — другий за поширеністю елемент в організмі людини після кальцію [3]. Більша частина (85 %) фосфору міститься в кістках і зубах у вигляді гідроксіапатиту, 14 % знаходяться внутрішньоклітинно у вигляді органічних фосфатних сполук, 1 % від загальної кількості фосфатів в організмі — поза клітиною, в основному у вигляді неорганічного фосфату [3, 4].
Неорганічний фосфат є компонентом багатьох органічних сполук і клітинних структур, таких як мембрани фосфоліпідних клітин, нуклеїнові кислоти і фосфопротеїни. Він відіграє важливу роль у багатьох біологічних процесах, таких як передача сигналів клітинами, синтез нуклеїнової кислоти, енергетичний обмін, мембранні функції, мінералізація кісток і вуглеводний обмін [5]. Крім того, це важливо для нормальної генерації еритроцитів, лейкоцитів і функції тромбоцитів. Фосфат надходить для синтезу аденозинтрифосфату — джерела енергії для фізіологічних процесів, таких як скоротливість м’язів, нервова активність, транспорт електролітів та інші біологічні реакції [6]. Враховуючи важливість фосфатів для різноманітних біологічних процесів, не дивно, що гомеостаз фосфатів є складним процесом, що суворо регулюється.
Середній вміст фосфату в раціоні становить приблизно 20 мг/кг/добу і знаходиться в молочних продуктах, м’ясі, яйцях, злаках, як харчові домішки, які містять фосфати [3]. Біодоступність фосфатів вегетаріанської дієти відносно низька порівняно з м’ясним дієтичним білком. Фосфор рослинних джерел в основному знаходиться в формі фітата, який не гідролізується людьми через нестачу фітазного ферменту і, як наслідок, не засвоюється [7].
Нирки відіграють головну роль в гомеостазі фосфатів, виділяючи загальну кількість фосфату з розрахунку 13 мг/кг/добу [8]. При нормальному фізіологічному стані у здорових людей фосфат вільно фільтрується через клубочки. Більша частина (85–90 %) профільтрованого фосфату реабсорбується переважно в проксимальних канальцях.
Життєво важливу роль в регуляції гомеостазу фосфору і кальцію відіграє паратгормон (ПТГ). Якщо вміст іонізованого кальцію зменшується при збільшенні концентрації фосфору в сироватці, то вивільнюється ПТГ і здійснює свою фосфатурійну дію безпосередньо на нирки. Крім того, ПТГ стимулює активність остеобластів у кістках для вивільнення кальцію і фосфату у позаклітинний пул, а також стимулює активацію вітаміну D через фермент 1a-гідроксилазу. ПТГ також зменшує кількість котранспортерів NaPi в проксимальних канальцях, що призводить до зниження реабсорбції фосфату і, як наслідок, більшому виділенню фосфату нирками [9]. В результаті знижується рівень сироваткового фосфату, знижується виведення кальцію і збільшується концентрація кальцію в сироватці крові.
Активований вітамін D (1a,25(OH)2D3) збільшує кількість котранспортерів NaPi і, як наслідок, збільшує поглинання як фосфату, так і кальцію в кишечнику. На відміну від ПТГ, 1a,25(OH)2D3 збільшує поглинання кальцію і фосфату кістками за рахунок стимуляції остеобластів та інгібіції активності остеокластів. Крім того, 1a,25(OH)2D3 напряму пригнічує дію ПТГ і стимулює котранспортери ниркових NaPi для інгібіції екскреції фосфатів. При підвищенні концентрації кальцію і фосфору в сироватці крові активність a-гідроксилази в ниркових канальцях знижується і, відповідно, зменшується активація вітаміну D [1].
При ХХН зниження швидкості клубочкової фільтрації (ШКФ) компенсується раннім підвищенням концентрації фактора росту фібробластів FGF-23 для зниження повторної абсорбції фосфату в проксимальних канальцях і спроби підтримки нормальних концентрацій фосфату. FGF-23 також знижує концентрацію 1a,25(OH)2D3, знижуючи ефекти котранспортерів NaPi в кишечнику і поглинання фосфатів [10].
Таким чином, FGF-23 відіграє центральну адаптивну роль в гомеостазі фосфату і 1,25-дигідроксивітаміну D. У пацієнтів із ХХН циркулюючі концентрації FGF-23 поступово збільшуються зі зменшенням ниркової здатності до екскреції фосфатів. Результати досліджень на тваринах і генетичних досліджень демонструють, що підвищений рівень FGF-23 може відображати патогенетичні зміни в стані кісток і/або нирок. Інші дослідження продемонстрували незалежний зв’язок FGF-23 з деякими патогенетичними механізмами, такими як збільшення маси лівого шлуночка, підкреслюючи несприятливі наслідки адаптивних механізмів, які включають FGF-23, що запускаються у відповідь на перевантаження фосфатом [11].
Нормальний діапазон еталонної концентрації фосфору становить від 2,5 до 4,5 мг/дл за даними Національного ниркового фонду США (National Kidney Foundation — NKF), що в європейських одиницях виміру відповідає значенням 0,80–1,45 ммоль/л [12].
Резюме рекомендацій KDIGO 2017 з ХХН-МКР в частині 3.1 рекомендує контролювати рівень кальцію, фосфатів, ПТГ та активності лужної фосфатази в сироватці крові починаючи з 3а стадії ХХН (1С). У дітей пропонується такий моніторинг починати з 2-ї стадії ХХН (2D). У пацієнтів із ХХН 3а–5Д пропонується, щоб індивідуальні значення кальцію та фосфору сироватки крові оцінювалися разом з метою визначення клінічного підходу, а не як математична конструкція множення фосфату й кальцію (Са ´ Р) (2D) [13]. Дані наведені в табл. 1.
Корекція гіперфосфатемії
Резюме рекомендацій KDIGO 2017 з ХХН-МКР в частині 4.1, розділі 4.1.1-4.1.2. пропонує: у пацієнтів з ХХН 3а–5Д стадій лікування ХХН-МКР повинно базуватися на серійному оцінюванні рівня фосфору, кальцію і ПТГ, ці результати аналізуються разом. У пацієнтів із ХХН 3а–5Д стадій пропонується зниження підвищеного рівня фосфору до нормального діапазону значень (2С) [13]. Коментар до Керівництва KDIGO 2018 з ХХН — мінеральної хвороби кісток (МХК) в аналогічному розділі підкреслює, що у Великій Британії для пацієнтів із ХХН 3а–5Д є доцільним прагматичний та індивідуалізований підхід щодо зниження фосфатів до нормального діапазону [14].
Резюме рекомендацій KDIGO 2017 з ХХН-МКР в частині 4.1, розділі 4.1.8 у пацієнтів із ХХН 3а–5Д стадій пропонує обмежити прийом фосфату в харчуванні при лікуванні гіперфосфатемії як самостійного заходу або в поєднанні з іншим лікуванням (2D). Доцільно визначати джерела фосфату (наприклад, тваринні, рослинні, добавки) при прийнятті дієтичних рекомендацій (табл. 1) [13].
Аналогічний розділ рекомендацій KDIGO 2018 з ХХН-МХК містить таку інформацію: обмеження споживання фосфатів пацієнтами з ХХН 3а–5Д залишається невід’ємною частиною управління гіперфосфатемією. З огляду на більш докладну інформацію про вміст фосфатів у їжі та їх біодоступність поради мають бути доказовими, індивідуалізованими і в ідеалі створеними спеціалістами з ниркової дієтології [14].
Міністерство охорони здоров’я і соціальних служб США і Національний нирковий фонд загальній популяції рекомендують дієти на рослинній основі, такі як дієтичні підходи до припинення гіпертензії (Dietary Approaches to Stop Hypertension — DASH) з високим вмістом клітковини, з низьким вмістом насичених жирів і переробленого м’яса, які містять джерела калію, фосфору, магнію, кальцію і мають низький рівень натрію. Користь від таких дієт включає попередження серцево-судинних захворювань і гіпертензії, а також затримку прогресування захворювань нирок [15]. Середземноморська дієта схожа на DASH, пов’язана з більш низьким ризиком смертності від серцево-судинних захворювань [12, 16].
На відміну від раціонів на основі м’яса, молочних продуктів, які містять багато сірковмісних амінокислот і фосфатів, раціони на рослинній основі містять менше цих амінокислот і біодоступного фосфору і пов’язані зі скороченням випадків серцево-судинних захворювань і ХХН [17].
Ретроспективні дані National Health and Nutrition Examination Survey продемонстрували, що в осіб зі ШКФ ≥ 15 мл/хв і < 60 мл/хв, які отримували м’ясні дієти з підвищеними кислотними навантаженнями, відзначався більш високий ризик прогресування термінальної стадії хронічної ниркової недостатності, ніж серед учасників з більш низьким розрахунковим дієтичним кислотним навантаженням.
Навпаки, у наступному дослідженні у пацієнтів, які отримували гемодіаліз (ГД) (n = 1751), обмеження вживання фосфору в раціоні було пов’язано з гіршим нутриційним статусом і більш високою смертністю, припускаючи, що обмеження вживання фосфору призводило до ненавмисного зниження корисних макронутрієнтів. Фактично автори виявили, що виживаність була вищою на 27 % у тих, хто отримував > 1000 мг/добу
фосфору, порівняно з пацієнтами, які обмежували щоденне вживання фосфору ≤ 870 мг/добу [18].
Останніми роками освітні програми поповнились новими даними щодо відмінності в біодоступності органічних і неорганічних сполук фосфору, що дозволяють краще орієнтуватися у питанні, в яких продуктах міститься більше всього фосфатів [19].
На сайті NKF розміщена інформація щодо продуктів з виском вмістом фосфору й альтернативні варіанти для обмеження або уникнення розвитку гіперфосфатемії у пацієнтів з ХХН [12]. Дані наведені в табл. 2.
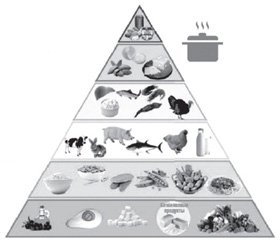
Також С. D’Alessandro зі співавт. запропонували «фосфорну піраміду», в якій продукти розподіляються за 6 рівнями залежно від вмісту фосфору, співвідношення фосфору і білка та біодоступності фосфору (рис. 1) [20]. Кожен рівень відповідає частоті споживання, яка є найвищою в основі піраміди (необмежене споживання) і найнижчою — у верхній частині (уникайте, наскільки це можливо).
Корекція гіперфосфатемії, безумовно, потребує комплексного підходу, який включає дієтичні обмеження вживання фосфатів, їх видалення за допомогою інтенсивних режимів діалізу і фармакологічної корекції за допомогою фосфатних біндерів.
У коментарі до Керівництва KDIGO 2018 з діагностики, оцінки, профілактики та лікування ХХН-МХК в розділі 4.1.5 пропонується, щоб фосфатні біндери не використовувались заздалегідь у пацієнтів із ХХН 3а–5Д, проте були зарезервовані для тих, у кого прогресивно зростає (або залишається постійно високим) рівень фосфатемії. Зниження рівня фосфатів вимагає мультипрофесійного підходу до терапії [14].
Фосфатні біндери — це група лікарських засобів з різною хімічною структурою, які застосовуються для лікування гіперфосфатемії у пацієнтів з ХХН за рахунок зменшення всмоктування фосфатів їжі у шлунково-кишковому тракті [19]. Фосфатні біндери та їх основні переваги і недоліки наведені в табл. 3 [21].
У Керівництві KDIGO 2018 в розділі 4.1.6 у пацієнтів з ХХН 3а–5Д пропонується обмежити застосування фосфатних біндерів на основі кальцію. На той час як фосфатні біндери на основі кальцію все ще відіграють певну роль в управлінні гіперфосфатемією у дорослих з ХХН, їх місце серед препаратів першої лінії більше не може бути рекомендоване, особливо за умови, що дешевші безкальцієві біндери-генерики стають все доступнішими [14]. Також рекомендується уникати довготривалого застосування алюмінійвмісних фосфатних біндерів, а в пацієнтів із ХХН 5Д — уникати контамінації алюмінію в діалізаті з метою запобігання алюмінієвій інтоксикації (1С) [13].
В окремих рекомендаціях для дітей пропонується застосовувати фосфатний біндер на основі кальцію як першу лінію гіпофосфатної терапії в дітей і/або комбінацію з севеламером або перехід на нього, якщо в серії вимірів кальцію в сироватці крові спостерігається тенденція до перевищення норми відповідного віку [14].
Майже після 20-річного періоду існування фосфатних біндерів на основі алюмінію та кальцію в 1998 році Управління з санітарного нагляду за якістю харчових продуктів і медикаментів Міністерства охорони здоров’я і соціальних служб США (Food and Drug Administration — FDA) затвердило перший фосфатний біндер на основі аніонообмінного полімеру, який не всмоктується і не містить метали, — севеламеру гідрохлорид, а в 2007 році — севеламеру карбонат.
У 2004 році FDA затвердило ще один фосфатний біндер, який не містить алюмінію або кальцію, — лантану карбонат. Лантан є природним «рідкоземельним» елементом, який має здатність зв’язувати фосфати. Він погано всмоктується в кишечнику людини і має абсолютну біодоступність при пероральному прийомі всього 0,00089 % [22].
У червні 2012 року в Японії запустили випуск ще одного фосфатного біндера — біксаломеру — неабсорбуємого полімеру з аміногрупою, механізм дії якого схожий з севеламером [21].
У 2013 і 2014 році FDA затвердило два залізомістких фосфатних біндери: полінуклеарний комплекс заліза оксигідроксиду, сахарози і крохмалю та цитрат заліза [21].
В Україні корпорація «Артеріум» представила новий лікарський засіб із діючою речовиною севеламеру гідрохлорид.
Препарат севеламеру гідрохлорид містить севеламер, фосфатозв’язуючий полімер, що не абсорбується, який не містить металів і кальцію. Він містить поліаміни, відокремлені молекулами вуглецю від основного ланцюга полімеру. Ці аміни частково протонуються у кишечнику i вступають у взаємодію з молекулами фосфатів за допомогою іонних та водневих зв’язків. Завдяки зв’язуванню фосфату в шлунково-кишковому тракті севеламер знижує концентрацію фосфату в сироватці крові.
У клінічних дослідженнях була показана ефективність севеламеру у зниженні рівня фосфору в сироватці крові у пацієнтів, які перебувають на гемодіалізі або перитонеальному діалізі.
Показаннями до застосування є: лікування гіперфосфатемії у дорослих пацієнтів, які перебувають на ГД або перитонеальному діалізі (ПД), для зменшення вмісту фосфатів в сироватці крові. Але, враховуючи резюме рекомендацій KDIGO 2017 з ХХН-МКР і KDIGO 2018 з ХХН-МХК, можливим є застосування препарату за наявності гіперфосфатемії у пацієнтів з ХХН 3а–5Д. Не слід забувати, що протипоказаннями до застосування севеламеру гідрохлориду є: підвищена чутливість до севеламеру або до будь-якого з компонентів препарату; гіпофосфатемія; кишкова непрохідність (обструкція).
Спосіб застосування: перорально. Пацієнтам слід приймати препарат разом із їжею i дотримуватися призначеної дієти. Порошок можливо розводити водою або додавати в їжу. Рекомендована початкова доза севеламеру гідрохлориду становить 2,4 г або 4,8 г на день залежно від клінічних потреб та вмісту фосфору в сироватці крові (табл. 4). Севеламеру гідрохлорид необхідно приймати 3 рази на день під час вживання їжі.
Севеламер ізолює фосфат в шлунково-кишковому тракті, запобігає його всмоктуванню і підсилює екскрецію з фекаліями. Крім того, лікування севеламером супроводжується зниженням частоти гіперкальціємії, виникненням низьких рівнів ПТГ, зниженням ліпопротеїнів низької щільності, як у пацієнтів на діалізі, так і до проведення НЗТ, зниженням рівня С-реактивного білка, гіперурикемії, рівня фетуїну А, уремічних токсинів, що свідчить про загальний протизапальний ефект препарату [23].
Декілька досліджень продемонстрували, що відмінності в смертності можуть бути пов’язані з застосуванням фосфатних біндерів на основі кальцію і севеламеру. У дослідженні Renagel in New Dialysis первинною кінцевою точкою була оцінка прогресування показників коронарної та аортальної кальцифікації (КАК) шляхом порівняння лікування із застосуванням севеламеру і фосфатних біндерів на основі кальцію. Автори продемонстрували значне зниження прогресування кальцифікації судин серед пацієнтів, які отримували севеламер, порівняно з пацієнтами, які отримували фосфатні біндери на основі кальцію; показали, що лікування севеламером пов’язано зі значною перевагою виживаності. Більш того, у пацієнтів, які вперше розпочали лікування ГД, початковий бал КАК був значним предиктором смертності від усіх причин. Фактично був проведений вторинний аналіз даних про смертність: смертність від усіх причин через 4 роки була вищою у пацієнтів, які отримували кальцій, ніж у пацієнтів, які отримували севеламер (10,6 на 100 пацієнтів-років проти 5,3 на 100 пацієнтів-років відповідно; p = 0,05). Покращення виживаності для групи севеламеру було підтверджено багатомірним аналізом після поправки на змішані фактори [24, 25].
The Dialysis Clinical Outcomes Revisited (DCOR) — велике проспективне рандомізоване дослідження виживаності — оцінило, чи було застосування севеламеру корисним для виживання у пацієнтів, які отримують ГД [26]. 2103 пацієнта були рандомізовані для лікування севеламером гідрохлоридом або кальцієвим фосфатним біндером на термін до 45 місяців. У цих двох групах не було відмінностей в показниках смертності від усіх причин і від конкретних причин. Проте попередній аналіз продемонстрував більш низький рівень смертності у пацієнтів старше 65 років, які отримували севеламер. Крім того, вторинний аналіз дослідження DCOR показав, що севеламер порівняно з фосфатними біндерами на основі кальцію зменшував кількість госпіталізацій за всіма причинами [27].
Що стосується ПД, то доступні дані багатоцентрового відкритого дослідження, в якому рандомізовано 143 дорослих пацієнти на ПД з фосфором в сироватці > 5,5 мг/дл до 12 тижнів лікування севеламером гідрохлоридом або ацетатом кальцію. У кінці дослідження рівні фосфору і ПТГ в сироватці крові були однаково і значно знижені як для севеламеру гідрохлориду, так і для ацетату кальцію. Навпаки, сироваткові рівні кальцію збільшились у пацієнтів, які отримували ацетат кальцію, порівняно з пацієнтами, які отримували севеламер (18 % проти 2 % відповідно, р = 0,001) [28].
У деяких дослідженнях задокументовані відповідні плейотропні ефекти севеламеру, що підкреслюють роль фосфатного біндера у профілактиці ризику серцево-судинних захворювань. Нові кінцеві точки спрямовані не тільки на лікування гіперфосфатемії, але і на більш широкий контроль порушень обміну речовин, в тому числі дисліпідемію, гіперурикемію, запалення та інші фактори, що беруть участь в кальцифікації судин. Згідно з останніми даними, севеламер задовольняє цим новим стандартам ефективності [29].
Впровадження некальційвмісних фосфатних біндерів знайшло широке застосування у пацієнтів із ХХН на НЗТ, але лише деякі дослідження продемонстрували їх потенціальні клінічні переваги на ранніх стадіях ХХН. Нещодавні роботи демонструють, що FGF-23, який продукується остеоцитами, може бути залученим у ранню ХХН-МХК. У відповідь на перевантаження фосфатом FGF-23 впливає на нирку, знижуючи продукцію 1,25-дигідроксивітаміну D, шляхом пригнічення 1α-гідроксилази, що обмежує можливості адекватної корекції фосфорно-кальцієвого обміну і зменшує ренопротекторний потенціал активованої форми 1,25-дигідроксивітаміну D. Усунення підвищення рівня FGF-23 в сироватці у пацієнтів з ХХН може запобігти передчасному зниженню рівня 1,25-дигідроксивітаміну D в сироватці і наступному збільшенню рівня ПТГ в сироватці. Потенціальні позитивні ефекти зниження рівнів FGF-23 припускають кореляцію між FGF-23, кальцифікацією судин, прогресуванням ХХН і смертністю [29, 30].
Потужна доказова база ставить питання менеджменту гіперфосфатемії в центр лікування пацієнтів із ХХН. Проведення своєчасних відповідних діагностичних процедур і грамотного та коректного лікування пацієнтів із гіперфосфатемією на тлі ХХН повинно базуватися на основних рекомендаціях Керівництва KDIGO 2017 з клінічної практики з діагностики, визначення, запобігання та лікування ХХН-МКР. Корекція гіперфосфатемії у світі сучасних рекомендацій потребує комплексного підходу, який включає дієтичні обмеження вживання фосфатів, їх видалення за допомогою інтенсивних режимів діалізу і фармакологічної корекції за допомогою фосфатних біндерів з метою попередження розвитку захворювань кісток, кардіоваскулярних ускладнень і проведення ефективної ренопротекції у пацієнтів з ХХН.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Рецензенти: зав. відділом дитячої урології ДУ «Інститут урології НАМНУ», д.м.н. В.Ф. Петербургський; завідувач кафедри педіатрії № 2 НМАПО ім. П.Л. Шупика, д.м.н., професор Т.В. Марушко.
1. Shaman A.M., Kowalski S.R. Hyperphosphatemia Management in Patients with Chronic Kidney Disease. Saudi Pharm. J. 2016. Vol. 24(4). P. 494-505.
2. Vervoloet M.G., van Ballegooijen A.J. Prevention and treatment of hyperphosphatemia in chronic kidney disease. Kidney International. 2018. Vol. 93(5). P. 1060-1072.
3. Bellasi A., Kooienga L., Block G.A. Phosphate binders: new products and challenges. Hemodial. Int. 2006. Vol. 10. P. 225-234.
4. Uribarri J. Phosphorus homeostasis in normal health and in chronic kidney disease patients with special emphasis on dietary phosphorus intake. J. Semin. Dial. 2007. Vol. 20. P. 295-301.
5. Berndt T., Thomas L.F., Craig T.A. et al. Evidence for a signaling axis by which intestinal phosphate rapidly modulates renal phosphate reabsorption. Proc. Natl. Acad. Sci. USA. 2007. Vol. 104. P. 11085-11090.
6. Nishi Y., Fujimoto S., Sasaki М. et al. Role of mitochondrial phosphate carrier in metabolism-secretion coupling in rat insulinoma cell line INS-1. Biochem. J. 2011. Vol. 435. P. 421-430.
7. Moe S.M., Zidehsarai М.Р., Chambers М.А. et al. Vegetarian compared with meat dietary protein source and phosphorus homeostasis in chronic kidney disease. Clin. J. Am. Soc. Nephrol. 2011. Vol. 6. P. 257-264.
8. Berndt T., Schiavi S., Kumar R. “Phosphatonins” and the regualtion of phosphorus homeostasis. Am. J. Physiol. 2005. Vol. 289. P. 1170-1182.
9. O’Donovan R.M., Widnell C.C., Chen T.C., Puschett J.B. Parathyroid hormone transport effects and hormonal processing in primary cultured rat proximal tubular cells. Biochem. J. 1993. Vol. 293(2). P. 377-380.
10. Shimada T., Hasegawa H., Yamazaki Y. et al. FGF-23 is a potent regulator of vitamin D metabolism and phosphate homeostasis. J. Bone Miner. Res. 2004. Vol. 19. P. 429-435.
11. Ketteler M., Wuthrich R.P., Floege J. Management of hyperphosphataemia in chronic kidney disease – challenges and solutions. Clinical Kidney Journal. 2013. Vol. 6(2). P. 128-136.
12. Phosphorus and Your CKD Diet. NKF. 2019. www.kidney.org.
13. KDIGO 2017. Доповнення Керівництва з клінічної практики з діагностики, визначення, запобігання та лікування хронічної хвороби нирок з мінеральними та кістковими розладами (ХХН-МКР) / Пер. М.Д. Іванова, Д.Д. Іванова, Л.А. Пирога. Почки. Нирки. Kidneys. 2017. № 3. С. 26-31.
14. Коментар до Керівництва KDIGO з діагностики, оцінки, профілактики та лікування ХХН-МХК (хронічної хвороби нирок — мінеральної хвороби кісток), 2018 / Пер. М.Д. Іванова, Л.А. Пирога. Почки. Нирки. Kidneys. 2018. № 3. С. 88-90.
15. Clegg D.J., Hill Gallant K.M. Plant-based diets in CKD. CJASN. 2019. Vol. 14(1). P. 141-143.
16. Banerjee T., Liu Y., Crews D.C. Dietary patterns and CKD progression. Blood Purif. 2016. Vol. 41. P. 117-122.
17. Moorthi R.N., Armstrong C.L., Janda К. et al. The effect of a diet containing 70% protein from plants on mineral metabolism and musculoskeletal health in chronic kidney disease. Am. J. Nephrol. 2014. Vol. 40. P. 582-591.
18. Lynch K.E., Lynch R., Curhan G.C. et al. Prescribed dietary phosphate restriction and survival among hemodialysis patients. Clin. J. Am. Soc. Nephrol. 2011. Vol. 6. P. 620-629.
19. Горелова Е.А., Чернышева Н.Н., Котенко О.Н., Шутов Е.В. Современные возможности применения фосфат-связывающих препаратов у больных, находящихся на диализе. Клиническая нефрология. 2017. № 1. С. 71-80.
20. D’Alessandro C., Piccoli G.B., Cupisti А. The “phosphorus pyramid”: a visual tool for dietary phosphate management in dialysis and CKD patients. BMC Nephrology. 2015. Vol. 16. Р. 9.
21. Barreto F.C., Barreto D.V., Massy Z.A., Drueke T.B. Strategies for phosphate control in patients with CKD. Kidney Int. Rep. 2019. Vol. 4(8). P. 1043-1056.
22. Zhang C., Ji Wen, Zi Li, Fan J. Efficacy and safety of lanthanum carbonate on chronic kidney disease – mineral and bone disorder in dialysis patients: a systematic review. BMC Nephrol. 2013. Vol. 14. Р. 226.
23. Spaia S. Phosphate binders: Sevelamer in the prevention and treatment of hyperphosphataemia in chronic renal failure. Hippokratia. 2011. Vol. 15(Suppl. 1). P. 22-26.
24. Komaba H., Wang M., Taniguchi M., Yamamoto S. Initiation of sevelamer and mortality among hemodialysis patients treated with calcium-based phosphate binders. Clin. J. Am. Soc. Nephrol. 2017. Vol. 12. P. 1489-1497.
25. Block G.A., Raggi Р., Bellasi А. et al. Mortality effect of coronary calcification and phosphate binder choice in incident hemodialysis patients. Kidney Int. 2007. Vol. 71. P. 438-441.
26. Suki W.N., Zabaneh R., Cangiano J.L. et al. Effects of sevelamer and calcium-based phosphate binders on mortality in hemodialysis patients. Kidney Int. 2007. Vol. 72. P. 1130-1137.
27. St Peter W.L., Liu J., Weinhandl E., Fan Q. A comparison of sevelamer and calcium-based phosphate binders on mortality, hospitalization, and morbidity in hemodialysis: A secondary analysis of the Dialysis Clinical Outcomes Revisited (DCOR) randomized trial using claims data. Am. J. Kidney Dis. 2008. Vol. 51. P. 445-454.
28. Evenepoel P., Selgas R., Caputo F. et al. Efficacy and safety of sevelamer hydrochloride and calcium acetate in patients on peritoneal dialysis. Nephrol. Dial. Transplant. 2009. Vol. 24. P. 278-285.
29. Cozzolino M., Rizo M.A., Stucchi А. et al. Sevelamer for hyperphosphataemia in kidney failure controversy and perspective. Ther. Adv. Chronic Dis. 2012. Vol. 3(2). P. 59-68.
30. Oliveira R.B., Cancela A.L.E., Graciolli F.G. Early control of PTH and FGF23 in normophosphatemic CKD patients: a new target in CKD-MBD therapy? Clin. J. Am. Soc. Nephrol. 2010. Vol. 5. P. 286-291.

/59-1.jpg)
/60-1.jpg)
/60-2.jpg)
/61-1.jpg)
/62-1.jpg)