Газета «Новости медицины и фармации» №14 (709), 2019
Вернуться к номеру
Вплив перорального застосування чотирьох штамів Lactobacillus на стан вагінальної мікрофлори, що оцінюється за шкалою Nugent: систематичний огляд і метааналіз
Авторы: Наталія Купріненко
Разделы: Клинические исследования
Версия для печати
Вступ
Нормальне кисле вагінальне середовище в дорослих жінок підтримується мікробіотою, що переважно складається з лактобацил (особливо Lactobacillus crispatus і Lactobacillus jensenii). Бактеріальний вагіноз (БВ), застосування хіміотерапії призводять до порушень мікробіоти піхви. Бактеріальний вагіноз характеризується зменшенням числа лактобацил, збільшенням числа анаеробних бактерій, зниженням концентрації H2O2 і молочної кислоти, збільшенням pH вище від 4,5 і асоціюється з підвищеним ризиком урогенітальних інфекцій, акушерських ускладнень і самовільних абортів (у вагітних) (Donders et al., 2000; Harmanli et al., 2000; Hauth et al., 2003; Hillebrand et al., 2002; Hillier et al., 1996; Klebanoff et al., 2004; Larsson et al., 1990; Leitich et al., 2003; Macones et al., 2004; Petricevic et al., 2014; Simhan et al., 2005; Swidsinski et al., 2013).
Було показано, що пероральне і/або місцеве введення бактерій, які продукують молочну кислоту (так званих пробіотиків), зокрема лактобацил, таких як Lactobacillus rhamnosus GR–1 і Lactobacillus reuteri RC–14, сприяє позитивним змінам мікробіоти піхви в здорових жінок, покращує або відновлює порушену мікробіоту піхви й підвищує ефективність антибіотикотерапії в жінок із БВ (Anukam et al., 2006; Martinez et al., 2009; Reid and Bocking, 2003). З метою підвищення ефективності лікування БВ з мікробіоти піхви здорових жінок були виділені потенційні лактобактерії. Критерії відбору були такими: активність каталази й оксидази, зростання в аеробних і анаеробних умовах, здатність до окиснення, позаклітинне продукування перекису водню, використання глікогену, стійкість до солей жовчних кислот і пригнічення росту патогенних мікроорганізмів (Escherichia coli, Gardnerella vaginalis, Candida krusei, Candida albicans і Candida glabrata), відсутність стійкості до антибіотиків, зменшення муцину, бета–гемоліз, а також активність глікозидази й ариламідази (Domig et al., 2014).
Було виділено чотири штами Lactobacillus (L.crispatus LbV 88, Lactobacillus gasseri LbV 150N, L.jensenii LbV 116 і L.rhamnosus LbV 96), що відповідають цим критеріям (De Seta et al., 2014; Domig et al., 2014). Суміш цих штамів була вивчена в кількох пілотних рандомізованих клінічних дослідженнях (РКІ) (Anoshina, 2016; Kaufmann et al., 2014; Laue et al., 2018; Marschalek et al., 2017), які показали позитивний вплив на мікробну флору піхви, і в одному дослідженні було продемонстровано покращання показника лікування БВ. Комерційний препарат даної суміші штамів доступний як харчова добавка (європейський патент EP 2505010B1). Однак через невелике число обстежених жінок у більшості досліджень не було продемонстровано вірогідності результатів.
Тому M. de Vrese et al. (2019), поставивши перед собою мету оцінити вплив перорального введення вищевказаних штамів Lactobacillus, виділених з вагінальної мікробіоти, на вагінальний дисбіоз, провели систематичний огляд і метааналіз рандомізованих клінічних досліджень, у яких для оцінки впливу перорального застосування суміші цих штамів Lactobacillus на дисбіоз піхви використовували шкалу Nugent. Для визначення вагінального дисбіозу застосовувалася шкала Nugent (> 3), оскільки глобальний тягар вагінального дисбіозу вивчався в дослідженнях, у яких виконувалася оцінка за цією шкалою, і ступінь дисбіозу (відсутність або низький вміст лактобацил; широко представлена бактеріальна флора) в молекулярних дослідженнях добре корелював з показниками за шкалою Nugent і вагінальним рН (Van de Wijgert і Jespers, 2017).
Матеріали та методи
Було проведено систематичний пошук літератури з видобуванням даних у базах PUBMED/MEDLINE, EMBASE і бібліотеці Cochrane, без обмежень за датою і мовою публікації. Використовуючи для пошуку ключові слова «lactobacillus», «lactobacilli», «вагінальний», «піхва», «мікробіота», «мікрофлора», автори знайшли 685 потенційно придатних статей. Їх кількість скоротилася до 215, коли пошук був обмежений вищезгаданими видами лактобацил (crispatus, gasseri, jensenii, rhamnosus). Коли пошук обмежився статтями, у яких вивчалася комбінація всіх чотирьох видів лактобактерій, і до пошукового терміну додавалися штами лактобактерій (LbV, або LbV88, або LbV 150N, або LbV116, або LbV96), залишилося тільки шість статей. Із них два дослідження (Kiss et al., 2007; Martinez–Pena et al., 2013) були відхилені після ознайомлення з їх резюме, оскільки в них не досліджували ефекти всіх чотирьох видів лактобактерій. Повнотекстовий пошук по одному і по всіх чотирьох штамах у базі Google Scholar дав той же результат. Відповідь на запит, відправлений власнику патенту на суміш чотирьох вищезазначених штамів лактобактерій, підтвердила повноту нашого списку з чотирьох РКІ.
Отже, у метааналіз були включені РКІ, у яких ефект від перорального застосування суміші чотирьох штамів Lactobacillus (L.crispatus LbV 88 (DSM 22566), L.gasseri LbV 150N (DSM 22583), L.jensenii LbV 116 (DSM 22567) і L.rhamnosus LbV96 (DSM 22560)) при дисбіозі піхви оцінювали за шкалою Nugent.
Результати
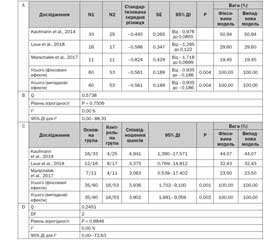
У результаті пошуку літератури було знайдено чотири РКІ, у яких були наведені результати досліджень 178 осіб (табл. 1):
1. Подвійне сліпе РКІ (Kaufmann et al., 2014) за участю 60 транссексуалів, які змінили чоловічу стать на жіночу.
2. Відкрите РКІ (Anoshina, 2016) за участю 60 вагітних жінок із герпесвірусною інфекцією (ГВІ) і 50 здорових жінок, які становили контрольну групу.
3. Подвійне сліпе РКІ (Laue et al., 2018) за участю 36 жінок із бактеріальним вагінозом.
4. Подвійне сліпе РКІ (Marschalek et al., 2017) за участю 22 пацієнток у постменопаузі з раком молочної залози, які отримують хіміотерапію.
Тільки в трьох подвійних сліпих РКІ (1, 3 і 4) проводили оцінку за шкалою Nugent. У дослідженні Anoshina (2016) було обстежено 2 ´ 30 вагітних із ГВІ. У цих жінок ГВІ і зміни кислотності піхви під впливом гестаційних гормонів і фізіологічної імуносупресії спричинили мікробний дисбіоз піхви. На відміну від інших трьох досліджень, ефекти застосування протягом одного тижня капсул із пробіотиками не визначались кількісно на основі показників за шкалою Nugent, натомість вони оцінювалися на підставі зміни концентрації окремих видів/груп бактерій у кишечнику й піхві та клінічних проявів порушень мікробіоти піхви. Отже, за шкалою Nugent оцінювали тільки показник КУО/мл лактобацил і гарднерел. Не повідомлялося про підрахунок морфотипів лактобацил, гарднерел і бактероїдів за допомогою мікроскопа в забарвлених за Грамом вагінальних мазках у структурі шкали Nugent. Оскільки взаємозв’язок між показником КУО/мл для лактобацил і гарднерел у піхві й показником за шкалою Nugent не досліджували ні в цій статті, ні в інших джерелах літератури, а також не вдалося отримати в авторів необроблені дані дослідження, не було спільних з іншими дослідженнями параметрів для вимірювання величини ефекту. З цієї причини, а також через те, що це РКІ не було подвійним сліпим, врешті–решт це дослідження теж було виключене з метааналізу.
Характеристики дослідження
Інші три дослідження — подвійні сліпі РКІ, у яких ступінь вагінального дисбіозу оцінювалася (виключно або поряд з іншими видами оцінки) за шкалою Nugent. Їх характеристики наведені в табл. 1. Дослідження були (1) неоднорідними (2) за причинами й ступенем вираженості вагінального дисбіозу, (3) за середнім балом за шкалою Nugent до лікування, (4) за методами й тривалістю лікування. І можна обговорити, наскільки добре шкала Nugent, яка в кінцевому підсумку була розроблена для полегшення діагностики бактеріального вагінозу, взагалі відображає природу, ступінь вагінального дисбіозу й зміни, що розвиваються при даній патології.
Зокрема, транссексуали, які змінили чоловічу стать на жіночу, які брали участь у дослідженні Kaufmann et al. (2014), мають неовагінальну мікробіоту, яка, з одного боку, має схожість із вагінальним мікробіомом при БВ, але, з іншого боку, значно відрізняється від мікробіоти природної піхви, особливо дуже обмеженим числом лактобацил (Weyers et al., 2009, 2010). Отже, метою дослідження було не лікування БВ, а зміщення неовагінальної мікробіоти в бік нормальної вагінальної мікробіоти, що оцінюється за шкалою Nugent при пероральному застосуванні препарату лактобацил (Petricevic et al., 2008; Reid et al., 2003). Критеріями виключення для цього дослідження були, серед іншого, клінічні ознаки вагінальної інфекції або інфекції сечовивідних шляхів, патологічні неовагінальні виділення й застосування антибіотикотерапії за чотири тижні до включення в дослідження, тому середній бал за шкалою Nugent у жінок на початку лікування мав відносно низьке значення — 5.
Учасниками дослідження Laue et al. (2018) були жінки середнього віку з бактеріальним вагінозом (на підставі критеріїв Amsel і оцінки за шкалою Nugent) і, отже, з високим (до 8) середнім балом за шкалою Nugent до лікування. На відміну від двох інших досліджень, період лікування був відносно тривалим (28 днів). У період із першого по сьомий день лікування пацієнти також отримували метронідазол для лікування БВ, тому показник за шкалою Nugent також покращився в конт–рольній групі. Слабким місцем цього дослідження є те, що в основній групі пацієнтки отримували пробіотики в йогурті, на той час як у контрольній групі пацієнтки отримували хімічно ацидофільоване й сквашене молоко, отже, не було можливості контролювати можливий ефект йогуртових бактерій.
Marschalek et al. (2017) обстежили 22 хворих на рак молочної залози в постменопаузальному періоді з атрофією піхви (унаслідок хіміотерапії і естрогенної деприваційної терапії), проміжним варіантом мікробіоти піхви й показником за шкалою Nugent від 4 до 6 (що було одним з критеріїв включення). Автор розрахував вплив 14–денного застосування препарату пробіотиків на величину показника за шкалою Nugent окремо для основної групи й групи плацебо без статистичного порівняння обох груп (ми зробили це порівняння, використовуючи необроблені дані, у контексті цього метааналізу).
Якість дослідження
Незважаючи на втрати якості через відмінності між дослідженнями щодо учасників дослідження, дизайну дослідження й оцінки ефектів, дослідження мали деякі недоліки, зокрема, всі вони були експериментальними дослідженнями з невеликою кількістю учасників.
Метааналіз впливу препарату лактобацил на показник за шкалою Nugent
Метааналіз трьох подвійних сліпих РКІ, що були включені в остаточну статистичну оцінку, показує вірогідне зниження показника за шкалою Nugent при застосуванні пробіотиків порівняно з плацебо у фіксованій моделі (стандартизована середня різниця (SMD) –0,561; довірчий інтервал (ДІ) від –0,935 до –0,186; P = 0,004) і моделі випадкового ефекту (SMD –0,561; ДІ від –0,935 до –0,186; P = 0,004) (табл. 2А, рис. 1А). Співвідношення шансів (OR) випадків з покращанням показника за шкалою Nugent після застосування пробіотиків порівняно з плацебо демонструє вірогідний ефект у фіксованій моделі (OR = 3,936; ДІ від 1,702 до 9,100; P = 0,001) і моделі випадкового ефекту (OR = 3,902; ДІ від 1,668 до 9,059; P = 0,002) (табл. 2C, рис. 1B). Візуально на форест–графіках немає ніяких ознак гетерогенності між дослідженнями (рис. 1А, 1В), а також відповідно до Q–критерію Кохрана і статистики I2 (невідповідність), так само як при оцінці змін показника за шкалою Nugent (Q = 0,574; P = 0,751; I2 = 0,0 %; табл. 2B) і OR (Q = 0,245; P = 0,885; I2 = 0,0 %; табл. 2D). Тут неоднорідність підтверджується, коли P < 0,1; Q > 2 (df) і/або I2 >> 0 % (Higgins et al., 2003).
Аналіз підгруп
Щоб, по–перше, оцінити, наскільки стан штучної неопіхви порівняно з природною піхвою впливав на результати метааналізу, і, по–друге, з’ясувати, чи чинила вірогідний вплив на результати слабкість групи плацебо в дослідженні Laue et al. (2018), ми провели два аналізи підгруп.
У першому аналізі підгрупи ми видалили дослідження Kaufmann et al. (2014) з метааналізу, у другому аналізі включили тільки дослідження Kaufmann et al. (2014) і Marschalek et al. (2017).
Незважаючи на відсутність групи пацієнтів зі штучною піхвою, метааналіз двох подвійних сліпих РКІ, що залишилися, демонстрував вірогідне зниження показника за шкалою Nugent при застосуванні пробіотиків порівняно з плацебо у фіксованій моделі (SMD –0,681; ДІ від –1,222 до –0,139; P = 0,015) і моделі випадко–вого ефекту (SMD –0,681; ДІ від –1,222 до –0,139; P = 0,015) (рис. 2А). OR випадків із покращанням показника за шкалою Nugent після застосування пробіотиків порівняно з плацебо демонструє також вірогідний ефект як у фіксованій моделі (OR = 3,241; ДI від 1,051 до 9,992; P = 0,041), так і в моделі випадкового ефекту (OR = 3,240; ДІ від 1,051 до 9,992; P = 0,041) (рис. 2В).
У другому аналізі підгрупи єдине дослідження (Laue et al., 2018), яке було пропущене, вивчало варіанти лікування в пацієнтів із БВ, але в ньому не було йогуртових культур у групі плацебо. Проте метааналіз двох рандомізованих клінічних досліджень, що залишилися, ще раз показує однаково вірогідне зниження показника за шкалою Nugent порівняно з плацебо в обох моделях (SMD –0,550; ДІ від –0,998 до –0,101; P = 0,017) (рис. 3А). OR випадків з покращеним показником за шкалою Nugent порівняно з плацебо демонструє вірогідний ефект як у фіксованій моделі (OR = 4,222; ДІ від 1,524 до 11,698; P = 0,006), так і в моделі випадкового ефекту (OR = 4,184; ДІ від 1,50 до 11,656; P = 0,006) (рис. 3В).
Із двох аналізів підгруп у жодному розрахунок Q–критерію Кохрана і статистики I2 не продемонстрував доказів неоднорідності між рештою досліджень.
Обговорення
Загальний результат
Наш метааналіз тільки трьох РКІ за участю 118 жінок, розподілених в основну й контрольну групи, продемонстрував чіткі докази того, що пероральний прийом пробіотичної суміші, яка містить 4 штами Lactobacillus (L.crispatus LbV 88 (DSM 22566), L.gasseri LbV 150N (DSM 22583), L.jensenii LbV 116 (DSM 22567) і L.rhamnosus LbV96 (DSM 22560)) (європейський патент PCT/EP2011/065877), покращує мікробну флору при вагінальному дисбіозі. Це підтверджується вірогідним зменшенням середнього показника за шкалою Nugent на 0,5 бала в групі застосування пробіотиків порівняно з контрольною групою (P = 0,004), а також OR (OR = 3,9; P < 0,002) у випадках покращання показника за шкалою Nugent після прийому пробіотиків порівняно з контрольною групою. Четверте дослідження (Anoshina, 2016) було виключене з метааналізу, тому що в ньому не оцінювався такий же показник ефекту, як в інших дослідженнях. Це дослідження також продемонструвало покращання мікробіоти піхви і вагінального середовища, про що свідчить збільшення кількості колонієутворюючих одиниць лактобацил і зменшення кількості G.vaginalis.
Зменшення показника за шкалою Nugent на 0,5 бала еквівалентне 8,3 % від середнього показника за шкалою Nugent (5,9 бала) для всіх жінок у трьох дослідженнях. Тому, з огляду на добру кореляцію між показником за шкалою Nugent і тягарем дисбактеріозу піхви, а також між показником за шкалою Nugent і результатами молекулярних досліджень (Van de Wijgert and Jespers, 2017), ефект від пробіотиків релевантний. Навпаки, усі дослідження поодинці продемонстрували однакову тенденцію, але принаймні не були або були незначно вірогідними: за одним винятком, їх відповідні ДІ включали нульові значення ефекту відмінностей показника за шкалою Nugent (0) або OR (1) відповідно (рис. 1).
Результат цього метааналізу узгоджується з більш ранніми дослідженнями, у яких різні штами Lactobacillus змінювали мікробіоту піхви у жінок (Reid і Bocking, 2003) або збільшували ефективність метронідазолу в жінок із БВ (Anukam et al., 2006).
Оцінка за шкалою Nugent не включає симптоми, і два дослідження (Kaufmann et al., 2014; Marschalek et al., 2017) не були спрямовані на оцінку симптомів, у них оцінювали тільки мікробну структуру вагінальних мазків за допомогою мікроскопії. Однак, як було продемонстровано, показник за шкалою Nugent корелює з наслідками дисбіозу піхви й результатами молекулярних досліджень (Van de Wijgert and Jespers, 2017) і є золотим стандартом у гінекології для діагностики бактеріального вагінозу (CDC, 2006; Sherrard et al., 2011), найбільш поширеної форми вагінального дисбіозу, на той час як критерії Amsel, що включають такі симптоми, як виділення і запах, були менш прогностичними для бактеріального вагінозу (Sha et al., 2005).
Гетерогенність
Дивує однозначність результату з огляду на те, що окремо три дослідження в даному метааналізі значно різняться щодо популяції дослідження, лікування й вихідних оцінок результату: натуральна піхва порівняно з неовагіною (у транссексуалів), проведення антибіотикотерапії чи ні, доведений бактеріальний вагіноз або дисбиоз тільки з проміжним варіантом мікробіоти піхви. Проте тести на гетерогенність показують, що гетерогенність між цими трьома дослідженнями дуже мала. Тому висновки можна робити шляхом вибору двох показників ефекту, а саме: (1) SMD між вихідним показником за шкалою Nugent і цим показником при першому медичному обстеженні і (2) OR випадків із покращеним показником за шкалою Nugent після застосування пробіотиків порівняно з прийомом плацебо, як це зроблено в цьому метааналізі. Отже, метааналіз заснований не на абсолютних значеннях, а скоріше на змінах, тобто відмінності показників за стандартизованою шкалою до і після лікування.
Показник за шкалою Nugent оцінює характер мікробіоти піхви навіть без прямого зв’язку з бактеріальним вагінозом, що підтверджує, що показник за шкалою Nugent є важливим для оцінки дисбактеріозу піхви незалежно від виконання критеріїв діагностики бактеріального вагінозу. Це узгоджується з доброю кореляцією між показником за шкалою Nugent і тяжкістю дисбіозу піхви, а також між показником за шкалою Nugent і результатами молекулярних досліджень (Van de Wijgert і Jespers, 2017). Однак слід враховувати той факт, що певні варіанти дисбіозу не можуть бути оцінені за допомогою шкали Nugent, наприклад кандидозний вагініт, який може бути асоційований з великою кількістю лактобацил (Van de Wijgert і Jespers, 2017; Van de Wijgert et al., 2014).
Пробіотик демонструє подібну ефективність при широкому діапазоні різних вагінальних мікробіот і вагінальних середовищ. Це можна зрозуміти, якщо врахувати, що мікробіота піхви значною мірою походить з кишечника (Antonio et al., 2005). Патогенні бактерії, здатні інфікувати урогенітальний тракт жінки, а також лактобацили та інші корисні мікроорганізми, які сприяють підтримці здорового середовища піхви, з’являються з кишкової мікробіоти жінок (Hilton et al., 1992; Reid et al., 2001). Було продемонстровано, що штами L.rhamnosus і L.fermentum можуть бути доставлені в піхву при пероральному застосуванні, що призводить до вірогідного збільшення кількості піхвових лактобацил (Morelli et al., 2004; Reid et al., 2003).
Ефекти на мікробіоту неовагіни
Основне заперечення проти даного метааналізу може полягати в тому, що штучні неопіхви 60 транссексуалів, вивчених Kaufmann et al. (2014) (це 51 % випадків, включених у метааналіз), можливо, не є відповідною моделлю для досліджуваного питання через значні і, можливо, фундаментальні відмінності від природної піхви. Однією з найбільш значних відмінностей від природної піхви є (майже) повна відсутність лактобацил у неовагінах, оскільки, крім інших причин, повідомляється, що неовагінальне середовище не підтримує зростання лактобацил (Weyers et al., 2009, 2010).
Інша причина полягає в тому, що мікробна колонізація (природної) піхви і неовагіни відбувається в абсолютно різних умовах. Набування вагінальної мікробіоти відбувається під час і незабаром після народження (Dominguez–Bello et al., 2010). Склад ранніх мікробних спільнот піхви, кишечника та інших ділянок організму дітей демонструє схожість із материнською мікробіотою кишечника (Ardissone et al., 2014), піхви або шкіри відповідно залежно від того, як здійснювалися пологи: вагінальним шляхом або шляхом кесаревого розтину (Makino et al., 2013).
Подальша диференціація вагінальної мікробіоти в дитинстві ще не зовсім зрозуміла (Huang et al., 2014), але було показано, що лактобацили починають переважати в дівчаток більш старшого віку, тоді як у молодших дівчаток найчастіше виділяються кишкові організми (Hammerschlag et al., 1978). У підлітковому віці відбуваються істотні зміни в складі мікробіоти піхви, обумовлені гормональними зрушеннями. Підвищення рівня естрогену в період статевого дозрівання збільшує відкладення глікогену у вагінальному епітелії, збільшує кількість глікоген–ферментуючих і молочнокислих бактерій, особливо лактобацил, і знижує рН піхви (Paavonen, 1983), що є нейтральним або слаболужним у ранньому дитинстві (Hammerschlag et al., 1978). Іншими потенційно важливими факторами, що впливають на мікробіоту піхви, є інфекції, контроль народжуваності або сексуальна поведінка (Gajer et al., 2012; Mitchell et al., 2012; Witkin and Ledger, 2012).
Ці фактори відрізняються від тих, що впливають на колонізацію неовагіни. Бактерії для мікробної колонізації неовагіни походять в основному з кишкової мікробіоти людини (Reuter, 2001). Інші фактори, пов’язані з хірургічною зміною статі, такі як лікування антибіотиками до, під час і після операції, тканина, з якої була сформована неовагіна, і її імунологічні й бактеріальні властивості, пов’язані з адгезією, або час між операцією, загоєнням неовагіни і початком мікробної колонізації, також впливають на колонізацію піхви.
Різний склад кишкової мікробіоти як джерела вагінальних бактерій і значно відмінні середовища неовагіни і природної піхви є причинами того, що розвиток адекватної мікробіоти в неовагінах транссексуальних жінок сповільнюється й порушується. Отже, пероральне застосування певних (пробіотичних) штамів лактобацил, які вижили в шлунково–кишковому тракті в достатній кількості, може збільшити резервуар лактобацил у кишечнику, що може колонізувати неовагіну або принаймні допомогти стабілізувати здорову мікробіоту піхви. Однорідність результатів метааналізу і схожість результатів після виключення окремих досліджень підтверджують припущення, що розглянута тут пробіотична суміш для покращання мікробного патерну при вагінальному дисбіозі також ефективна щодо штучної неопіхви.
Ефекти йогуртових культур
Інше фундаментальне заперечення проти даного метааналізу може полягати в тому, що відсутність справжньої групи плацебо в дослідженні Laue et al. (2018) могла призвести до хибнопозитивного результату не тільки самого дослідження, а й метааналізу. Дійсно, дослідження показали, що йогуртові культури виживають під час пасажу через шлунково–кишковий тракт (Elli et al., 2006), хоч і з низьким відсотком. У дослідженні Laue et al. (2018) йогурт із живими культурами застосовували тільки в основній групі, тоді як контрольний препарат містив хімічно підкислене молоко без бактерій. В основній групі йогуртові культури могли посилити сприятливий вплив пробіотика на бактеріальний вагіноз і мікробну флору відповідно.
Доводи проти цього заперечення полягають у наступному. (1) У метааналізі всіх трьох досліджень середня величина ефекту, виміряна Laue et al. (2018), знаходиться між ефектами, отриманими в дослідженнях Kaufmann (2014) і Marschalek et al. (2017), як показано на форест–графіках стандартизованої середньої різниці й співвідношення шансів (рис. 1). (2) У другому аналізі підгрупи виключення з дослідження Laue et al. (2018) вірогідно не вплинуло на результати. Це означає, що вплив досліджуваної суміші лактобацил на дисбіоз піхви є вірогідним незалежно від включення або виключення з метааналізу дослідження Laue et al. (2018). Найбільш вірогідним поясненням цього є те, що навіть якщо йогуртові бактерії повинні були досягти піхви й підкислити піхвове середовище незначною мірою, цей ефект був несуттєвим або незначним порівняно з ефектом пробіотичної суміші. Це узгоджується з тим фактом, що L.crispatus, L.jensenii і L.gasseri домінують у вагінальній мікробіоті, тоді як бактерії йогуртової закваски S.thermophilus і L.delbruckii ssp. bulgaricus там не виявлені (Antonio et al., 1999; Aroutcheva et al., 2001; Fredricks, 2011; Fredricks and Giedler, 2005; Fredricks et al., 2007; Hyman et al., 2005; Ling et al., 2010; Oakley et al., 2008; Ravel et al., 2011; Srinivasan et al., 2012; Verhelst et al., 2004), і що відповідні штами були обрані з урахуванням їх особливих властивостей щодо підтримання здорового вагінального середовища (Domig et al., 2014).
Висновки
Метааналіз показує, що пероральний прийом пробіотика, який містить L.crispatus LbV 88 (DSM 22566), L.gasseri LbV 150N (DSM 22583), L.jensenii LbV 116 (DSM 22567) і L.rhamnosus LbV96 (DSM 22560), у вигляді йогурту або в формі капсул може покращити мікробну флору (що оцінюється за шкалою Nugent) при різних формах вагінального дисбіозу.
Підготувала Наталія Купріненко
за матеріалами статті M. de Vrese, C. Laue, E. Papazova, L. Petricevic, J. Schrezenmeir
«Impact of oral administration of four Lactobacillus strains on Nugent score — systematic review and meta-analysis»,
надрукованої в Benef. Microbes. 2019; 10(5): 483-496

/15-1.jpg)
/16-1.jpg)
/17-1.jpg)