Газета «Новости медицины и фармации» Репродуктология. Акушерство. Гинекология. Урология (641) 2018 (тематический номер)
Вернуться к номеру
Комбинированная гормональная контрацепция и риск венозной тромбоэмболии: обзор рекомендаций
Авторы: Практический комитет Американского общества репродуктивной медицины
Американское общество репродуктивной медицины, Birmingham, Alabama
Рубрики: Акушерство и гинекология
Версия для печати
гіпогонадизм; тестостерон
Введение
Венозная тромбоэмболия (ВТЭ) представляет собой образование сгустка крови в глубокой вене и является редкой, но потенциально предотвратимой причиной смерти у женщин репродуктивного возраста. Глубокие венозные тромбозы, которые обычно развиваются в нижних конечностях, могут разрушаться и перемещаться в легочную сосудистую сеть, что представляет угрозу для жизни. Однако большинство венозных тромбозов не приводят к смерти. Распространенными факторами риска ВТЭ являются гиперкоагуляция и повреждение сосудов. Беременность и послеродовой период, в частности, ассоциируются с повышенным риском ВТЭ по сравнению с частотой риска у небеременных: частота ВТЭ составляет 5–20/10 000 женщин в год при беременности и 40–65/10 000 женщин в год в послеродовой период по сравнению с 1–5/10 000 женщин в год среди небеременных [1].
Применение комбинированных гормональных контрацептивов (КГК), по-видимому, связано с повышенным риском ВТЭ по сравнению с частотой риска, когда КГК не применяются (3–15/10 000 женщин в год против 1–5/10 000 среди тех, кто не использует КГК), но этот риск все же меньше риска ВТЭ во время беременности и со временем уменьшается [1]. В целом, чтобы определить, следует ли женщине принимать КГК, необходимо сопоставить риск ВТЭ при применении гормональной контрацепции с потенциальными преимуществами контрацепции и рисками ВТЭ во время беременности и послеродового периода.
Хотя имеются убедительные доказательные данные того, что применение КГК ассоциируется с повышенным риском ВТЭ, существуют значительные противоречия, связанные с фактическим риском применения разных видов КГК. Существует множество вариаций КГК с различными дозами эстрогена и типами прогестина и различными путями доставки в организм.
Методы
Качество доказательств в источниках литературы, приведенных ниже в библиографических ссылках, оценивалось с использованием следующей системы классификации:
— уровень I: доказательства, полученные по крайней мере в одном рандомизированном контролируемом исследовании с четким дизайном;
— уровень II-1: доказательства, полученные в контролируемых исследованиях с хорошим дизайном, без рандомизации;
— уровень II-2: доказательства, полученные в когортных исследованиях или аналитических исследованиях «случай — контроль» с хорошим дизайном, проведенных на базе более чем одного центра или более чем одной исследовательской группой;
— уровень II-3: доказательства, полученные из множества временных серий с вмешательством или без такового (отрицательные результаты в неконтролируемых исследованиях также могут быть отнесены к данному уровню доказательности);
— уровень III: мнения уважаемых экспертов на основе клинического опыта, описательных исследований или докладов экспертных комитетов.
Систематические обзоры/метаанализы были индивидуально рассмотрены и включены, если в них соблюдался строгий методологический процесс и оценивались релевантные доказательства.
Сила доказательств оценивалась следующим образом:
— класс A: есть хорошие доказательства для поддержки рекомендаций (как за, так и против);
— класс B: есть справедливые доказательства для поддержки рекомендаций (либо за, либо против);
— класс C: недостаточно доказательств для поддержки рекомендаций (либо за, либо против).
Классификация комбинированных гормональных контрацептивов
Комбинированные гормональные контрацептивы подразделяются на несколько категорий. Комбинированные оральные контрацептивы (КОК) с 50 мкг этинилэстрадиола (ЭЭ) считаются первым поколением данного класса препаратов. Таблетки комбинированных оральных контрацептивов второго поколения содержат более низкие дозы эстрадиола (20, 30 или 35 мкг), а также прогестин норэтиндрон и его производные, включая левоноргестрел [4]. Таблетки комбинированных оральных контрацептивов третьего поколения, содержащие прогестины дезогестрел и гестоден, создавались как менее андрогенные, чем прогестины второго поколения [5]. Норгестимат технически является прогестином третьего поколения, однако его биоактивность опосредуется главным образом через левоноргестрел, что отличает его от других прогестинов третьего поколения [6].
Наконец, таблетированные контрацептивы четвертого поколения включают, среди прочего, прогестин дроспиренон, который получен из спиронолактона и обладает антиандрогенной активностью [7]. Кроме того, КГК доступны в виде нескольких лекарственных форм, включая таблетки, трансдермальные пластыри и вагинальное кольцо. В данных рекомендациях будут обсуждаться только препараты, доступные в Соединенных Штатах.
Научные вопросы
Влияет ли доза эстрогена на частоту ВТЭ?
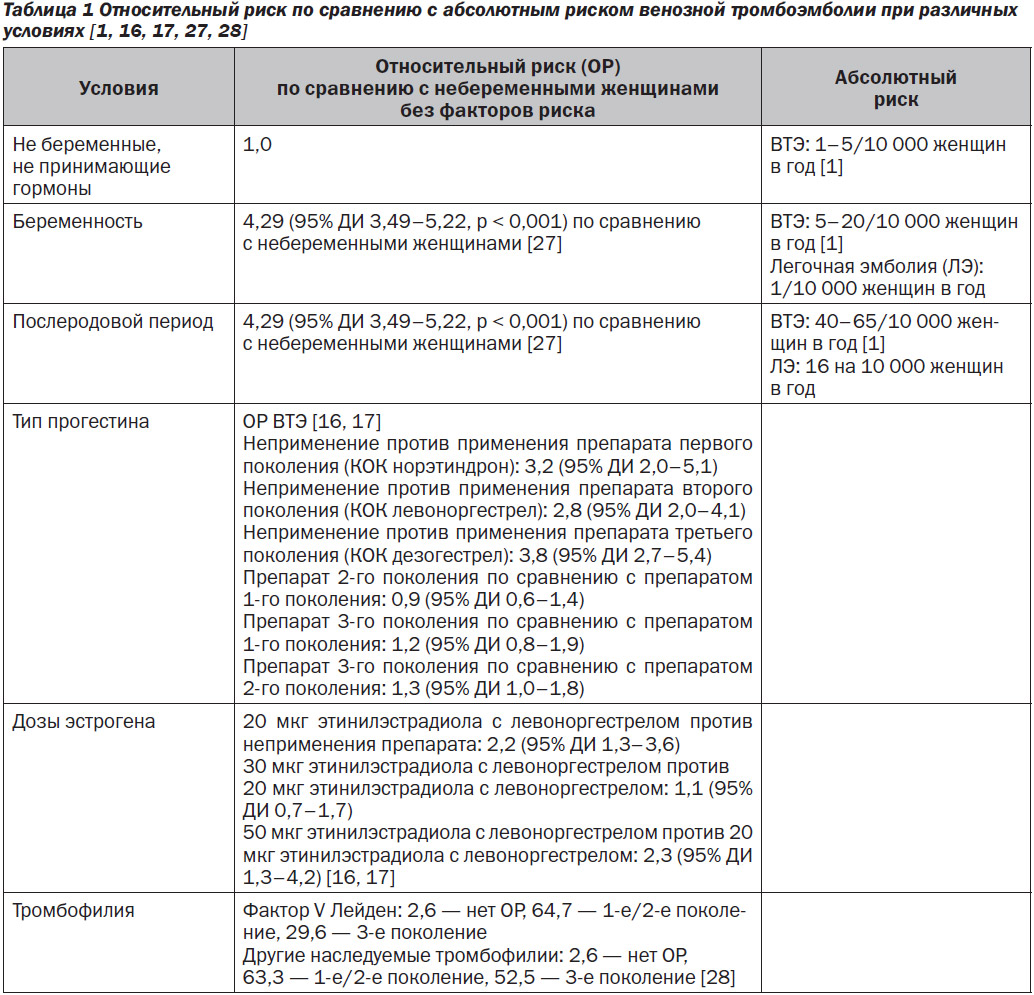
Современные КОК могут содержать 10, 15, 20, 30 или 35 мкг ЭЭ и применяются непрерывно в течение 21 или 24 из 28 дней. Кроме того, доступны к применению полунепрерывные оральные контрацептивы, которые состоят из таблеток ЭЭ для приема в течение 84 дней, а затем следует 7-дневное беспрогестиновое «окно». Трудно сравнить эффекты доз ЭЭ, поскольку препараты часто отличаются прогестиновым компонентом. Несмотря на это ограничение, существует много доказательных данных о том, что повышенная доза эстрогена ассоциируется с риском развития ВТЭ. Наилучшие доказательные данные свидетельствуют о том, что при снижении содержания эстрогена в таблетке до ≤ 50 мкг ЭЭ частота случаев развития ВТЭ уменьшается [8–17]. В ряде крупных исследований было установлено, что препараты КОК, содержащие 50 мкг ЭЭ, ассоциируются с более высоким риском тромбоза по сравнению с содержащими менее 50 мкг ЭЭ [12–14]. Это соотносится с подобными выводами, сделанными в последующих обзорах/метаанализах, о повышенном риске ВТЭ при применении КОК, содержащих 50 мкг ЭЭ и некоторые прогестины [15–17]. В Кокрановском обзоре в 2014 году сделан вывод, что таблетки 50 мкг ЭЭ, содержащие левоноргестрел, ассоциируются с относительными рисками (ОР) развития ВТЭ 2,1 (95% ДИ 1,4–3,2) и 2,3 (95% ДИ 1,3–4,2) по сравнению с таблетками 30 и 20 мкг, содержащими левоноргестрел, соответственно [16, 17]. Однако в ряде исследований не было установлено, что снижение дозы ЭЭ с 50 мкг до < 50 мкг в КОК уменьшает риск ВТЭ [18–26]. Нет никаких доказательств того, что уменьшение содержания эстрогенов в КОК ниже 35 мкг дополнительно снижает риск ВТЭ (табл. 1) [12, 14, 15, 18–20, 23, 24, 26, 27, 29, 30].
Резюме
Нет крупных рандомизированных исследований, которые бы позволили сравнить риск тромбоза у пациентов, принимающих оральные контрацептивы, содержащие разные дозы ЭЭ. Существуют только исследования уровня II-2, в том числе крупные когортные исследования и исследования «случай — контроль». Трудно сравнить влияние дозы ЭЭ, поскольку препараты отличаются по прогестиновому компоненту. Кроме того, наблюдательные исследования ограничены рядом неизмеримых факторов и предвзятостью. Исходя из литературы можно сделать следующий вывод.
Хотя в США они больше не применяются, высокодозовые комбинированные оральные контрацептивы (> 50 мкг) ассоциируются с более высоким риском ВТЭ, чем более низкодозовые препараты (класс B).
Есть беспристрастные доказательные данные о том, что комбинированные оральные контрацептивы, содержащие 50 мкг ЭЭ, ассоциируются с более высоким риском тромбоза по сравнению с препаратами, содержащими дозы ЭЭ менее 50 мкг (класс B). Однако данные противоречивы и трудно интерпретируются из-за того, что в исследуемых таблетированных препаратах содержатся разные прогестиновые компоненты.
Есть беспристрастные доказательные данные о том, что КОК, содержащие дозы ЭЭ ниже 35 мкг, имеют риск ВТЭ, сходный с КОК, содержащими 35 мкг ЭЭ (класс B).
Влияет ли доза прогестина на частоту ВТЭ?
Отдельной темой для дискуссий является вопрос о том, влияет ли тип прогестина, содержащегося в КОК, на частоту ВТЭ. В частности, были получены противоречивые результаты крупных эпидемиологических исследований, ни одно из которых не было рандомизированным, относительно того, существует ли повышенный риск ВТЭ при применении КОК, содержащих самые новые прогестины дезогестрел, гестоден (недоступный в Соединенных Штатах), норгейстит и дроспиренон, по сравнению с прогестинами левоноргестрелом и норэтиндроном.
Начиная с середины 1990-х годов в когортных исследованиях и исследованиях «случай — контроль» сообщалось о двукратном увеличении риска ВТЭ при применении КОК, содержащих прогестины третьего поколения дезогестрел и гестоден, по сравнению с препаратами второго поколения [21, 31, 32]. Однако дальнейшие исследования ставили под сомнение первоначальные выводы, объясняя повышенный риск смешанными факторами, в том числе предвзятостью потребителей этих препаратов и врачей, которые их назначают [3, 4, 23–26, 33–40]. Известно, что новые потребители оральной контрацепции имеют более высокий риск ВТЭ, который с увеличением продолжительности приема КОК постепенно уменьшается [3]. Поэтому повышенный риск, наблюдаемый в ранних исследованиях прогестинов третьего поколения, возможно, был результатом различий в популяциях, принимающих прогестины второго и третьего поколений [2, 4, 40, 41]. Однако дополнительные исследования показали повышенный риск ВТЭ при применении прогестинов третьего поколения (за исключением норгестимата, который, как было установлено, имеет риск, сходный с таковым у левоноргестрела) даже при учете потенциальных факторов (табл. 1) [9, 10, 12–14, 28, 42–51].
В когортных исследованиях и исследованиях «случай — контроль» также наблюдался повышенный риск ВТЭ при применении прогестина четвертого поколения дроспиренона [12, 13, 30, 51–55]. В недавнем крупном американском когортном исследовании с участием более 100 000 женщин, которые были новыми потребителями дроспиренона, по сравнению с более чем 300 000 женщин, которые были новыми потребителями КОК второго поколения, установлен повышенный риск ВТЭ в группе применения дроспиренона (коэффициент риска [HR] 1,77; 95% ДИ 1,33–2,35) [55]. Однако в других испытаниях, в том числе в крупных когортных исследованиях и исследованиях «случай — контроль», в которых принимались во внимание множественные факторы, включая применение препарата его новыми потребителями, не был продемонстрирован повышенный риск при применении дроспиренона [56–60]. Аналогично в Международном исследовании активного наблюдения женщин, принимающих оральные контрацептивы, не установлено разницы в частоте развития ВТЭ при применении различных прогестинов. В этом большом европейском проспективном обсервационном исследовании частота ВТЭ составила около 7,2–9,8/10 000 женщин в год среди потребителей КОК с аналогичной частотой для дроспиренона и прогестинов третьего поколения по сравнению с левоноргестрелом и при уровне HR 0,8 (95% ДИ 0,5–1,3) между дроспиреноном и левоноргестрелом [61]. Другое исследование «случай — контроль», которое включало 311 женщин, принимающих КОК, с впервые развившейся ВТЭ выявило повышенный риск и отношение шансов (OR) 2,5 (95% ДИ 1,2–5,1) при использовании дезогестрела по сравнению с левоноргестрелом. Однако при применении других прогестинов, включая дроспиренон, достоверно более высоких рисков не было (OR 1,9, 95% ДИ 0,9–4,1) [62].
В недавних метаанализах и систематических обзорах продемонстрирован немного, но достоверно повышенный риск ВТЭ при применении прогестинов третьего поколения и дроспиренона по сравнению с прогестинами второго поколения [15–17, 63–65]. В одном метаанализе, который включал 23 исследования, сообщалось, что применение КОК увеличивало риск венозного тромбоза в 4 раза. Относительный риск ВТЭ при применении КОК с норэтиндроном по сравнению с риском у тех, кто не применяет этот препарат, составил 3,2 (95% ДИ 2,0–5,1), при применении КОК с левоноргестрелом — 2,8 (2,0–4,1) и КОК с дезогестрелом — 3,8 (2,7–5,4) [16]. Аналогично Кокрановский обзор 26 исследований продемонстрировал повышение на 50–80 % относительного риска ВТЭ у потребителей КОК третьего поколения или дроспиренона по сравнению с потребителями КОК с левоноргестрелом при одинаковой дозе ЭЭ (30–35 мкг). Относительный риск при применении КОК третьего поколения по сравнению с КОК второго поколения составлял 1,3 (95% ДИ 1,0–1,8). В целом относительный риск ВТЭ у тех, кто применяет КОК, составлял 3,5 (95% ДИ 2,9–4,3) (табл. 1) [17].
Поскольку ни одно из исследований не было рандомизированным, они могут быть ограничены смешением факторов риска ВТЭ, таких как новый потребитель данного препарата, старший возраст, ожирение, отягощенный семейный анамнез по ВТЭ или длительная иммобилизация. Исследования также могут быть –ограничены предвзятостью, включая эффект здорового потребителя, неправильную классификацию ВТЭ и предвзятость со стороны врача, назначившего КОК [39, 41]. Доза ЭЭ также не является постоянной среди препаратов КОК, что затрудняет непосредственное сравнение прогестинового компонента. Наконец, важно отметить, что даже в исследованиях, в которых установлен повышенный риск ВТЭ при применении более новых прогестинов, абсолютный рост риска очень мал по сравнению с общим повышенным риском у КОК. Абсолютный риск КОК третьего поколения или КОК, содержащих дроспиренон, в одном метаанализе составил 10–15 ВТЭ/10 000 женщин в год по сравнению с 8 ВТЭ/10 000 женщин, применяющих левоноргестрел, и 2 ВТЭ/10 000 женщин, которые не используют КОК [63]. Эти цифры все же ниже общего риска ВТЭ при беременности (5–20/10 000 женщин в год).
Резюме
Нет крупных рандомизированных исследований, в которых сравнивался бы риск ВТЭ у женщин, принимающих различные типы оральных контрацептивов. Существуют только исследования уровня II-2, в том числе крупные когортные исследования и исследования «случай — контроль». Трудно сравнить влияние только прогестинового компонента, так как некоторые исследования включают препараты с различными дозами ЭЭ. Кроме того, обсервационные исследования ограничены рядом факторов и предвзятостей (в том числе различия между применяющими и не применяющими КОК женщинами, продолжительность использования КОК и ошибочная классификация ВТЭ из-за различий используемых диагностических критериев).
В связи с недостатком высококачественных исследований I уровня, сравнивающих прогестины, существует возможность того, что небольшой повышенный риск ВТЭ является результатом методологических проблем в настоящих исследованиях и что на самом деле нет повышенного риска при применении прогестинов третьего или четвертого поколения, таких как дезогестрел или дроспиренон. Если действительно существует увеличение относительного риска (ОР), то абсолютное увеличение риска крайне мало. Таким образом, при четком отборе пациенток выбор метода КОК не должен определяться типом прогестина. Если у женщины есть эстрогенассоциированный риск развития ВТЭ, связанный с приемом КОК, то любой путь введения или любая доза эстрогена не будут безопасными. В такой ситуации противопоказаны все эстрогенсодержащие гормональные методы контрацепции.
Существует справедливое доказательство того, что все доступные КГК повышают риск ВТЭ по сравнению с риском у небеременных.
Существует справедливое доказательство того, что женщины, использующие КОК с прогестинами третьего поколения или дроспиреноном, имеют несколько более высокий риск ВТЭ по сравнению с теми, кто применяет норэтиндрон или левоноргестрел (класс B). Эти результаты частично могут быть связаны с характеристиками популяций, принимающих эти препараты.
Влияет ли способ доставки КГК в организм на частоту ВТЭ?
КГК обычно доставляется в организм перорально, но может также быть в виде вагинального кольца с трансмукозальным путем доставки активного вещества или в виде трансдермального препарата. Хотя предполагалось, что трансдермальная форма эстрадиола, применяемая в качестве гормонотерапии у женщин в постменопаузальном периоде, может снизить риск ВТЭ из-за эффекта первого прохождения в печени, данное утверждение не было подтверждено для пероральных форм гормональных контрацептивов. Сообщалось, что непероральный путь введения увеличивает риск ВТЭ. Тем не менее нет достаточно больших проспективных рандомизированных исследований, в которых бы изучалась разница величины риска ВТЭ при применении вагинального кольца или трансдермальной формы гормональных контрацептивов по сравнению с пероральным способом введения.
Единственное имеющееся в настоящее время противозачаточное вагинальное кольцо (NuvaRing®, Merck) содержит 11,7 мг этоногестрела (биологически активный метаболит дезогестрела, прогестин третьего поколения) и 2,7 мкг ЭЭ с выделением в течение суток около 120 мкг/мг этоногестрела и 15 мкг ЭЭ. При применении кольца оказывается одинаковое системное воздействие на прогестиновый компонент, но при этом системное воздействие оказывает только половина дозы ЭЭ по сравнению с применением перорального препарата 150 мкг де–зогестрела и 30 мкг ЭЭ [66].
Обсервационные исследования продемонстрировали, что так же как и женщины, применяющие КОК, женщины, которые используют кольцо, имеют повышенный риск ВТЭ по сравнению с теми, кто не применяет гормональную контрацепцию [66]. В ретроспективном когортном исследовании, проведенном в Дании, установлен несколько повышенный риск ВТЭ среди женщин, применяющих вагинальное кольцо, по сравнению с теми, кто применяет КОК, содержащие левоноргестрел (ОР 1,9, 95% ДИ 1,3–2,7) [67]. Однако большое ретроспективное когортное исследование, использующее данные четырех планов по охране здоровья в США, в которых рассматривались отдельно начинающие применять контрацептивы и те, кто их уже давно использует, не установило разницы в риске ВТЭ среди применяющих вагинальное кольцо по сравнению с теми, кто использует КОК. Частота случаев ВТЭ у тех, кто использует вагинальное кольцо, составляла 11,3 на 10 000 женщин в год [55]. В большом европейском проспективном обсервационном исследовании также не было обнаружено повышенного риска ВТЭ среди тех, кто использует вагинальное кольцо, по сравнению с женщинами, применяющими КОК (отношение рисков 0,8, 95% ДИ 0,5–1,5) [68]. Таким образом, данные доказательной медицины свидетельствуют о том, что риск развития ВТЭ при применении вагинального кольца такой же, как и при применении оральных КГК, а не ниже и не выше.
Имеются также противоречия в отношении КГК в виде трансдермального пластыря, содержащего 6 мг норэлгестромина (активный метаболит норгестимата, прогестина третьего поколения) и 0,75 мг ЭЭ, с ежедневным выделением приблизительно 150 мкг норэлгестромина и 20 мкг ЭЭ [69]. Количество эстрадиола и прогестина было эквивалентно таблетке для перорального применения, содержащей 250 мкг норгестимата и 35 мкг ЭЭ, однако фармакокинетические исследования показали, что системное воздействие выше, но пиковые уровни ниже у трансдермального пластыря [70, 71].
Постмаркетинговые исследования, в которых сравнивались риски ВТЭ у тех, кто применяет трансдермальный пластырь, и тех, кто применяет КОК, показали противоречивые результаты. Три исследования «случай — контроль» (включая первое исследование, в котором добавлено 56 дополнительных случаев) не показали различий в рисках ВТЭ между применяющими трансдермальный пластырь по сравнению с теми, кто использовал КОК, содержащие прогестины норгестимат и левоноргестрел [72–75]. Однако в третьем исследовании «случай — контроль» установлен более высокий риск у пациентов, использующих трансдермальный пластырь, с частотой 2,2 (95% ДИ 1,3–3,8) [76]. Более поздние исследования также продемонстрировали непоследовательные результаты. В исследовании «случай — контроль» с участием 152 женщин с тромботическими или сердечно-сосудистыми событиями и 606 женщин в контрольной группе установлено увеличение риска ВТЭ в 2 раза у пациенток, использующих трансдермальный пластырь, по сравнению с теми, кто применял КОК, содержащие норгестимат (ОР 2,0, 95% ДИ 1,2–3,3) [77]. Однако такое же крупное ретроспективное когортное исследование в США, о котором говорилось выше (в котором не были установлены различия в рисках ВТЭ среди применяющих вагинальное кольцо), также не обнаружило повышенного риска ВТЭ среди применяющих трансдермальный пластырь, при этом общая частота ВТЭ составляла 12,3 на 10 000 женщин в год для использующих пластырь [55].
Резюме
Все исследования, посвященные этому вопросу, были II–III уровня.
Недостаточно доказательств того, что риск ВТЭ при использовании контрацептивного трансдермального пластыря или противозачаточного вагинального кольца отличается от такового при применении КОК (класс C).
Являются ли курение, ожирение или наследственная тромбофилия факторами риска ВТЭ у женщин, применяющих КГК?
В нескольких исследованиях II и III уровня установлены факторы риска, связанные с ВТЭ. Однако трудно определить, в какой степени конкретный фактор риска увеличивает риск ВТЭ, так как эти исследования неоднородны, часто подвержены изменениям и анализируют факторы риска как осложнения, а не как первичные предикторы результатов. Но во многих исследованиях был выявлен ряд факторов риска, связанных с риском ВТЭ при применении оральных контрацептивов, включая такие, как длительная иммобилизация, возраст старше 35 лет, увеличение индекса массы тела (ИМТ) у пациентов старше 35 лет, ВТЭ в анамнезе, отягощенный семейный анамнез по тромбозу глубоких вен, наследственная тромбофилия (чаще всего фактор V Лейден или протромбин G20210A), антифосфолипидный синдром, активная системная красная волчанка и недавно диагностированный рак. Ни один из этих факторов риска не увеличивает риск ВТЭ в большей степени, чем беременность (5–20/10 000 женщин в год), однако они являются аддитивными.
Общая вероятность развития ВТЭ является наибольшей в течение 6 недель после родов (приблизительно 40–65 на 10 000 женщин в год и увеличивается до 12 недель) [1, 78]. Женщины с семейными синдромами тромбофилии, в том числе мутацией фактора V Лейден, мутацией протромбина G20210 А, дефицитом белка C, белка S или антитромбина, имеют в несколько раз повышенный риск ВТЭ (в зависимости от типа тромбофилии), и использование оральных контрацептивов у этих пациенток увеличивает риск тромбоза [9, 15, 28, 43, 62, 65, 79–84]. В одном популяционном исследовании «случай — контроль» установлено, что среди женщин с тромбофилией риск развития ТГВ в течение первых 6 месяцев применения оральных контрацептивов (по сравнению с длительным использованием) был выше в 19 раз (95% ДИ 1,9–175,7), и в первый год использования он был выше в 11 раз (95% ДИ 2,1–57,3) [83]. Учитывая редкость фатальной ВТЭ, одна группа исследователей сделала вывод о том, что скрининг на тромбофилию более чем 1 млн кандидатов на применение КГК в лучшем случае предотвратит две смерти, ассоциированные с использованием оральных контрацептивов [85]. Поэтому центры по контролю и профилактике заболеваний (CDC) не рекомендуют рутинно проводить скрининг тромбофилий с лабораторными исследованиями (табл. 1) [86].
Другими факторами, ассоциированными с ВТЭ, у женщин, которые используют КГК, являются курение, возраст и ожирение, хотя только курение и ожирение являются слабыми факторами риска для ВТЭ. Женщины, которые курят, особенно более 15 сигарет ежедневно, имеют больший риск [18, 20, 26, 31, 32, 34, 37, 39, 40, 49, 54, 87, 88]. Риск значительно возрастает, если женщины в возрасте старше 35 лет и курят, поскольку в нескольких исследованиях возраст был признан независимым фактором риска ВТЭ [10, 12–14, 18, 20, 23, 31, 39, 43, 44, 51, 80, 87]. Учитывая растущую эпидемию ожирения в Соединенных Штатах и даже во всем мире, связь между ожирением и тромбозом особенно важна. Некоторые исследования показали, что использование оральных контрацептивов еще больше увеличивает влияние ожирения на риск тромбоза, приводя к увеличению риска ВТЭ в 10 раз у женщин с ожирением, которые используют гормональные контрацептивы, по сравнению с теми, кто их не использует [12, 22, 24, 26, 31, 32, 34, 40, 49, 54, 59, 60, 64, 65, 88–91].
Резюме
В нескольких исследованиях II и III уровня были установлены факторы риска, ассоциированные с ВТЭ, однако определить, в какой степени конкретный фактор риска увеличивает риск ВТЭ, сложно, поскольку эти исследования неоднородны и часто имеют предубеждения.
Имеются убедительные доказательства того, что табакокурение, возраст (> 35 лет), ожирение и наличие наследственных тромбофилий (включая мутацию фактора V Лейден, мутацию протромбина G20210A и дефицит белка C, белка S или антитромбина) увеличивают риск тромботических событий при применении КГК (класс B).
Выводы
Хотя ВТЭ — редкое событие у молодых женщин репродуктивного возраста (1–5/10 000 женщин в год), применение КОК повышает ее риск. У женщин, принимающих препараты, содержащие дроспиренон и прогестины третьего поколения, по-видимому, наблюдается несколько повышенный риск ВТЭ по сравнению с теми, кто принимает препараты первого и второго поколений. Тем не менее общий риск ВТЭ даже при применении этих препаратов является низким — примерно 10–15 ВТЭ/10 000 женщин. У большинства женщин преимущества любого доступного КОК для предотвращения беременности перевешивают риски. Важно признать, что риск ВТЭ во время беременности (5–20/10 000 женщин в год) и в послеродовом периоде (40–65/10 000 женщин в год) значительно выше, чем у женщин, которые принимают КГК. Тем не менее при выборе конкретного препарата КГК любой потенциальный повышенный риск ВТЭ должен быть сбалансирован с потенциальными преимуществами, связанными с применением этого препарата.
Резюме рекомендаций
— Применение высокодозированных комбинированных оральных контрацептивов (> 50 мкг) ассоциируется с более высокими рисками ВТЭ, чем применение более низкодозированных препаратов (класс B).
— Доказательства того, имеют ли КОК, содержащие 50 мкг ЭЭ, более высокий риск тромбоза по сравнению с препаратами, содержащими менее 50 мкг ЭЭ, противоречивы, хотя в нескольких крупных исследованиях наблюдался повышенный риск ВТЭ при применении КОК, содержащих 50 мкг ЭЭ (класс B).
— Нет достоверных доказательств того, что при применении доз ЭЭ ниже 35 мкг риск ВТЭ меньше, чем при применении дозы ЭЭ 35 мкг (класс B).
— Имеются справедливые доказательства того, что препараты КОК с прогестинами третьего поколения или дроспиреноном имеют лишь несколько более высокий риск развития ВТЭ по сравнению с препаратами, содержащими норэтиндрон или левоноргестрел (класс B).
— Недостаточно доказательств того, что уровень риска ВТЭ при применении контрацептивов в форме пластыря или противозачаточного вагинального кольца отличается от уровня риска ВТЭ при применении КОК (класс C).
— Имеются убедительные доказательства того, что табакокурение, возраст старше 35 лет, ожирение, гипертензия и наличие наследственных тромбофилий (включая мутацию фактора V Лейден, мутацию протромбина G20210A и дефицит белка C, белка S или антитромбина) увеличивают риск тромботических событий при применении КГК (класс B).
1. Committee on Gynecologic Practice. ACOG Committee Opinion Number 540: Risk of venous thromboembolism among users of drospirenonecontaining oral contraceptive pills // Obstet. Gynecol. 2012; 120: 1239-42. Level III.
2. Van Lunsen H.W. Recent oral contraceptive use patterns in four European countries: evidence for selective prescribing of oral contraceptives containing third-generation progestogens // Euro. J. Contracept. Reprod. Health Care. 1996; 1: 39-45. Level II-2.
3. Suissa S., Blais L., Spitzer W.O., Cusson J., Lewis M., Heinemann L. First-time use of newer oral contraceptives and the risk of venous thromboembolism // Contraception. 1997; 56: 141-6. Level II-2.
4. Lewis M.A. The Transnational Study on Oral Contraceptives and the Health of Young Women. Methods, results, new analyses and the healthy user effect // Hum. Reprod. Update. 1999; 5: 707-20. Level II-2.
5. Speroff L., DeCherney A. Evaluation of a new generation of oral contraceptives. The Advisory Board for the New Progestins // Obstet. Gynecol. 1993; 81: 1034-47. Level III.
6. Hammond G.L., Abrams L.S., Creasy G.W., Natarajan J., Allen J.G., Siiteri P.K. Serum distribution of the major metabolites of norgestimate in relation to its pharmacological properties // Contraception. 2003; 67: 93-9. Level II-2.
7. Muhn P., Krattenmacher R., Beier S., Elger W., Schillinger E. Drospirenone: a novel progestogen with antimineralocorticoid and antiandrogenic activity. Pharmacological characterization in animal models // Contraception. 1995; 51: 99-110.
8. Gerstman B.B., Piper J.M., Freiman J.P., Tomita D.K., Kennedy D.L., Ferguson W.J. et al. Oral contraceptive oestrogen and progestin potencies and the incidence of deep venous thromboembolism // Int. J. Epidemiol. 1990; 19: 931-6. Level II-2.
9. Bloemenkamp K.W., Rosendaal F.R., Helmerhorst F.M., Buller H.R., Vandenbroucke J.P. Enhancement by factor V Leiden mutation of risk of deep-vein thrombosis associated with oral contraceptives containing a third-generation progestogen // Lancet. 1995; 346: 1593-6. Level II-2.
10. Lewis M.A., Heinemann L.A., MacRae K.D., Bruppacher R., Spitzer W.O. The increased risk of venous thromboembolism and the use of third generation progestagens: role of bias in observational research. The Transnational Research Group on Oral Contraceptives and the Health of Young Women // Contraception. 1996; 54: 5-13. Level II-2.
11. Hannaford P.C., Kay C.R. The risk of serious illness among oral contraceptive users: evidence from the RCGP’s oral contraceptive study // Br. J. Gen. Pract. 1998; 48: 1657-62. Level II-2.
12. Van Hylckama Vlieg A., Helmerhorst F.M., Vandenbroucke J.P., Doggen C.J., Rosendaal F.R. The venous thrombotic risk of oral contraceptives, effects of oestrogen dose and progestogen type: results of the MEGA casecontrol study // BMJ. 2009; 339: b2921. Level II-2.
13. Lidegaard O., Lokkegaard E., Svendsen A.L., Agger C. Hormonal contraception and risk of venous thromboembolism: national follow-up study // BMJ. 2009; 339: b2890. Level II-2.
14. Lidegaard O., Nielsen L.H., Skovlund C.W., Skjel–destad F.E., Lokkegaard E. Risk of venous thromboembolism from use of oral contraceptives containing different progestogens and oestrogen doses: Danish cohort study, 2001–9 // BMJ. 2011; 343: d6423. Level II-2.
15. Plu-Bureau G., Maitrot-Mantelet L., Hugon-Rodin J., Canonico M. Hormonal contraceptives and venous thromboembolism: an epidemiological update // Best Pract. Res. Clin. Endocrinol. Metab. 2013; 27: 25-34. Level III.
16. Stegeman B.H., de Bastos M., Rosendaal F.R., van Hylckama Vlieg A., Helmerhorst F.M., Stijnen T. et al. Different combined oral contraceptives and the risk of venous thrombosis: systematic review and network metaanalysis // BMJ. 2013; 347: f5298. Level III.
17. De Bastos M., Stegeman B.H., Rosendaal F.R., Van Hylckama Vlieg A., Helmerhorst F.M., Stijnen T. et al. Combined oral contraceptives: venous thrombosis // The Cochrane database of systematic reviews. 2014; CD010813. Level III.
18. Beaumont V., Lemort N., Beaumont J.L. Evaluation of risk factors associated with vascular thrombosis in women on oral contraceptives. Possible role of anti-sex steroid hormone antibodies // Artery. 1983; 11: 331-44. Level II-2.
19. Kierkegaard A. Deep vein thrombosis and the oestrogen content in oral contraceptives. An epidemiological analysis // Contraception. 1985; 31: 29-41. Level II-2.
20. Beaumont V., Lemort N., Beaumont J.L. Oral contraceptives, sex steroidinduced antibodies and vascular thrombosis: results from 1318 cases // Eur. Heart J. 1991; 12: 1219-24. Level II-2.
21. Spitzer W.O., Lewis M.A., Heinemann L.A., Thorogood M., MacRae K.D. Third generation oral contraceptives and risk of venous thromboembolic disorders: an international case-control study. Transnational Research Group on Oral Contraceptives and the Health of Young Women // BMJ. 1996; 312: 83-8. Level II-2.
22. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception/Poulter. Venous thromboembolic disease and combined oral contraceptives: results of international multicenter case-control study. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception // Lancet. 1995; 346: 1575-82. Level II-2.
23. Farmer R.D., Lawrenson R.A., Thompson C.R., Kennedy J.G., Hambleton I.R. Population-based study of risk of venous thromboembolism associated with various oral contraceptives // Lancet. 1997; 349: 83-8. Level II-2.
24. Lidegaard O., Edstrom B., Kreiner S. Oral contraceptives and venous thromboembolism. A case-control study // Contraception. 1998; 57: 291-301. Level II-2.
25. Lidegaard O. Smoking and use of oral contraceptives: impact on thrombotic diseases // Am. J. Obstet. Gynecol. 1999; 180: S357-63. Level II-2.
26. Farmer R.D., Lawrenson R.A., Todd J.C., Williams T.J., MacRae K.D., Tyrer F. et al. A comparison of the risks of venous thromboembolic disease in association with different combined oral contraceptives // Br. J. Clin. Pharmacol. 2000; 49: 580-90. Level II-2.
27. Heit J.A., Kobbervig C.E., James A.H., Petterson T.M., Bailey K.R., Melton L.J. 3rd. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study // Ann. Intern. Med. 2005; 143: 697-706. Level II-2.
28. Andersen B.S., Olsen J., Nielsen G.L., Steffensen F.H., Sorensen H.T., Baech J. et al. Third generation oral contraceptives and heritable thrombophilia as risk factors of non-fatal venous thromboembolism // Thromb. Haemost. 1998; 79: 28-31. Level II-2.
29. Royal College of General Practitioners’ Oral Contraception Study. Oral contraceptives, venous thrombosis, and varicose veins. Royal College of General Practitioners’ Oral Contraception Study // J. R. Coll. Gen. Pract. 1978; 28: 393-9. Level II-2.
30. Bird S.T., Delaney J.A., Etminan M., Brophy J.M., Hartzema A.G. Drospirenone and non-fatal venous thromboembolism: is there a risk difference by dosage of ethi-ny––l-estradiol? // J. Thromb. Haemost. 2013; 11: 1059-68.
Level II-2.
31. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception/Meirik. Effect of different progestogens in low oestrogen oral contraceptives on venous thromboembolic disease. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception // Lancet. 1995; 346: 1582-8. Level II-2.
32. Jick H., Jick S.S., Gurewich V., Myers M.W., Vasilakis C. Risk of idiopathic cardiovascular death and nonfatal venous thromboembolism in women using oral contraceptives with differing progestagen components // Lancet. 1995; 346: 1589-93. Level II-2.
33. Farmer R.D., Lawrenson R.A. Oral contraceptives and venous thromboembolic disease: the findings from database studies in the United Kingdom and Germany // Am. J. Obstet. Gynecol. 1998; 179: S78-86. Level II-2.
34. Farmer R.D., Lawrenson R.A., Todd J.C., Williams T.J., MacRae K. Oral contraceptives and venous thromboembolic disease. Analyses of the UK General Practice Research Database and the UK Mediplus database // Hum Reprod Update. 1999; 5: 688-706. Level II-2.
35. Farmer R.D., Williams T.J., Simpson E.L., Nightingale A.L. Effect of 1995 pill scare on rates of venous thromboembolism among women taking combined oral contraceptives: analysis of general practice research database // BMJ. 2000; 321: 477-9. Level II-3.
36. Farmer R.D., Todd J.C., Lewis M.A., MacRae K.D., Williams T.J. The risks of venous thromboembolic disease among German women using oral contraceptives: a database study // Contraception. 1998; 57: 67-70. Level II-2.
37. Lidegaard O., Edstrom B., Kreiner S. Oral contraceptives and venous thromboembolism: a five-year national case-control study // Contraception. 2002; 65: 187-96. Level II-2.
38. Lidegaard O. Thrombotic diseases in young women and the influence of oral contraceptives // Am. J. Obstet. Gynecol. 1998; 179: S62-7. Level II-2.
39. Lawrenson R., Farmer R. Venous thromboembolism and combined oral contraceptives: does the type of progestogen make a difference? // Contraception. 2000; 62: 21S-8S. Discussion 37S-8S. Level II-2.
40. Lewis M.A., MacRae K.D., Kuhl-Habichl D., Bruppacher R., Heinemann L.A., Spitzer W.O. The differential risk of oral contraceptives: the impact of full exposure history // Hum. Reprod. 1999; 14: 1493-9. Level II-2.
41. Heinemann L.A., Lewis M.A., Assmann A., Thiel C. Case-control studies on venous thromboembolism: bias due to design? A methodological study on venous thromboembolism and steroid hormone use // Contraception. 2002; 65: 207-14. Level II-2.
42. Black C., Kaye J.A., Jick H. Clinical risk factors for venous thromboembolus in users of the combined oral contraceptive pill // Br. J. Clin. Pharmacol. 2002; 53: 637-40. Level II-2.
43. Bloemenkamp K.W., Rosendaal F.R., Buller H.R., Helmerhorst F.M., Colly L.P., Vandenbroucke J.P. Risk of venous thrombosis with use of current lowdose oral contraceptives is not explained by diagnostic suspicion and referral bias // Arch. Intern. Med. 1999; 159: 65-70. Level II-2.
44. Hedenmalm K., Samuelsson E., Spigset O. Pulmonary embolism associated with combined oral contraceptives: reporting incidences and potential risk factors for a fatal outcome // Acta Obstet. Gynecol. Scand. 2004; 83: 576-85. Level II-2.
45. Herings R.M., Urquhart J., Leufkens H.G. Venous thromboembolism among new users of different oral contraceptives // Lancet. 1999; 354: 127-8. Level II-2.
46. Jick S.S., Kaye J.A., Russmann S., Jick H. Risk of nonfatal venous thromboembolism with oral contraceptives containing norgestimate or desogestrel compared with oral contraceptives containing levonorgestrel // Contraception. 2006; 73: 566-70. Level II-2.
47. Kemmeren J.M., Algra A., Grobbee D.E. Third ge-neration oral contraceptives and risk of venous thrombosis: meta-analysis // BMJ. 2001; 323: 131-4. Level III.
48. Parkin L., Skegg D.C., Wilson M., Herbison G.P., Paul C. Oral contraceptives and fatal pulmonary embolism // Lancet. 2000; 355: 2133-4. Level II-2.
49. Samuelsson E., Hagg S. Incidence of venous thromboembolism in young Swedish women and possibly preventable cases among combined oral contraceptive users // Acta Obstet Gynecol Scand. 2004;83: 674-81. Level II-2.
50. Vinogradova Y., Coupland C., Hippisley-Cox J. Use of combined oral contraceptives and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases // BMJ. 2015; 350: h2135. Level II-2.
51. Ziller M., Ziller V., Haas G., Rex J., Kostev K. Risk of venous thrombosis in users of hormonal contraceptives in German gynaecological practices: a patient database analysis // Arch. Gynecol. Obstet. 2014; 289: 413-9. Level II-2.
52. Jick S.S., Hernandez R.K. Risk of non-fatal venous thromboembolism in women using oral contraceptives containing drospirenone compared with women using oral contraceptives containing levonorgestrel: case-control study using United States claims data // BMJ. 2011; 342: d2151. Level II-2.
53. Gronich N., Lavi I., Rennert G. Higher risk of venous thrombosis associated with drospirenone-containing oral contraceptives: a population-based cohort study // CMAJ. 2011; 183: E1319-25. Level II-2.
54. Parkin L., Sharples K., Hernandez R.K., Jick S.S. Risk of venous thromboembolism in users of oral contraceptives containing drospirenone or levonorgestrel: nested case-control study based on UK General Practice Research Database // BMJ. 2011; 342: d2139. Level II-2.
55. Sidney S., Cheetham T.C., Connell F.A., Ouellet-Hellstrom R., Graham D.J., Davis D. et al. Recent combined hormonal contraceptives (CHCs) and the risk of thromboembolism and other cardiovascular events in new users // Contraception. 2013; 87: 93-100. Level II-2.
56. Burnhill M.S. The use of a large-scale surveillance system in Planned Parenthood Federation of America cli-nics to monitor cardiovascular events in users of combination oral contraceptives // Int. J. Fertil. Womens Med. 1999; 44: 19-30. Level II-2.
57. Eng P.M., Seeger J.D., Loughlin J., Clifford C.R., Mentor S., Walker A.M. Supplementary data collection with case-cohort analysis to address potential confounding in a cohort study of thromboembolism in oral contraceptive initiators matched on claims-based propensity scores // Pharmacoepidemiol. Drug. Saf. 2008; 17: 297-305. Level II-2.
58. Seeger J.D., Loughlin J., Eng P.M., Clifford C.R., Cutone J., Walker A.M. Risk of thromboembolism in women taking ethinylestradiol/drospirenone and other oral contraceptives // Obstet. Gynecol. 2007; 110: 587-93. Level II-2.
59. Dinger J.C., Heinemann L.A., Kuhl-Habich D. The safety of a drospirenonecontaining oral contraceptive: final results from the European Active Surveillance Study on oral contraceptives based on 142,475 women-years of observation // Contraception. 2007; 75: 344-54. Level II-2.
60. Dinger J., Assmann A., Mohner S., Minh T.D. Risk of venous thromboembolism and the use of dienogest- and drospirenone-containing oral contraceptives: results from a German case-control study // J. Fam. Plann. Reprod. Health Care. 2010; 36: 123-9. Level II-2.
61. Dinger J., Bardenheuer K., Heinemann K. Cardiovascular and general safety of a 24-day regimen of drospirenone-containing combined oral contraceptives: final results from the International Active Surveillance Study of Women Taking Oral Contraceptives // Contraception. 2014; 89: 253-63. Level II-1.
62. Bergendal A., Persson I., Odeberg J., Sundstrom A., Holmstrom M., Schulman S. et al. Association of venous thromboembolism with hormonal contraception and thrombophilic genotypes // Obstet. Gynecol. 2014; 124: 600-9. Level II-2.
63. Martinez F., Ramirez I., Perez-Campos E., Latorre K., Lete I. Venous and pulmonary thromboembolism and combined hormonal contraceptives. Systematic review and meta-analysis // Eur. J. Contracept. Reprod. Health Care. 2012; 17: 7-29. Level III.
64. Lidegaard O., Milsom I., Geirsson R.T., Skjeldestad F.E. Hormonal contraception and venous thromboembolism // Acta Obstet. Gynecol. Scand. 2012; 91: 769-78. Level III.
65. Maxwell W.D., Jacob M., Spiryda L.B., Bennett C.L. Selection of contraceptive therapy for patients with thrombophilia: a review of the evidence // J. Womens Health. 2014; 23: 318-26. Level III.
66. Timmer C.J., Mulders T.M. Pharmacokinetics of etonogestrel and ethinylestradiol released from a combined contraceptive vaginal ring // Clin. Pharmacokinet. 2000; 39: 233-42. Level I.
67. Lidegaard O., Nielsen L.H., Skovlund C.W., Lokke-gaard E. Venous thrombosis in users of non-oral hormonal contraception: follow-up study, Denmark 2001-10 // BMJ. 2012; 344: e2990. Level II-2.
68. Dinger J., Mohner S., Heinemann K. Cardiovascular risk associated with the use of an etonogestrel-containing vaginal ring // Obstet. Gynecol. 2013; 122: 800-8. Level II-1.
69. Abrams L.S., Skee D.M., Natarajan J., Wong F.A., Lasseter K.C. Multiple-dose pharmacokinetics of a contraceptive patch in healthy women participants // Contraception. 2001; 64: 287-94. Level I.
70. Abrams L.S., Skee D., Natarajan J., Wong F.A. Pharmacokinetic overview of Ortho Evra/Evra // Fertil. Steril. 2002; 77: S3-12. Level III.
71. Van den Heuvel M.W., van Bragt A.J., Alnabawy A.K., Kaptein M.C. Comparison of ethinylestradiol pharmacokinetics in three hormonal contraceptive formulations: the vaginal ring, the transdermal patch and an oral contraceptive // Contraception. 2005; 72: 168-74. Level I.
72. Jick S.S., Kaye J.A., Russmann S., Jick H. Risk of nonfatal venous thromboembolism in women using a contraceptive transdermal patch and oral contraceptives containing norgestimate and 35 microg of ethinyl estradiol // Contraception. 2006; 73: 223-8. Level II-2.
73. Jick S.S., Jick H. Cerebral venous sinus thrombosis in users of four hormonal contraceptives: levonorgestrel-containing oral contraceptives, norgestimate-containing oral contraceptives, desogestrel-containing oral contraceptives and the contraceptive patch // Contraception. 2006; 74: 290-2. Level II-2.
74. Jick S., Kaye J.A., Li L., Jick H. Further results on the risk of nonfatal venous thromboembolism in users of the contraceptive transdermal patch compared to users of oral contraceptives containing norgestimate and 35 microg of ethinyl estradiol // Contraception. 2007; 76: 4-7. Level II-2.
75. Jick S.S., Hagberg K.W., Hernandez R.K., Kaye J.A. Postmarketing study of ORTHO EVRA and levonorgestrel oral contraceptives containing hormonal contraceptives with 30 mcg of ethinyl estradiol in relation to nonfatal venous thromboembolism // Contraception. 2010; 81: 16-21. Level II-2.
76. Cole J.A., Norman H., Doherty M., Walker A.M. Venous thromboembolism, myocardial infarction, and stroke among transdermal contraceptive system users // Obstet. Gynecol. 2007; 109: 339-46. Level II-2.
77. Dore D.D., Norman H., Loughlin J., Seeger J.D. Extended case-control study results on thromboembolic outcomes among transdermal contraceptive users // Contraception. 2010; 81: 408-13. Level II-2.
78. Kamel H., Navi B.B., Sriram N., Hovsepian D.A., Devereux R.B., Elkind M.S. Risk of a thrombotic event after the 6-week postpartum period // N. Engl. J. Med. 2014; 370: 1307-15. Level II-2.
79. Martinelli I., Taioli E., Bucciarelli P., Akhavan S., Mannucci P.M. Interaction between the G20210A mutation of the prothrombin gene and oral contraceptive use in deep vein thrombosis // Arterioscler. Thromb. Vasc. Biol. 1999; 19: 700-3. Level II-2.
80. Girolami A., Spiezia L., Girolami B., Zocca N., Luzzatto G. Effect of age on oral contraceptive-induced venous thrombosis // Clin. Appl. Thromb. Hemost. 2004; 10: 259-63. Level II-2.
81. Lopez M., Vaya A., Martinez Triguero M.L., Contreras M.T., Todoli J., Ricart A. et al. Yasmin and venous thromboembolism: new case reports // Clin. Hemorheol. Microcirc. 2009; 42: 65-9. Level II-3.
82. Vaillant-Roussel H., Ouchchane L., Dauphin C., Philippe P., Ruivard M. Risk factors for recurrence of venous thromboembolism associated with the use of oral contraceptives // Contraception. 2011; 84: e23-30. Level II-2.
83. Bloemenkamp K.W., Rosendaal F.R., Helmerhorst F.M., Vandenbroucke J.P. Higher risk of venous thrombosis during early use of oral contraceptives in women with inherited clotting defects // Arch. Intern. Med. 2000; 160: 49-52. Level II-2.
84. Vessey M., Mant D., Smith A., Yeates D. Oral contraceptives and venous thromboembolism: findings in a large prospective study // Br. Med. J. (Clin. Res. Ed.). 1986; 292: 526. Level II-2.
85. Price D.T., Ridker P.M. Factor V Leiden mutation and the risks for thromboembolic disease: a clinical perspective // Ann. Intern. Med. 1997; 127: 895-903. Level III.
86. Jack B.W., Atrash H., Coonrod D.V., Moos M.K., O’Donnell J., Johnson K. The clinical content of preconception care: an overview and preparation of this supplement // Am. J. Obstet. Gynecol. 2008; 199: S266-79. Level III.
87. Farley T.M., Meirik O., Chang C.L., Poulter N.R. Combined oral contraceptives, smoking, and cardiovascular risk // J. Epidemiol. Community Health. 1998; 52: 775-85. Level II-2.
88. Vasilakis-Scaramozza C., Jick H. Risk of venous thromboembolism with cyproterone or levonorgestrel contraceptives // Lancet. 2001; 358: 1427-9. Level II-2.
89. Nightingale A.L., Lawrenson R.A., Simpson E.L., Williams T.J., MacRae K.D., Farmer R.D. The effects of age, body mass index, smoking and general health on the risk of venous thromboembolism in users of combined oral contraceptives // Eur. J. Contracept. Reprod. Health Care. 2000; 5: 265-74. Level III.
90. Abdollahi M., Cushman M., Rosendaal F.R. Obesity: risk of venous thrombosis and the interaction with coagulation factor levels and oral contraceptive use // Thromb. Haemost. 2003; 89: 493-8. Level II-2.
91. Huerta C., Johansson S., Wallander M.A., Garcia Rodriguez L.A. Risk factors and short-term mortality of venous thromboembolism diagnosed in the primary care setting in the United Kingdom // Arch. Intern. Med. 2007; 167: 935-43. Level II-2.