Газета «Новости медицины и фармации» №9 (696), 2019
Вернуться к номеру
Огляд міжнародного консенсусу з алергології та ринології: Алергічний риніт (частина 1)
Разделы: Справочник специалиста
Версия для печати
I. Вступ
Кількість доступної літератури щодо алергічних ринітів (АР) збільшується з кожним десятиріччям. Пошук за темою «алергічний риніт» у базі даних PubMed виявив 4135 статей, опублікованих між 1945 і 1979 рр. У наступні 20 років (1980–2000) виявлено 7064 опубліковані статті, з 2000 по 2010 р. їх число досягло 8143, а 8212 статей опубліковані з 2010 року по сьогодні. Як і в інших галузях медицини, прискіпливе вивчення доступної літератури демонструє широку варіабельність типів і рівня якості публікацій щодо АР. Рівень публікацій коливається від аналізу випадків з метааналізом, оглядових публікацій і рандомізованих контрольованих досліджень (РКД) до невеликих ретроспективних досліджень. Коли лікар-спеціаліст читає літературу або чує про літературні дані, цитовані іншими, важливо, щоб він/вона знали якість доказів для того, щоб правильно впровадити висновки та рекомендації до щоденної клінічної допомоги пацієнту з АР. За наявності такої великої кількості доступної літератури щодо АР розробка і належне розуміння наданих доказів можуть бути складними.
Міжнародний консенсус з алергії та ринології: алергічний риніт (This International Consensus Statement on Allergy and Rhinology: Allergic Rhinitis (ICAR:AR)) було створено для узагальнення найкращих зовнішніх доказів, що стосуються АР, з метою збору та критичного аналізу наявної літератури щодо епідеміології АР, факторів ризику, діагностики, ведення АР і пов’язаних з ними станів/супутніх захворювань.
Понад 100 багатонаціональних авторів різних спеціальностей використовували структурований процес перегляду для оцінки доказів, пов’язаних з АР. Аналізувалася початкова розробка тематики з подальшим написанням дослідження основним автором або групою авторів, а потім здійснювався послідовний анонімний ітераційний перегляд більше ніж 100 тематичних статей з АР, що призвело до високих стандартів дослідження.
Отриманий документ забезпечує багатогранний огляд існуючої літератури про АР. Рекомендації щодо методів діагностики АР, які містяться в цьому документі, безпосередньо спираються на ці докази, чітко окреслюючи переваги, недоліки та втрати, що обґрунтовують кожен рівень рекомендацій.
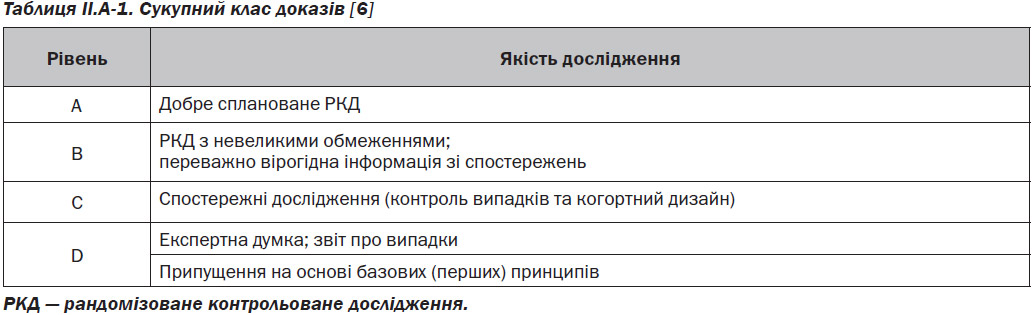
Подібно Міжнародному консенсусу з алергії та ринології: риносинусит (МКАР) ICAR:RS) Orlandi et al. (2016) [1], у цьому ICAR за темою АР приділено особливу увагу силі доказів при складанні рекомендацій. Тому, наприклад, думка експерта отримує меншу вартість (табл. II.A-1).
Проте є певні обмеження. МКАР не є клінічною настановою (КН) або метааналізом. Цей документ узагальнює дані метааналізів та інших систематичних оглядів, які містяться в літературі за спеціальною тематикою АР. Водночас метааналіз не проводився щодо даних, включених у цей документ. Додатково відзначимо, що більша частина наявної літератури з АР не підлягає метааналізу через її різнорідність та суперечливість методологічних підходів. МКАР щодо АР не є КН, оскільки типові кроки, необхідні для створення КН (тобто огляди медичною спільнотою та органами захисту пацієнтів), не використовувались. У цьому документі певні тематичні області мають дуже суттєві докази, тоді як інші теми демонструють відносно слабкі докази. Багато з наших загальних практик діагностики та догляду за пацієнтом із АР базуються на слабких зовнішніх доказах.
В цілому у цьому документі певні розділи мають дуже суттєві докази, тоді як інші теми демонструють відносно слабкі докази. Багато загальних практик діагностики та догляду за пацієнтом із АР базуються на слабких зовнішніх доказах. Як практики, академічні співробітники та науковці ми повинні вивчати докази і намагатись підвищити силу доказів у тих положеннях, де в них є прогалини. У межах МКАР документи, рекомендації базуються на доказах за певними темами.
Незважаючи на те, що цей документ являє собою узагальнення кращих доказів стосовно АР, він не є керівництвом для надання допомоги пацієнтам з АР. Медицина, заснована на доказах, вимагає, щоб клініцист не тільки отримував найкращі докази, але й використовував свої знання та враховував цінності й очікування пацієнта [2]. Тому ґрунтуючись на доказових даних, практикуючий лікар повинен підходити до пацієнта як до особистості, визначаючи для кожного з них найвідповідніші методи діагностики та лікування. Зважаючи на численні потенційні стани, які потрібно мати на увазі при диференційній діагностиці АР, різноманітні діагностичні та лікувальні варіанти та розмаїття супутніх захворювань, що можуть супроводжувати АР, лікування пацієнта з АР на доказовій базі вимагає виваженого підходу.
Як до цього встановлено Orlandi et al. [1], рекомендації, надані МКАР, повинні інтерпретуватись з урахуванням сили доказів, що лежать в їх основі. Рекомендації цього документа ґрунтуються на доказах. Вони не визначають стандарти медичної допомоги. Рекомендації, написані в цьому документі або будь-якому аналогічному документі, не вимагають особливої турботи про окремих пацієнтів. Існує безліч інших факторів, які містять рішення відносно лікування кожного конкретного пацієнта.
Рекомендації
Рекомендації, які наведені в даному документі або в подібних документах, не визначають специфіку надання допомоги конкретному пацієнту. Існує багато інших факторів, що впливають на рішення стосовно лікування конкретного пацієнта.
Кінець кінцем очікується, що ці рекомендації будуть змінюватись з часом та появою нових доказів. Ми ініціюємо нові дослідження, особливо дослідження, спрямовані на заповнення прогалин у знаннях.
З новими доказами рекомендації будуть зазнавати необхідних змін, що дозволить досягати кращих результатів для пацієнта. З новими доказами рекомендації будуть переглядатись і дозволять пацієнту досягнути кращих результатів.
II. Методи
II.A. Розробка розділів
Таким же чином, як і публікація 2016 ICAR:RS Orlandi et al. [1], так і цей документ ICAR:AR складено з максимальною залежністю від опублікованих доказів. Згідно із заснованими на доказах оглядами 2011 Rudmik and Smith [3], які створені на основі рекомендацій (EBRR), ICAR:AR намагається аналізувати існуючу літературу з кожного аспекту АР, ранжуючи докази та надаючи, коли це можливо, рекомендації на підставі даних літератури.
У наявній літературі містяться різноманітні за видом та якістю публікації. Починаючи від повідомлень про випадки хвороби до метааналізів, оглядових публікацій і до рандомізованих контрольованих досліджень (РКД), а також від великих проспективних досліджень до малих ретроспективних серій спостережень.
Коли лікар-професіонал читає літературу або чує про літературні джерела, цитовані іншими, важливо, щоб він/вона розуміли якість доказів, щоб правильно впроваджувати висновки та рекомендації до щоденного надання клінічної допомоги пацієнтам з АР. За наявності такої великої кількості літератури з АР формування адекватного розуміння відповідних доказів може бути складним.
International Consensus Statement on Allergy and Rhinology: Allergic Rhinitis (ICAR:AR) був створений для узагальнення найкращих зовнішніх доказів щодо АР з метою зібрання і критичного аналізу доступної літератури з питань АР, вивчення епідеміології, факторів ризику, діагностики, лікування і супутніх станів та хвороб для виявлення доказів, що стосуються АР.
Ініціальне створення і написання розділів здійснювалось основним автором або групою авторів і передбачало поступовий анонімний ітеративний процес із дотриманням дуже високих стандартів за більше ніж 100 аспектами АР.
Підсумковий документ являє собою ретельний огляд існуючої літератури з питань АР.
Рекомендації щодо діагностичних методів та методів лікування, що містяться в цьому документі, безпосередньо спираються на докази, чітко окреслюючи переваги, шкоду та витрати, обґрунтовуючи кожен рівень рекомендацій.
Як і 2016 International Consensus Statement on Allergy and Rhinology: Rhinosinusitis (ICAR:RS) by Orlandi et al. [1], цей документ ICAR:AR має високу цінність щодо сили доказів у створенні рекомендацій. Тому, наприклад, експертна думка мала нижчу й обмежену цінність (табл. II.A-1).
Так само, як і ICAR:RS, цей документ не є керівництвом для клінічної практики чи метааналізом. Він узагальнює дані метаанализу та інші систематичні огляди літератури, які стосуються специфічних аспектів АР.
Однак метааналіз не проводився відносно усіх даних цього документу. На додаток, більшість доступної літератури не підходить для метааналізу через неоднорідну природу та методологію. ICAR:AR не є КН (клінічною настановою), тому що типові кроки, необхідні для КН, не застосовувались.
У цілому, звичайно, розділи документа мали сильну доказовість, тоді як інші розділи мали відносно слабку доказовість. Багато з наших загальноприйнятих методів діагностики та ведення пацієнта з АР базуються на слабких зовнішніх доказах. Як практичні лікарі, так і академічні працівники, вчені мають вивчати силу доказів і намагатись підвищувати силу доказів у випадках дефіциту інформації.
В документі ICAR:AR рекомендації надаються на підставі доказів за певною темою.
Проте цей документ є компіляцією кращих доказів АР, а не підручником з догляду за пацієнтом з АР. Доказова медицина потребує, щоб клініцист мав найкращі доступні докази, але також використовував свої знання та враховував цінність та очікування пацієнта [2].
Тому, ґрунтуючись на доказовій медицині, практичний лікар має ставитись до пацієнта як до особистості і визначати відповідні методи діагностики та лікування для конкретного пацієнта. Наявні численні потенційні стани, які потребують диференціальної діагностики з АР, різні коморбідні та стани, що можуть супроводжувати АР, лікування вимагає уважності і ретельності. Як попередньо стверджено Orlandi et al. [1], рекомендації, надані у документі ICAR, мають бути інтерпретовані на основі сили доказів, на яких базуються ствердження. Вони не визначають стандарт надання допомоги чи медичні показання. Рекомендації, написані в цьому чи подібних документах, не диктують особливості допомоги конкретному пацієнту. Існують численні інші фактори, що впливають на рішення щодо лікування у певного пацієнта. Нарешті, очікується, що ці рекомендації зміняться з часом із появою нових доказів. Ми заохочуємо нові дослідження, особливо суворі дослідження, які спрямовані на заповнення виявлених прогалин у знаннях. З огляду на нові докази рекомендації будуть піддані необхідним переглядам, і в результаті повинні бути досягнуті кращі результати для пацієнтів.
Суб’єкт АР спочатку було розділено на 103 теми або розділи вмісту. Був призначений головний автор, який є визнаним авторитетом з алергології, ринології або за певними темами.
Спочатку авторів обирали за допомогою онлайн-пошуку літератури за кожною темою ICAR:AR. Автори високоякісних публікацій з кожної теми були запрошені як учасники ICAR:AR. До інших запрошених авторів включені фахівці зі створення ЄБРР, фахівці, обізнані в окремих тематичних аспектах АР, та ті, хто знається на процесах створення систематичних
оглядів.
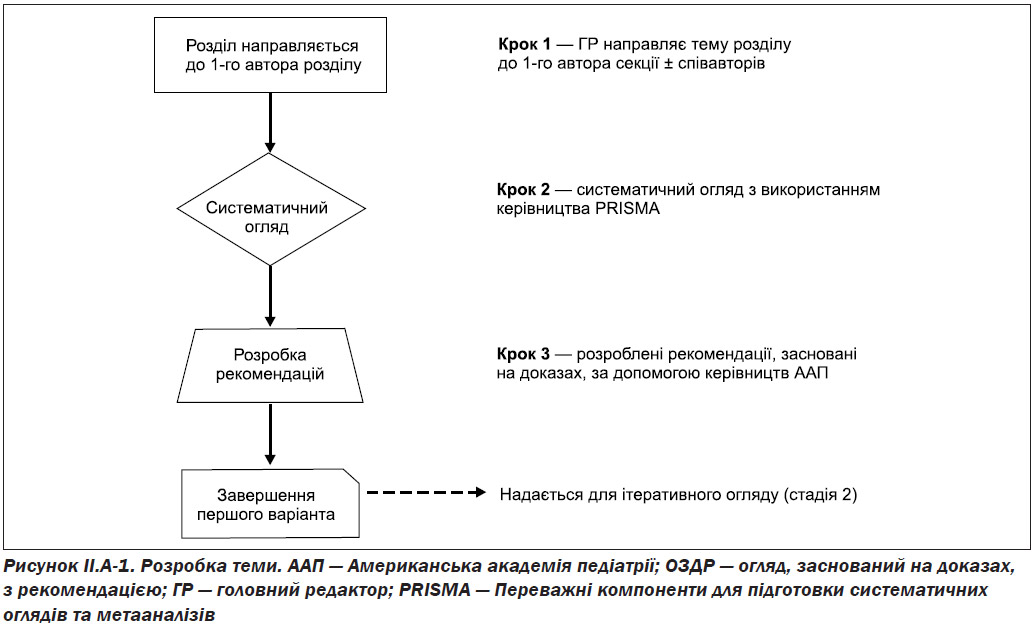
За деякими темами, які були не прийнятні для створення клінічних рекомендацій, було вирішено створити доказові огляди без рекомендацій. Деякі теми, такі як ті, що містять довідкову інформацію або визначення, були визначені як огляди літератури без оцінок доказів. Теми, за якими були докази для включення у клінічні рекомендації, були визначені як EBRs. Автор розділу теми отримав конкретні вказівки для здійснення систематичного огляду тематичної літератури, використовуючи стандартизовані Керівні принципи рекомендованих пунктів включення для систематичних оглядів та метааналізів (PRISMA) [4].
Включались бази даних Ovid MEDLINE® (1947 — September 2016), EMBASE (1974 — September 2016) та огляди Кохрана (Cochrane Review). Пошук починався з ідентифікації попередньо опублікованих директивних принципів. Спочатку знаходили будь-які раніше опубліковані систематичні огляди або керівні принципи, що стосуються заданої теми.
Оскільки клінічні рекомендації краще підтверджуються високоякісними доказами, пошук зосереджено на визначенні RCTs та метааналізу RGT, щоб забезпечити найвищий рівень доказовості (LOE).
Було перевірено список з усіх виявлених досліджень, щоб зафіксувати усі релевантні дослідження.
Якщо автори сприймали те, що дослідження не англійською мовою повинно бути включено до огляду, їм було запропоновано, щоб цей документ був належним чином перекладений, щоб мінімізувати ризик втрати важливих даних під час розробки рекомендацій.
Референтні списки усіх виявлених досліджень були перевірені, щоб упевнитись, чи усі релевантні дослідження були внесені до переліку.
Якщо автори вважали, що не англомовні дослідження повинні бути включені до огляду, їм було запропоновано, щоб цей документ був належним чином перекладений для мінімізації ризику втрати важливих даних під час розробки рекомендацій [4].
Щоб оптимізувати прозорість доказів, усі включені дослідження в розділи теми EBR та EBRR представлені у стандартному форматі таблиці, а якість кожного дослідження оцінювалась для досягнення рівня, заснованого на оксфордському LOE (рівень 1a-5) [5].
Після завершення систематичного огляду та оцінки якості досліджень за кожною клінічною темою, для цієї тематики була складена сукупна категорія доказів на основі рекомендацій комітету з питань управління якістю та управління Американської академії педіатрії (AAP SCQIM) [6] (табл. II.A-1).
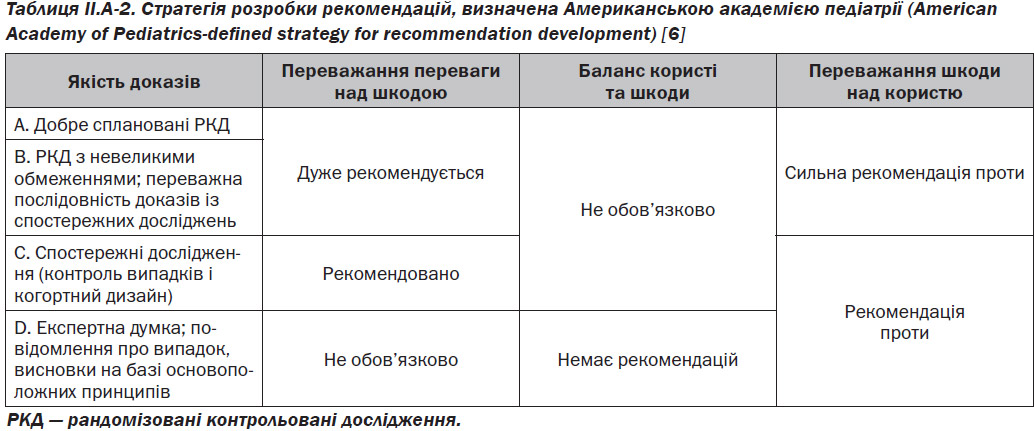
Після отримання сукупної кількості доказів для кожної теми ЄБРР (A до D) була підготовлена рекомендація, що використовує керівні принципи AAP SCQIM (табл. II.A-2). Слід зазначити, що кожна доказова рекомендація враховувала сукупний клас доказів разом із співвідношенням вигоди, шкоди та витрат.
Резюме стосовно процесу розробки EBRR подано на рис. II.A-1.
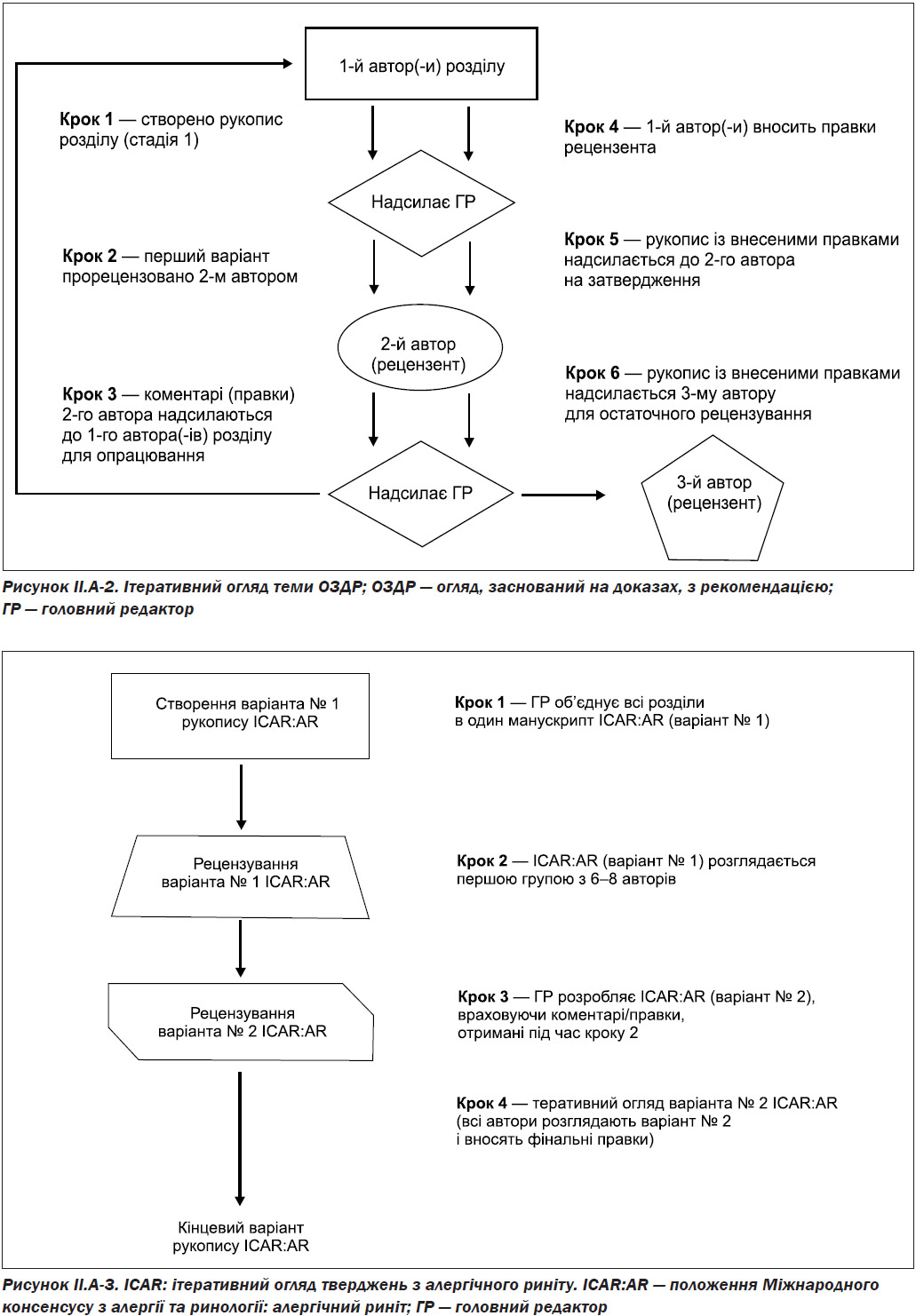
II.B. Ітеративний огляд
Після створення початкового тексту та будь-яких пов’язаних із цим таблиць доказів, оцінок доказів та рекомендацій щодо розділу, два незалежних рецензенти проводять двохетапний онлайн-перегляд (рис. II.A-2).
Суть метатематичного ітераційного огляду полягала в оцінці повноти використаної літератури та забезпечення відповідності основаним на доказах оглядам з рекомендаціями (EBR Revidence-based review with recommendations).
Зміст чернетки кожної секції теми був розглянутий першим рецензентом, і всі зміни були погоджені між початковим автором та цим першим рецензентом. Потім розділ опрацьованої теми розглядав другий рецензент.
Початкові автори розділу та обидва рецензенти погоджували всі зміни доти, поки кожна секція вважалася відповідною для того, щоб перейти до остаточного етапу створення ICAR.
II.D. Обмеження методів та подання даних
Слід зазначити, що оскільки з кожної теми автором індивідуально виконувався пошук літератури за його/її темою, результати пошуку можуть демонструвати деяку притаманну їм мінливість, незважаючи на конкретні та детальні інструкції пошуку.
Крім того, хоча цей документ намагались створити максимально вичерпним, він може не містити певне дослідження, опубліковане з кожної теми. Для деяких тем література є екстенсивною і містить лише високоякісні дослідження або систематичні огляди.
Якщо сукупні докази на певну тему отримали високий рівень доказів лише дослідженнями високого рівня, то вичерпний перелік досліджень нижчого рівня (або всіх проведених досліджень) не надається.
III. Визначення і диференційна діагностика
III.A. Визначення алергічного риніту
АР — це імуноглобулін E (IgE)-опосередкований стан носа, що виникає внаслідок дії алергену на сенсибілізовану особу [7]. У 1929 році АР був визначений як процес, який включає 3 кардинальних симптоми: чхання, обструкцію і виділення слизу [8]. Ці симптоми з’являються при дії алергену на пацієнта з алергією.
АР — це дуже поширене захворювання, яке може призвести до значних органічних змін та періодичних або постійних захворювань.
Поширеність АР становить приблизно 10–40 % залежно від географічного розташування [9] і найчастіше зустрічається у дітей [10]. Проте АР майже відсутній у грудних дітей молодшого віку і звичайно не проявляється до другого року життя і раніше. Поява АР у дітей вірогідно пов’язана з бурхливим розвитком імунної системи.
АР часто виникає через гіперреактивну відповідь Т-хелперів (T helper — Th) 2 лімфоцитів, які можуть ініціювати системну, IgE-керовану реакцію, яка домінує в імунній системі дитини до повного дозрівання. Протягом цього часу шкірний прик-тест (ШПТ) (skin-prick test, SPT) чи тести in vitro на антиген-специфічний IgE (antigen-specific IgE — sIgE) можуть бути використані для підтвердження діагнозу АР.
В атопічної особи експозиція внутрішніх та зовнішніх алергенів може стимулювати синтез антиген-специфічного IgE. Повторна дія алергену викликає реакції раннього і пізнього періоду і призводить до клінічних проявів АР.
Реакція ранньої стадії відбувається протягом декількох хвилин після повторного введення алергену, до якого виникла сенсибілізація, викликаючи свербіння носа, закладеність носа та ринорею [11].
Реакція пізньої стадії відбувається протягом 4–8 годин після введення алергену та призводить до закупорки носа, гіпоосмії, підвищення секреції слизу та гіперреактивності носа на ті самі або інші алергени. Крім того, навіть за відсутності явних симптомів, відзначається підвищення вмісту IgE у лімфоїдній тканині пацієнта з атопією, що може призвести до персистуючого запалення слизової оболонки [12].
III.B. Класифікація алергічного риніту
Сезонний vs багаторічний алергічний риніт
Уяви про алергічний риніт та його вплив на астму (ARIA) визначають АР на підставі припущення причини і сезонності vs цілорічної наявності симптоматики. В класичному випадку це призводить до сезонних АР (SAR, сінна лихоманка) та цілорічного алергічного риніту (PAR) [7].
SAR викликається широким спектром екзоалергенів, особливо пилком рослин [7]. PAR звичайно викликається ендоалергенами, що діють протягом року: пилові кліщі, цвіль, комахи (таргани) та лупа тварин [7].
Інтермітуючий vs персистуючий алергічний риніт
Класифікація на «сезонний» і «цілорічний» АР може бути суперечливою, оскільки прояви цілорічної алергії можуть не виникати протягом цілого року. Особливо це стосується пацієнтів з алергією на домашні пилові кліщі (ДПК — HDM), при яких може спостерігатися легкий або середній/тяжкий інтермітуючий алергічний риніт (ІАР) [9, 13–15].
Крім того, через праймінг-ефект на слизову оболонку носа, ініційований низьким рівнем алергену пилку [16–21] та мінімальним персистуючим запаленням носа, у пацієнтів з «безсимптомним ринітом» [14, 22, 23] симптоми можуть взагалі не проявлятися в сезон дії алергену і призводити до неспецифічних загострень. Забруднення повітря також може сприяти зміні чутливості до алергенів, що призводить до різного ступеня симптомів залежно від місця розташування та якості повітря [24].
Крім того, особи, сенсибілізовані до декількох видів пилку, можуть мати симптоми протягом декількох сезонів, тому симптоми в осіб із персистуючим АР (ПАР) можуть спостерігатися короткочасно, з частими, повторними рецидивами.
Через вищевикладені проблеми ARIA запропонована нова класифікація, яка ґрунтується на тривалості та частоті рецидивів симптоматики [25]. ІАР характеризується симптомами, що тривають менше 4 днів на тиждень чи менше ніж 4 послідовні тижні. Персистуючому АР (ПАР, або persistent AR (PER)) притаманні симптоми, що проявляються частіше від 4 днів на тиждень протягом не менше 4 послідовних тижнів; тому у пацієнтів із ПАР симптоматика наявна більшість часу [26].
Рекомендовано використовувати попередні класифікації сезонних та цілорічних АР (тобто САР та ЦАР) разом із новою класифікацією ІАР та ПАР, тому що вони не пропонують аналогічний розподіл захворювань. Таким чином, ІАР та ПАР не є синонімами сезонних та цілорічних ринітів [25, 27–30]. Описуючи АР, слід зважати на те, яка схема класифікації найкращим чином передає патологічний стан, який ми намагаємось змалювати: сезонні/цілорічні або інтермітуючі/стійкі. Симптоми АР можуть бути подібними до симптомів інших синоназальних захворювань, але водночас можуть співіснувати різні варіанти. Важливо правильно визначити етіологію риніту, щоб правильно лікувати пацієнта і мати найкращі шанси подолати його або його симптоми. У наступних розділах обговорені питання диференціальної діагностики АР, а також описано те, чим кожен варіант риніту відрізняється від АР. Зауважимо, що цей розділ про диференціальну діагностику АР стосується ринітів різної етіології. Інші захворювання, які можуть підлягати диференціальній діагностиці з АР, такі як структурна синоназальна патологія (наприклад, викривлення перегородки), пухлини та витікання спинномозкової рідини, тут не розглядаються (табл. III.C).
Тяжкість алергічного риніту
АР може призводити до значних порушень якості життя (QOL), сну, толерантності до фізичного навантаження, продуктивності праці та соціалізації. Рекомендаціями ARIA також запропоновано стратифікацію тяжкості (легкого та помірного ступеня тяжкості) з огляду на обмеження можливостей пацієнта [13] (див. розділ VII «Тягар хвороби» для отримання додаткової інформації з цього питання).
Сенсибілізація vs клінічна алергія
Моносенсибілізація — це сенсибілізація тільки до 1 алергену, наприклад такого, як пилок трави, пилок дерев (за даними стандартного прик-тесту чи рівня сироваткового IgE, кліщів домашнього пилу HDM чи котячої лупи (навіть коли екстракти цих концентратів містять численні різноманітні поліпептиди) [31].
Моноалергія визначається як реакція на єдиний сенсибілізуючий алерген, що викликає клінічні симптоми алергії.
Полісенсибілізації притаманна сенсибілізація до 2 або більше алергенів.
При поліалергії спостерігаються клінічні прояви на 2 або більше сенсибілізуючих алергенів. Результати тестування на алергію або шкірні тести чи sIgE повинні корелювати з клінічними проявами до виявленого алергену(-ів), які, імовірно, викликають симптоми [32]. Провокації з алергеном (наприклад, носові, кон’юнктивальні провокації або у спеціальних приміщеннях для проведення тестів (allergen challenge chambers — ACCs) можуть надавати клінічне підтвердження значущості сенсибілізуючого алергену, але ці тести можуть бути складними для виконання, суб’єктивними та обмеженими через подразнюючі ефекти [33].
Шкірні алергологічні тести чи визначення вмісту sIgE повинні бути ретельно інтерпретовані на рівні пацієнта, а також можуть бути корисними на рівні популяції при оцінці сенсибілізації під час епідеміологічних досліджень [34].
Зі збільшенням доступності компонентного діагнозу лікарі матимуть більш об’єктивні засоби для виявлення клінічно важливих алергенів і розмежування справжньої сенсибілізації з полісенсибілізацією через перехресну реактивність (див. розділ VIII.F.6 «Компонентна діагностика (КД)» — для отримання додаткової інформації на цю тему).
III.С. Диференційна діагностика алергічного риніту
Симптоми алергічного риніту можуть бути подібними до інших синоназальних захворювань. Часом різні типи ринітів можуть співіснувати. Дуже важливо правильно визначити етіологію риніту для того, щоб належним чином лікувати пацієнта і мати кращі шанси вирішити проблеми з його симптомами.
У наступному розділі подано обговорення проблем диференційної діагностики алергічного риніту, а також рекомендації до того, як відрізняти різні варіанти риніту від АР.
Зазначимо, що в цьому розділі також міститься інформація щодо різних варіантів АР. Інші різновиди риніту, з якими повинна проводитись диференційна діагностика — різні структурні дефекти (викривлення носової перегородки), пухлини і витік цереброспінальної рідини, тут не обговорюються (табл. III.C).
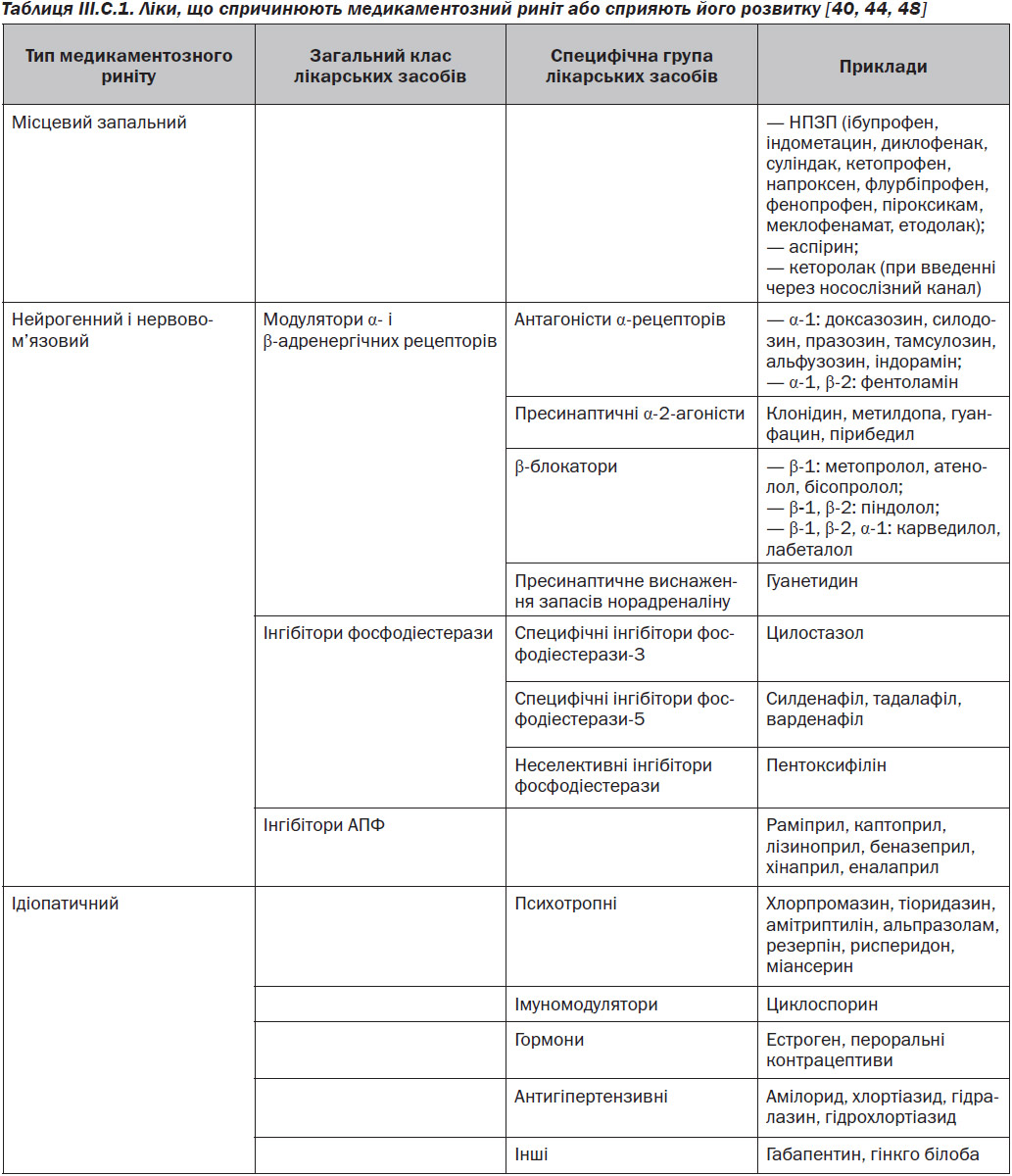
III.С.1. Риніти, що викликані медикаментами
Риніти, вторинні щодо системного медикаментозного лікування, класифікуються на локальні запальні, нейрогенні та ідіопатичні [35, 36] (табл. III.С.1). Локально-запальний тип зустрічається тоді, коли вживання ліків викликає у слизовій оболонці носа безпосередні зміни у медіаторах запалення.
Для нейрогенного типу притаманні порушення нервової стимуляції, які призводять до змін у слизовій оболонці носа.
Під ідіопатичним ринітом розуміють ситуацію, коли точно не встановлені механізми, які викликають симптоми.
Деконгестанти місцевої дії можуть викликати медикаментозно-індукований риніт, відомий як медикаментозний риніт (МР). Додаткову інформацію див. у розділі III.C.2 «Риніт медикаментозний».
Локально-запальний тип
Системне застосування нестероїдних протизапальних препаратів (НПЗП) у пацієнтів з розладами синтезу ейкозаноїдів може призводити до ринітів і закладеності носа, які можуть поєднуватись із хронічними риносинуситами (ХРС, chronic rhinosinusitis) та астмою [37].
Спрощено, НПЗП гальмують фермент циклооксигеназу (COX)-1 і COX-2, зсувають метаболізм арахідонової кислоти на ліпоксигеназний шлях, знижують виробництво простагландинів і тромбоксанів в обмін на запальні лейкотрієни (leukotrienes — LT). Зменшення рівня простагландину E2 у слизовій оболонці, так само як і збільшення LTC4, LTD4 та LTE4, викликає продукцію слизу і набряк слизової оболонки, що є ознакою риніту [35, 38].
Нейрогенний і нервово-м’язовий тип
Нейрогенний тип неалергічного риніту (НАР, neurogenic type non-allergic rhinitis) викликається медикаментозно-індукованою модуляцією вегетативної нервової системи.
Серед багатьох класів препаратів, які можуть викликати медикаментозний НАР, вирізняють антигіпертензивні препарати та вазодилататори. Інші неспецифічні препарати, такі як психотропні й імуносупресанти, мають невідомі механізми впливу, але також можуть мати нейромодулюючу дію і можуть бути визнані ідіопатичними.
Модуляція автономної нервової системи призводить до наступних змін у слизовій носа, кровоносних судинах і секреторних залозах [39].
Наприклад, α- і β-адреноблокатори і пресинаптичні антагоністи, адренергічні антагоністи можуть викликати зниження симпатикотонії. Необмежена парасимпатична стимуляція викликає застій крові у слизовій оболонці, закладеність носа та ринорею [40–42].
Селективні інгібітори фосфодіестерази-5 (ФДЕ, phosphodiesterase) викликають вазодилатацію судин пеніса й ерекцію.
Неселективні інгібітори ФДЕ-3 викликають вазодилатацію і підвищення току крові у кінцівках, полегшуючи симптоматику захворювань периферичних артеріальних судин.
У слизовій носа також відбувається пов’язана із закисом азоту (Nitric oxide — NO) й опосередкована циклічними нуклеотидами вазодилатація, що викликає застій крові і набряк [43–46].
Наприкінці інгібітори ангіотензинперетворюючого ферменту (АПФ, angiotensin converting enzyme inhibitors) гальмують перетворення ангіотензину І в ангіотензин II у легенях, що призводить до зниження симпатичної активності. Також утворюється брадикінін. У слизовій носа виявлені рецептори брадикініну B1 і B2 [47]. Аплікація брадикініну на слизову носа підвищує частоту чхання [44, 48], що свідчить про роль інгибіторів АПФ у перебігу НАР.
Незаконне вживання наркотиків
Ніс надає унікальний доступ для незаконного вживання наркотиків, тому що слизова оболонка носа добре васкуляризована і легкодоступна. Незаконний споживач наркотиків може уникати інвазивного внутрішньосудинного або внутрішньом’язового шляху введення бажаного продукту шляхом застосування подрібненої твердої, рідкої або аерозольної форми безпосередньо до носової порожнини.
Стосовно деяких речовин назальне застосування відзначається підвищеною біодоступністю і швидкою дією порівняно з пероральним застосуванням [49, 50]. Кокаїн найчастіше використовується для назального споживання, реалізуючи свою дію шляхом модуляції переносників допаміну, гальмуючи зворотній захват у синапсах, підвищуючи доступність допаміну, постсинаптичну стимуляцію [51]. Кокаїн-індукований риніт є результатом судино-
звужуючої дії, що може спричинити появу набряку слизової оболонки носа і продукцію слизу, подібних до тих, що спостерігаються при медикаментозному риніті [52–55].
У повторних споживачів кокаїну спазм судин, пряме їх пошкодження посилюються знеболюючим ефектом і/або вторинним пошкодженням внаслідок забруднення і призводить до перфорації носової перегородки [56–59]. Подібним чином можливе зловживання інтраназальним застосуванням наркотичних препаратів і за рецептом [59], антидепресантами [47], антихолінергічними препаратами та психостимуляторами [47, 60]. Показано, що інтраназальне застосування гідрокодону (hydrocodone) викликає некроз і пошкодження тканин носа, подібні до кокаїну [59]. Антидепресанти, такі як бупропіон, що використані для досягнення ейфорії, подібної до кокаїну, можуть викликати судоми [47].
Таким чином, системні препарати та інтраназальні незаконні (наркотичні) препарати пошкоджують слизову оболонку носа. При системному їх застосуванні спостерігаються набряк слизової, вазодилатація і підвищення вмісту медіаторів запалення. Незаконне вживання наркотиків викликає вазоконстрикцію і безпосередню травматизацію слизової оболонки носа. Фізіологічні реакції на медикаментозно-індукований риніт відрізняються від АР і не є залежними від IgE механізмів, хоча їх симптоматика подібна.
III.C.2. Риніт медикаментозний (РМ)
Рецидивний риніт (rebound rhinitis), або риніт із симптомами, які повертаються, є станом, викликаним тривалим використанням топічного інтраназального деконгестанту (ІНД) (of topical intranasal decongestant — IND) [26, 61] (табл. III.C.2). Хоча не існує узгоджених критеріїв, РМ у типових випадках пов’язаний із тріадою симптомів тривалого прийому ІНД, постійною назальною обструкцією і недостатнім звуженням слизової оболонки [61] в умовах закладеності носа, ринореї та зниження ефективності дії ІНД при їх подальшому застосуванні [55, 62, 63].
Фізикальне обстеження виявляє набряк слизової оболонки, еритему і гіперемію. Точні фізіологічні механізми, які викликають РМ, не ясні. Тривале застосування ІНД може знижувати ендогенну продукцію –норепінефринів і стимуляцію парасимпатичної нервової системи, що викликає закладеність носа після відміни ІНД [54, 55]. Це може викликати подальші прояви гіпоксії тканин носа та негативний зворотний зв’язок з боку нервової системи і стійко знижену реакцію, епітеліальну метаплазію та гіперплазію, розширення міжклітинного простору, гіперплазію стовбурових клітин та набряк тканин [65–67].
У механізмі виникнення РМ задіяний бензалконію хлорид (benzalkonium chloride — BKC) — антимікробна речовина, яка використовується у багатьох носових деконгестантах як консервант. Дослідження показують, що BKC токсичний для назального епітелію і може сприяти РМ, хоча ці дані не є остаточними [68–71]. Невідомі ні тривалість дії, ні кумулятивна доза IND, яка необхідна для виникнення РМ.
Реактивна конгестія розвивається після 3–10 днів застосування медикаментів [55, 66], але може не виникати і протягом 30 днів [72, 73]. Деякі дослідження показали відсутність реакції після 8-тижневої тривалості застосування [72–75]. Більше того, подвоєння дозування інтраназального імідазоліну (imidazoline) не підвищує ступеня реактивного набряку [72].
Попередні непереконливі дослідження свідчать, що використання ІНД слід припинити через 3 дні, щоб запобігти реактивній конгестії [62, 76, 77].
Лікування РМ включає відміну застосування IND. З метою усунення закладеності носа застосовуються різні ліки, такі як кромолін, седативні препарати, сольові спреї, пероральні антигістамінні препарати, –пероральні деконгестанти й інтраназальні кортикостероїди (INCS), які інколи застосовуються у поєднанні з коротким курсом системних кортикостероїдів [50, 62, 78–82]. Лише застосування INCS продемонструвало зменшення реактивної конгестії після відміни топічних IND [67, 81–83]. Найчастіше виникає риніт та або анатомічні зміни, які ініційовані застосуванням протизапальних засобів. Основна увага має бути спрямована на зменшення бажання пацієнтів продовжувати використання IND.
РМ, як правило, асоціюється з повторною дією IND, посиленням симптомів у випадках, коли препарат продовжує діяти. Навпаки, АР звичайно пов’язаний з алергічним тригером із подібними симптомами, що посилюються при експозиції алергену і залежать від IgE-опосередкованого запалення.
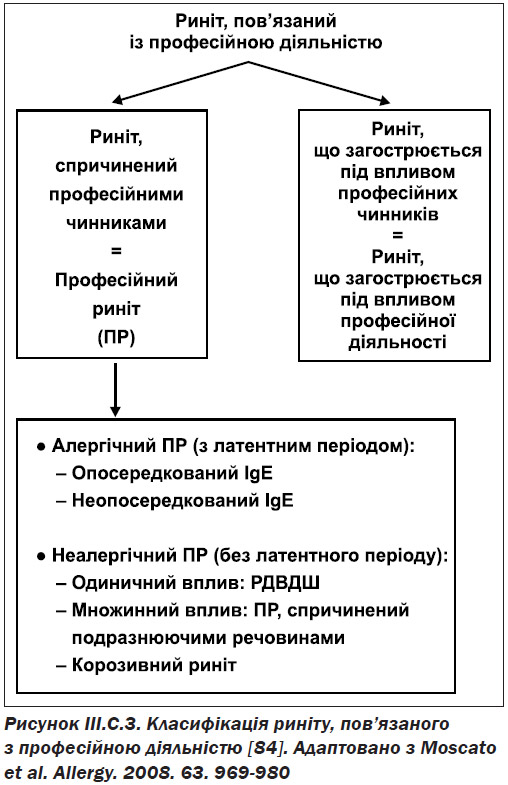
III.С.3. Професійний риніт
Професійний риніт — це запалення слизової оболонки, яке характеризується запальним станом слизової носа, чханням, ринореєю. Професійний риніт — запальний стан слизової оболонки носа, якому притаманна періодична або стійка закладеність носа, чхання, ринорея, свербіння та/або гіперсекреція внаслідок впливу факторів на робочому місці, а не факторів, що діють поза робочим місцем [84]. Професійний риніт є формою «пов’язаного з роботою риніту», що також включає провокований професійною діяльністю риніт, що являє собою передчасний або супутній риніт, який погіршується внаслідок впливу робочого місця [84, 85] (рис. III.C.3).
Професійний риніт може бути алергічним, обумовленим наявністю сенсибілізуючої дії високомолекулярної (high-molecular — HMW) або низькомолекулярної сполуки, що діє шляхом включення імунологічних механізмів і характеризується латентним періодом між початком експозиції і розвитком симптомів риніту.
З іншого боку, професійний риніт може бути викликаний неалергічним, опосередкованим, подразнюючим чи неімунологічним механізмами. Симптоми з’являються після одноразового або множинного впливу подразнюючих сполук і зазвичай виникають без латентного періоду. Неалергічний професійний риніт, спричинений одноразовим впливом дуже високої концентрації подразників, також називають синдромом реактивної дисфункції верхніх дихальних шляхів (РДВДШ) (reactive upper airways dysfunction syndrome — RUDS). Найбільш тяжкими формами є індуковані іритантами корозивні риніти, яким притаманне постійне запалення слизової носа, часом асоційованої з утворенням виразок і перфорацією носової перегородки [84, 85].
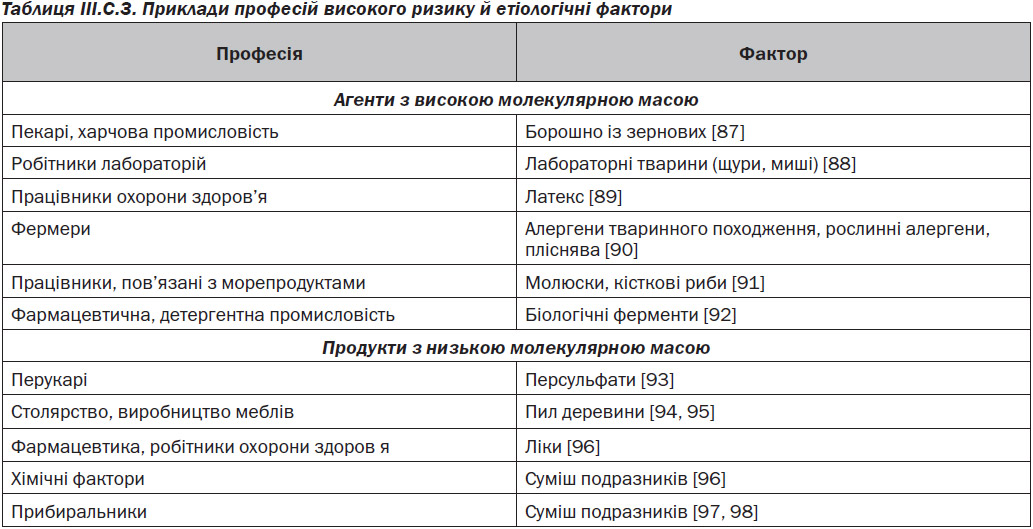
Результати перехресних досліджень у професійних групах демонструють широкий діапазон поширеності професійних ринітів (3–87 %) [86], а також більш низьку поширеність дії LMW-агентів проти більш високої поширеності експозиції HMW-агентів. Приклади професій з високим ризиком наведені у табл. III.C.3 [87–98]. Професійний риніт внаслідок дії HMW-агентів зустрічався у 3 рази частіше, ніж професійна астма [86], з якою він був часто асоційований (до 92 % випадків) [99].
Професійний риніт і професійна астма мають подібну етіологію і патогенез [100], тому можуть розглядатись у більш широких контекстних рамках уніфікованої моделі захворювань дихальних шляхів (Unified Airway Disease Model) [85, 93, 101, 102]. Тяжкість професійного риніту також може вплинути на тяжкість професійної астми [103]. У значної частині (20–78 %) працівників, які зазнають впливу сенсибілізаторів, пов’язані з роботою назальні симптоми, як правило, передують на 5–6 місяців появі бронхіальних симптомів [84, 86]. Отже, професійний риніт може розглядатися як маркер імовірного розвитку професійної астми.
Клінічні прояви професійного риніту неспецифічні. Носові симптоми не відрізняються від тих, що спостерігаються при непрофесійному риніті. Професійне походження слід підозрювати при всіх нових випадках риніту у дорослих, особливо у тих, хто зайнятий на роботах високого ризику (табл. III.C.3). Діагностична оцінка в першу чергу включає ретельний клінічний анамнез та професійну історію, спрямовану на визначення типу симптомів, пов’язаних із роботою, а також збирання інформації про вплив професійних факторів. Типові носові симптоми супроводжуються утворенням кірок, спорадичними носовими кровотечами, порушенням нюху і кон’юнктивітом, що пов’язані з фарингеальними, ларингеальними і бронхіальними симптомами (на які завжди слід звертати увагу). Наявність латентного періоду між дією професійного фактора і появою симптомів свідчить про алергічну природу захворювання.
Підозрілий анамнез із позитивним імунологічним тестом у випадку, що пов’язаний з професією обстеженого, може вважатися ймовірним випадком алергічного професійного риніту.
Остаточний діагноз підтверджують об’єктивною демонстрацією причинно-наслідкового зв’язку між ринітом і робочим середовищем із застосуванням назального провокаційного тесту (nasal provocation test — NPT) із підозрюваним агентом(-ами) в умовах лабораторії, що вважається золотим стандартом діагностики [84, 85]. Якщо NPT негативний, рекомендується додаткове оцінювання пов’язаних із роботою змін параметрів носа на робочому місці, особливо за наявності дуже переконливого анамнезу.
У суб’єктів, які зазнали впливу HMW-агентів із переконливим анамнезом та негативними імунологічними тестами, тип запальної реакції на NPT може продемонструвати наявність професійного локального алергічного риніту (ЛАР) (local allergic rhinitis) [106, 107]. Внаслідок тісного зв’язку між верхніми та нижніми дихальними шляхами також можуть бути виконані спірометрія, визначення неспецифічної чутливості дихальних шляхів і вимірювання запалення бронхів за допомогою дослідження видихуваного NO [84, 85].
Перше місце у лікуванні алергічного професійного риніту займає вилучення або зменшення дії причинно-значущого фактора [108]. Фармакологічне лікування не відрізняється від лікування непрофесійного риніту [101]. При алергічному професійному риніті, викликаному HMW-сенсибілізаторами, може бути запропонована специфічна імунотерапія, якщо доступні валідовані екстракти алергенів [109]. Профілактика і рання ідентифікація професійного риніту, медичний нагляд за вразливими працівниками та молодими учнями може забезпечити чудову можливість запобігти розвит-ку професійної астми [110, 111].
III.C.4. Хімічний риніт
Хімічний риніт часто потрапляє до категорії професійного риніту, однак існують хімічні фактори, які не обов’язково є професійними (і навпаки). Деякі хімічні речовини можуть викликати подразнення, що можуть проявлятися застійними явищами, ринореєю, дискомфортом у носі, постназальними виділеннями, головним болем та навіть носовими кровотечами [112]. Наявність факторів впливу хімічних агентів або їх експозиції є важливими елементами для вивчення анамнезу. Багато хімічних речовин тісно пов’язані з певними професіями, хоча є речовини, які діють вдома та поза роботою, і також під час спортивних вправ та дозвілля (наприклад, хлор-індуковані риніти у плавців [113]). Водорозчинні агенти, такі як аміак, формальдегід, діоксид сірки, можуть легко розчинятися у слизовій оболонці [114]. Ці реакції — не IgE-опосередковані, а є рефлекторною реакцією, яку часто називають ней-рогенним запаленням [115]. У частини осіб, в яких відзначаються виражені однократні реакції, у подальшому можуть розвинутися постійні прояви. Цей феномен був описаний, як RUDS, коли наявні тільки назальні симптоми або синдром реактивної дисфункції дихальних шляхів у тому випадку, коли є астмоподібні симптоми [116, 117].
Хоча хімікати не завжди вважаються сенсибілізаторами, деякі з цих сполук можуть викликати імунологічне захворювання. Хімічні речовини, відомі як чинники сенсибілізації респіраторних шляхів, включають диізоціанати, ангідриди кислот, деякі солі платини, реактивні барвники, глутаральдегід, олов’яні кислоти та хлорамін [118–120]. Дотепер існує багато суперечок щодо точного механізму підвищення чутливості до цих хімічних речовин. Проте менші хімічні сполуки мають зв’язуватися з більшими молекулами білка, щоб викликати імунну відповідь. Незважаючи на те, що спостерігається специфічна продукція IgE, викликана хімічними речовинами, які спричиняють респіраторну алергопатологію, є також обґрунтовані докази того, що можливі симптоми, пов’язані з хімічним впливом без супутнього підвищення IgE [121]. Цілком можливо, що ці висновки можуть бути пов’язані з неможливістю синтезу відповідних кон’югатів in vitro для виявлення сироваткового IgE, який зв’язує ці хімічні речовини [122, 123].
Як правило, диференцйна діагностика повинна включати АР і НАР, а також риніт змішаного генезу, періодичний гострий риносинусит (RARS) та потенційно CRS. Деякі симптоми хімічного риніту можуть бути подібні до АР. Повідомляється про виділення з носа, закладеність, чхання і свербіння. При хімічному чи АР можуть бути носові виділення з передніх чи/або задніх носових ходів, але зазвичай при будь-якому з цих діагнозів вони не однобічні.
Хімічно-індукований риніт може бути асоційованим з ольфакторною дисфункцією, як тимчасовою, так і тривалою. Зазначені розлади можуть включати гіпоосмію чи аносмію, а також дисосмію або аносмію (неможливість ідентифікувати запахи) [112]. Також інколи спостерігається назальний дискомфорт, виділення, закладеність, головний біль та інколи носові кровотечі [112].
III.C.5. Риніт, викликаний курінням
Дію тютюнового диму в навколишньому середовищі пов’язують із хронічним ринітом і в деяких випадках з АР [124, 125]. У кількох дослідженнях симптоми, про які повідомляли самі досліджувані, як правило, виникали під впливом диму та могли корелювати з умістом котиніну у сироватці крові [126–128]. Симптоми, що є загальними як для АР, так і для індукованого курінням риніту, включають ринорею і застій, але, як видається, тютюновий дим не викликає риніт, обумовлений IgE-опосередкованою гіперчутливістю (яка зазвичай виявляє поєднання закладеності, ринореї та чхання під впливом певного алергену).
Оскільки симптоми АР є імунологічно-опосередкованими, то у пацієнта наявний період сенсибілізації при експозиції речовини, що викликає симптоми. І навпаки, риніт, викликаний тютюновим димом, зазвичай не потребує сенсибілізації, хоча було повідомлено про вірогідно алергізуючі сполуки у димі [129].
Цікаво, що хоча активні курці, ймовірно, мають підвищений рівень IgE у сироватці крові, вони проявляють нижчу реакцію шкіри на алерген, ніж алергізовані некурці [130]. На відміну від АР індукований тютюновим димом риніт, імовірно, є поліетіологічним, тобто й інші механізми, такі як нейрогенні або іритантні, відіграють більш значну роль [131, 132]. Нейрогенне запалення носа опосередковується нейропептидами, такими як речовина Р, нейрокінін А і пептид, пов’язаний з генами кальцитоніну. Ці медіатори вивільняються чутливими нервовими волокнами в носі і призводять до вазодилатації, набряку та запалення [133]. Пацієнти, які реагують на вплив тютюну, ідентифікуються суб’єктивними (застій, ринорея, чхання) й об’єктивними ознаками (підвищення резистентності носа) до контрольованої дії тютюнового диму. У проспективному дослідженні пацієнтів визначали показову реактивність, якщо резистентність носа за даними акустичної ринометрії збільшувалась на понад 35 % у відповідь на дію тютюнового диму. Пацієнти з меншим ніж 5 % підвищенням носової резистентності визначались як нереактивні [131]. Додатково були продемонстровані порушення мукоциліарного кліренсу (МЦК) (mucociliary clearance), спричинені виявленням тютюнового диму. Застійні реакції спостерігались у відповідь як на короткочасний, так і на тривалий вплив тютюнового диму. В осіб, які повідомляли про індивідуальний ризик риніту, викликаного димом, коротка дія диму (45 частин на мільйон протягом 15 хвилин) призводила до підвищення опірності носа, що була визначена при проведенні задньої ринометрії.
В осіб з індукованим димом ринітом в анамнезі та без такого тривалий вплив помірного рівня диму (15 частинок на мільйон протягом 2 годин) також викликав застійну реакцію упродовж години або довше [134]. Незважаючи на те, що об’єктивна відповідь була нетривалою, пацієнти повідомили про довготермінові симптоми від години до кількох днів після впливу подразника.
З огляду на спільність низки важливих симптомів ретельний аналіз анамнезу та алергологічні тести допомагають диференціювати риніт, викликаний табачним димом, від АР (див. розділ VI.E. «Тютюновий дим»).
III.C.6. Інфекційні риніти
Інфекційні риніти розподіляються на гострі та хронічні форми бактеріальної чи вірусної етіології. Клінічні дані та тривалість симптомів відіграють важливу роль у диференціації різних форм риніту. Включно інфекційний, алергічний риніти і запалення при них пов’язані з хронічним риносинусітом (ХРС). До симптомів, які свідчать про неінфекційну природу риніту, відносять свербіння в носі і чхання. Тоді як наявність запалення слизової оболонки і ринорея можуть бути присутні при інфекційних і неінфекційних ринітах [26]. Окремо виявлена темна, або гнійна, ринорея, не патогномонічна для бактеріального риніту/риносинуситу.
Додаткові дані, що свідчать про інфекційну етіологію, включають супутнє запалення гортані і шийну лімфаденопатію [135].
Вірусні риніти переважно мають гострий перебіг і становлять до 98 % ринітів у дітей молодшого віку. Частота вірусного риніту у маленьких дітей становить 6 епізодів на рік [136]. Частота вірусних ринітів у дорослих дорівнює 2–3 епізодам захворювання на рік. Симптоми, асоційовані з вірусними ринітами, — це прозора ринорея, закладеність носа і часта лихоманка.
Етіологічними чинниками вірусних ринітів можуть бути риновіруси, віруси грипу і парагрипу [81]. Більшість вірусних ринітів самовиліковуються протягом 4–5 днів. Пролонгація симптомів понад двох тижнів свідчить про неінфекційну етіологію чи приєднання бактеріальної інфекції. Більш активно пацієнтів слід лікувати у випадках, коли тривалість риніту перевищує 10 днів, що відбувається через інфекційні ускладнення (інфекційні ускладнення можливі внаслідок приєднання бактеріального риносинуситу) [137]. Приблизно 2 % випадків вірусних ринітів виникають при вторинному інфікуванні бактеріями, такими як Streptococcus pneumoniae, Haemophilus influenzaе і Moraxella catarrhalis, що викликають прояви гострої бактеріальної інфекції [138].
III.C.7. Риніти вагітних та гормонально-індуковані –риніти
У вагітних жінок виникає специфічний різновид ринітів, який відносять до ринітів вагітних, або ринітів вагітності. Вони виникають під час близько 22 % вагітностей [139], і хоча можуть виникати у будь-який час, але в типових випадках вони з’являються на другому місяці вагітності і найбільш тяжкі у другому триместрі [26, 140]. Риніт вагітності визначають як закладеність носа, виявлену в останні 6 або більше тижнів вагітності, без інших ознак інфекції респіраторних шляхів або дії алергізуючих факторів, після чого симптоми спонтанно зникають протягом 2 тижнів після пологів [141].
Симптоми (ринорея, закладеність носа) нагадують алергічний риніт, можуть бути значними і тривалими. В анамнезі часто виявляється попереднє захворювання на хронічний риніт, що нівелює роль вагітності як етіологічного чи обтяжуючого чинника [139]. Крім того, наявний АР може загостритися приблизно у третини вагітних жінок [142].
Існують потенційно тяжкі етіологічні фактори, пов’язані з назальними симптомами при ринітах вагітних. Вважають, що у патогенезі задіяні гормональні зміни, такі як підвищення рівня прогестерону, естрогену, пролактину, вазоактивний інтестинальний пептид і/або плацентарний гормон росту, але ці теорії мають незначну кількість доказів [145].
Інші фізіологічні явища, що виникають під час вагітності, можуть сприяти збільшенню закладеності або порушенню прохідності носа. Вони включають вазодилацію, релаксацію гладкої мускулатури, викликану прогестероном, і значне розширення об’єму циркулюючої крові, що може сприяти збільшенню наповнення носових судин [146].
Риніти вагітності, як правило, не потребують терапії, а також недостатньо реагують на стандартні протиалергічні препарати. Їх лікування ускладняється відсутністю високоякісних досліджень ефективності лікування та його впливу на плід. Тим, хто звертається за лікуванням, пропонують консервативні нефармакологічні заходи. Вони можуть включати підвищене розташування головного кінця ліжка [147], застосування носових розширювальних смужок [148] і спеціальні вправи [149, 150].
Показано, що сольове промивання з використанням гіпертонічного фізіологічного розчину ефективне і не має очевидного шкідливого впливу на плід [151]. При риніті вагітності вивчалось декілька лікарських засобів, у тому числі INCS, але не було продемонструвано їх чіткого ефекту [152]. Раніше у систематичному огляді Kumar et al. [153] визначив лише 1 РКД, яке не показало будь-яких переваг у використанні флутиказону порівняно з плацебо для контролю симптомів у даній групі пацієнтів.
Незважаючи на те, що широке обговорення проблеми риніту в аспекті риніту вагітних виходило за рамки цього документа, використання різних інших лікарських засобів (тобто топічних та пероральних деконгестантів) є суперечливим і має розглядатися на рівні окремих пацієнтів при тісному залученні акушерів. Пряма стимуляція естрогенами слизової носа може викликати гіперактивність слизових залоз/ринорею [154]. Таким чином, назальні симптоми можуть бути пов’язані з іншими станами, крім вагітності, що впливають на гормональну рівновагу, наприклад з гіпотиреозом та акромегалією [155].
Риніт також може виникнути внаслідок змін вмісту гормонів у крові протягом пубертатного періоду, менструації та перименопаузальних років [145]. Хоча оральні контрацептиви також були визнані як причини назальних симптомів, дослідження Wolstenholme et al. [156] не виявило носових симптомів у пацієнтів, які отримували лікування оральними контрацептивами.
Підсумовуючи, відзначимо, що є численні метаболічні стани із симптомами, подібними до АР. Точний діагноз може бути встановлено на основі анамнезу і проявів хвороби, але додаткові дослідження є необхідними за наявності стійких і тяжких симптомів.
III.C.8. Риніти, викликані харчовими продуктами і– алкоголем
Риніти, викликані харчовими продуктами. Певні харчові продукти можуть призвести до розвитку риніту, але вони не характеризуються як стан алергії. Наприклад, в осіб із смаковим ринітом, незабаром після прийому гострої або пряної їжі виникає однобічна чи двобічна водяниста ринорея, з’являється закладеність носа, свербіж або біль в обличчі. Це вважається віддаленою реакцією внаслідок адренергічної і холінергічної нейрогенної реакції носа [157].
Поширеність викликаного харчовими продуктами риніту менше 1 % [157]. Взагалі, риніт часто може розглядатись, як частина системної IgE-опосередкованої харчової алергічної реакції і рідко є поодиноким симптомом. У подвійному сліпому плацебо-контрольованому дослідженні 480 дітей, 185 (39 %) з яких мали ознаки інфекції очей та верхніх дихальних шляхів, тільки 5 % симптомів були пов’язані лише з верхніми дихальними шляхами [158]. Пацієнти із синдромом пилково-харчової алергії (ПХАС) (pollen-food allergy syndrome — PFAS), який також називають оральним алергічним синдромом (ОАС) (oral allergy syndrome — OAS), часто страждали від орофарингеального та/чи легкого припухання губ, язика, піднебіння і глотки і менш часто від симптомів АР після вживання звичайних сирих фруктів та овочів. Орієнтовна поширеність цього стану становить від 5 до 17 %, і від нього страждає до половини пацієнтів з алергією на пилок [159–161].
Цей стан трапляється в осіб, які сенсибілізовані до пилкових аероалергенів, що діють через дихальні шляхи, які потім схильні до розвитку клінічних симптомів PFAS після прийому перехресно-реактивних, термолабільних похідних харчових білків рослинного походження. Оскільки антигени термолабільні, пацієнти, як правило, можуть переносити термічно оброблені форми причинно-значущих фруктів та овочів [162] (див. розділ X «Харчова алергія і пилково-харчовий синдром (ПХС)» для додаткової інформації з цього питання).
Риніти, викликані алкоголем. Назальні симптоми можуть також зустрічатись після вживання алкоголю [163, 164]. Проте дуже мало відомо про поширеність і прояви алкоголь-індукованих назальних симптомів. Крім того, недостатньо інформації про зв’язок між алкоголь-індукованими гострими симптомами та іншими захворюваннями, такими як АР, поліпоз носа, астма та інші хронічні захворювання нижніх дихальних шляхів [165].
Респіраторні симптоми переважно викликаються інгаляційними речовинами, які контактують зі слизовою оболонкою. Проте цей механізм може не діяти при деяких формах риніту та астми. Приклад одного з таких захворювань — алкоголь-індукована астма. Особливо часто червоні і білі вина можуть бути пусковим механізмом виникнення бронхіальних симптомів [163, 166, 167]. Алкоголь-індуковані назальні симптоми вдвічі частіше зустрічаються у жінок, ніж у чоловіків [165], але причина такої схильності не відома [168–170]. Провідним симптомом є закладеність носа, а червоне вино найбільш частий чинник, який викликає симптоми. Крім того, вино, особливо червоне, також є найбільш широко визнаним тригером алкоголь-індукованих бронхіальних симптомів [163].
Нарешті, пряме вживання алкоголю також було пов’язане з тенденцією до розвитку позитивної реакції при проведенні шкірного прик-тесту (SPT) [171] із підвищенням загального рівня IgE (tIgE) [172].
III.C.9. Неалергічний риніт з еозинофільним синдромом (НАРЕС)
Неалергічний риніт з еозинофільним синдромом (НАРЕС) — клінічний розлад, що складається з симптомів, які відповідають ПАР, при якому була доведена відсутність ознак атопії, але з еозинофілією при цитологічному дослідженні носа [173].
Патофізіологія НАРЕС добре не з’ясована, але ключові ланки включають еозинофілію, запалення, що самопідтримується, і неспецифічне вивільнення гістаміну. Це найпоширеніший вид запального НАР. Його було описано в 1981 році Джейкобсом та ін. [174]. У пацієнтів з НАРЕС виявляються характерні симптоми риніту, хоча і частіше більш виражені, ніж симптоми при ЦАР. Ці симптоми включають закладеність носа, профузну водянисту ринорею, чхання, назальний і очний свербіж. Відома особливість, що не характерна для АР, — це аносмія, яка часто зустрічається у пацієнтів з НАРЕС [175]. НАРЕС діагностується ретельним збором анамнезу, з’ясуванням результатів фізикального огляду (блідість, хронічний нежить (boggy turbinates), подібний до такого в пацієнтів ЦАР), а також негативні алергологічні тести in vivo або іn vitro.
Цитологічне дослідження при НАРЕС показує присутність у назальному мазку значної еозинофілії, звичайно від 10 до 20 % [173]. Запропоновані окремими дослідниками критерії включають наявність понад 25 % еозинофілів [176]. Крім цього, при назальній біопсії у цих пацієнтів звичайно відзначаються підвищення кількості і виражена дегрануляція мастоцитів [177, 178].
Дослідження доводять роль хронічного запалення в розвитку НАРЕС. Незважаючи на те, що до сих пір бракує повного розуміння патофізіологічного підґрунтя, дослідження показали підвищення транс–ендотеліальної міграції еозинофілів, залучених і активованих цитокінами і цитокінінами [179, 180]. Зокрема, НАРЕС характеризується підвищеним вмістом триптази у носовій рідині (також і у пацієнтів з ЦАР) та еозинофільного катіонного протеїну (ЕКП, ECP) (помітно збільшений винятково при НАРЕС) [181].
Крім того, збільшення Th2 цитокінів (інтерлейкін (IL)-6 та ІЛ-17), вірогідно є фактором у процесі ремоделювання, що виявлено при НАРЕС [182]. Інші прозапальні хемокіни, які відіграють роль у хемотаксисі й інфільтрації еозинофілів та фільтрації, включають макрофагальний/моноцитарний хемоатрактантний білок ММХП-1, що регулюється при активації нормальних експресованих та секретованих Т-клітин (НЕКСТ). Підвищені концентрації НЕКСТ були виявлені в назальній рідині пацієнтів з ЦАР і НАРЕС [183]. Нещодавно Peric et al. [184] показали кореляцію між концентрацією НЕКСТ з назальними симптомами і кількістю еозинофілів у пацієнтів з ЦАР. Проте рівні ММХП-1 та НЕКСТ були значно вищими у носовій рідині при НАРЕС порівняно з особами з ЦАР, які знову ж таки співвідносяться з проявами носових симптомів та щільністю еозинофілії у цих
пацієнтів.
Нервові дисфункції також були описані як фактор, що сприяє проявам симптоматики НАРЕС [185]. НАРЕС звичайно зустрічається ізольовано, але може бути пов’язаним з аспірин-обумовленою респіраторною хворобою (АОРХ) (aspirin-exacerbated respiratory disease — AERD), для якої притаманні астма, поліпи носа і непереносимість НПЗП [173]. НАРЕС також визначено як фактор ризику виникнення або посилення обструктивного апное сну (ОАС, OSA) [186].
Лікування НАР фокусується на їх основних причинах. НАР, при яких при клінічному обстеженні та цитологічно виявляються запальні зміни, лікуються переважно аерозолями ІНКС [154]. Відомо, що за цього методу лікування підвищується хемотаксис нейтрофілів та еозинофілів, знижується вивільнення медіаторів мастоцитами і базофілами, що призводить до зменшення набряку слизової оболонки і місцевих проявів запалення [187].
Інтраназальний антигістамінний засіб азеластин, схвалений Адміністрацією США з виробництва продуктів харчування та ліків (FDA U.S. Food and Drug Administration), затверджений для лікування як АР, так і НАР. Клінічні дослідження показали, що азеластин знижує симптоми риніту, включаючи постназальний дренаж, чхання, ринорею та застій в носі [188]. Проте під час багатоцентрових плацебо-контрольованих досліджень азеластин вивчали при лікуванні вазомоторного риніту (неалергічної ринопатії), а не конкретно при НАРЕС.
III.C.10. Вазомоторний риніт (неалергічна ринопатія)
Вазомоторний риніт — одна з найбільш частих причин НАР, яка виявляється у 71 % випадків [189–191]. Відсутність IgE-опосередкованої імунної відповіді відрізняє вазомоторний риніт від алергічних форм риніту [101]. Рекомендується заміщати термін «вазомоторний риніт» терміном «неалергічна ринопатія», оскільки запалення вважається важливою ланкою неалергічної ринопатії.
В Європі для характеристики цього стану застосовується визначення «ідіопатичний риніт». Неалергічна ринопатія — це діагноз виключення, і тому інші етіологічні фактори ринопатії мають бути враховані. Вони включають ХРС, НАРЕС, ВАРЗ, інфекційний риніт, анатомічні аномалії, РМ, побічні дії ліків, витік цереброспінальної рідини і риніт вагітних.
Клінічні ознаки неалергічної ринопатії були узагальнені в консенснусній статті Kaliner et al. [40]. Неалергічна ринопатія являє собою хронічне захворювання з первинними симптомами у вигляді ринореї. Супутні симптоми — це закладеність носа, постназальне затікання без кислотного рефлюксу, очищення глотки, кашель. Також можуть бути наявні дисфункція євстахієвої труби, чихання, гіпоосмія, відчуття тиску на обличчя/головний біль з неалергічною ринопатією. Ці симптоми можуть бути цілорічні, персистуючі чи сезонні і типово викликаються певними чинниками, такими як холодне повітря, кліматичні зміни (наприклад, температура, вологість, барометричний тиск), сильні запахи, тютюновий дим, коливання рівня статевих гормонів, забруднювачі оточуючого середовища, фізичні вправи і алкоголь. Незважаючи на частий тісний зв’язок з алергічною ринопатією, відсутність визначеного тригера не виключає цей діагноз.
Крім цього, гіперактивність носа у відповідь на неспецифічні стимули може зустрічатись як при алергічному, так і неалергічному риніті [192]. Перш за все неалергічна ринопатія первинно зустрічається у дорослих із співвідношенням жінок до чоловіків з коливанням від 2 : 1 до 3 : 1.
При фізикальному дослідженні слизова носа має нормальний вигляд, але можуть зустрічатись ознаки гіперемії чи прозора ринорея. Зазвичай достатньо системних алерготестів (шкірних чи in vitro) для диференціації АР та неалергічної ринопатії. Діагноз ЛАР може розглядатися в умовах негативного системного тестування. Особи з ЛАР під дією алергенів страждають від типових алергічних симптомів, але в них відсутня системна IgE-сенсибілізація. Для виключення цього діагнозу необхідний локальний провокаційний тест з алергенами [193, 194]. Незважаючи на те, що точна патофізіологія неалергічної ринопатії залишається не повністю визначеною, вважається, що нейросенсорні порушення відіграють вирішальну роль [40].
Протягом попереднього вивчення центральних реакцій на ольфакторні (нюхові) стимули суб’єкти з неалергічною ринопатією були піддані функціональній магнітно-резонансній томографії під впливом різних ароматів (ванільного та диму пекану). Дослідження показали підвищення кровообігу в ольфакторних ділянках кори, що призвело до виникнення припущення про порушення нервових реакцій при неалергічній ринопатії [195, 196]. Пацієнти з неалергічною ринопатією і переважними проявами у вигляді ринореї частіше реагують на лікування інтраназальними антихолінергічними засобами, такими як іпратропію бромід.
III.C.11. Риніти, пов’язані з віком
Вікові зміни виникають у всіх органах, включаючи респіраторну систему. Конкретно у носовій порожнині патофізіологічні процеси старіння викликають –нервові, гормональні, слизові, ольфакторні і тканинні пошкодження старіючого носа [197, 198]. Це робить старшу частину населення більш вразливою до таких симптомів, як ринорея, закладення носа, постназальне стікання, сухість носа, кірки в носі і послаблення нюху [199, 200]. У недавній публікації Del Gaudio та Panella [201] розглянуто літературу, що стосується інтраназальних проявів старіючого носа, які вони називають presby nasalis.
Пов’язана з віком ринорея. Риніти людей похилого віку (тобто «вологий ніс» чи «стареча ринорея») добре вивчені. Rodriguez et al. [202] за допомогою опитування довели, що частота прозорої ринореї зростає з віком. Результати свідчать про те, що тільки 33 % респондентів молодшого віку регулярно відзначали чисті виділення з передніх відділів носа (n = 76, середній вік 19 років). У групі старшого віку регулярні виділення відзначали до 74 % осіб (n = 82, середній вік 86 років).
Фізіологічна причина збільшення ринореї з віком не повністю з’ясована. Проте відомо, що з віком α- і β-рецептори стають менш чутливими, а функції автономної нервової системи знижуються, що призводить до дисбалансу симпатичного та парасимпатичного тонусу [202–204]. Цілком можливо, що зниження симпатичного тонусу при незміненій парасимпатичній стимуляції призводить до збільшення активності залоз у носовій порожнині і збільшення носового дренажу [202, 205]. Цей механізм подібний тому, що спостерігається при вазомоторних ринітах, неалергічних ринопатіях, коли автономна відповідь на звичайні стимулятори викликає розширення носових судин і підвищення активності слизових залоз, що призводить до гіперсекреції і виділень з носа [206].
Вазомоторні риніти/неалергічні ринопатії — найбільш частий тип НАР [205], який найчастіше зустрічається у людей старшого віку [144, 189, 200, 207]. Це може свідчити про дисрегуляцію автономної нервової системи як причини підвищення ринореї у людей похилого віку.
Пов’язана з віком назальна обструкція і закладеність (конгестія). Фактори, які сприяють посиленню обструкції/закладеності старіючого носа, включають потовщення слизової (вторинні до зменшення вмісту води в організмі) [208–210], перешкоджання потоку повітря (вторинні щодо структурних змін), які виникають внаслідок втрати еластичності носового хряща і підтримки кінчика носа [198, 200, 210], вторинний застій слизу внаслідок меншої ефективності мукоциліарного кліренсу [200, 209].
Ho et al. [211] продемонстрували зниження протягом життя МЦК у 90 здорових осіб віком від 11 до 90 років. Суб’єкти віком старше 40 років мали меншу частоту циліарних рухів, збільшилися розлади мікротрубочок, а також довший час МЦК при тестуванні сахарином. Згущення слизу та менш ефективна система МЦК також можуть призвести до постназального капання з носа, що є звичайною назальної скаргою на слизові оболонки у людей похилого віку [200].
Ще одним чинником, який сприяє обструкції носа/закладеності в літньому віці, є вікові зміни центральної нервової системи, які впливають на фізіологічний носовий цикл [208, 212]. Mirza та ін. [229] вимірювали відносний потік повітря у 6 носових порожнинах з 15-хвилинними інтервалами протягом 6 годин у 4 різних вікових групах (n = 60) за допомогою рідкокристалічної термографії. Вони встановили, що кількість осіб, які зберігають нормальний назальний цикл, зменшується з віком, і найнижчий він у віковій групі від 70 до 85 років.
Пов’язані з віком сухість і кіркоутворення. Сухість носа і кіркоутворення найбільш часто зустрічаються серед людей старшого віку. Напевно, це пов’язано з віковими змінами слизової носа [199], зниженням кровотоку в слизовій і посиленням атрофії епітелію [213]. Schrodter et al. [214] оцінювали зразки слизової оболонки носа середніх носових ходів 40 здорових пацієнтів віком від 5 до 75 років та встановили вікове збільшення атрофічного епітелію та потовщення базальних мембран у пацієнтів старше 40 років. Сухість носа серед старших людей також може бути викликана зниженням внутрішньоносової температури і вологості [200].
Lindemann et al. [199] оцінювали ці значення у здорових пацієнтів і виявили, що вони значно нижчі у літніх пацієнтів (віком від 61 до 84 років), ніж у молодих пацієнтів (віком від 20 до 40 років). Автори пояснювали цю різницю збільшенням інтраназального об’єму (ІНО) (intranasal volume) і виникненням вікової атрофії слизової оболонки носа, при цьому ІНО вимірювався мінімальними ділянками поперечного перерізу та об’ємом кожної носової порожнини. Збільшення ІНО з віком також було продемонстровано Loftus та співавт. [215] з використанням 3D-аналізу комп’ютерної томографії (КТ) при скануванні осіб без синоназальної патології. Середній показник ІНО становив 15,73 мл у віці від 20 до 30 років (n = 22), 17,30 мл — групі віком від 40 до 50 років (n = 20) та 18,38 мл — групі понад 70 років (n = 20).
Алергічний риніт у людей похилого віку. Незважаючи на те, що у людей похилого віку поєднуються віковий риніт та АР і рекомендується лікування ІНКС [210–216], основні фізіологічні зміни є зовсім різними. АР — це IgE-опосередкована реакція гіперчутливості [217, 218], у той час як при віковому риніті алергія та алергени не відіграють ролі у симптомах та фізіологічних змінах. Проте було показано, що старіння не зменшує поширеності АР і що АР у людей похилого віку, ймовірно, недостатньо діагностується, тому можливість АР слід враховувати при діагностиці нових назальних симптомів у літньому віці [210].
III.C.12. Синдром «порожнього носа» й атрофічний риніт
Термін «синдром порожнього носа» (СПН) запронований вперше Kern та Stenkvist в 1994 році для описання порожнього простору в ділянці нижніх і середніх носових раковин на КТ-зображеннях пацієнтів, які перенесли часткове або загальне видалення нижньої і середньої раковини [219]. Сьогодні СПН визначається як зміни верхніх дихальних шляхів, що характеризуються порушенням відчуття повітряного потоку в носі і часто включає втрату тканин внаслідок хірургічних втручань на носі.
СПН щонайменше поділяється на 3 підтипи: СПН нижньої раковини, СПН середньої раковини, СПН обоїх раковин, які класифікуються на основі втрати тканин [219]. Найпоширеніший тип— СПН нижньої раковини [220]. Четвертий підтип — це такий різновид, коли у пацієнта є достатньо тканин носа, але у нього спостерігаються післяопераційні симптоми, що впливають на поверхню слизової оболонки носових раковин. СПН звичайно виникає після хірургічного втручання на носових раковинах. Більшість випадків хірургічних втручань на носових раковинах має успішний результат, коли СПН формується після незначного відсотка синоназальних втручань [221, 222]. Найчастіше СПН зустрічається після тотального висічення носових раковин, але і після менших процедур, таких як підшкірне видалення або резекція, лазерної терапії та кріохірургії [223].
Пацієнти часто скаржаться на сухість та кірки, хоча типова скарга цих пацієнтів із СПН — парадоксальна закладеність носа, яка може бути настільки тяжкою, що вони відчувають задуху [223]. Недавні дослідження підтвердили, що первинний фізіологічний механізм, який створює відчуття достатнього носового потоку повітря, — це активація трійчастих холодових терморецепторів, а саме TRPM8, через охолодження слизової носа [224–228]. Окрім зміни повітряного потоку та зменшення площі поверхні, порушення в нейросенсорних системах, імовірно, відіграють важливу роль у патологічних відчуттях пацієнтів із СПН. Резекція раковин не тільки видаляє слизову оболонку носа, а отже, і терморецептори, які реагують на повітряний потік; така операція спричинює ушкодження нервів, що при неправильному загоєнні призводить до неможливості повернення до нормального фізіологічного стану [221]. Різниця у відновленні нервів після операції може пояснити, чому лише у деяких пацієнтів формується СПН, незважаючи на однакові хірургічні втручання на раковинах.
Дійсно, деякі хірурги виявляють пацієнтів з однобічними симптомами СПН, тоді як їх чутливість здорової сторони виглядає як дзеркальне відтворення з огляду на відсутність тканин нижньої частини раковини. Діагноз базується на анамнезі, фізикальному дослідженні та «шовковому тесті», коли частинка злегка зволоженого шовку на 10–30 хвилин розміщується у носовій порожнині, дає полегшення симптомів і підтверджує діагноз [223].
Слід мати на увазі й інші стани, які можуть супроводжуватись сухістю носа і кіркоутворенням (такі як атрофічний риніт, саркоїдоз, інші). Доведена ефективність опитувальника з 6 питань на виявлення СПН [229]. Хірургічне розширення слизової оболонки внутрішньої слизової носа часто призводить до полегшення стану пацієнтів [223]. Також повідомлялося, що у пацієнтів з СПН (синдром «порожнього носа») переважно спостерігаються депресія та тривожність [230].
Атрофічний риніт
Атрофічний риніт — це хронічний дегенеративний стан, який характеризується запаленням і атрофією назальної та параназальної слизової оболонки [231]. Атрофічний риніт має первинно затяжний перебіг. Він виникає спонтанно і має невстановлену етіологію, але також може бути пов’язаний з бактеріальною інфек-
цією. Дослідження 45 пацієнтів, у яких було діагностовано первинно атрофічний риніт, показало, що у всіх з них була виявлена Klebsiella ozaenae [231]. Пошкодження слизової носа також може бути пов’язане з тривалими мікроваскулярними або ішемічними пошкодженнями [231–233].
Вторинний атрофічний риніт набагато більш поширений і зазвичай розвивається внаслідок прямого пошкодження, внаслідок травми, опромінення, редуктивного хірургічного втручання на носі або синусах, або при деяких рідкісних гранулематозних захворюваннях [231, 234]. Вторинний атрофічний риніт також пов’язаний з бактеріальною інфекцією. Найбільш частими патогенами є Staphylococcus aureus, Proteus mirabilis та Escherichia coli, але Klebsiella ozaenae виділяється рідко [231].
Атрофічний риніт проявляється товстими, міцно прикріпленими носовими кірками, закладеністю носа з неприємним запахом й атрофією поверхні слизової оболонки та носової раковини, при тяжких випадках, коли має місце повна відсутність впізнаваних анатомічних орієнтирів, — перфорацією перегородки або деформацією сідла носа [231–233]. Також зустрічається гіпоосмія, носові кровотечі і біль чи відчуття тиску у ділянці обличчя. При гістологічному дослідженні внутрішньоносових тканин при обох типах атрофічного риніту спостерігається скваматозна метаплазія, атрофія залоз та дифузний облітеруючий ендартеріїт [231]. Діагноз ґрунтується на клінічному дослідженні, даних біопсії носа і бактеріологічного дослідження на асоційовані бактерії.
Пацієнти з обома варіантами атрофічного риніту і з СПН скаржаться на закладеність носа. У пацієнтів з атрофічним ринітом часто це є наслідком значної кількості носових кірок, хоча, оскільки хвороба прогресує і втрачаються слизова оболонка та тканини носових раковин, стан розширеної носової порожнини може дуже нагадувати стан пацієнта з СПН. Патофізіологія парадоксального відчуття закладеності носа з цієї точки зору однакова при обох захворюваннях, однак причини цього феномена відрізняються. У літературі СПН неодноразово помилково описувався як форма або різновид атрофічного риніту. СПН виникає внаслідок ятрогенного видалення тканини носової раковини і не пов’язаний з бактеріальною інфекцією, тоді як атрофічний риніт є результатом хронічного, часто ідіопатичного запального процесу, пов’язаного з бактеріальною інфекцією, яка прогресує аж до розчинення тканини раковини.
Пацієнти з атрофічним ринітом страждають від потужного кіркоутворення, тоді як у пацієнтів з атрофічним ринітом і СПН не спостерігається кіркоутворення або воно незначне. Щоб диференціювати АР (алергічний риніт) від атрофічного риніту, слід зважати на те, що АР — це імунологічна реакція на алерген, що проявляється насамперед у вигляді запалення носа. АР є IgE-залежним станом [235] і характеризується чиханням, прозорою ринореєю, набряком носа й очей [1]. Цей стан чітко відрізняється від СПН та атрофічного риніту за клінічною картиною та патофізіологією.
III.C.13. Автоімунний, гранулематозний риніти і риніт при васкуліті
Верхні та нижні дихальні шляхи можуть бути уражені при системних захворюваннях, таких як васкуліти, гранулематоз і автоімунні захворювання. Звичайно в уражених пацієнтів можуть бути наявні неспецифічні симптоми (назальна обструкція, ринорея, біль у ділянці обличчя, відсутність сприйняття запахів), подібні до АР. Алергологічні тести, проте, негативні або клінічно не значущі. Клініцистам слід розглянути можливість розширення диференційної діагностики щодо системних причин, розглядати системну етіологію, якщо є кіркоутворення або рецидивуючі носові кровотечі [236].
Пероральні стероїди є основою лікування осіб, які обговорюються в цьому розділі, хоча недавнє впровадження моноклональних антитіл, орієнтованих на конкретні біомаркери, є важливим орієнтиром для майбутньої терапії.
Гранулематоз із поліангіїтом
Гранулематоз із поліангіїтом (ГПА) (granulomatosis with polyangiitis — GPA), що раніше називався хворобою Вегенера, — ідіопатичне захворювання, що характеризується некротичним та гранулематозним запаленням верхніх і нижніх дихальних шляхів (85 %), гломерулонефритом (75 %) і системним васкулітом [237–239].
Також можуть спостерігатися обмежені форми ГПА, що уражають лише ділянки голови і шиї. ГПА переважно уражає стінку артерій малого і середнього діаметра [240]. ГПА уражає в рівних пропорціях жінок і чоловіків та діагностується на четвертому — шостому десятиріччі життя [240]. Орієнтовна поширеність у США становить від 13 до 30 випадків на мільйон осіб за 5 років.
Назальні симптоми включають обструкцію, ринорею, рецидивуючі носові кровотечі, кірки та біль у дорсальній ділянці носа [237, 241]. Пошкодження слизової оболонки носа може призвести до аносмії, тоді як некроз тканин із вторинною інфекцією може призвести до какосмії [236]. Носова ендоскопія може виявити еритематозну, пухку слизову оболонку з кіркою і грануляцією, які спостерігаються в перегородці і нижній носовій раковині [240]. У пацієнтів із тяжкими формами захворювання може бути невузловий некроз, що спричиняє перфорацію або знищення кістки перегородки та/або інших назальних структур [242].
Діагноз ґрунтується на клінічних симптомах, результатах радіологічних досліджень, лабораторних даних (позитивний тест на антинуклеарні цитоплазматичні антитіла (АЦПА) (c-ANCA) у 60–90 % випадків) та біопсії ураженої тканини при патогістологічному обстеженні [237, 238, 240].
Профіль носового транскриптому АЦПА демонструє унікальні можливості експресії генів, пов’язаних із вродженим імунітетом, хемотаксисом запальних клітин, складом позаклітинної матриці та цілісністю епітеліальних бар’єрів, які можуть бути використані в клініці [243, 244]. Лікування включає преднізон, циклофосфамід і метотрексат [237, 238, 245]. Ефективною терапією рефрактерного або рецидивуючого васкуліту АЦПА можуть бути ритуксимаб, моноклональні антитіла [246], хоча необхідні додаткові дослідження.
Еозинофільний гранулематоз із поліангіїтом
Еозинофільний гранулематоз із поліангіїтом (ЕГПА) (eosinophilic granulomatosis with polyangiitis — EGPA), раніше відомий як синдром Churg — Strauss, є рідкісним васкулітом малих судин із поширеністю 1,3 випадку на 100 000 осіб [247], частіше діагностується у пацієнтів віком від 30 до 50 років [236].
Риніт (у 75 % пацієнтів) є одним із початкових проявів ЕГПА [248], на додаток до ХРСП (хронічний риносинусит із носовими поліпами (CRSwNP)), і супроводжується частковою/повною втратою нюху [249]. Діагноз має бути запідозрений у пацієнтів із астмою з підвищеною кількістю еозинофілів у периферичній крові (> 10 %) і легеневими проявами [238, 248]. ЕГПА часто поєднується з р-АЦПА (p-ANCA) [247].
ХРНП наявний приблизно у 50 % пацієнтів [238]. У пацієнтів рідше, ніж при ГПА, відзначається носовий біль з гнійними або кров’янистими виділеннями з носа, кірки в носі та перфорація [238, 250]. Лікування звичайно включає високі дози кортикостероїдів і імунодепресантів [248, 251]. Біологічна терапія анти-IL-5 (меполізумаб — mepolizumab) потенційно гарантує клінічне поліпшення і зниження потреби у кортико–стероїдах [252].
Саркоїдоз
Саркоїдоз — хронічне мультисистемне захворювання, що характеризується двосторонньою аденопатією коренів легень, легеневою інфільтрацією, ураженнями очей і шкіри [238, 253]. Найчастіше спостерігається у дорослих осіб молодого і середнього віку [254], у жінок частіше, ніж у чоловіків, і афро-американців [255]. Так, повідомляється про його поширеність — 50 випадків на 100 000 населення [236]. Залучення епітелію верхніх дихальних шляхів відбувається рідко [236], а носові симптоми неспецифічні: обструкція, носові кровотечі, болі у носі, сльозотеча та аносмія [237]. Найбільш характерні симптоми: гіперемія, набряк, припухлість, гіпертрофія слизових оболонок, носової перегородки та нижньої носової раковини.
При біопсії можуть бути ідентифіковані жовті вузли, що являють собою внутрішні гранульоми, а також можуть виявлятися поліпи носа, ринофіми та перфорація перегородки [238, 256]. Агресивні некасаїдні гранульоми можуть викликати ерозії твердого або м’якого піднебіння, перфорацію перегородок, що призводить до деформації сідла носа [257, 258].
Діагноз синоназального саркоїдозу встановлюють на підставі клінічних проявів із поліпоїдними змінами чи характерними жовтуватими підслизовими утвореннями [238]. Тканини для діагностики, як правило, отримують за допомогою трансбронхіально-легеневої біопсії, біопсії слизової носа, а також уражень шкіри, малих слинних залоз та лімфатичних вузлів [238]. Першою лінією лікування саркоїдозу є системні стероїди, хлорохін, імунодепресанти та трансплантація легені [237, 238, 256, 257]. Виникнення біологічної терапії посилило терапевтичні можливості лікування рефрактерних органів, яким загрожує саркоїдоз. Найбільш перспективними агентами є інфліксимаб із моноклональним анти-ФНП (фактором некрозу пухлини) [259].
Системний червоний вовчак
Системний червоний вовчак (СКВ) (systemic lupus erythematosus) — це автоімунне захворювання, яке може уражати будь-яку систему організму. СКВ переважно уражає жінок у співвідношенні 10 : 1 із частотою 5,6 випадку на 100 000 населення [260]. Шкіра носа і носової перегородки також можуть бути залучені у процес у формі шкірних висипань [237]. Ураження слизових спостерігаються у 9–18 % випадків. Найбільш часто пошкоджується оральна, назальна та фарингеальна слизові оболонки [260]. Діагноз потребує детального збору анамнезу, фізикального і лабораторного дослідження: антинуклеарні антитіла (anti-nuclear antibody — ANA) та антитіла до двоспіральної ДНК (anti-double-stranded DNA), розгорнутий аналіз крові, панель хімічних тестів, аналіз сечі [236, 261]. Призначається терапія кортикостероїдами, імуномодуляторами (прастерон, вітамін D, гідроксихлорокін) чи імунодепресантами (азатіоприн, циклофосфамід або мікофенолат) з метою контролю симптомів [238, 262]. Потенційно для лікування СКВ може застосовуватись недавно запропонований белімумаб (belimumab) (анти-BAFF (B-клітинний активний фактор) моноклональне антитіло) [263].
III.C.14. Риносинусити
Симптоми АР можуть збігатися із симптомами інших запальних станів, у тому числі риносинуситів. Важливо диференціювати АР та риносинусит, щоб встановити правильний діагноз і у подальшому проводити правильне лікування. АР може бути пов’язаний із супутнім риносинуситом, хоча питання, чи підвищує АР ризик розвитку риносинуситу, є дискусійним [1]. Діагностика супутнього риносинуситу є суттєвою для забезпечення належного лікування обох станів. Відзначимо, що ці стани не є взаємовиключними, і може існувати зв’язок між риносинуситом та АР. Можливо одночасно хворіти на АР та риносинусит. На цю імовірність слід зважати, коли пацієнти відповідають діагностичним критеріям обох захворювань або відповідь на лікування не відповідає єдиному діагнозу. Необхідний високий ступінь клінічної налаштованості; лише тоді ретельне врахування усіх факторів може допомогти клініцистам правильно встановлювати діагноз або діагнози.
Риносинусит — це широкий термін, який включає діагноз гострого риносинуситу (ГРС) (acute rhinosinusitis — ARS), RARS та CRS, відокремлюючи CRS із NP або CRS без поліпозу носа (CRSsNP). Симптоматика цих станів включає порушення прохідності і закладеність носа, тиск або біль в обличчі, передні або задні виділення з носа, аносмію/гіпосмію різної тривалості [1, 138]. АР має декілька перехресних симптомів, а саме ринорею та закладеність носа, які можуть бути переплутані з різновидами риносинуситу [264, 265]. І навпаки, риносинусит може бути переплутаний з АР через подібну симптоматику [1]. Розуміння діагностичних критеріїв різних варіантів риносинуситів допомагає клініцисту сформулювати правильний діагноз і також ідентифікувати супутні стани. ГРС (гострі риносинусити, ARS) діагностується при раптовій появі синоназальних симптомів, поєднаних із синоназальним запаленням, яке триває менше 4 тижнів [1, 137, 138, 266, 267].
Симптоми включають закладеність носа, обструкцію носа, виділення, відчуття тиску і болі в ділянці обличчя та аносмію/гіпосмію. Виділення з носа частіше бувають гнійними, але можуть бути і знебарвленими, частіше односторонніми, хоча можуть бути й двосторонніми [1, 138]. Відчуття тиску і болю в ділянці обличчя коливаються від помірних до тяжких [137]. ГРС може бути вірусним або бактеріальним. Взагалі вірусний ГРС триває менше 10 днів. Довша тривалість захворювання свідчить про бактеріальну етіологію ГРС [137, 138]. Прогресивне погіршення протягом короткого періоду часу (тобто 5 днів) також свідчить про бактеріальний ГРС. У Європейському установчому документі, присвяченому виявленню риносинуситів та назальних поліпів (European Position Paper on Rhinosinusitis and Nasal Polyps — EPOS) лихоманка, підвищення маркерів запалення (С-реактивний білок і швидкість осідання еритроцитів) також враховуються як діагностичні критерії [138].
Лихоманку не включено до інших настанов, тому що ця ознака має низькі специфічність і чутливість [137]. При ПГРС відзначаються щонайменше 4 епізоди ГРС на рік, причому без інтервалів, вільних від симптомів між окремими епізодами [1, 137, 138, 266, 268]. ГРС є запальним станом синоназальної порожнини, що триває протягом понад 12 тижнів із принаймні двома симптомами обструкції та закладеності носа слизово-гнійним дренажем (переднім і заднім), тиском чи болем у ділянці обличчя та аносмією/гіпосмією [1, 137, 138, 266, 267]. Крім того, пацієнти повинні мати об’єктивні ознаки синоназального запалення при проведенні ендоскопії носа (поліпи, набряк, слизово-гнійна ринорея) або КТ носових пазух [137, 138, 266, 267]. ГРС поділяється на 2 основні візуальні групи: хронічний риносинусит із назальними поліпами і без назальних поліпів (CRSwNP та CRSsNP).
На відміну від ГРС АР характеризується наявністю обструкції, закладеності носа, прозорою водянистою ринореєю (передньою або задньою) та симптомами алергії [264, 265]. Наявність цих симптомів може посилити підозри щодо присутності АР як основного або супутнього діагнозу. І навпаки, АР, як правило, не асоціюється з гнійними або односторонніми виділеннями з носа. Помірний або сильний біль у пацієнта та/або лихоманка також не типові для неускладненого АР і можуть свідчити на користь ГРС або загострення хронічного риносинуситу і диференціюються на підставі тривалості та хронічністі симптомів [1, 137, 138].
Аналіз перебігу симптомів у часі також може допомогти розрізнити риносинусит та АР, тому що симптоми ГРС, як правило, тривають від кілька днів до тижнів (але не більше 4 тижнів). При ХРС щоденні симптоми тривають понад 12 тижнів. Симптоми АР мінливі за тривалістю і зазвичай мають сезонні чи пов’язані з експозицією алергенів коливання [1, 137, 138]. У дні загострення симптоми АР тривають принаймі 1 годину. Проте пацієнти можуть мати і вільні від симптоматики інтервали [264, 265].
Симптоми АР також мінливі у часі залежно від особливостей впливу алергенів [264]. Рання реакція відбувається відразу після їх дії і характеризується чханням, свербежем в носі і в ділянці очей. Ринорея, як правило, зникає протягом 30 хвилин [264]. Пізня реакція виникає через 6 годин після дії алергену і характеризується закупоркою та закладеністю носа [264]. Розвиток пізньої реакції може послаблювати прояви симптомів гострої фази і робити діагноз АР менш очевидним.
Намагаючись встановити той факт, чи страждає пацієнт від АР, ГРС, ПРС чи ХРС, важливо вивчити анамнез щодо специфічних проявів симптомів, звертаючи увагу на особливості симптоматики початкових проявів і тривалість. Наявність в анамнезі алергічних симптомів або симптомів, пов’язаних з експозицією алергенів, свідчить на користь діагнозу АР, оскільки вони не пов’язані з риносинуситом. АР може бути цілорічним або сезонним, що також може бути виявлено в анамнезі [264, 265]. Наявність гострих, помірних і тяжких симптомів, гнійні виділення з носа можуть бути притаманні ГРС або ПАРС, а не АР [137, 138]. Подовження тривалості симптомів (понад 12 тижнів) підтверджує підозри щодо ХРС і потребує подальших досліджень [1, 137, 138] (див. розділ X.B «Риносинусити» для додаткової інформації за цією темою).
IV. Патофізіологія та механізми алергічного риніту
Оскільки ми вивчаємо клінічні та фізикальні прояви, мету виконання тестів на алергію та відповідь на лікування, необхідно надати загальне уявлення про патофізіологію та основні механізми АР. Цей розділ стосується клітинного запалення, розчинних медіаторів, місцевих алергічних проявів і системних ефектів, пов’язаних з АР. Незважаючи на те, що цей документ не має на меті зробити широкий огляд патофізіології АР, наступний короткий розділ є основою для розуміння клінічних проявів АР та його лікування.
IV.A. IgE-опосередкований алергічний риніт
IV.A.1. Системні механізми та прояви
Імунна відповідь, що призводить до продукції IgE при АР, часто є системним феноменом, і у пацієнтів із АР наявні докази системної атопії [269, 270]. Одним із проявів системної атопії при АР є шкірна реакція, що виникає під час традиційного шкірного алерготесту [271]. Подальші докази системної природи IgE-відповіді при AР включають тимчасовий зв’язок AР та інших алергічних захворювань, у тому числі атопічного дерматиту (АД), харчової алергії й алергічної астми, це явище відоме як «атопічний марш» [272]. Цей патерн прогресування атопічного захворювання добре відомий і підтверджується у проспективних дослідженнях [273].
Імунологічні процеси, що лежать в основі IgE-опосередкованого АР, схожі на інші атопічні стани і включають активацію адаптивної імунної системи. Адаптивну імунну відповідь можна класифікувати на 2 категорії з огляду на предомінантний підтип Th-лімфоцитів [274]. Профіль Th1 відповідає за захист від внутрішньоклітинних патогенів, у той час як відповіді Th2 залучені до захисту від паразитарних інфекцій, а також до IgE-опосередкованого еозинофільного алергічного запалення [272]. Чи буде розвиватися АР внаслідок впливу інгаляційного алергену, значною мірою залежить від балансу між Th1- і Th2-ефекторними клітинами [274].
Низка кроків у процесі сенсибілізації є відповідальними за виявлення Th2-предомінантної відповіді. Процес починається з експозиції інгаляційних алергенів на слизовій оболонці носа [275]. Хоча раніше вважалося, що епітеліальні клітини слизової оболонки функціонують лише як механічний бар’єр для проникнення алергенів, останні дослідження показують, що епітеліальні клітини відіграють значно складнішу роль у розвитку алергії, секреції численних запальних медіаторів, у тому числі цитокінів, хемокінів, ейкозаноїдів та ендопептидаз, а також підвищують інтенсивність клітинних адгезійних молекул та вивільнення матриксних металопротеїназ [276]. Вони також проводять важливі ранні імпульси для Th2-імунної відповіді через секрецію стромального лімфопоетину тимуса (TSLP) [272, 275, 276]. TSLP обумовлює дозрівання дендритних клітин у Th2-стимулюючих підтипах [277], які секретують хемокіни, що залучають Т-лімфоцити, призначені для Th2, сприяють клональній ампліфікації Th2-клітин і підвищують виживаність B-клітин пам’яті [272]. TSLP також сприяє включенню у процес еозинофілів і підвищенню активності базофілів і тучних клітин [272].
Потім алергени захоплюються дендритними клітинами, які мігрують до лімфоїдних органів, де антиген представлений простими Т-хелперними клітинами (Th0) на молекулах МНС класу II [274]. Диференціювання Th2 також потребує костимуляції через взаємодію CD28 на Т-клітинах із CD80 і CD86 на антигенпрезентуючих клітинах (АПК) [278]. Крім того, необхідна наявність цитокіну IL-4 [279]. IL-4 зв’язує STAT-6 на Th0-клітині, активуючи головний перемикач GATA-3 [272]. Це стимулює продукцію IL-4, IL-5 і IL-13 [274], що характерно для Th2-відповіді. Ці цитокіни, що продукуються новою диференційованою Th2-клітиною, мають кілька ефектів, які додатково сприяють IgE-опосередкованому еозинофільному запаленню й алергії.
IgE продукується В-клітинами під впливом Th2-ефекторних клітин і цитокінів, які вони секретують [275]. Розвиток IgE-секретуючих B-клітин вимагає наявності IL-4 або IL-13, які індукують перемикання класів за допомогою регулювання транскрипції гена e-лінії клональної експансії, а також взаємодії між лігандом CD40 на поверхні Т-клітин і CD40 на поверхні B-клітин, що сприяє активації В-клітин і продукуванню IgE [279]. Алерген-специфічний IgE (sIgE) потім вивільняється плазматичними клітинами у кровотік.
Антитіла IgE згодом зв’язують високоафінні рецептори (FceRI) на поверхні тучних клітин і базофілів, і таким чином роблять їх сенсибілізованими [280]. Майбутня експозиція алергену призводить до крослінкінгу IgE на поверхні тучних клітин і базофілів, що викликає дегрануляцію, вивільнення медіаторів запалення, таких як гістамін, а також класичні симптоми АР.
IV.A.2. IgE-IgE-рецепторний каскад
IgE відіграє центральну і визначальну роль у патофізіології гострих алергічних реакцій, а також хронічного атопічного захворювання [281]. В осіб із АР вплив специфічних алергенів призводить до продукування алерген-специфічного IgE, який потім зв’язується з ефекторними клітинами, такими як тучні клітини і базофіли, за допомогою високоафінного рецептора FceRI. Хоча IgE у плазмі є короткоживучим, IgE, який пов’язаний із рецептором, залишається прикріпленим до цих клітин протягом тижнів або місяців. Більше того, коли IgE зв’язується FceRI поперечними зв’язками зі специфічним алергеном, він індукує вивільнення попередньо сформованих медіаторів запалення з тучних клітин і базофілів, що призводить до клінічних проявів алергічних захворювань.
Цитокіни, включаючи IL-4 і IL-13, що виділяються з Т-клітин і тучних клітин, викликають диференціювання В-клітин на IgE-секретуючі плазматичні клітини. Декілька досліджень як in vivo, так і in vitro підтвердили продукцію локальних IgE у слизовій оболонці носа у пацієнтів з AР [282–284]. Локально продукований IgE відіграє ключову роль у продовженні запалення шляхом регулювання експресії FceRI в тучних клітинах [283–285]. Доповнена експресія FceRI дозволяє їм зв’язувати більшу кількість комплексів «IgE — антиген», що, в свою чергу, підвищує чутливість тучних клітин до алергену. Це призводить до збільшення продукції імуномодулюючих цитокінів і хімічних медіаторів, утворюючи посилення позитивного зворотного зв’язку, що включає каскад рецепторів IgE-IgE, таким чином подовжуючи поточне запалення [285, 286]. Цікаво, що щільність рецепторів IgE і молекул IgE в тучних клітинах у слизовій оболонці носа пацієнтів з АР корелює з рівнями сироваткового IgE [285]. Наявність підвищених рівнів IgE в назальному секреті також було продемонстровано при неалергічній ринопатії, що потенційно ще більше підкреслює значення IgE-IgE-рецепторного каскаду в розвитку риніту [287].
IV.A.3. Місцеве продукування IgE та локальний алергічний риніт (ЛАР)
ЛАР — це регіональний запальний процес, який характеризується місцевими симптомами та sIgE-спричиненим запаленням без ознак системної гіперчутливості [107, 194, 284, 288]. Важливо пам’ятати, що звичайні тести на алергію, такі як шкірний прик-тест і радіоалергосорбентний тест (RAST), лише вказують на сенсибілізацію (атопію), але не на симптомну алергію.
Незважаючи на те, що позитивний результат шкірного тесту на алергію або тесту in vitro може не мати клінічної значущості, інша ситуація теж є правильною, оскільки негативний результат шкірного тесту на алергію або тесту in vitro не виключає регіональної IgE-опосередкованої чутливості, як у випадку ЛАР [194, 288–290]. ЛАР може бути у понад 47 % дітей і дорослих, у яких раніше захворювання було класифіковано як неалергічний риніт [290–295], і він персистує протягом багатьох років із низькою частотою трансформації у клінічний АР [296–298]. Однак ЛАР може долучатися до розвитку астми [296, 297]. Діагностика ЛАР заснована на демонстрації позитивної відповіді до назального провокативного тесту (НПТ), та/або виявленні назального sIgE, та/або позитивному тесті активації базофілів (ТАБ) за відсутності системної атопії. Патофізіологія ЛАР є складною і не повністю зрозумілою. Імунологічні дослідження виявили Th2-запальну відповідь у слизовій оболонці носа у пацієнтів із ЛАР [177, 299–301], з позитивною відповіддю на НПТ [291, 300–302], і місцеве продукування sIgE [77, 290, 299–301, 303–305] і медіаторів запалення [304, 306, 307].
Назальна Th2-запальна відповідь. Дослідження проточної цитометрії в назальних секретах підтвердили, що експозиція аероалергену викликає Th2-запальну відповідь у слизовій оболонці носа у пацієнтів з ЛАР із підвищеними рівнями еозинофілів, базофілів, тучних клітин, CD3+ та CD4+ Т-клітин [300, 301]. Дослідження НПТ продемонстрували наявність характерних негайної/ранньої і пізньої алергічних відповідей у пацієнтів з ЛАР із місцевим продукуванням sIgE, активацією тучних клітин і еозинофілів, із секрецією триптази та еозинофільного катіонного протеїну (ЕКП) [306, 307]. Недавнє дослідження показало, що 83 % пацієнтів з ЛАР, сенсибілізованих до пилку Olea europea, відповідали на НПТ з nOle e 1 (найбільш значущим алергеном Olea europea), демонструючи, що очищені алергени можуть також викликати алергічну реакцію з секрецією EКП [308].
Місцеве продукування IgE. Слизова оболонка дихальних шляхів є місцем продукування IgE під час алергічного запалення, як це було продемонстровано у пацієнтів з AР [309–312] і ЛАР [299–301, 303–307], як із соматичною гіпермутацією, так і з перемиканням класів, що відбуваються в слизовій оболонці носа [309, 312–315]. Клітинні дослідження підтвердили експресію транскриптів генів e-зародкової лінії та РНК (мРНК) для важкого e-ланцюга IgE у B-клітинах слизової оболонки носа [310]. Швидкість локального продукування IgE [316] достатня для насичення рецепторів IgE на локальних тучних клітинах і потенційного переходу в кровотік [316, 317]. При ЛАР наявність sIgE в назальному секреті було підтверджено після природної експозиції алергену [300, 301], НПТ [300, 301, 303–305], і періодів без експозиції алергену [300, 301]. Крім того, місцевий sIgE при ЛАР має можливість активації базофілів через високоафінний рецептор FceRI, що призводить до вивільнення медіаторів запалення, характерних для АР [308, 318].
IV.B. Не-IgE-опосередковане запалення при алергічному риніті
Загальноприйнятим є те, що АР є насамперед IgE-опосередкованою відповіддю [319]. Проте останніми роками суттєво зросли наше розуміння та оцінка важливого внеску назальної вродженої імунної відповіді у патогенез АР [320]. Патофізіологічні механізми запальної хвороби дихальних шляхів пов’язані з великими фізіологічними мережами, що впливають на взаємодію «господар — середовище». Назальний епітелій є першою структурою, з якою стикаються інгаляційні аероалергени. Внутрішня протеолітична активність алергенів може порушити назальний епітеліальний бар’єр, що сприяє проникненню алергенів і хронічному запаленню [321]. Нещодавно отримані дані надають додаткові докази того, що дисфункція епітеліального бар’єра сприяє розвитку запальних захворювань, таких як АР, але залишається з’ясувати, як первинні (генетичні) і вторинні (запальні) механізми впливають на це порушення [322]. Епітеліальні клітини не тільки діють як фізичний бар’єр щодо інгаляційних алергенів, але й активно сприяють запаленню дихальних шляхів через виявлення факторів навколишнього середовища та реагування на них. Назальний епітелій експресує патерни розпізнавання рецепторів, подібних до toll (TLR), які після активації алергенами або патогенами призводять до утворення різних медіаторів [323, 324]. Ці медіатори впливають на рекрутування запальних клітин до місцевих тканин і створюють мікрооточення, що впливає на функцію імунних клітин, тим самим поширюючи місцеві запальні процеси [325]. При алергічних захворюваннях назальний епітелій перебуває в постійно активованому стані [326], потенційно це наслідок неможливості вимкнути активацію відповіді [327].
Цікавим прикладом розвитку науки останнім часом стало відкриття вроджених лімфоїдних клітин (ВЛК) як потенційних ключових складників у патогенезі хвороб Th2-типу, таких як АР, хронічний риносинусит з поліпозом носа та астма [328–330]. ВЛК — це родина ефекторних клітин, які є важливими для захисту від інфільтративних патогенів і відновлення цілісності тканин. ВЛК не експресують антиген-специфічні Т-клітинні рецептори, але можуть оперативно реагувати на «сигнали небезпеки» і виробляти масив цитокінів, які обумовлюють відповідні імунні відповіді. Визначено три основні підгрупи на основі їх фенотипу і функціональних подібностей до клітин Th1 (ВЛК1), Th2 (ВЛК2) і Th17 (ВЛК3). Після впливу антигенів навколишнього середовища, включаючи віруси та алергени, епітеліальні клітини дихальних шляхів швидко вивільняють цитокіни IL-25, IL-33 і TSLP, які безпосередньо активують ВЛК2, які потім продукують прототипні цитокіни типу 2 — IL-5 і IL-13 [331]. Вплив алергену в осіб з АР індукує збільшену кількість ВЛК2 [332, 333] у сироватці, однак подібне збільшення у слизовій оболонці носа ще не продемонстровано. На додаток до лікування, спрямованого на модулювання IgE-опосередкованого запалення, розробляються нові способи терапії АР, спрямовані на вроджену імунну систему [334, 335].
IV.C. Концепція єдиної системи дихальних шляхів
Верхні та нижні відділи дихальних шляхів із анатомічної, гістологічної й імунологічної точок зору пов’язані із запаленням в одній частині дихальних шляхів, яке впливає на іншу частину, утворюючи, таким чином, єдину систему дихальних шляхів [336]. Нові системні варіанти лікування обумовлюють ще більшу важливість розуміння зв’язку між верхніми і нижніми дихальними шляхами [337].
Слизова оболонка верхніх і нижніх відділів дихальних шляхів однакова, містить псевдостратифікований епітелій з війчастою стовпчастою оболонкою. Також наявні базальні епітеліальні клітини, прикріплені до базальної мембрани (lamina reticularis), що виконують функцію епітеліальних стовбурових клітин. У підслизовій оболонці знаходяться судини, слизові залози, фібробласти і деякі запальні клітини. Основною відмінністю компонентів слизової оболонки є відсутність гладких м’язів у верхніх відділах дихальних шляхів порівняно з нижніми відділами дихальних шляхів, а також відсутність великих субепітеліальних капілярів, артеріальних систем і венозних кавернозних синусоїдів у нижній частині дихальних шляхів порівняно з верхніми дихальними шляхами.
Характеристики фенотипів риніту й астми дуже схожі, з акцентом на алергію й еозинофілію, неалергічні фенотипи як у верхніх, так і в нижніх дихальних шляхах, а також зв’язок між хронічним риносинуситом, особливо з поліпами носа, і пізнім початком астми [319, 338, 339]. Як АР, так і астма також можуть характеризуватися гіперреактивністю, що не корелює з атопічним станом [192, 340]. Крім того, в ендотипуванні можна виділити схожість з акцентом на імунні відповіді типу 2 проти не-типу 2. При алергічних захворюваннях видатним ендотипом є тип 2 (наприклад, Th2-клітини, В-клітини типу 2, IL-4-продукуючі природні кілери (NK)/Т-клітини, базофіли, еозинофіли, тучні клітини, ВЛК2, IL-4, IL-5, IL-13, IL-25, IL-31, IL-33) [319, 341]. Загалом профіль типу 2 при АР і астмі пов’язаний із позитивною реакцією на лікування кортикостероїдами. Нові цільові методи лікування, що фокусуються на елементах (підгрупах) типу 2, таких як анти-IgE-антитіла, анти-IL-5 (меполізумаб) і анти-IL-4/IL-13 (дупілумаб), на цей час використовуються при астмі, але ще не схвалені для використання при патології верхніх дихальних шляхів [342]. Подібності виявляються не тільки в набутій імунній відповіді, але і в ролі вродженого імунітету як функції епітеліального бар’єра [334] та вроджених лімфоїдних клітин [332]. Нещільність епітеліального бар’єра та щільні сполуки, що ущільнюють епітеліальну поверхню слизової оболонки верхніх та нижніх дихальних шляхів, продемонстровані при астмі, АР та хронічному риносинуситі [343, 344].
Вплив синоназального запалення на нижні дихальні шляхи пояснюється кількома механізмами, наприклад пошкодженим патерном дихання, легеневою аспіра-цією носового вмісту, назобронхіальним рефлексом і захопленням медіаторів запалення в системному кровообігу [345]. Ніс діє як фільтр і кондиціонер, що захищає нижні дихальні шляхи. Знижені фільтраційні та кондиціонуючі функції носа можуть призвести до збільшення експозиції алергенів у нижніх дихальних шляхах. Дихання ротом незалежно пов’язане із захворюваністю на астму, що свідчить про те, що кондиціонування повітря може мати велике значення. Ефективність назального фільтра залежить від розміру частинок, що вдихаються. Малі молекули, такі як пліснява та котяча лупа, більше асоціюються з підвищеним ризиком астми, тоді як великі молекули, такі як пилок дерев і трав, переважно асоціюються із симптомами з боку верхніх дихальних шляхів. Роль переважно дихання ротом у розвитку астми не зрозуміла [346].
Незважаючи на те, що існує зв’язок між постназальними виділеннями і кашлем, не було доведено прямого зв’язку між надмірним продукуванням носового секрету і гіперреактивністю бронхів. Більше того, після назального введення відкладення радіоактивно міченого алергену можна виявити в травному тракті, але не в дихальних шляхах [347]. Стимуляція фаринголарингеальних рецепторів є більш імовірною причиною кашлю, що викликається постназальними виділеннями [348]. Цікаво, що кашель не індукується у хворих iз ринітом чи здорових пацієнтів контрольної групи при моделюванні постназальних виділень [349].
Є не так багато доказів, що підтверджують назобронхіальний рефлекс як важливий внесок у концепцію єдиної системи дихальних шляхів. Дія назального алергену може бути блокована вазоконстриктором, але не лідокаїном. Більше того, вплив алергену на нижні дихальні шляхи в цілому є більш відкладеним, ніж можна було очікувати після назально-бронхіального рефлексу носоглотки [350].
Дослідження провокації алергенами є гарною моделлю для вивчення назально-бронхіальних перехресних перешкод при алергічних захворюваннях дихальних шляхів. У пацієнтів з АР сегментарна бронхіальна або назальна провокація може викликати алергічне запалення у слизовій оболонці як носа, так і бронхів [347–349]. Можливо, абсорбція медіаторів запалення (наприклад, IL-5 і еотаксину) з ділянок запалення у системний кровотік призводить до вивільнення еозинофілів, базофілів і їх клітин-попередників із кісткового мозку [351]. Системна алергічна відповідь додатково характеризується підвищеною експресією молекул адгезії, таких як молекули адгезії 1 судинних клітин і Е-селектин у назальному і бронхіальному ендотелії, що полегшує міграцію запальних клітин у тканину [352].
Підвищення числа CD34+ клітин, здатних до диференціювання еозинофілів, а також інших медіаторів кровообігу (IL-5, еотаксин і цистеїніл-лейкотрієни), пов’язане з порушенням параметрів функції легенів і посиленням запалення слизової оболонки у хворих на астму [353], і реагуює на місцеві кортикостероїди при АР [354]. Показано, що лікування анти-IL-5 та іншими інтерлейкінами, релевантними в еозинофільному шляху, є ефективним при астмі, з деякими корисними результатами при еозинофільному захворюванні верхніх дихальних шляхів [342].
Ці дослідження демонструють, що ті ж самі механізми, що і при АР, можуть мати важливе значення при запаленні у дихальних шляхах, навіть за відсутності клінічних симптомів астми. Системні фактори, як-от: кількість еозинофілів у кровообігу і тяжкість атопії, свідчать про більш тяжке захворювання дихальних шляхів.
IV.D. Клітинні запальні інфільтрати
У патофізіології АР беруть участь різні клітини. Завдяки природі захворювання, з різними механізмами та ендотипами, детально описати кожну з цих запальних клітин практично неможливо. Це свідчить про необхідність ендотипування та характеристики клітинного інфільтрату для кожного ендотипу [355]. Крім того, багато досліджень, сфокусованих на типах клітин при алергічних захворюваннях, включаючи нещодавно ідентифіковані клітини, такі як ВЛК типу 2, клітини Th17 і клітини Th22, в основному обмежуються вивченням клітин периферичної крові, а не біоптатів тканин. Докази, отримані з обмеженого числа досліджень, свідчать про те, що в різних стадіях запалення, як-от: загострення, ремісія та ремоделювання, беруть участь різні клітини. Крім того, у тканині різних ділянок, –як-от: слизова оболонка пазух, нижні носові раковини або поліпозні утворення, визначають різні інфільтруючі імунні та запальні клітини.
Клітини назального епітелію локалізуються на межі тіла людини та навколишнього середовища і часто виступають як перша лінія захисту від зовнішніх патогенів. Епітеліальні клітини взаємодіють з алергенами і регулюють клітини, що інфільтруються при АР, шляхом продукування різних костимуляторних молекул, хемокінів, цитокінів і ліпідних медіаторів. Ці цитокіни запускають імунну відповідь типу 2, характерну для АР [356]. Однак коли алергени мають додаткову протеазну активність та/або супроводжуються мікробними компонентами, як-от: ендотоксини або неорганічні частинки, епітеліальні секреторні відповіді можуть призвести до змішаної імунної відповіді типу 2 і типу 17, або навіть до відповіді типу 1 [357, 358]. У відповідь на респіраторні віруси епітеліальні клітини продукують широкий спектр медіаторів, як-от: інтерферони типу I, гранулоцитарний макрофагальний колонієстимулюючий фактор (GM-CSF), RANTES/CC Motif Chemokine 5 (CCL5) та індукований інтерфероном гаммабілок 10/CXC Motif Chemokine 10 (IP-10/CXCL10) [359]. Ці медіатори запускають подальшу вроджену і адаптивну антивірусну клітинну імунну відповідь.
Щоб активувати алерген-специфічні Т-клітини CD4, необхідна адекватна костимуляція. Дендритні клітини є професійними АПК, які безпосередньо пов’язані з АР, із підвищеним числом і концентрацією IgE при атопічній хворобі [360]. Вони перебувають у тісному контакті з епітеліальними клітинами і ВЛК і контролюють активацію і диференціацію Т- та В-клітин [356]. Показано, що елімінація дендритних клітин пригнічує розвиток АР [360].
У розвитку алергічного захворювання відіграють суттєву роль вроджені й ефекторні механізми [361]. Дисбаланс підгрупи Т-хелперів і продукування типових Th2 цитокінів [362], поряд із підвищеною експресією GATA-3 [363], зазвичай спостерігається при АР у слизовій оболонці носа [364]. Крім того, в слизовій оболонці у пацієнтів із цілорічним АР збільшуються рівні Т-клітин пам’яті CD4+ і гамма/дельта-Т-клітин. Клітини-ефектори Th2 продукують IL-4, IL-5, IL-9 і IL-13 [356, 365]. Крім того, стромальний лімфопоетин ти–муса (TSLP), IL-25, IL-31 і IL-33 сприяють розвитку та інтенсивності Th2-відповідей і запалення. Ці цитокіни відіграють роль у продукуванні sIgE, еозинофілії, слизу, тканинної міграції Th2-клітин і еозинофілів, регуляції щільних з’єднань і цілісності епітеліального бар’єра [343, 356, 366, 367]. Т-регуляторні (Treg) підгрупи клітин мають різні фенотипи і включають конститутивні й індуцибельні підрозділи CD4+ CD25+ Forkhead box P3 (FOXP3)+ клітини Treg і клітини типу Treg 1 [368–370]. Treg-клітини відіграють важливу роль в толерантності до алергену та алерген-імунотерапії (AIT) [371–373]. Продукування IL-10 та трансформуючого фактора росту β (TGF-β) від інших клітин є вирішальним для їх імунорегуляторних функцій. Співвідношення між ефекторними та регуляторними типами клітин визначає, чи викликає алерген алергічну відповідь чи ні.
Популяції лімфоїдних клітин, які не мають реорганізованих антигенних рецепторів і маркерів для мієлоїдних і лімфоїдних ліній, як-от: Т-клітини, В-клітини і NK-клітини, були визначені як ВЛК. ВЛК типу 1 (ВЛК1) переважно продукують інтерферон γ (IFN-γ), ВЛК2 продукують IL-5 і IL-13 [374], а ВЛК3 продукують IL-17 та IL-22 [361]. ВЛК типу 2 знайдені при АР, при якому вони тісно взаємодіють з епітеліальними та іншими клітини, що контролюють середовище слизової оболонки. Через продукування цитокінів і індукцію хемокінів імунна відповідь типу 2 є сприятливою, що підтримує подальший розвиток запалення алергічної тканини [375].
Хоча вважалося, що В-клітини, які продукують IgE, знаходяться в лімфоїдних фолікулах кільця Вальдеєра [376], а потім антитіла переносяться на слизову оболонку, більш нові докази ідентифікували В-клітини і плазматичні клітини, що здатні продукувати IgE в тканині носа у пацієнтів з АР. При хронічному риносинуситі з носовими поліпами локальна продукція алерген-специфічних антитіл додатково підтримується виявленням вторинної лімфоїдної тканини і формуванням IgE до Staphylococcus aureus [378].
В назальному епітелії у осіб з алергією під час сезону пилку збільшується кількість багатьох основних білок-позитивних і EG2+ (активованих) еозинофілів. Аналогічно, тучні клітини знаходяться в епітелії і підслизовому шарі, проте під час сезонної експозиції алергену не спостерігається збільшення кількості клітин Т-лімфоцитів або їх субтипів, а також нейтрофілів або макрофагів [379]. Чисельність базофілів у lamina propria слизової оболонки носа збільшується протягом 1 години провокації алергенами [380]. Під час ранньої і пізньої фаз реакції типу 1 після зустрічі з алергеном і зшивання молекул IgE, а також при стимуляції IL-33 відбувається дегрануляція тучних клітин і базофілів [381, 382].
У пізній фазі алергічної реакції приплив запальних клітин полегшується хемоатрактантами і підвищенням адгезії молекул [383]. Це призводить до подальшої інфільтрації тканини еозинофілами, базофілами і Т-клітинами. Нарешті, залишається ідентифікувати ті запальні клітини, які супроводжують ремоделювання слизової оболонки при АР, а також регулюючі фактори, як-от: матриксні металопротеїнази і ангіогенні фактори [384].
IV.E. Мережа цитокінів і розчинні медіатори
Цитокіни є імуномодулюючими білками, важливими для клітинної сигналізації. Складні взаємодії вроджених і адаптивних імунних клітин, а також структурних клітин і їх цитокінів відіграють важливу роль у регулюванні алергічного запалення дихальних шляхів. Запальний процес, що лежить в основі АР, координується мережею цитокінів.
Цитокіни типу 2, як-от: IL-4, IL-5, IL-6 і IL-13, мають вирішальне значення в регулюванні алергічного запального каскаду, що характеризується підвищеною наявністю еозинофілів і тучних клітин і підвищенням продукування IgE. Крім їхньої ролі в індукції синтезу IgE, цитокіни типу 2 підвищують продукування інших цитокінів і хемокінів з епітеліальних клітин і фібробластів [283], що призводить до припливу запальних клітин, включаючи еозинофіли і тучні клітини [385, 386]. Scadding та співавт. [387] продемонстрували імунологічні аспекти риніту за умов дії назального алергену. Після впливу пилку трави на слизову оболонку носа у чутливих індивідуумів підвищувалися рівні IL-4, IL-5 і IL-13 протягом 2–3 годин, і їх рівень ще збільшувався протягом 5–6 годин [387]. Аналогічно підвищувалися рівні хемокінів, як-от: хемокіни, регульовані тимусом і регульовані активацією (TARC, CCL17), хемокіни, отримані з макрофагів (MDC, CCL22), еотаксин, RANTES, MCP-1 і запальний білок макрофагів (MIP)-1α [388–391]. Збільшення цих цитокінів типу 2 та пов’язаних з ними хемокінів мало виражену кореляцію з алергічними клінічними відповідями.
Хоча цитокіни 2-го типу спочатку визначалися як Th2-цитокіни з клітинного джерела, деякі інші клітини теж були ідентифіковані як їх імовірні джерела, включаючи тучні клітини, епітеліальні клітини, ВЛК типу 2 і еозинофіли. Тучні клітини дихальних шляхів є важливим джерелом цитокінів типу 2, прозапальних цитокінів, хемокінів і IL-7-подібного цитокіну TSLP [283, 392–394]. IL-13 з тучних клітин відіграє вирішальну роль в індукованому тучними клітинами локальному синтезі IgE B-клітинами [286, 395], які, в свою чергу, регулюють експресію FcεRI на тучних клітинах [286]. Крім того, кілька продуктів мастоцитів чинять виражений вплив на епітеліальні клітини. TNF-α, прозапальний цитокін, що продукується тучними клітинами, спільно з IL-4 і IL-13 підсилює продукцію TARC, TSLP і еотаксину з епітеліальних клітин [385]. А хемокіни, як-от: триптаза і хімаза, можуть регулювати продукування RANTES і GM-CSF з епітеліальних клітин [385]. Таким чином, має місце вирішальна взаємодія між тучними клітинами і епітеліальними клітинами у сприянні та регулюванні алергічного запального каскаду.
На додаток до цитокінів і хемокінів, про які йшлося у попередніх параграфах, клітини назального епітелію є важливим джерелом для IL-1, IL-6, IL-8 і TNF-α. Через ці сигнали епітеліальні клітини відіграють вирішальну роль у міграції та активації еозинофілів, базофілів і Th2-клітин [396]. Крім того, епітеліальні клітини вивільняють цитокіни IL-25, IL-33 і TSLP, які створюють як вроджену, так і адаптивну імунну відповідь 2-го типу. Ці ж цитокіни також вивільняються шляхом пошкодження тканин, розпізнавання патогену і впливу алергену. Вони можуть регулювати функцію Th2-клітин або безпосередньо, або через вроджені лімфоїдні клітини, які, в свою чергу, продукують IL-5, IL-9, IL-13, TSLP, IL-25 і IL-33, кількість яких зростає у слизовій оболонці носа у пацієнтів з АР, що вказує на роль цих цитокінів у патофізіології АР [397–400]. Насправді, як було показано, рівні IL-33 в назальному секреті корелюють із загальною кількістю назальних симптомів [400]. Крім того, продемонстровано, що TSLP активує дендритні клітини, сприяє відповіді Th2 і активує тучні клітини [401].
Еозинофіли — це ще один тип клітин, який відіграє значну роль у патофізіології АР. Вони є основним джерелом інгібуючого фактора міграції макрофагів запального цитокіну (MIF) [402] і фактора росту нервів (NGF) [403]. Еозинофіли експресують рецептори 5-ліпоксигенази, LTC4S, CysLT1 і CysLT2, які відіграють певну роль у шляху арахідонової кислоти [404]. ІL-5 відіграє ключову роль в модуляції дозрівання, диференціювання та виживаності еозинофілів [405]. Еозинофільні хемоатрактанти включають еотаксин, MCP4, RANTES і цистеїніл-лейкотрієни [406–408]. Як обговорювалося у попередніх параграфах цього розділу, тучні клітини й епітеліальні клітини або безпосередньо продукують, або підвищують регуляцію цих же хемоатрактантів.
Нарешті, клітини Th17 є унікальною субпопуляцією CD4+ Т-клітин. Вони продукують IL-17A, IL-17F, IL-22, TNF-α та IL-21 [409]. Було показано, що вони локалізуються у слизовій оболонці носа у пацієнтів з АР, і тому вважається, що вони відіграють певну роль в алергічному запаленні [409, 410]. Продемонстровано, що IL-17A підвищується у пацієнтів із сезонним АР через 5 годин після появи алергенів у порожнині носа [411]. Нарешті, у пацієнтів з алергією на пилових кліщів була продемонстрована наявність підвищеної кількості клітин IL-17A+ та IL-17A мРНК у слизовій оболонці носа, що вказує на їх можливу роль у роз-
витку АР [412].
Отже, АР є захворюванням, опосередкованим 2-м типом, що характеризується важливими регуляторними цитокінами, як-от: IL-4, IL-5 і IL-13. Нові цитокіни типу 2 були ідентифіковані при АР, включаючи цитокіни сімейства IL-17. Нарешті, ВЛК типу 2 і цитокіни, отримані з епітеліальних клітин, як-от: TSLP, IL-25 і IL-33, відіграють вирішальну роль у регуляції алергічного запального каскаду.
IV.F. Гістологічні та епітеліальні зміни
В нормі слизова оболонка носа містить псевдостратифікований колоноподібний миготливий епітелій з келихоподібними клітинами над базальною мембраною. Назальний підслизовий шар містить стромальні елементи, включаючи фібробласти, кровоносні судини, серомуцинні залози, сенсорні нерви і лейкоцити. Лейкоцити, наявні у слизовій оболонці носа, включають лімфоцити CD4+ і CD8+ T- та В-лімфоцити, еозинофіли, нейтрофіли, базофіли, тучні клітини і макрофаги. Об’єднані функції миготливих і секреторних клітин роблять можливим назоциліарний кліренс, видаляючи патогенні мікроорганізми й алергени як захисний механізм. На додаток до фізичного бар’єра, назальний епітелій відіграє важливу роль у вродженому і набутому імунологічному захисті проти патогенів [359, 413, 414] шляхом: 1) експресії рецепторів розпізнавання образів, які розпізнають патоген-пов’язані молекулярні структури; 2) секретування величезного арсеналу молекул захисту господаря, як-от: антимікробні ферменти, опсоніни, проникні білки, колектини та зв’язуючі білки; 3) продукування запальних цитокінів у відповідь на антигенні подразники.
Алергія опосередковано викликає епітеліальні зміни слизової оболонки носа. У пацієнтів з АР назальний епітелій стає товщим після впливу алергену [415, 416], але дані досліджень товщини епітелію без дії алергенів є суперечливими [415–417]. Хоча ремоделювання епітелію є ключовою особливістю хронічного риносинуситу (епітеліальна гіперплазія, гіперплазія келихоподібних клітин і плоскоклітинна метаплазія) [418–420], ремоделювання астми (епітеліальна десквамація, суб-епітеліальний фіброз і гіпертрофія гладких м’язів) в АР є менш помітним. Загалом обмежені дослідження не виявили вірогідного збільшення товщини базальної мембрани, субепітеліального фіброзу, гіперплазії келихоподібних клітин або об’єму кровоносних судин і поверхневої щільності [415, 421, 422], хоча спостерігалася підвищена проникність судин [423]. На відміну від епітеліального ремоделювання епітеліальна запальна реакція на алергени є ключовою особливістю АР. Під впливом алергену спостерігається вірогідно вища інфільтрація запальних клітин і підвищений рівень цитокінів (IL-4, IL-5 і IL-13) в назальному епітелії у пацієнтів з алергією порівняно з пацієнтами без алергії [182]. Ця запальна відповідь перетворюється на набряк слизової оболонки, вегетативну нейронну стимуляцію і посилене виділення секрету слизової оболонки, що проявляється як ознаки непрохідності порожнини носа, свербіж, чхання, ринорея і втрата відчуття запахів у тяжких випадках.
Зазначається, що при алергії епітеліальний бар’єр має специфічні функції. Проникнення алергенів через цей бар’єр може призвести до сенсибілізації алергенів і локальної та/або системної запальної реакції. У слизовій оболонці носа цей бар’єр складається зі слизу й епітеліальних клітин, які пов’язані апікальними сполучними комплексами (щільні сполуки й адгезивні переходи) [367]. Механічні або інфекційні порушення кровообігу в епітелії або дефекти епітелію призводять до порушення бар’єра та проникнення алергенів [367, 424–426]. Мутації втрати функції та поліморфізми генів, що кодують маркери епітеліального бар’єра, такі як флагрин, асоційовані з АР та екземою [427, 428]. Деякі алергени можуть викликати комплексне порушення функцій, що призводить до проникнення алергенів через епітеліальний бар’єр [322, 429]. Протеолітичні алергени безпосередньо порушують апікальний сполучний комплекс через протеоліз, призводячи до бар’єрної дисфункції [430]. Виявлення алергенів антиген-презентуючими клітинами, Th2-відповіді та вивільнення цитокінів (IL-4, IL-13 і IFN-γ) індукують подальшу «нещільність» апікального з’єднання через різні механізми, що дозволяє підвищити рівень проникнення алергенів [367]. Доказові дані свідчать про те, що це порушення бар’єра може бути скасовано кортикостероїдами. Було виявлено, що флутиказону пропіонат підвищує експресію щільного з’єднання білків zonula occludens 1 і оклюдину і більш інтактний назальний епітеліальний бар’єр [322]. Однак кортикостероїди не продемонстрували, що вони викликають витончення назального епітелію [322, 431].
В наш час алергія вважається як системним, так і місцевим епітеліальним станом [337]. Докази вказують на те, що епітелій є не пасивним бар’єром, а активним учасником розвитку та прогресування алергії [432]. Було встановлено, що пилок берези швидко зв’язується з Bet v 1-зв’язуючими білками у сенсибілізованому назальному епітелії і транспортується через ліпідний раф і кавеолярно-залежний процес перед зв’язуванням з тучними клітинами в lamina propria [433–435]. Епітеліальна відповідь на алергени відрізняється від такої у здорових людей тим, що у пацієнтів з алергією не настільки міцна епітеліальна захисна реакція на алергени, і це призводить до збільшення проникнення алергенів [432].
IV.G. Мікробіом
Мікробіом людини являє собою комплексне співтовариство мікроорганізмів, що перебуває в організмі людини і взаємодіє з ним. Кишечник дорослої людини є середовищем для приблизно до 100 трлн мікробів, і вважається, що мікробіом становить близько 90 % всіх клітин в організмі людини [436, 437]. Мікробіоми індивідуумів змінюються, ймовірно, через те, що зростання, розвиток і склад мікробіому впливають на складні взаємодії між середовищем, дієтою та факторами, пов’язаними з господарем [437].
З появою незалежних від культури високопродуктивних методів секвенування бактеріальної ДНК, можна зробити детальний опис складу та різноманітності мікробіому органів та організму в цілому [438]. 2007 року розпочався проект мікробіому людини, і, як результат, з’явилися дані, що вивчають асоціації мікробіоти дихальних шляхів, ротової порожнини, кишки, шкіри та сечостатевого тракту з розвитком процесів захворювання, включаючи алергію та астму [437].
Розширення досліджень у тварин і людини призвело до встановлення змін у мікробіомі з розвитком алергічних захворювань [439, 440]. Вважається, що порушення роботи шлунково-кишкових бактерій погіршує імунологічну толерантність слизової оболонки [441]. Низка авторів встановила асоціації погіршення мікробного різноманіття кишечника з розвитком алергічного захворювання у дітей шкільного віку [442, 443]. Наприклад, розвиток алергічних симптомів у дітей було пов’язано із загальним зниженням мікробного різноманіття, підвищеною поширеністю Bacteroides та Bifidobacterium adolescentis, а також меншою кількістю Akkermansia muciniphilia, Faecalibacterium prausnitzii та Clostridium [444]. Крім того, Fujimura et al. [445] нещодавно відзначили, що менша чисельність Bifidobacterium, Akkermansia і Faecalibacterium асоціювалася з більш високим ризиком розвитку полісенсибілізації у віці до 2 років, а діагностована лікарем астма — у віці до 4 років. Автори дійшли висновку, що мікробний дисбіоз кишечника новонароджених може стимулювати дисфункцію CD4+ T-клітин, що асоціюється з алергічною хворобою у дітей [445, 446].
Найповніший перелік доказів, що оцінюють потенційну асоціацію між мікробіомом та розвитком алергічного захворювання, — це нещодавно проведений систематичний огляд Melli та співавт. [444]. У дослідженнях, включених до цього систематичного огляду, порівнювали мікробіоту кишечника у пацієнтів з алергією із такою у здорових осіб контрольної групи. Всього було зареєстровано 21 дослідження з вивчення зв’язку між мікробіотою кишечника та алергічною хворобою, в яких для оцінки результатів проводили аналіз калу. Лише у 4 проаналізованих дослідженнях були встановлені специфічні результати, пов’язані з АР або сенсибілізацією. Penders та співавт. [447] встановили, що наявність Clostridium difficile у віці 1 місяць пов’язана з підвищеним ризиком алергічної сенсибілізації (відношення шансів (OR) 1,54; 95% довірчий інтервал (ДІ), від 1,09 до 2,31) до віку 2 роки. Adlerberth та співавт. [448] відзначили збільшення співвідношення грамнегативних до грампозитивних бактерій у віці 1 рік, що пов’язано з рівнями IgE більше ніж 100 кОд/л у віці 1,5 року. Bisgaard та співавт. [449] виявили меншу бактеріальну різноманітність, пов’язану з підвищеним ризиком алергічної сенсибілізації (p = 0,003) і АР (p = 0,007). Johansson та співавт. [450] повідомили про меншу частоту колонізації Lactobacilli та Bifidobacterium bifidum у дітей з алергією [15]. Melli та співавт. [444] встановили, що більшість досліджень, в яких мікробіоми асоціюються з розвитком атопічного захворювання, були різноманітними і складними для інтерпретації через різні методики, розміри зразків і методи дослідження культур.
Є деякі думки, що склад та/або дисбактеріоз мікробіоти (віруси, гриби та/або бактерії) інших ділянок, як-от: носоглотка, легені та синоназальні порожнини, також можуть відіграти роль у розвитку алергічних розладів. Проте ці дослідження перебувають у початковому стані, і на цей час мало що може бути зроблено [451].
Чіткого розуміння ролі мікробіому та його впливу на алергічну хворобу до кінця не з’ясовано. Хоча деякі дані свідчать про асоціації між алергічними захворюваннями та мікробіотою, на основі наявних даних важко розрізняти захисні мікроорганізми та механізми, що підвищують ризик алергічних захворювань [446]. Подальші дослідження повинні забезпечити збагачення та різноманітність мікробіому людини та з’ясувати, як він впливає на АР.
V. Епідеміологія алергічного риніту
V.A. Поширеність алергічного риніту у дорослих
Для оцінки поширеності АР серед дорослого населення використовувалися різноманітні популяційні дослідження. Оцінка поширеності в основному залежить від повідомлень пацієнтів про «сінну лихоманку» або «назальну алергію», або від назальних симптомів, «коли у вас не було застуди або грипу». Але є кілька великомасштабних популяційних досліджень, які оцінювали стійкі (тривалістю більше як 4 дні/тижні протягом понад 4 тижнів поспіль) та переривчасті симптоми. Оскільки багато обстежень відрізняються в термінах визначення захворювань, географії та сезонності, отримані в них результати широко варіюються.
В одному з найбільш ранніх досліджень, проведених в Tecumseh, штат Мічиган, у 1959–1960 рр. було встановлено, що поширеність сінної лихоманки (діагностована як «симптоми верхніх дихальних шляхів, що вважаються алергічними за походженням і виникають переважно навесні, влітку або восени») становить близько 11 % в осіб віком старше 20 років [452]. Близько 20 років потому було проведено Національне дослідження охорони здоров’я та харчування (NHANES, 1976–1980) серед географічно репрезентативної вибірки населення США. Воно дало загалом аналогічні оцінки поширеності АР, які визначаються як «встановлений лікарем діагноз сінної лихоманки або часті назальні та/або очні симптоми, що змінювалися як сезонно, так і залежно від пилку, протягом останніх 12 місяців, якщо не брати до уваги застуду або грип» [453]. У більш пізньому звіті на основі NHANES (2005–2006) наведені показники поширеності серед населення — дві третини осіб були віком понад 20 років; продемонстровано, що поширеність медичної діагностики сінної лихоманки протягом життя становила 11,3 %, у 6,6 % осіб симптоми діагностувалися протягом останніх 12 місяців. Проте залежність діагнозу АР від лікаря може значно недооцінювати фактичну поширеність АР, оскільки багато пацієнтів самостійно діагностують захворювання і займаються самолікуванням. Дослідження, в яких беруть участь пацієнти, які самі розповідають про наявність у них АР, продемонстрували, що третина населення повідомила про «чхання та/або назальні симптоми за відсутності застуди або грипу», причому приблизно 24 % респондентів повідомляли про те, що симптоми мали сезонний характер, і ще у 10 % ці симптоми були наявними протягом усього року (тобто цілорічний АР) [454].
На початку 1990-х років дослідження Європейського респіраторного співтовариства (ECRHS), яке було багатоцентровим дослідженням дорослої популяції віком від 20 до 44 років у 23 країнах (переважно Західна Європа, а також Австралія та Нова Зеландія), використовувало анкету, що заповнюється самостійно пацієнтами, для оцінки поширеності «сінної лихоманки або назальної алергії». Поширеність варіювала від 10 до 40 % у всіх центрах-учасниках [455], із ще більшою кількістю учасників (12–65 %), які повідомили, що вони відчули нежить або закладеність носа або почали чхати при появі впливу джерела алергену [456]. Якщо у визначення захворювання був включений критерій «позитивний шкірний прик-тест», то показник поширеності АР знизився на змінну величину (абсолютне зниження показника поширеності між 4 і 16 % у всіх центрах). У швейцарському дослідженні забруднення повітря і захворювання легенів у дорослих (SAPALDIA), проведеному приблизно в той самий час, що і ECRHS, поширеність «назальної алергії, включаючи сінну лихоманку», про що доповідали самі пацієнти, серед дорослих віком від 18 до 60 років становила 17,9 %, а поширеність симптому «сінна лихоманка цього року або минулого року» становила 14,2 % [457]. Оцінка поширеності була нижчою, якщо був включений критерій «позитивний шкірний прик-тест» (11,2 % для поточної сінної лихоманки при щонайменше 1 позитивному результаті шкірного прик-тесту і 9,1 % для поточної сінної лихоманки з позитивним результатом шкірного прик-тесту до трави або берези, або Parietaria). Зовсім недавно в дослідженні Глобальної мережі алергії та астми (GA2LEN) було встановлено, що поширеність «назальної алергії та сінної лихоманки» коливалася від 22 до 41 % у дорослих віком від 18 до 75 років, які проживають у 12 європейських країнах-учасницях [458].
Популяційні дослідження продемонстрували збільшення поширеності АР серед дорослого населення останніми десятиліттями. Наприклад, в Renfrew Paisley, Великобританія, поширеність сінної лихоманки була вищою у дорослих і дітей у 1996 році, ніж у їхніх матерів і батьків у еквівалентному віці у 1972 році [459]. Поширеність сінної лихоманки збільшилася вдвічі у період з 1981 по 1990 р. у Busselton, Австралія [460], збільшилася в Італії з 1991 до 2010 р. [461], і збільшилася в 8 з 11 міст Китаю, де проводилося дослідження у 2005 році і знову в 2011 році [462]. У Uppsala, Umea і Goteborg, Швеція, поширеність «сінної лихоманки і назальної алергії» зросла з 21 до 31 % у період з 1990 по 2008 р. [463], хоча останні повідомлення зі Стокгольма свідчать про можливе зниження рівня назальної алергії протягом останніх років [464].
З огляду на ці дані показник поширеності АР у Сполучених Штатах протягом життя можна оцінити між 11 % (діагноз, встановлений лікарем) і приблизно 33 % (діагноз, встановлений самостійно). У Європі поширеність АР у дорослих коливається в межах від 10 до 41 % залежно від конкретної країни.
V.B. Захворюваність на алергічний рінит і його поширеність у дітей
Проведено відносно мало досліджень щодо захворюваності на АР у дітей. Є дані про те, що АР може починатися вже у перший рік життя. У дослідженні впливу алергенів та забруднення повітря на дітей в Цинциннаті (Cincinnati Childhood Allergen and Air Pollution Study (CCAAPS) 9 % дітей 12-місячного віку із сімейним анамнезом (у батьків) респіраторної алергії відповідали критеріям АР [465]. В дослідженні ризику астми при забрудненні повітря у немовлят (Pollution and Asthma Risk: an Infant Study (PARIS)) 9,1 % 18-місячних дітей мали симптоми, подібні до АР, та виражену асоціацію з атопією і сенсибілізацією до інгаляційних алергенів. Серед них 23,7 % мали ринокон’юнктивіт [466]. У дослідженні з аналізом історій хвороби 29 662 дітей із Сполучених Штатів частота встановленого лікарем діагнозу АР протягом першого року життя становила 1 %. З 1- до 5-річного віку захворюваність становила від 3,6 до 4,5 %, з найвищою захворюваністю від 2 до 3 років [467]. Це в цілому відповідає оцінкам частоти сезонного АР від 3 до 4 % у віці від 3 до 7 років, що зареєстрована в 1314 немовлят у Німеччині [468].
У лонгітудинальних дослідженнях АР часто трапляється вперше в дитинстві і його поширеність збільшується з віком [467–471]. Більшість дітей із симптомами АР на початку життя мають стійкі симптоми протягом декількох років [469–471]. В міжнародному дослідженні астми та алергії у дитинстві (Study of Asthma and Allergies in Childhood (ISAAC)) оцінювали поширеність алергічних захворювань у 2 різних вікових групах: від 6 до 7 років і від 13 до 14 років.
Приблизно за 7 років (діапазон від 5 до 10 років) були проведені два перехресних дослідження. В цілому спостерігалося збільшення поширеності ринокон’юнктивіту між цими 2 дослідженнями [10]. Проте існували географічні відмінності як у базовому періоді, так і в періоді спостереження; отже, складно визначити, чи є відмінності, що спостерігалися, репрезентативним збільшенням поширеності з часом. Частка дітей із симптомами ринокон’юнктивіту була вищою у старшій віковій групі. Дані другого дослідження (ISAAC Phase Three, 1999–2004) свідчать про те, що в групі дітей 6–7-річного віку поширеність нинішнього ринокон’юнктивіту становила 8,3 % (діапазон між країнами від 1,8 до 24,2 %), а у віковій групі від 13 до 14 років — 15,1 % (діапазон від 4,5 до 45,1 %) [472]. У більш недавньому метааналізі всіх досліджень, проведених відповідно до протоколу ISAAC (1 430 329 дітей віком від 0 до 18 років), загальна поширеність АР становила 12,66 % [473].
Повідомляється, що ринокон’юнктивіт трохи частіше виявляється у хлопчиків, ніж у дівчаток віком від 6 до 7 років, причому у віковій групі від 13 до 14 років спостерігається протилежна тенденція [474]. Однак у всіх країнах, що пройшли дослідження, не спостерігалися відмінності, залежні від статі. Інші дослідження демонcтрують більшу поширеність АР серед хлопчиків різного віку. Наприклад, у когорті 1456 новонароджених на острові Уайт (Великобританія) поширеність риніту серед хлопчиків порівняно з дівчатами була вищою в усіх вікових групах (4 роки — 4,7 проти 2,1 %, 10 років — 14,9 проти 11,7 %, 18 років — 31,0 проти 24,0 %) [469].
V.C. Географічні варіації алергічного риніту
Для поширеності АР характерна виражена географічна варіабельність. Цьому сприяють багато факторів, і не всі вони повністю зрозумілі. Головну проблему у порівнянні показників поширеності АР між регіонами становить різниця в методах, які використовуються для набору учасників у дослідження, та відмінності в оцінці наявності захворювання. Наприклад, Bauchau і Durham [9] проводили діагностику у бельгійських пацієнтів з використанням серологічного тестування рівня IgE після позитивного телефонного скринінгу і повідомили, що поширеність АР у Бельгії становить 28,5 % (найвищий показник серед європейських країн, де проводилося оцінювання). На відміну від цього Bousquet et al. [456], проводили шкірні тести у випадковій вибірці бельгійської популяції і повідомили, що позитивній результат тесту у Бельгії дорівнює 16,4 % (один з найнижчих серед 15 країн, де проводилося дослідження).
Було докладено значних міжнародних зусиль для порівняння варіацій національної поширеності АР з використанням стандартизованих методів (наприклад, ECRHS та ISAAC). Ці дослідження показують виражені географічні відмінності за параметрами «сінна лихоманка або назальна алергія» (дорослі) або «чи є проблема з чханням, або нежитем, або заблокованим носом, коли не було впливу фактора холоду або грипу, що супроводжується свербежем або сльозотечею з очей?» (діти). Більш висока поширеність позитивних відповідей спостерігається у людей, які живуть у англомовних країнах (наприклад, Великобританії, Австралії, Новій Зеландії), більш низька поширеність — у Східній Європі порівняно із Західною Європою, і діагноз АР частіше спостерігається в країні з більш високими показниками астми та сенсибілізацією до сезонних алергенів [455, 475]. Оскільки ці дослідження оцінювали національні рівні поширеності на основі даних, наданих лише одним або кількома центрами у кожній країні, можуть бути пропущені значні варіації показників у цих країнах. Диференціація між сезонним та цілорічним АР є важливим фактором для розуміння впливу географічного розташування, але це не розглядається в дослідженнях ECRHS та ISAAC. Менші дослідження цілорічного АР у більш обмежених географічних регіонах свідчать про підвищені показники чутливості в міських умовах і більш холодному кліматі [476–479]. Щодо цих відмінностей було висунуто кілька гіпотез. Li et al. [477] висловили припущення, що міські мешканці проводять більше часу в приміщенні порівняно з сільськими мешканцями, це посилює вплив на них кліщів домашнього пилу, і, можливо, призводить до підвищення сенсибілізації до цих цілорічних алергенів. Крім того, деякі повідомлення свідчать про те, що вплив міських забруднювачів може асоціюватися з підвищеним ризиком розвитку АР у дітей [476]. Географічна широта також має певний плив на розвиток цілорічного АР. Наприклад, поширеність персистуючого АР виявилася вищою як у Північній Європі, так і у Північному Китаї порівняно з південними регіонами цих географічних територій [9, 477].Також широта може бути важливим фактором, що визначає сезонний АР. Алергенні рослини можуть бути поширеними в певних географічних місцях, а концентрації пилку різних видів залежать від кліматичних умов регіону. Холодніший клімат у північних широтах має тенденцію до більш коротких сезонів зростання рослин, і багато алергенних рослин не ростуть у вкрай північному кліматі. Наприклад, пилок трави, який зустрічається в Європі, викликає широкі відмінності в атопічній сенсибілізації в різних регіонах із різним кліматом [480]. Крім того, навколишнє середовище чинить підвищений вплив на розвиток АР і симптоми атопічних захворювань носа у пацієнтів [481, 482].
У цілому покращення знань про поширеність і сезонні варіації АР на основі географічного розташування є важливим, оскільки дозволяє пацієнтам передбачати і краще управляти своїми симптомами за допомогою методів профілактики та попереднього використання фармакологічних методів лікування [480, 482]. Для розширення розуміння епідеміології цього захворювання необхідні різні фенотипи АР та подальші дослідження.
VI. Фактори ризику алергічного риніту
VI.A. Генетика
Відомо, що АР є сімейним захворюванням, і одним з найбільш виражених факторів ризику є наявність захворювання у членів сім’ї першого ступеня споріднення [483]. Дослідження близнюків підтримують генетичну основу АР з більш високими показниками конкордантності для АР у монозиготних близнюків порівняно з дизиготними близнюками [484, 485]. Припускається, що передбачувана спадковість АР становить від 70 до 80 %. Подібно до багатьох комплексних захворювань жоден ген або поліморфізм не пояснює спадковий вплив на АР. Натомість багато генів і кілька варіантів, кожен із невеликими ефектами, сприяють ініціації захворювання, його персистенції і ступеню тяжкості. У цьому розділі розглянуто дані сучасної літератури з генетики АР, включаючи дослідження генів-кандидатів та нещодавні широкомасштабні дослідження геномної асоціації (ДГА). Крім того, коротко розглядаються ефекти взаємодії «ген — середовище» та епігенетичні дослідження.
Однонуклеотидний поліморфізм, асоційований з АР
Дослідження геномної асоціації. ДГА з неупередженим підходом, що включають сотні тисяч варіантів загальних генів або однонуклеотидні поліморфізми (ОНП), успішно визначили важливі варіанти складних захворювань протягом останнього десятиліття. Станом на вересень 2016 року було опубліковано п’ять ДГА з АР (або сінної лихоманки). Однонуклеотидний поліморфізм у багатому на лейцин протеїні 32, який має фрагменти, що повторюються (LRRC32), був вірогідно асоційований з АР в 3 ДГА [486–488], а також із астмою [487, 489], екземою [488, 490] та іншими пов’язаними з алергією захворюваннями [486, 489, 491]. На протеїновому рівні LRRC32 регулює проліферацію Т-клітин, секрецію цитокінів і активацію TGF-β [492]. Ці взаємодії пропонують спільні генетичні механізми для АР та інших захворювань, пов’язаних з алергією, докази, які підтверджуються широкомасштабними ДГА алергії на котів, кліщів домашнього пилу та пилок (так само як АР), у яких виявлено 16 локусів загальної сприйнятливості з вираженою асоціацією (p < 5 • 10–8; найвища позиція у TLR-локуса) [487]. У супроводжуючому ДГА алергічної сенсибілізації спостерігалося виражене перекриття найвищих позицій для сенсибілізації та самовстановленої алергії [487, 493]. У ДГА Ferreira та співавт. [489] 11 варіантів асоціювалися з комбінованим фенотипом астми і сінною лихоманкою нижче рівня вірогідності геному (HLA-DQB1). TLR відіграють вирішальну роль в імунній регуляції. У ДГА та в дослідженнях генів-кандидатів (TLR8) ОНП в різних TLRs асоціювався з АР (TLR1, TLR6, TLR10) [486, 487], про що йдеться в наступному параграфі [494]. На додаток до загальних генетичних ефектів між різними захворюваннями, пов’язаними з алергією, спостерігалося виражене перекриття між локусами схильності до алергії та автоімунних захворювань [495].
Дослідження генів-кандидатів. Підхід генів-кандидатів до вибору гена, відповідного до захворювання, ґрунтується на попередніх асоціаціях, про які повідом-лялося в ДГА, або на біологічних особливостях, які можуть бути актуальними для ризику захворювання. Дослідження АР з використанням цього підходу виявили декілька реплікованих генів [496–498]. Слід зазначити, що ОНП у генах, що беруть участь у презентації антигена (наприклад, HLA-DQA1), розпізнаванні патогенів (TLR2, TLR7, TLR8), IL-сигналінгу і прозапалення (IL13, IL18 і TSLP), вважаються важливими варіантами визначення ймовірності АР [496–502].
Нещодавно було повідомлено про наявність в імунних клітинах крові функціональних доказів для генетичних варіантів нейротрофічного фактора, отриманого з головного мозку (BDNF), секреторного прозапального білка, який був пов’язаний з патогенезом АР [503]. Проте багато з генів-кандидатів, про які повідомлялося в літературі, не були добре відтворені в різних дослідженнях і популяціях [427, 504]. Це може бути пояснене недостатньою статистичною потужністю, пов’язаною з малими розмірами вибірки, непослідовним визначенням фенотипу або відсутністю справжньої асоціації хвороб. Крім того, рідкісні дослідження, орієнтовані на гени-кандидати, не були особливо успішними [494]. Особливо необхідне вивчення генів-кандидатів для аналізу гіпотез і функціонального генетичного аналізу, наприклад, у популяціях зі специфічним впливом навколишнього середовища або зі змішаним етнічним походженням.
Взаємодії «ген — середовище» та епігенетичні ефекти
Епігенетичні механізми, визначені як зміни у фенотипі або експресії генів, викликані іншими механізмами (наприклад, метилювання), ніж зміни в основній послідовності ДНК, були запропоновані як зв’язок між генетичними та екологічними факторами. Недавні дослідження показують, що на метилювання ДНК у дітей дуже сильно впливають відомі фактори ризику алергічних захворювань, такі як куріння матері під час вагітності [505] та вплив забруднення повітря [506]. На цей час невідомо, чи ці зміни метилювання є причинно пов’язаними з розвитком АР та астми, або ці біомаркери є виключно маркерами впливу. Кілька досліджень переконливо пов’язували профілі метилювання з AР [507–509] і IgE [510, 511], але великі дослідження ще не завершені.
Отже, наявність АР у сімейному анамнезі залишається фактором ризику розвитку цього захворювання, і було встановлено його виражену асоціацію з генами, що беруть участь в активації Т-клітин (наприклад, LRRC32) і вродженим імунітетом (наприклад, TLR). В останніх великомасштабних дослідженнях були чітко визначені спільні генетичні механізми АР та інших захворювань, пов’язаних з алергією. Однак є необхідність функціональної характеристики варіантів генів-кандидатів для розуміння механізмів, що лежать в основі патогенезу АР. Зі збільшенням доказів ролі епігенетики в розвитку АР майбутні дослідження також мають бути сфокусовані на вивченні епігенетичних механізмів, забезпечуючи тим самим пояснення зв’язку між впливом навколишнього середовища, генетичними варіантами і розвитком хвороби.
Сукупний рівень доказів: C (рівень 2a: 5 ДГА. Дослідження генів-кандидатів не оцінені щодо ступеня доказовості).
VI.B. Вплив інгаляційних алергенів (внутрішньоутробний вплив та вплив у молодшому дитячому віці)
АР характеризується втратою імунологічної та клінічної толерантності до певного алергену. Це включає продукцію специфічних IgE (sgE), які спричиняють розвиток алергічного запалення у відповідь на контакт з алергеном. Саме тому sgE є візитною карткою алергії, а їх утворення визначає розвиток сенсибілізації. Сенсибілізація являє собою складний процес, який регулюється генетичними та екологічними чинниками та потребує первинного впливу відповідного алергену. У разі відсутності контакту людини з певним алергеном розвиток сенсибілізації до цього алергену не відбувається. З іншого боку, слід розрізняти поняття сенсибілізації та алергії. Алергія, яка передбачає розвиток симптомів після сенсибілізуючого впливу тригерного агента, відрізняється від сенсибілізації. Алергія не може існувати без сенсибілізації, але сенсибілізація може існувати без алергії. В поданому розділі буде розглянуто вплив інгаляційних алергенів під час внутрішньоутробного розвитку плода та в молодшому дитячому віці, а саме вплив алергенів кліщів, пилку рослин, епідермісу тварин та грибкових алергенів.
Кліщі
На сьогодні є дані 6 досліджень, присвячених питанням раннього впливу алергенів кліщів на розвиток АР. У більшості досліджень не вдалося продемонструвати чіткий зв’язок між раннім впливом алергенів кліщів та розвитком АР [468, 516–519]. Marinho та співавт. [520] повідомляють, що ранній вплив алергенів кліщів домашнього пилу (КДП) не відіграє роль захисного чинника при наявному АР, у той час як Kim та співавт. [521] вказують на те, що вплив алергенів павутинних кліщів є фактором ризику виникнення АР. Слід зауважити, що нерідко домашні тварини виступають джерелом кліщів, адже останні часто розміщуються на їх шерсті; це, в свою чергу, може призводити до неправильної оцінки АР та, як наслідок, вибору тактики лікування. Загалом наявні на даний момент результати досліджень щодо раннього впливу алергенів кліщів та розвитку АР суперечливі та потребують проведення додаткових досліджень.
Загальний рівень доказовості: C (рівень 2b: 5 досліджень; рівень 3b: 1 дослідження).
Пилок рослин
Є тільки 2 дослідження, в яких вивчали ранній вплив пилку рослин на розвиток АР. Згідно з даними Kihlstrom та співавт. [519], не виявлено зв’язку між впливом пилку рослин та розвитком алергічного ринокон’юнктивіту, в той час як Erbas та співавт. зазначають, що вплив алергену пилку в період новонародженості може виступати фактором ризику виникнення сезонного алергічного риніту.
Загальний рівень доказовості: C (рівень 2b: 1 дослідження; рівень 3b: 1 дослідження).
Епідерміс тварин
У численних дослідженнях проводили аналіз можливого зв’язку раннього впливу алергенів епідермісу тварин на подальший розвиток АР; але отримані результаті містять суперечливі дані. Усі проведені дослідження можна розподілити за отриманими результатами: на позитивні дослідження (повідомляють про захисний ефект на розвиток АР [522–535]), негативні дослідження (показують, що ранній вплив алергенів епідермісу домашніх тварин є фактором ризику розвитку АР [523, 536–542]) і нейтральні дослідження (свідчать, що ранній вплив алергенів епідермісу тварин не пов’язаний із розвитком АР [468, 517, 518, 520, 524, 528, 530, 532, 536, 538, 539, 543–554]). Слід також враховувати наявність додаткових факторів, таких як вік, стать та вид тварини; кількість домашніх тварин; характеристики будинку; схильність власників домашніх тварин до атопії та інші. Враховуючи комплекс зазначених параметрів, триває полеміка щодо раннього впливу алергенів епідермісу тварин на розвиток алергічних захворювань. Таким чином, неможливо запропонувати засновані на доказах рекомендації щодо утримання домашніх тварин (див. розділ VI.G.2 «Вплив алергенів тварин у дитячому віці»).
Загальний рівень доказовості: C (рівень 2b: 15 досліджень; рівень 3b: 24 дослідження).
Грибкові алергени
У кількох дослідженнях оцінювали роль раннього впливу грибкових алергенів як фактора, що сприяє розвитку АР. Більшість досліджень продемонстрували докази на користь того, що ранній вплив грибкових алергенів є фактором ризику розвитку АР [527, 538, 551, 553, 555–560]. Проте згідно з результатами 3 досліджень, ранній вплив грибкових алергенів не асоційований з АР [465, 542, 557]. Рівень вологості повітря приміщення, який тісно пов’язаний з наявністю грибкових алергенів у домашніх умовах, може бути додатковим фактором, на який потрібно зважати при інтерпретації доказів зв’язку впливу грибкових алергенів на розвиток АР. Вологість повітря навколишнього середовища сама по собі може виступати невід’ємним фактором ризику, але в той же час слід враховувати, що підвищена вологість також пов’язана з підвищеним рівнем кліщів. Рівень вологості можна досить легко визначати як шляхом прямого вимірювання за допомогою гігрометра, так і опосередковано — шляхом спостереження за наявністю плям цвілі на стінах.
Загальний рівень доказовості: C (рівень 2b: 3 дослідження; рівень 3b: 10 досліджень).
Таким чином, клінічна значимість раннього впливу інгаляційних алергенів на розвиток АР досі дискутується. Незважаючи на декілька поглиблених оглядів та зростаючу кількість літературних даних [561–563], поки що залишається неможливим прийняти єдине чітке консенсусне рішення щодо користі та ризику раннього впливу інгаляційних алергенів. Висвітлення суперечливих питань з цього приводу потребує проведення подальших досліджень.
VI.C. Харчові алергени (внутрішньоутробний вплив та вплив у ранньому дитячому віці)
У деяких дослідженнях рання сенсибілізація до харчових алергенів була пов’язана з розвитком АР у дитячому віці [468, 564, 565]. Метааналіз, проведений Alduraywish та співавт. [564], продемонстрував, що сенсибілізація до харчових продуктів протягом перших 2 років життя пов’язана з підвищеним ризиком розвитку АР у дитячому віці (відношення шансів (ВШ) — 3,0; 95% ДІ 2,1–4,2). Взаємозв’язок між сенсибілізацією до харчових алергенів та подальшим розвитком АР у дитячому віці було досліджено як у популяційних когортах, так і в когортах високого ризику [468, 565–568]. В когортах з високим ризиком була отримана статистично вірогідна кореляція [567], у той час як у загальній популяції — суперечливі дані [566, 568, 569]. Отримані результати стали поштовхом до проведення подальших проспективних досліджень наслідків уникнення контакту з алергеном під час внутрішньоутробного розвит-ку та у ранньому дитинстві.
У РКД, в якому оцінювали внутрішньоутробний вплив харчових алергенів на розвиток АР, 162 вагітні з високим ризиком (анамнез респіраторної алергії на епідерміс тварин та/або пилок рослин) були рандомізовані на групи, які протягом останніх 3 місяців вагітності споживали меншу кількість курячих яєць та коров’ячого молока або щоденно вживали 1 куряче яйце та 1 літр коров’ячого молока. Загалом під спостереженням перебувало 163 немовляти, які знаходились під наглядом до 18-місячного віку. Частоту розвитку атопічних захворювань, включаючи АР, оцінювали сліпим методом. Не було отримано вірогідної різниці в частоті розвитку АР між 2 групами [570]. В іншому РКД обмежена дієта під час вагітності (виключення з раціону коров’ячого молока та курячих яєць, починаючи з 28-го тижня вагітності і до пологів) була пов’язана з невеликим, але статистично вірогідно нижчим середнім значенням гестаційного набору маси тіла, що в подальшому не продемонструвало захисного ефекту щодо розвитку атопії [571]. Узагальнені результати 2 досліджень дозволяють припустити, що уникнення контакту з алергеном може бути пов’язаним із більш високим ризиком передчасних пологів і можливим несприятливим впливом на середню масу тіла немовлят при народженні без досягнення сприятливого впливу щодо попередження розвитку АР у дітей [570, 571].
У дослідженнях також було вивчено вплив раннього введення харчових продуктів порівняно зі стратегію їх уникнення відносно розвитку алергічних захворювань. У проспективному когортному дослідженні, що включало 2073 новонароджених, уповільнене введення в раціон твердих продуктів харчування (у віці 4 або 6 місяців) не було пов’язане зі зменшенням ризику виникнення АР, астми або сенсибілізації до харчових або інгаляційних алергенів у віці 6 років. Насправді, сенсибілізація до харчових продуктів частіше спостерігається у дітей, яким прикорм вводили на пізніших термінах [572]. У проспективному РКД, в якому вивчали стратегію уникнення контакту з алергенами харчових продуктів у ранньому віці, проаналізували частоту розвитку в подальшому алергічних захворювань, включаючи АР. Дизайн дослідження включав відмову вагітної від споживання коров’ячого молока, курячих яєць та арахісу протягом останнього триместру вагітності та увесь період годування груддю, в свою чергу, діти мали не споживати коров’яче молока до 1 року (гідролізат казеїну до 1 року), курячі яйця до віку 2 роки, а арахіс та рибу — до віку 3 роки. Порівняно з парами мати — немовля, які дотримувалися стандартної практики годування, новонароджені групи, де була застосована стратегія уникнення контакту, показали значне зниження показників виникнення харчової алергії та сенсибілізації до молока у віці до 2 років. Однак при досягненні 7-річного віку різниця між групами зникала. Окрім того, вірогідної різниці не було простежено у частоті виникнення АР, атопічного дерматиту, астми та інших атопічних захворювань у віці 7 років [573].
На підставі поданого метааналізу, проспективних рандомізованих досліджень і великого проспективного когортного дослідження немає даних щодо підтримки обмеження дієти матері як фактора, що запобігає розвитку харчової алергії та АР; однак є докази, що наявність харчової алергії в дитячому віці (старше 2 років) є фактором ризику розвитку АР.
Загальний рівень доказовості: A (рівень 1b: 3 дослідження; рівень 2a: 1 дослідження; рівень 2b: 1 дослідження).
VI.D. Забруднення повітря
Можливий взаємозв’язок між забрудненням повітря та розвитком АР привертає все більше уваги протягом останнього десятиліття. До речовин — забруднювачів повітря належать декілька сполук; однак більшість досліджень в основному зосереджується на вмісті у повітрі твердих частинок розмірами < 10 мкм (ТЧ10), твердих частинок розмірами < 2,5 мкм (ТЧ2,5), діоксиду азоту (NO2), діоксиду сірки (SO2), монооксиду вуглецю (CO) та озону (O3). Ці частинки можуть потенціювати атопію за допомогою безлічі механізмів, включаючи ушкодження епітелію носа, зміну імунної відповіді та збільшення алергенності деяких антигенів [574, 575]. Так, забруднення повітря може призводити до ушкодження слизової оболонки носа та порушення мукоциліарного кліренсу, тим самим полегшуючи доступ інгаляційних алергенів до клітин імунної системи [576]. Окрім того, тверді частинки повітря, включаючи вихлопи дизельного палива, здатні переносити алергени на собі, таким чином потенційно збільшуючи поширення алергенів або тривалість їх впливу [574]. У дослідженнях із проведенням назальних провокаційних проб серед осіб, чутливих до алергенів кліщів домашнього пилу (КДП), комбінована назальна провокаційна проба з алергенами КДП та дизельними вихлопними частинками призвела до посилення дегрануляції тучних клітин та зростання тяжкості симптомів риніту порівняно з пробами лише з алергеном КДП [577].
У численних дослідженнях вивчали вплив забруднювачів повітря на розвиток АР як серед дорослих пацієнтів, так і дітей. Проте у 3 проспективних когортних дослідженнях (найвищий рівень доказів, визначених для даної теми) не виявлено статистично вірогідної різниці [578–580]. Codispoti та співавт. [578] спеціально досліджували взаємозв’язок між впливом частинок дизельного палива (ЧДП) у віці 1 року і подальшим розвитком АР у віці 2, 3 і 4 років. Ними був встановлений незначний позитивний зв’язок ЧДП з аероалергенною сенсибілізацією на 2-му і 3-му році життя, а підвищена аероалергенна сенсибілізація підвищувала ризик АР. У той же час автори не змогли довести сильний прямий кореляційний зв’язок між впливом ЧДП та розвитком АР. Окрім того, Kim та співавт. [579] проаналізували вплив NO2, SO2, CO і ТЧ10 у дітей і не виявили вірогідного зв’язку з уперше встановленим діагнозом АР через 2 роки. Проте вони відзначили позитивний зв’язок між підвищеними рівнями O3 і діагнозом АР у промислових районах; концентрація О3 також значною мірою була асоційована з розвитком нових випадків сенсибілізації до зовнішніх алергенів, що може пояснити механізм відповідного збільшення поширеності АР. Нарешті, Gehring та співавт. [580] об’єднали результати 4 проспективних когортних досліджень новонароджених з періодом спостереження від 14 до 16 років і не виявили жодних ознак того, що рівні NO2, ТЧ2,5 або ТЧ10 впливали на частоту розвитку ринокон’юнктивіту.
У декількох міжнародних дослідженнях «випадок-контроль» та перехресних дослідженнях також проводили аналіз зв’язку між забрудненням повітря та розвитком АР, отримавши досить різні результати Anderson та співавт. [581] провели найбільше перехресне дослідження, в якому оцінювали вплив рівнів ТЧ10 на розвиток ринокон’юнктивіту у 322 529 дітей з 51 країни. Між країнами, що аналізувались, не було отримано зв’язку частоти розвитку риніту з модельованими рівнями забруднення, а в межах країн (24 країни мали понад 1 дослідницький центр) спостерігали слабкий позитивний зв’язок між рівнями ТЧ10 і симптомами ринокон’юнктивіту у 6-річних дітей і серед 13-річних та 14-річних дітей зі встановленим діагнозом САР. Цікавим є той факт, що автори виявили позитивний зв’язок між високими рівнями ТЧ10 та розвитком атопії [581]. Деякі дослідження в групах дітей показали позитивну кореляцію між підвищеним впливом різних забруднювачів повітря та збільшенням діагностування АР у дитячому віці [476, 557, 582–589]. Liu та співавт. [586] і Deng та співавт. [557] навіть виявили, що пренатальний/гестаційний вплив високих концентрацій NO2 пов’язаний із більш високою поширеністю АР у дитячому віці. Проте майже всі ці дослідження використовують щільність дорожнього руху поряд із домівкою або геокоди домашньої адреси для оцінки впливу місцевого забруднення. У багатьох країнах люди, які живуть у більш забруднених районах із високим рівнем дорожнього руху, можуть також мати інші додаткові ймовірні фактори, які впливають на розвиток АР (соціально-економічний статус (СЕС), вплив різних аероалергенів тощо), що не враховано у всіх дослідженнях. Окрім того, декілька з цих досліджень були обмежені конкретними містами в Азії, що, у свою чергу, обмежує можливість узагальнення даних.
Загалом зв’язок між забрудненням повітря та роз-витком АР у даний час залишається неясним. Для кращого розуміння проблеми потрібні подальші проспективні дослідження серед дорослих та дітей, що матимуть місце в різних географічних регіонах.
Загальний рівень доказовості: C (рівень 2b: 3 дослідження; рівень 3b: 2 дослідження; рівень 4: 9 досліджень).
VI.E. Тютюновий дим
Розвиток АР часто пов’язаний як з активним, так і з пасивним (вторинним) впливом тютюнового диму. Проте патофізіологічні механізми, що стоять за цим взаємозв’язком, є досить складними та часом супе-речливими. Дослідження показали, що вплив тютюнового диму може сприяти розвитку атопічних захворювань завдяки декільком механізмам, включаючи пряме ушкодження слизової оболонки носа, порушення епігенетичних механізмів внаслідок процесу ацетилювання гістонів, експресії мікроРНК та метилювання ДНК [590, 591]. Додатково також було встановлено, що нікотин може спричиняти імуносупресивну дію на перебіг алергічних захворювань шляхом пригнічення функціонування еозинофілів та Th2-цитокінової/хемокінової відповідей [592].
Нещодавно було опубліковано результати 2 великих метааналізів, в яких була зроблена спроба більш чітко визначити взаємозв’язок між впливом тютюну та розвитком АР. Saulyte та співавт. [593] виявили сильну кореляцію між пасивним курінням та розвитком АР, але не встановили вірогідного зв’язку між активним або пасивним курінням матері у пренатальному періоді та виникненням АР. Проте автори продемонстрували вірогідний кореляційний зв’язок між активним курінням та неалергічним/хронічним ринітом. Hur та співавт. [594] також провели систематичний аналіз зв’язку пасивного куріння та АР. Згідно з результатами метааналізу, підтверджено такий зв’язок у популяції дорослих, але не серед дітей. Отримані дані вірогідно вказують на те, що клінічні прояви атопічного впливу пасивного куріння на слизову оболонку носа можуть проявлятися через кілька років. Так, Lin та співавт.
[595] виявили, що дорослі з алергічними захворюваннями мали в анамнезі вплив пасивного куріння близько 20 років тому на відміну від осіб без алергії.
У п’яти проспективних когортних дослідженнях вивчали вплив тютюну на розвиток АР, і в жодному не знайдено кореляції між активним або пасивним курінням та розвитком АР [596–600]. Keil та співавт. [596] виявили, що в той час як вплив пасивного куріння не був вірогідно пов’язаний з розвитком АР, він був асоційований з виникненням алергічної сенсибілізації та симптомами астми у дітей з генетичною схильністю (принаймні в одного з батьків в анамнезі є атопічні захворювання). Окрім того, Wright та співавт. [597] зазначають, що, незважаючи на відсутність вірогідного зв’язку між пасивним курінням та АР, у 63 % астматиків, народжених від завзятих курців, у перші 6 місяців від народження спостерігали симптоми риніту порівняно з 43 % астматиків, матері яких не курили. Нарешті, Bendtsen та співавт. [598] виявили, що активне куріння (понад 15 сигарет у день) фактично знижує ризик розвитку АР у пацієнтів.
Ця обернена кореляція була виявлена в низці інших досліджень [124, 601–603]. Eriksson та співавт. [124] зазначають, що хоча куріння пов’язане з високою поширеністю в цілому хронічного риніту як у чоловіків, так і у жінок, у той же час відзначається низька поширеність АР серед чоловіків. Крім того, автори виявили значно нижчу поширеність сенсибілізації до поширених повітряних алергенів у осіб, які продовжують активно курити, та у тих, хто кинув курити. На противагу цьому був виявлений сильний позитивний зв’язок між тютюнокурінням та розвитком неалергічного/хронічного риніту [124, 128, 604]. Саме тому при обговоренні цього питання важливим є розрізняти, про що йде мова, — про алергічний або неалергічний/хронічний риніт.
Також слід зазначити, що куріння не впливає на ефективність лікування АР. Katotomichelakis та –співавт. [605] проаналізували історії 163 пацієнтів (як курців, так і тих, хто не курить), які отримували сублінгвальну імунотерапію (СЛІТ) з приводу АР, і виявили, що незалежно від статусу тютюнокуріння у пацієнтів однаковою мірою відзначали покращення перебігу захворювання та загального балу згідно з опитувальником якості життя. В цілому, незважаючи на те, що більшість досліджень, присвячених цьому питанню, є перехресними або дослідженнями «випадок-контроль», наявні результати кількох проспективних когортних досліджень і 2 систематичних оглядів, які також не виявили кореляції між активним або пасивним впливом куріння та розвитком АР. Окрім того, частина досліджень вказує, що вплив тютюнового диму може мати захисний ефект відносно розвит-ку АР. Для більш чіткого розуміння даного питання потрібні подальші дослідження, щоб визначити, чи можлива зміна наших уявлень при вивченні окремих популяцій пацієнтів (наприклад, астматики або особи, у яких хоча б один із батьків має атопічне захворювання) або змінних параметрів (наприклад, вплив тютюну протягом понад 20 років).
Загальний рівень доказовості: C (дослідження рівня 2a: 1 дослідження; рівень 2b: 5 досліджень; рівень 3a: 1 дослідження).
VI.F. Соціально-економічні фактори
У 1829 році Джон Босток описав, включаючи себе, 29 випадків Catarrhus aestivus, або «літньої застуди», у Великобританії, яку він спостерігав у пацієнтів середнього та високого рівня соціально-економічного статусу (СЕС) [606]. Протягом 1870-х років Блеклі не виявив жодного випадку САР серед фермерів і людей, що живуть у малозабезпечених районах міст. Наявність позитивних кореляційних зв’язків між САР та високим рівнем СЕС пізніше відзначена у британських когортних дослідженнях 1958 і 1970 рр. [607, 608], а також у шведському дослідженні призовників, народжених у період з 1952 по 1977 рік [609]. Хоча у подальшому було відмічено, що з часом зв’язок слабшав, розрахований показник ВШ серед осіб із низьким СЕС коливався в межах 0,79–0,92.
У 2000 році була опублікована стаття на підставі результатів дослідження Німецької когорти з вивчення алергії (MAS), яке включало 1314 дітей, народжених у 1990 році [610]. У цьому дослідженні було встановлено, що поширеність САР протягом життя була вище серед батьків із високим рівнем СЕС порівняно з батьками з низьким рівнем соціально-економічного життя. Однак при цьому підвищення частоти САР у дітей таких батьків не відзначено. У той же час результати шведського когортного дослідження BAMSE, яке включало 4089 дітей, народжених у період між 1994 і 1996 роками, зазначають, що високий рівень СЕС фактично призводив до зниження ризику розвитку АР, астми та розвитку сенсибілізації до харчових алергенів [611]. У нещодавніх дослідженнях, що проводились в Данії і охоплювали 9720 дітей, народжених у період між 1994 і 2006 роками, частота виникнення АР була пов’язана з низьким рівнем освіти батьків [612]. Цікавим є той факт, що під час подальшого спостереження за учасниками дослідження MAS було відзначено, що СЕС взагалі не відігравав роль фактора ризику розвитку АР у віці до 20 років [613]. Таким чином, високий рівень СЕС був асоційований із ризиком розвитку АР серед дітей, народжених до 1970-х років у західних країнах, у той же час серед дітей, народжених у тих же регіонах після 1990-х років, низький рівень СЕС, особливо на початку життя, ставав фактором ризику [614].
Нещодавні 2 дослідження, проведені у Кореї, підтвердили раніше зазначений зв’язок між високим рівнем СЕС та розвитком АР. Ahn та співавт. [478] виявили позитивний кореляційний зв’язок між більш високим рівнем доходу сім’ї та частотою встановлення діагнозу АР на підставі відповідної симптоматики (але не за результатами шкірних алергологічних тестів). Lee
та співавт. [615] також відзначали, що сімейний достаток або високий рівень СЕС є важливим фактором ризику АР у корейських підлітків. Однак додаткові нещодавні дослідження, проведені у Південній Америці та Європі, показали суперечливі результати. У 2016 році Penaranda та співавт. [616] виявили, що високий рівень СЕС пов’язаний із розвитком АР у дітей/підлітків, але не у дорослих. У той ж час Wronka та співавт. [617] зазначають значно вищу частоту АР серед студенток університету (вік від 19 до 25 років) із родин з високим СЕС.
У цілому СЕС, імовірно, є непрямим показником впливу різних додаткових факторів, таких як кількість братів і сестер, вірусні інфекції, вплив тютюнового диму, умови проживання та місце розташування будинку, вплив алергенів, дієтичні фактори та харчування, включаючи грудне вигодовування та харчування загалом. Деякі з цих факторів пов’язані з гігієнічною гіпотезою, що була запропонована Strachan [618] наприкінці 1980-х років. Однак варто відзначити, що вплив факторів, що мали значення в гігієнічній гіпотезі, був предиктором розвитку АР у ранньому віці [614].
На сьогодні існують суперечливі докази щодо зв’язку між СЕС та АР. Хоча більшість досліджень свідчить на користь наявності зв’язку між високим СЕС і встановленням діагнозу АР, результати їх є непослідовними. Цю невідповідність можна пояснити додатковими факторами, аналіз яких був проведений у деяких із цих досліджень, що можуть впливати на точність взаємозв’язку між СЕС та АР. Окрім того, може існувати тимчасовий зв’язок між СЕС та АР, з огляду на різні результати, отримані у дітей порівняно з дорослими. Потрібне проведення додаткових досліджень для встановлення взаємозв’язку АР та СЕС.
Загальний рівень доказовості: C (рівень 2b: 4 дослідження; рівень 4: 6 досліджень).
VI.G. Захисні фактори, що попереджають розвиток АР
VI.G.1. Грудне вигодовування
Грудне вигодовування асоційоване з декількома позитивними наслідками для здоров’я матері та дитини і тому рекомендоване всім новонародженим [619]. Однією з потенційних його переваг є профілактика алергічних захворювань [620]. Грудне молоко є імунологічно складним розчином, що містить кілька сполук, які підтримують ріст дитини та сприяють розвитку імунної системи [621, 622]. Зв’язок між грудним вигодовуванням і профілактикою алергічних захворювань часто вивчали, так само часто це питання було предметом дискусій.
Mimouni Bloch та співавт. [623] провели метааналіз проспективних досліджень, в яких зроблена оцінка впливу винятково грудного вигодовування протягом перших 3 місяців життя на розвиток АР. Шість проспективних досліджень відповідали критеріям включення. У своєму об’єднаному аналізі автори зазначають захисний ефект ізольованого грудного вигодовування протягом перших 3 місяців життя, отримані результати наближаються до статистичної значущості в загальній популяції (OR 0,74; 95% ДІ 0,54–1,01). Цікаво, що захисний ефект не спостерігався у дітей із сімейним анамнезом атопічних захворювань (OR 0,87; 95% ДІ 0,48–1,58).
Нещодавно Lodge та співавт. [624] провели систематичний огляд та метааналіз (2015). Автори намагалися оцінити зв’язок між грудним вигодовуванням та частотою АР, усього проаналізовано результати 5 когортних досліджень [550, 599, 607, 625, 626] та 11 перехресних досліджень [627–637]. Кількість учасників коливалась від 361 до 13 889 у когортних дослідженнях та від 1402 до 206 453 у перехресних дослідженнях. Об’єднаний аналіз результатів різних досліджень виявив незначний захисний ефект грудного вигодовування щодо розвитку АР (ВШ 0,92; 95% ДІ 0,84–1,01). У подальшому результати були стратифіковані за частотою АР у різних вікових групах. Після стратифікації за віком відзначено, що зниження ризику АР у пацієнтів віком до 5 років асоційоване з грудним вигодовуванням (ВШ 0,79; 95% ДІ 0,63–0,98). Однак після 5-річного віку такий зв’язок вже не простежувався (ВШ 1,05; 95% ДІ 0,99–1,12). Незважаючи на те, що автори цього метааналізу висловлювалися на користь грудного вигодовування у профілактиці АР, вони визнають, що захисний ефект грудного вигодовування, який спостерігається у пацієнтів молодше 5 років, може бути зумовлений відомими захисними ефектами грудного молока проти вірусних респіраторних інфекцій. Автори висунули гіпотезу, що, з огляду на труднощі диференціації між АР та вірусним ринітом у дітей раннього віку, зменшення вірусних респіраторних інфекцій, можливо, трактується як зниження частоти виникнення симптомів риніту [624].
Загальний рівень доказовості: C (дослідження рівня 3a: 2 дослідження).
Користь: можливий корисний ефект грудного вигодовування у зниженні частоти розвитку АР, особливо у дітей раннього віку.
Шкода: немає. Ніякі дослідження не виявили несприятливого впливу грудного вигодовування протягом 6 місяців.
Вартість: низька.
Оцінка співвідношення користь/шкода: лише корисний ефект.
Висновки про цінність: є дані про те, що грудне вигодовування може знизити ризик розвитку АР без виникнення будь-яких несприятливих ефектів. З огляду на загальну користь для матері та дитини грудне вигодовування протягом 4 і, можливо, 6 місяців рекомендоване.
Рівень впровадження: наявні поточні докази свідчать на користь переваги грудного вигодовування з метою профілактики АР. Загалом, грудне вигодовування має бути рекомендоване завдяки його численним перевагам.
Втручання: грудне вигодовування, як правило, рекомендоване протягом щонайменше 4 місяців завдяки його численним перевагам. Слід розглядати як варіант попередження розвитку АР.
VI.G.2. Контакт із домашніми тваринами в дитинстві
Серед осіб, які чутливі до алергенів тварин, контакт із ними може посилювати симптоми захворювання. Проте дані стосовно зв’язку утримання домашніх тварин у дитинстві з подальшим розвитком АР суперечливі, а сам такий зв’язок важко встановити (див. розділ VI.B «Фактори ризику алергічного риніту — Інгаляційні алергени (у внутрішньоутробному та ранньому дитячому віці) — Епідерміс тварин» для отримання додаткової інформації за цією темою).
Поширеність утримання домашніх тварин використовується для оцінки впливу алергенів домашніх тварин. У той же час власники домашніх тварин часто контамінуються алергенами тварин, що призводить до впливу на загальну популяцію через соціальні контакти. Таким чином, не існує популяції, яка б взагалі не мала контакту з алергенами тварин, що обмежує нашу здатність чітко зрозуміти взаємозв’язок між впливом алергенів тварин і розвитком АР. Початковий вплив алергенів тварин залежно від віку дитини, починаючи від народження, може стати важливим фактором дозрівання імунної системи. Саме тому часто проводять аналіз впливу тваринних алергенів у перинатальному періоді та періоді новонародженості. У декількох дослідженнях вимірювали концентрацію основного алергену котів (Felis catus — Feld1) або собак (Canis familiaris — Canf1) у домашньому пилу. Найчастіше більшість досліджень лише повідомляють про наявність контакту з кішкою та/або собакою або іншими домашніми улюбленцями — від гризунів до птахів. У систематичному огляді епідеміологічних досліджень, присвячених алергії та астмі, лише у 10 з 96 досліджень рекомендовано уникати контакту з тваринами [638]. Окрім того, в дослідженнях часто можуть бути не враховані змішані змінні, такі як сімейний анамнез алергії на домашніх тварин, що, в свою чергу, може обумовлювати уникнення контакту з тваринами дітей із можливою атопією.
Існує значна невідповідність між утриманням домашніх тварин у дитинстві та розвитком алергії в подальшому. Ці суперечливі результати можуть бути обумовлені з такими демографічними факторами, пов’язаними з утриманням домашніх тварин, як расова приналежність, проживання в місті або сільській місцевості, розмір сім’ї та СЕС. Згідно з метааналізом, у 32 дослідженнях відзначено нижчу поширеність АР серед осіб, які утримують хутрових домашніх тварин, — дані перехресних досліджень — та нижчу частоту астми серед власників котів. У більшості когортних досліджень новонароджених вплив собак у періоді раннього дитинства захищав від розвитку сенсибілізації до аероалергенів [640, 641]. На противагу цьому результати перехресних досліджень вказують на непослідовний зв’язок між контактом з алергенами кішки або собаки та розвитком сенсибілізації, а в подальшому — атопічних захворювань [562, 640].
Вплив уникнення контакту з домашніми тваринами на розвиток АР найкраще простежений у повздовжніх когортних дослідженнях. Систематичний огляд 9 досліджень, проведених винятково в міських умовах, оцінював вплив алергенів тварин у перинатальному періоді [642]. У шести дослідженнях було показано, що утримання собак або котів попереджує розвиток алергічних захворювань. Два дослідження виявили підвищений ризик алергії тільки у родинах із високим ризиком атопічних захворювань. Крім того, у когорті з 620 дітей із сімейним анамнезом алергічних захворювань вплив контакту з котами або собаками виявляв захисний ефект лише у дітей, батьки яких не мали алергічного анамнезу [534].
В об’єднаному аналізі результатів 11 європейських когорт новонароджених утримання будь-яких домашніх тварин протягом перших 2 років життя дитини було пов’язане з меншим ризиком виникнення сенсибілізації до аероалергенів, але не зі зменшенням поширеності АР у більш пізні роки [552]. У нещодавньому дослідженні, в якому вивчали відмінності між міськими та сільськими мешканцями, було виявлено, що ризик розвитку АР у дорослому віці на 20 % нижчий у осіб, які контактували з тваринами при народженні або в дитинстві. Проте утримання домашніх тварин не пояснює захисного ефекту від життя на фермі поряд із сільськогосподарськими тваринами порівняно з мешканцями міст [643].
У цілому алергени тварин поширені повсюдно. Немає жодних доказів того, що уникнення утримання тварин у дитячому віці запобігає розвитку АР або сенсибілізації до аероалергенів пізніше в житті. Ранній вплив алергенів тварин може викликати імунну толерантність і тим самим зменшити ймовірність розвитку алергічного захворювання. Цей захисний ефект, імовірно, найбільш виражений у родинах без алергологічного анамнезу, в яких собаки утримуються з раннього дитинства.
Загальний рівень доказовості: C (дослідження рівня 2a: 6 досліджень; рівень 2b: 2 дослідження).
VI.G.3. Гігієнічна теорія (біологічне різноманіття або мікрофлора)
Зворотний зв’язок між кількістю братів і сестер та частотою розвитку САР повідомлявся ще майже 3 десятиліття тому на підставі дослідження в британських когортах [618]. Strachan [618] запропонував термін «гігієнічна теорія» і припустив, що часті інфекційні захворювання у великих родинах можуть бути захисним фактором.
У подальшому гігієнічна теорія трансформувалась у більш сучасну теорію біологічного різноманіття, яка виходить за межі впливу лише інфекцій і захисної дії окремих мікроорганізмів та охоплює потенційний захисний ефект колонізації слизових оболонок та шкіри різноманітною екологічною мікрофлорою [644]. Нещодавно був запропонований термін «теорії мікробіоти», в якому у подальшому було рекомендовано змінити поняття «мікробіота» на «мікрофлора». В поданому розділі будуть розглянуті окремі пов’язані потенційні кофактори та їх зв’язок із розвитком АР.
Кількість братів і сестер. Широко вивчається зв’язок між кількістю братів і сестер та наявністю алергічних захворювань. Метааналіз 53 досліджень виявив, що, за даними 48 досліджень, більша кількість братів і сестер була пов’язана зі зменшенням частоти розвитку алергічних захворювань. Більшою мірою така тенденція простежувалась для АР порівняно з розвитком сенсибілізації та астми [645]. Результати великого дослідження, що було засноване на даних, отриманих при анкетуванні дітей віком від 6 до 7 років із 31 країни і від 13 до 14 років з 52 країн, підтвердили, що зворотний кореляційний зв’язок між кількістю старших братів і сестер та поширеністю САР був найсильнішим у більш багатих країнах [646].
Сільське господарство. З перших публікацій 1999–2000 рр. почав зростати інтерес до так званого фермерського ефекту на розвиток алергії. У метааналізі 8 досліджень ризик сенсибілізації в дорослому та дитячому віці, що оцінювався за допомогою рівня сироваткового IgE або результатів шкірних алергологічних тестів, був на 40 % нижчим (ВШ 0,60; 95% ДІ 0,52–0,70) серед осіб, які проживали у сільській місцевості протягом першого року життя [647].
У нещодавньому американському дослідженні «випадок-контроль» зазначається захисний вплив проживання у сільській місцевості під час внутрішньоутробного розвитку та в періоді раннього дитинства стосовно розвитку сенсибілізації у дорослому віці. Подібний ефект відносно розвитку в подальшому астми не спостерігався [648]. Захисний ефект був більшим за наявності контакту з сільськогосподарськими тваринами та перебування у стайні [522, 649–655], а також якщо найбільший вплив припадав на ранні роки життя [650].
Бактеріальний ендотоксин. Як захисний фактор було досліджено вплив бактеріальних ендотоксинів. Виявлений зворотний кореляційний зв’язок між впливом ендотоксину в період новонародженості та в дитячому віці та розвитком алергічної сенсибілізації, що простежено серед мешканців міст і сільської місцевості. В той же час відзначено неоднорідність результатів за даними різних досліджень [656, 657].
Пробіотики. Метааналіз 29 рандомізованих конт-рольованих досліджень не виявив вірогідного зв’язку між прийомом пробіотиків жінками під час вагітності та годування груддю або немовлятами та розвитком сенсибілізації або алергічного риніту у віці від 12 до 36 місяців [658] (див. додаткову інформацію з цієї теми).
Мікробне різноманіття. Зміни способу життя, урбанізація, особливості харчування та прийом антибіотиків змінили мікробіоту навколишнього середовища, шкіри людини та слизових оболонок. Відмінності мікробіоти можуть пояснити різницю поширеності атопічних захворювань серед мешканців сільської місцевості та міст, а також між Фінляндією та російською Карелією (частина Росії, що географічно межує з Фінляндією) [659–661]. Домогосподарства, в яких утримуються собаки, мають багату різноманітну мікробіоту домашнього пилу зі значною концентрацією видів Firmicutes і Bacteroides [662].
У дослідженні GABRIEL за допомогою кількісного аналізу ДНК вивчали пил матраців фермерських дітей та контрольної групи. Особливо високі рівні збудників видів Mycobacterium, Bifidobacteriaceae, Clostridium були відзначені в групі фермерських дітей, що було обернено пропорційно пов’язано з частотою розвитку алергічних захворювань [661].
Низька різноманітність мікробіоти кишечника в ранньому дитинстві асоційована з більш високим ризиком розвитку астми та сенсибілізації згідно з даними деяких повздовжніх досліджень з різним дизайном [442, 445, 449, 663]. Дисбіоз мікробіоми, обумовлений збільшенням числа бактероїдів та зменшенням таксонів Clostridia у дорослому віці, був пов’язаний з більшою поширеністю сезонної алергії та алергії на горіхи в дорослому віці, що зазначено в результатах American Gut Project [664].
Мікробіота шкіри також може бути пов’язана із захистом від розвитку алергічних захворювань. Порівняно зі здоровими людьми у пацієнтів з атопічними захворюваннями виявили нижче мікробіологічне розмаїття вдома та значно нижчу загальну різноманітність гамма-протеобактерій шкіри [665]. Відзначено, що види Acinetobacter шкіри (гамма-протеобактерії) пов’язані з протизапальними імунними відповідями тільки у здорових осіб [666].
Таким чином, гігієна важлива для запобігання інфекціям у всьому світі. Процеси урбанізації, що спочатку мали місце в розвинутих країнах, а потім поширились на країни, що розвиваються, призвели до зменшення мікробного різноманіття в навколишньому середовищі. Велике мікробне різноманіття шкіри, дихальних шляхів та кишечника в дитячому віці є важливим фактором профілактики розвитку сенсибілізації та алергічних захворювань у популяції. Для підтвердження взаємозв’язку потрібні подальші довготривалі дослідження.
Загальний рівень доказовості: B (рівень 2а: 2 дослідження; рівень 2b: 10 досліджень; рівень 3а: 2 дослідження; рівень 3b: 1 дослідження).
Дослідження, включені до оцінки загального рівня доказовості, — це систематичні огляди та метааналізи різних аспектів гігієнічної теорії, обговореної вище. Також включені останні дослідження, опубліковані після зазначених систематичних оглядів і метааналізів. Якщо систематичні огляди та метааналіз із певного питання був відсутній, нами зазначалися результати окремих досліджень.
VII. Тягар захворювання
VII.A. Індивідуальний тягар
VII.A.1. Вплив на якість життя
У двох систематичних оглядах проводили оцінку впливу АР на якість життя (ЯЖ), дійшовши висновку, що пацієнти з АР істотно страждають від зниження як загальної, так і специфічної для захворювання якості життя, що обумовлено впливом на фізичне та психічне здоров’я. Окрім того, в обох дослідженнях було показано, що лікування АР призводить до поліпшення якості життя [667, 668]. Незважаючи на те, що питання впливу АР на якість життя обговорювалось у літературі протягом десятиліть, лише останніми роками це питання стало вивчатися більш ретельно, що частково пояснюється розробкою якісних інструментів оцінки якості життя, загальної та специфічної для даного захворювання, а також їх використанням у клінічних дослідженнях.
Серед опитувальників якості життя, що найчастіше використовуються в науковій літературі, присвяченій питанням АР, слід зазначити короткі форми 12 та 36 (SF-12/36) [669, 670], які дозволяють оцінити загальне фізичне та психічне здоров’я, пов’язані з якістю життя. Найчастіше для оцінки якості життя, специфічної для захворювання, застосовують опитувальник якості життя хворих на ринокон’юнктивіт (RQLQ) або одну з його модифікованих версій (міні-опитувальник RQLQ або нічний RQLQ) [671]. Однак, незважаючи на наявність цих опитувальників, численні опубліковані дослідження використовують незатверджені методи оцінки ЯЖ, що призводить до труднощів порівняння поданих результатів.
У декількох дослідженнях високої якості проводився аналіз впливу АР на загальну та специфічну для захворювання ЯЖ. Більшість досліджень доказової бази рівня 1b включають РКД, що оцінюють вплив місцевих назальних глюкокортикостероїдів [671–673], антигістамінних препаратів [672, 674–677] або алерген-специфічної терапії (AIT) [678, 679]. Успішне лікування АР будь-яким із вищезазначених методів сприяє поліпшенню симптомів та ЯЖ пацієнтів. За результатами одного РКД, в якому автори оцінювали ефективність монотерапії порівняно з політерапією, встановлено, що комбінація мометазону та/або левоцетиризину або монтелукасту призводить до більш значного зниження вираженості клінічних проявів захворювання та, відповідно, покращення якості життя порівняно з призначенням лише мометазону. Проте вірогідної різниці в ефективності при порівнянні між групами, що отримували левоцетиризин і монтелукаст, не було отримано [672]. Додатково слід відзначити, що в РКД, в якому проведене порівняння ефективності акупунктури та медикаментозної терапії, встановлено, що поліпшення ЯЖ відмічається в обох групах дослідження та більш виражене в групі акупунктури [680].
Хоча решта доказів мають нижчу якість, вони все ж таки містять досить важливі та цікаві висновки, які доповнюють результати РКД та систематичних оглядів. Так, екстраназальні симптоми, зокрема очні, мають значний вплив на ЯЖ та не можуть бути проігноровані при оцінці перебігу та призначенні лікування АР [681–684]. Окрім того, працездатність, активність, емоційні, соціальні функції та функції запам’ятовування пацієнтів здатні спричиняти значний вплив на перебіг АР [685–689].
У жодному дослідженні високої якості не було зроб-лено спроби повною мірою визначити коливання ЯЖ у пацієнтів з АР із плином часу. Більшість з них характеризуються короткими періодами спостереження або взагалі лише одним. Проте деякі спостереження щодо природної мінливості ЯЖ при АР можна екстраполювати з даних груп, яким призначали плацебо, в дослідженнях 1-го рівня.
У двох РКД аналізували ефективність призначення левоцетиризину тривалістю понад 6 місяців [675, 677]. Згідно з отриманими результатами як у групі плацебо, так і в групі, де призначали препарат, спостерігали клінічно і статистично вірогідне поліпшення загальної та специфічної для хвороби ЯЖ, більше виражене в групі левоцетиризину. РКД, в яких вивчали ефективність АІТ, характеризуються більш тривалим періодом спостереження (від 12 до 18 місяців), але в той же час демонструють схожі результати: у пацієнтів групи плацебо оцінка ЯЖ залишається або незмінною, або відзначається покращення, яке значно поступається групі АІТ [678, 679]. Цілком очікувано у пацієнтів із САР покращення якості життя відмічається поза сезоном цвітіння рослин та погіршується при відновленні контакту з алергеном [690, 691].
Загальний рівень доказовості: B (рівень 1b: 11 досліджень; рівень 2a: 2 дослідження; рівень 2b: 16 досліджень; рівень 2c: 1 дослідження; рівень 3b: 3 дослідження).
Користь: успішне лікування АР сприяє поліпшенню загальної та специфічної для захворювання ЯЖ.
Шкода: різні тактики ведення пацієнтів з АР пов’язані із змінним рівнем несприятливих ефектів, що додатково зазначені в розділі IX «Тактика ведення».
Вартість: тактика лікування АР пов’язана зі змінними рівнями витрат, що додатково зазначені в розділі IX «Тактика ведення».
Оцінка співвідношення користь/шкода: користь від лікування пацієнтів з АР з метою поліпшення ЯЖ може переважати над ризиком такого лікування.
Висновок про цінність: успішний контроль за перебігом АР впливає на загальну та специфічну для захворювання ЯЖ.
Рівень впровадження: слід рекомендувати лікування АР для покращення ЯЖ.
Втручання: пацієнтам з АР можна запропонувати різні тактики лікування для поліпшення загальної та специфічної для захворювання ЯЖ.
VII.A.2. Вплив на сон
Так само, як існують опитувальники щодо оцінки загальної і специфічної для захворювання ЯЖ, існують стандартизовані опитувальники оцінки ЯЖ, пов’язаної зі сном, у пацієнтів з АР, але вони не завжди використовуються в опублікованих дослідженнях. У деяких дослідженнях, в яких проводиться оцінка загальної та специфічної для захворювання ЯЖ, робиться припущення, що АР негативно впливає на сон пацієнтів [673, 685, 687]. У деяких дослідженнях автори спеціально аналізували зв’язок між АР та сном у дорослих і дітей. Згідно з узагальненим висновком отриманих даних, АР негативно впливає на ЯЖ, пов’язану зі сном, так само, як і на загальну та риніт-специфічну ЯЖ; успішне лікування АР зменшує вираженість порушень сну. В цілому якість результатів досліджень вища у дорослих пацієнтів, ніж у дітей. Для дорослого населення наявні докази рівня 1b, які підтверджують висновок, що АР негативно впливає на сон [705–709]. Подані результати включають суб’єктивну оцінку пацієнтом наявності сонливості вдень, якості сну в цілому та симптомів захворювання, зазвичай використовуючи стандартизовані опитувальники в рамках вивчення ефективності застосування назальних глюкокортикостероїдів та/або монтелукасту. Результати вказують, що у пацієнтів з АР спостерігається поліпшення якості сну і відчуття сонливості вдень поряд зі зменшенням симптомів, обумовлених ураженням слизової носа та придаткових пазух, та ЯЖ після терапії інтраназальними глюкокортикостероїдами [705, 706, 709, 710] або комбінацією глюкокортикостероїдів та монтелукасту [709]. Окрім того, АР пов’язаний з гіршою фрагментацією сну [711, 712] і хропінням [713, 714]. Лікування АР також було рекомендоване для поліпшення комплаєнсу до неінвазивної вентиляції легень під постійним позитивним тиском під час сну (СРАР-терапія) у пацієнтів із синдромом обструктивного апное сну (СОАС) [715].
Дані про вплив АР на показники полісомнограми у дорослих суперечливі. Більшість досліджень, які включали аналіз полісомнограми, показали, що АР асоціюється з погіршенням її параметрів [712, 714, 716–719], однак у 2 дослідженнях рівня 3b виявили або відсутність різниці, або незначні відмінності [720, 721]. Ще в двох дослідженнях аналізували зміну вираженості симптомів порушення сну зі змінами запалення слизової носа з плином часу. Було зроблено припущення, що зміни в рівнях цитокінів слизової носової порожнини пов’язані зі змінами показників полісомнограми [719] і що у пацієнтів з АР спостерігається погіршення показників полісомнограми та порушення сну при наявності симптомів або протягом піку сезону алергії [718].
Дослідження у дитячій популяції 2-го та 3-го рівнів свідчать, що АР пов’язаний з порушенням сну у вигляді підвищеної частоти хропіння, порушення дихання під час сну та СОАС. Окрім того, було зроблено припущення, що АР є фактором ризику погіршення ЯЖ після проведення аденотонзилотомії [722] (див. розділ X.K «Асоційовані стани — Порушення сну і синдром обструктивного апное сну» для отримання додаткової інформації з цієї теми).
Загальний рівень доказовості: B (рівень 1b: 5 досліджень; рівень 2b: 10 досліджень; рівень 2c: 3 дослідження; рівень 3a: 1 дослідження; рівень 3b: 21 дослідження; рівень 4: 6 досліджень).
Користь: успішна тактика ведення АР призводить до зменшення порушень сну.
Шкода: різні тактики ведення пацієнтів з АР пов’язані зі змінним рівнем несприятливих ефектів, що додатково зазначені в розділі IX «Тактика ведення».
Вартість: різні тактики ведення пацієнтів із АР пов’язані зі змінними рівнями витрат, що додатково зазначені в розділі IX «Тактика ведення».
Оцінка співвідношення користь/шкода: користь від лікування пацієнтів з АР та симптомами порушення сну може переважати можливі ризики лікування.
Висновок про цінність: успішний контроль симптомів АР сприяє поліпшенню сну.
Рівень впровадження: слід рекомендувати лікування АР для зменшення порушень сну.
Втручання: пацієнтам з АР можна запропонувати різні способи лікування з метою поліпшення сну.
VII.B. Соціальний тягар
Як зазначено в розділі VII.A.1, АР може спричиняти значний негативний вплив на ЯЖ пацієнтів та призводити до серйозних наслідків за відсутності лікування. Протягом багатьох років діагноз АР розглядався як досить тривіальний, незважаючи на його поширеність, хронічний перебіг та тягар, який припадав як на окремих осіб, так і на суспільство в цілому [101, 681, 753]. Загальний тягар АР включає не тільки порушення фізичних та соціальних функцій, а й економічні витрати, які, по суті, є значно більшими, якщо мати на увазі роль супутніх захворювань, таких як астма та риносинусит [754–756]. В Європі загальна сума витрат на АР та супутні захворювання у 2002 році становила приблизно 355,06 євро на одного пацієнта в місяць [755]. На сьогодні тягар AР визнаний Європейською академією алергії та клінічної імунології (EAACI), а також парламентом Європейського Союзу (ЄС) для того, щоб зробити акцент на вираженому впливі цього патологічного стану на ЯЖ пацієнтів з АР [757, 758].
З точки зору загального економічного тягаря хвороби, АР займає п’яте місце серед хронічних захворювань у Сполучених Штатах [759]. Згідно з аналізом річних прямих витрат на АР, останні становлять від 2 до 5 млрд доларів США, причому більше половини прямих витрат обумовлені рецептурними ліками [760–762]. Прямі витрати, пов’язані з АР, включають візити до лікарів, лабораторні аналізи, лікарські препарати та AIT [763]. Порівняно з контрольними групами виявлено, що пацієнти з АР мають майже 2-кратне збільшення витрат на ліки та 1,8-кратне збільшення частоти візитів до лікаря [756, 764, 765]. Приховані прямі витрати включають лікування коморбідних станів, що у пацієнтів з АР реєструються з високою частотою.
У нещодавньому дослідженні TOTALL («Загальні витрати на алергічний риніт у Швеції») була проведена оцінка загальних витрат, пов’язаних з АР, серед пацієнтів працездатного віку. Дані цього дослідження свідчать про те, що пацієнти з легким перебігом АР мають менші економічні витрати, які в середньому становлять близько 25 % витрат від тих, які відзначаються серед пацієнтів із середньотяжким перебігом захворювання [667, 766]. Пацієнти з середньотяжким та тяжким перебігом АР частіше потребують відвідувати сімейного лікаря порівняно з пацієнтами з легким перебігом АР (1,61 проти 1,19 раза на рік) [753].
Непрямі витрати, пов’язані з АР, такі як невихід на роботу та формальна присутність на роботі, також становлять значну проблему та фактично формують більшість економічних витрат при АР [767, 768]. Порушення працездатності та/або невихід на роботу відзначається у 52 % пацієнтів з АР [753]. В опитуванні, в якому взяли учать понад 8000 працівників 47 робочих місць у США, в 55 % випадків відзначено наявність симптомів АР, які в середньому тривали 52,5 дня на рік. Відсутність на роботі/прогул у зв’язку з АР становив 3,6 дня на рік, формальна присутність на роботі становила 2,3 години протягом робочого дня за наявності симптомів захворювання. Середні загальні втрати у зв’язку з непрацездатністю (невихід на роботу або формальна присутність на робочому місці) при АР становили в середньому 593 долари на одного працівника на рік [769]. Згідно з результатами іншого британського дослідження, порушення працездатності у пацієнтів із середньотяжким та тяжким перебігом АР становило 37,7 дня на рік, що майже вдвічі більше, ніж у пацієнтів із легким перебігом АР у цьому ж дослідженні (21,0 дня) [753].
Порушення здоров’я, які виникають на тлі АР, часто не є достатньо серйозними, щоб спричинити невихід на роботу, але вони здатні знижувати когнітивні функції, що призводить до втомлюваності, порушення здатності навчатися, до концентрації та прийняття рішень [770]. У дослідженні Blanc та співавт. [771] більше третини пацієнтів з АР повідомили про зниження праце–здатності на робочому місці.
У Сполучених Штатах АР спричиняє 3,5 млн випадків пропущених робочих днів і 2 млн випадків пропущених днів відвідування школи щорічно [772]. Близько 10 000 дітей у Сполучених Штатах відсутні в школі щодня у зв’язку з АР [773]. Пропуск занять у школі також може впливати на відсутність батьків на роботі.
У дослідженні Hellgren та співавт. [774] середній показник втрати працездатності серед шведських працівників у зв’язку з невиходом на роботу, формальною присутністю на роботі, відсутністю на роботі у зв’язку з доглядом за хворою особою становив 5,1 дня, з яких 2,3 дня були пов’язані з невиходом на роботу, а 2,0 дня — з формальною присутністю на роботі. При аналізі груп, які включали лише осіб з дітьми віком від 0 до 7 років, середня кількість днів невиходу на роботу у зв’язку з доглядом за дитиною становила 3,6 дня. Витрати, пов’язані з невиходом на роботу у зв’язку з доглядом, становили 19 % від середніх загальних витрат за рік у цьому дослідженні, найбільші вони були серед жінок віком від 30 до 44 років.
AР є найбільш поширеним хронічним захворюванням у педіатричній практиці. АР може впливати на сон, призводити до денної сонливості, порушувати пізнання та пам’ять, що може суттєво впливати на процес навчання та успішність у школі. Такі діти, навіть коли присутні на заняттях, демонструють нижчу продуктивність. Супутні захворювання, пов’язані з АР, такі як риносинусит, дисфункція євстахієвої труби і пов’язана з ними кондуктивна втрата слуху, можуть додатково спричиняти погіршення навчання [775, 776]. АР є причиною значного тягаря для пацієнтів та суспільства в цілому. Захворювання може викликати зниження працездатності та ЯЖ у пацієнтів і погіршувати перебіг супутніх захворювань, що призводить до значного впливу на систему охорони здоров’я [773].
VIII. Оцінка та діагностика
Діагностика АР у кожного окремого пацієнта заснована на даних анамнезу захворювання та результатах об’єктивного обстеження. Діагноз підтверджується за допомогою додаткових методів дослідження (лабораторних, інструментальних). У цьому розділі будуть подані наявні докази стосовно використання різних методів оцінки ступеня тяжкості та діагностики АР.
VIII.A. Об’єктивне фізикальне обстеження
Анамнез захворювання
Анамнез захворювання є невід’ємною частиною обстеження пацієнтів із підозрюваним діагнозом АР [7, 26, 218, 761, 777]. Збір анамнезу включає уточнення симптомів захворювання, їх давність та тривалість, частоту виникнення, вплив будь-яких факторів навколишнього середовища, що здатні спричиняти появу клінічних проявів вдома/на роботі/у школі, інформацію стосовно медикаментозних засобів, які полегшують або загострюють симптоми [7, 26, 218, 761, 777, 778]. Окрім того, слід встановити попередній анамнез захворювання, включаючи супутні захворювання, такі як астма або синдром обструктивного апное сну, сімейний анамнез атопічних захворювань, соціальний анамнез (наприклад, утримання домашніх тварин, вплив певних алергенів на роботі, вдома) та лікування, яке пацієнт отримує на сьогодні [7, 26, 218, 761, 777, 778]. Важливе значення має встановлення ефекту від самолікування безрецептурними препаратами.
Закладеність носа, місцевий свербіж, ринорея та чхання є класичними проявами АР [7, 26, 218, 761, 777, 778]. Пацієнти можуть також зазначати наявність очних симптомів (почервоніння очей та/або сльозотечі), свербежу слизової ротової порожнини. Також можлива поява хрипів або кашлю (реактивні захворювання дихальних шляхів та/або астма) [7, 26, 778]. До додаткових симптомів слід віднести гіпосмію або аносмію, хропіння та порушення дихання під час сну, закладеність вух, біль у горлі [778, 779]. Як правило, у пацієнтів із підозрою на АР є численні скарги, причому у 96 % відзначається наявність 2 та більше симптомів [778]. У пацієнтів із ЦАР зазвичай, на відміну від пацієнтів із САР, відзначаються симптоми закладеності (тиск у носових пазухах, закладеність носа і хропіння). Пацієнти з персистуючим перебігом АР частіше повідомляють про наявність ангіни, кашлю, чхання, ринореї та стікання носового секрету по задній стінці горла. Ринорея, чхання, хропіння, гіпосмія/аносмія, закладеність носа, свербіж носа мають найбільше значення в діагностиці АР [779].
У декількох клінічних рекомендаціях пропонують діагноз АР встановлювати за наявності у пацієнта впливу алергічного чинника та 1 або більше симптомів, перелічених у попередньому абзаці, незважаючи на відсутність доказів високого рівня на користь таких рекомендацій [7, 26, 218, 761, 777, 780]. Проте відсутність доказів більш високого рівня не викликає подиву, оскільки для встановлення даного діагнозу основне значення мають результати фізикального обстеження та анамнезу захворювання, на що не спираються рандомізовані дослідження. У дослідженнях було показано, що результати фізикального обстеження без урахування даних анамнезу мають низьку прогностичну цінність для встановлення діагнозу АР [781]. При цьому надійність та прогностична цінність власне анамнезу захворювання при АР перевищує цінність об’єктивного обстеження [781]. У клінічній практиці діагноз АР часто встановлюється на підставі винятково анамнестичних даних [780].
Фізикальний огляд
Фізикальне обстеження є частиною загального обстеження пацієнтів із підозрою на АР [7, 26, 218, 761, 777]. Воно включає огляд органів голови та шиї, включаючи шкірні покриви; зовнішній слуховий прохід, барабанну перетинку та середнє вухо; порожнини носа; орбіту та періорбітальні тканини; ротову порожнину; гортань за допомогою непрямої ларингоскопії; та тканини шиї [26, 218, 761, 777]. Додатково може виникнути потреба у проведенні аускультації легень за наявності супутньої астми або скарг на хрипи або кашель при контакті з алергеном [7].
Не рідкістю для фізикального обстеження пацієнтів з АР є повна відсутність скарг, особливо при непостійному контакті з провокуючим фактором [779]. До об’єктивних ознак, які вказують на можливість діагнозу АР, слід віднести дихання відкритим ротом, свербіж носа, очищення горла, періорбітальний набряк або «алергічні відблиски» (темне забарвлення нижньої повіки та періорбітальної ділянки) [26, 777]. Огляд вуха може виявити ретракцію барабанної перетинки або транссудат [26, 218, 777]. При огляді носа відзначаються гіпертрофія нижньої носової раковини, набряк, гіперемія або ціаноз слизової носа та ознаки явної ринореї [26, 218, 761, 777]. Огляд очей допомагає виявити почервоніння кон’юнктиви та/або хемоз [26, 777].
Дані лише фізикального обстеження мають низьку прогностичну цінність порівняно з анамнестичними даними при постановці діагнозу АР. Середні величини показників чутливості, специфічності, позитивна прогностична цінність та негативні прогностичні значення анамнезу захворювання вищі за відповідні показники об’єктивного обстеження [781]. У більшості клінічних настанов рекомендують проводити фізикальне обстеження як частину діагностики АР, незважаючи на відсутність доказів високого рівня. Без проведення об’єктивного обстеження інші потенційні причини таких симптомів, як, наприклад, хронічний риносинусит, не можуть бути повністю оцінені або усунені. Анамнез захворювання в поєднанні з даними фізикального обстеження підвищує точність діагностики [781].
Загальний рівень доказовості: D (рівень 3b: 1 дослідження; рівень 4: 3 дослідження; рекомендації рівня 5: 4 дослідження).
Користь: покращити точність діагностики, уникнути зайвих направлень до інших спеціалістів, обстежень та лікування. Можливою є покращена діагностика АР за результатами фізикального обстеження, при оцінці/виключенні альтернативних діагнозів.
Шкода: можливе відчуття дискомфорту пацієнтом від проведення планового обстеження, не включаючи ендоскопію. Потенційним є помилковий діагноз, зай-ве лікування.
Вартість: мінімальна.
Оцінка співвідношення користь/шкода: користь переважає над шкодою, можливе встановлення помилкового діагнозу при проведенні лише фізикального обстеження без урахування анамнестичних даних.
Висновок про цінність: встановлення заключного діагнозу АР на підставі анамнестичних даних (в ідеалі — разом із даними фізикального обстеження) є оптимальним та не затримує призначення відповідного лікування. Підтвердження діагнозу додатковими методами обстеження необхідно при вирішенні питання призначення АІТ або при неочікуваній реакції на призначене лікування.
Рівень впровадження: рекомендація.
Втручання: збір анамнезу відіграє ключову роль при постановці діагнозу АР. Рекомендоване проведення фізикального обстеження, яке в поєднанні з даними анамнезу підвищує точність діагностики АР і виключає альтернативні причини захворювання.
VIII.B. Назальна ендоскопія
Проведення діагностичної назальної ендоскопії слід розглянути у пацієнтів із підозрою на АР. У декількох неконтрольованих дослідженнях проводилась оцінка зв’язку ендоскопічних змін та симптомів риніту; були отримані суперечливі результати. Ameli та співавт. [782] провели аналіз ендоскопічних змін у дітей із підозрюваним АР та відзначали прогностичне значення виявлення гіпертрофії нижньої або середньої носової раковини для діагностики АР, у той же час блідість слизової раковин прогностичного значення не виявила. Протилежні результати зазначають Eren та співавт. [783], які досліджували популяцію дорослих пацієнтів з АР та дійшли висновку, що назальна ендоскопія не є вірогідним методом діагностики АР. Так, у дорослих та дітей з діагнозом АР, що був підтверджений алергологічними тестами, не було виявлено вірогідного кореляційного зв’язку між змінами, виявленими при риноскопії, та специфічними назальними симптомами [784].
Алергічний варіант хронічного риносинуситу (Central compartment atopic disease — CCAD) являє собою нещодавно описаний патологічний стан, що пов’язує між собою атопію та центрально розташоване запалення, яке охоплює середні/верхні носові раковини або верхню частину носової перегородки [785–787].
У нещодавно опублікованій серії паралельних випадків (рівень доказів = 4), Brunner та співавт. [788] порівняли зміни при риноскопії у пацієнтів із поліпозною формою хронічного риносуноситу та ізольованими поліпами середньої носової раковини. Автори відзначають більш високу частоту АР у пацієнтів із поліпозними змінами середньої носової раковини (83 проти 34 %, р < 0,001), що дозволяє виділити CCAD як унікальний атопічний стан.
З огляду на суперечливі дані зв’язку змін при рино-скопії з клінічними проявами АР назальна ендоскопія рекомендована для виявлення або виключення інших можливих причин симптомів пацієнта, таких як поліпоз носа або хронічний риносинусит.
Загальний рівень доказовості: D (рівень 3b: 2 дослідження; рівень 4: 3 дослідження)*.
Користь: вірогідне покращення діагностики АР за рахунок візуалізації слизової оболонки носових раковин, виявлення їх гіпертрофії або ізольованого набряку середньої носової раковини.
Шкода: можливе відчуття пацієнтом дискомфорту, асоційоване з оглядом.
Вартість: помірні витрати на обладнання та проведення процедури.
Оцінка співвідношення користь/шкода: рівні.
Висновок про цінність: відсутній.
Рівень впровадження: може бути розглянутий як варіант.
Втручання: назальна ендоскопія може збільшити діагностичну точність при встановленні діагнозу АР у дорослих і дітей та допомогти виключити інші причини назальних симптомів.
VIII.C. Рентгенологічне дослідження
Рутинне рентгенологічне обстеження не рекомендоване для діагностики АР, хоча призначення останнього слід розглянути для виключення інших патологічних станів (наприклад, риносинуситу). У деяких нещодавніх дослідженнях було встановлено зв’язок між алергічним варіантом хронічного риносинуситу та чутливістю до аероалергенів [787, 788].
З огляду на можливі ризики опромінення з точки зору розвитку раку в подальшому рутинне призначення рентгенологічного дослідження не рекомендоване [789, 790].
Загальний рівень доказовості: неможливо вказати**.
Користь: оцінка не проводилась.
Шкода: опромінення може спричинити розвиток пухлинного процесу.
Вартість: високі витрати на обладнання та проведення процедури.
Оцінка співвідношення користь/шкода: шкода переважає над користю.
Висновки про цінність: довгострокові ризики зайвого іонізуючого впливу опромінення перевищують потенційну користь.
Рівень впровадження: не слід рекомендувати.
Втручання: при підозрі на АР не рекомендується рутинне призначення рентгенологічного дослідження; можливе призначення у випадку необхідності виключення інших патологічних станів.
VIII.D. Використання підтверджених методів обстеження
Як точні інструменти клінічної оцінки пацієнтів із підозрою на АР можуть бути використані опитувальники та анкети, клінічна ефективність яких була підтверджена. Клініцисти часто користуються шкірними алергологічними пробами, визначенням рівня специфічних IgE серологічними методами або низкою інших лабораторних досліджень для підтвердження або спростування діагнозу, але зазначені методи являють цінність лише за умови правильно зібраного анамнезу захворювання [791]. Затверджені інструменти клінічної оцінки пропонують більш структурований підхід для встановлення важливих складових анамнезу захворювання. Окрім того, у регіонах із низькою матеріально-технічною базою проведення шкірних алергологічних тестів або лабораторних досліджень може бути недоступним. Більш сучасні технології, такі як мультиплексний скринінг алергенів, компонентна серологія та автоматизовані пристрої для графічної обробки результатів шкірних алергологічних проб, є дорогими і тому не завжди доступними [792–795]. У таких умовах саме підтверджені опитувальники є швидким і досить простим інструментом оцінки алергічних захворювань.
Опитувальник PROM (інформація про клінічні наслідки, яку повідомляє сам пацієнт) може допомогти оцінити ряд аспектів впливу АР на пацієнтів [796]. Сюди слід зарахувати шкалу загальної тяжкості симптомів риніту (TNSS), що дозволяє оцінити ступінь вираженості симптомів, та опитувальники ЯЖ, такі як RQLQ. Додатково також визначають інші аспекти, такі як використання ліків (шкала щоденного застосування лікарських засобів), прогнозування захворювання (прогнозування перебігу алергії органів дихання) та контроль за перебігом захворювання (тест-контроль алергічного риніту). Кожне з представлених обстежень вивчає різні, але в той же час пов’язані аспекти клінічних наслідків захворювання. Деякі з цих інструментів широко використовувались у багатьох великих клінічних дослідженнях для визначення ефективності медикаментозних препаратів та біопрепаратів у лікуванні АР [797–802]. Шкірні алергологічні проби та провокаційні проби можуть бути використані для перехресного підтвердження отриманих завдяки опитувальникам результатів, хоча інформація, надана власне пацієнтом про динаміку клінічних проявів АР, може вважатися найкращим предиктором контролю захворювання.
Підтверджені клінічні анкети при АР часто включають питання про наявність закладеності носа, ринореї та/або чхання і можуть бути спрямовані на отримання миттєвого результату або визначення ретроспективно динаміки симптомів протягом часового проміжку — декілька днів або тижнів. Опитувальник TNSS зазвичай використовують для миттєвого щоденного обстеження, і він складається лише з 4 питань про нежить, свербіж носа, чхання і закладеність носа. В деяких дослідженнях TNSS використовувався як ретроспективна оцінка, що розраховувалась як середнє значення параметрів за 12-годинний нічний період та 12-годинний денний період (rTNSS). Показник TNSS можна поєднувати з питаннями щодо застосування медикаментозних препаратів для отримання щоденного комбінованого показника (DCS) та загальної суми шкали комбінованої загальної оцінки тяжкості риніту (TCRS). Зазначені опитувальники були використані в багатьох дослідженнях, що вивчали ефективність призначеної терапії [803]. Опитувальник RQLQ (оцінка якості життя при ринокон’юнктивіті) є більш комплексним методом дослідження, який потребує, щоб пацієнт зазначив зміни власного самопочуття протягом минулого тижня, та включає питання, що мають на меті відобразити якість життя при АР. Незважаючи на те, що результати даного анкетування можуть потенційно мати похибки, перевагою залишається можливість проведення його на місці та уникнення пропуску пацієнтом самостійного заповнення під час перебування вдома.
Шкала CARAT10 (тест-контроль алергічного риніту і астми) оцінює симптоми ринокон’юнктивіту й астми за проміжок часу — останні 4 тижні, що дає можливість зробити більш детально оцінку контролю за сезонними симптомами [804].
Тест прогнозування респіраторної алергії (RAP) — це анкета з 9 питань, що включає питання стосовно симптомів ураження верхніх і нижніх дихальних шляхів, а також питання щодо прийому ліків. Симптоми кон’юнктивіту слід оцінювати одночасно з симптомами риніту, а шкала загальних симптомів риніту (RTSS) має поєднуватись зі шкалою застосування медикаментозних засобів для зменшення проявів захворювання (RMS) для отримання комбінованої оцінки (CS) [805]. У табл. VIII.D-1 подані декілька методик клінічного обстеження [696, 804, 806–813].
Використання тієї чи іншої методики залежить від того, які власне клінічні наслідки захворювання слід визначити. Наприклад, якщо метою лікаря первинної ланки є визначення необхідності перенаправлення до іншого спеціаліста та подальшого дообстеження, може бути використана шкала RAP [814]. Міні-опитувальник RQLQ і шкала DCS широко застосовуються в клінічних дослідженнях для оцінки ефективності медикаментозної терапії та АІТ [797–801], тому можуть бути корисними для вибору правильної тактики ведення пацієнтів даної категорії. Важливо відзначити, що частина шкал використовує більш високий бал, щоб вказати на тяжкість захворювання, тоді як інші тим самим вказують на кращий контроль симптомів. Наприклад, високий бал за шкалою RCAT, ARCT і CARAT10 вказує на достатній контроль алергічних симптомів.
На жаль, не всі дослідження використовують уніфіковану термінологію та інтерпретацію бальної оцінки [801]. Це може стати причиною зниження цінності отриманих результатів та висновків, зроблених у деяких дослідженнях, що вивчали ефективність певного терапевтичного втручання. Тому правильне проведення обстеження з використанням підтверджених інструментів дослідження має вирішальне значення при проведенні досліджень, що в подальшому допоможе клініцистам проводити діагностику АР та приймати правильні діагностичні рішення.
Загалом підтверджені інструменти клінічного обстеження можуть бути використані як для діагностики АР, так і визначення успішності різних терапевтичних підходів. Цей висновок заснований на огляді більше ніж 30 досліджень, 9 з яких мають рівень від 1a до 2b (сукупний клас доказів A). Приклад підходу, що використовує окремі підтверджені інструменти обстеження, полягає в наступному. TNSS може використовуватися для щоденного моніторингу симптомів при визначенні ефективності терапії та контролю AР. TNSS слід поєднувати із щоденною оцінкою ефективності призначеного лікування для врахування впливу медикаментозних препаратів на симптоматику. Оцінку симптомів як кон’юнктивіту, так і риніту, а також впливу призначеної терапії можна проводити, використовуючи шкалу комбінованої оцінки (RTSS + RMS) або шкалу контрою алергії при ринокон’юнктивіті (RC-ACS). RQLQ або mini-RQLQ можна використовувати як додаткову методику для врахування впливу захворювання на ЯЖ, що може проводитись безпосередньо лікарем. З метою швидкої оцінки або простеження ефективності терапії пацієнта слід використовувати просту візуальну аналогову шкалу (VAS) або глобальну оцінку. Шкала RAP може бути використана як швидкий і простий метод лікарями первинної медичної допомоги для визначення необхідності направлення пацієнта до алерголога для подальшого дообстеження.
Загальний рівень доказовості: А (дослідження 1а: 2 дослідження; рівень 1b: 4 дослідження; рівень 2b: 4 дослідження). Примітка: були розглянуті результати численних додаткових досліджень, але докази класу А були отримані в зазначених 10 дослідженнях, тому розширений перелік усіх досліджень, в яких використовували підтверджені інструменти обстеження, нами не наводиться.
Користь: підтверджені інструменти обстеження пропонують простий та зручний метод відбору та відстеження симптомів, ЯЖ і контролю перебігу алергічних захворювань.
Шкода: мінімальна або відсутня.
Витрати: фінансовий тягар для пацієнтів відсутній. У деяких випадках витрати обумовлені тестами, які використовуються для клінічних досліджень.
Оцінка співвідношення користь/шкода: користь перевищує шкоду. Низький ризик встановлення хибного діагнозу призводить до непотрібного додаткового обстеження. Окрім того, існує низький ризик того, що хибнонегативні відповіді можуть затримати призначення додаткового дообстеження та лікування.
Висновки про цінність: докази рівня 1 використовують підтверджені методи обстеження як інструмент скринінгу та визначення первинних або вторинних наслідків.
Рівень впровадження: сильні рекомендації.
Втручання: підтверджені методи обстеження можуть бути використані для обстеження пацієнтів з АР, моніторингу за результатами лікування та як основний показник визначення клінічних наслідків при проведенні досліджень. Окремі шкали оптимізовані для різних клініко-патологічних сценаріїв і повинні бути використані відповідно до особливостей пацієнта та клінічних умов.
VIII.E.1. Шкірні алергологічні проби (прик-тест)
Для підтвердження діагнозу АР, а також з метою диференційної діагностики з іншими неалергічними типами ринітів поряд із фізикальним обстеженням пацієнта та збором анамнестичних даних можуть бути використані шкірні алергологічні проби.
Підтвердження IgE-опосередкованого генезу патологічного процесу обумовлює застосування стратегії уникнення контакту з алергеном та вибір відповідної терапевтичної тактики. Проведення шкірних проб є надзвичайно важливим для вирішення питання про призначення АІТ. Згідно з рекомендаціями ARIA, для призначення АІТ слід розглянути пацієнтів, які не відповіли на 2- або 4-тижневий курс помірних доз ІКС у поєднанні з антигістамінними препаратами [101].
Коли антиген наноситься на шкіру сенсибілізованого пацієнта, антиген поперечно зв’язує антитіла IgE на поверхні тучних клітин шкіри, що призводить до дегрануляції і вивільнення медіаторів (у тому числі гістаміну), що в свою чергу призводить до розвитку шкірної реакції за типом «цвітіння» протягом 15–20 хвилин [816, 817]. З огляду на обмежену глибину проникнення, прик-тест є безпечним; про анафілаксію повідомляється досить рідко і не повідомляється про смертельні наслідки [818]. Прик-тест можна виконувати в будь-якій віковій групі, що має особливе значення у педіатричній популяції, зважаючи на швидкість, з якою можна застосовувати кілька антигенів, і незначний дискомфорт під час тестування.
Шкірні тести не є доцільними для всіх пацієнтів. Абсолютні або відносні протипоказання до проведення шкірних прик-тестів включають неконтрольовану або тяжку астму, тяжкі або нестабільні серцево-судинні захворювання, одночасну терапію бета-блокаторами і вагітність. Прийом деяких препаратів та стан шкіри можуть перешкоджати проведенню шкірних проб. Вони детально розглядаються в розділі VIII.E.4 «Фактори, які впливають на проведення або інтерпретацію шкірних проб»: VIII.E.4.a «Медикаменти» і VIII.E.4.b «Стан шкіри» відповідно.
Окрім відмінного профілю безпеки, шкірні прик-тести мають зареєстровану чутливість і специфічність близько 80 % [818–820]. Вони, як повідомляється, є більш чутливими, ніж сироваткові тести, і також мають перевагу в нижчій вартості [818, 821, 822]. Незважаючи на дослідження, спрямовані на порівняння шкірних алергологічних проб, внутрішньошкірних проб і сироваткових тестів, відсутні переконливі докази того, що один метод діагностики є кращим за інші [761].
Кількість і вибір антигенів, що використовуються для тесту, значно варіює в різних клінічних умовах. Рекомендується застосування панелі антигенів, що являють відповідний до географічного регіону профіль антигенів, впливу якого пацієнт регулярно піддається. Позитивні (гістамінові) і негативні (гліцеринові або фізіологічний розчин) контролі повинні завжди бути виконані. Була продемонстрована різноманітність якості та сили комерційно доступних екстрактів алергенів [823, 824]. Тому, коли це можливо, слід використовувати стандартизовані алергени.
Шкірні алергологічні проби виконуються скарифікаторами, які мають різну форму. Як правило, скарифікатори призначені для обмеження глибини проникнення у шкіру до 1 мм. Однак різний тиск, з яким діють на пристрій для виконання проби, може змінювати глибину проникнення у шкіру, що в кінцевому підсумку впливає на реакцію шкіри на антиген [825]. Пристрої для виконання шкірного прик-тесту можуть мати вигляд одиничного або множинних скарифікаторів. Множинні скарифікатори мають перевагу в тому, що вони здатні швидко нанести декілька антигенів на шкіру за один раз з однаковим тиском [826, 827]. Розмір папули, чутливість та відтворюваність результату залежить від пристрою, який використовують [826–828]; таким чином, будь-який медичний працівник, який виконує шкірну алергологічну пробу, повинен ретельно ознайомитися з пристроєм для виконання проби. Як правило, скарифікатор занурюють у лунку, що містить антиген, а потім наносять на шкіру.
Долонні поверхні передпліч і спина є найбільш поширеними ділянками проведення шкірних прик-тестів. Вибір ділянки залежить від віку/розмірів пацієнта. Тести повинні застосовуватися на відстані 2 см або більше, тому що розміщення їх ближче один до одного може призвести до перехресного забруднення [829]. Після 15–20 хвилин результати аналізуються шляхом вимірювання розміру папули за її найбільшим діаметром. Папули діаметром 3 мм або більше від негативного контролю вважають позитивним результатом проби.
Існує велика кількість доказів, що деталізують використання шкірних прик-тестів у клінічній практиці. На основі кількох проспективних досліджень і систематичних оглядів було продемонстровано, що це безпечний метод діагностики алергії. Він не поступається серологічній діагностиці або внутрішньошкірним пробам і є менш дорогим, ніж сироваткові тести. Однак він пов’язаний з ризиком системної реакції, тому завжди слід проявляти обережність. Він також пов’язаний з певним дискомфортом під час тестування; однак дискомфорт, як правило, менше, ніж під час проведення внутрішньошкірних проб. Переглядаючи наявну літературу, можна зробити висновок про переважання користі над шкодою для шкірних прик-тестів. Таким чином, застосування прик-тестів рекомендується в ситуаціях, коли необхідно підтвердити діагноз AР, або за відсутності належного ефекту від емпіричної медикаментозної терапії пацієнта з підозрою на AР.
Загальний рівень доказовості: B (рівень 1a: 1 дослідження; рівень 3b: 7 досліджень).
Користь: підтверджує діагноз і дозволяє вибрати фармакологічну терапію, одночасно уникаючи непотрібних/неефективних методів лікування; допомагає скоригувати стратегію уникнення, АІТ.
Шкода: несприятливі наслідки від тестування, включаючи дискомфорт, свербіж, еритему, погіршення симптомів астми, і анафілаксія, неточні результати тестування і неправильно інтерпретовані результати тестування.
Вартість: низька.
Оцінка співвідношення користь/шкода: користь переважає над шкодою.
Висновки про цінність: пацієнти можуть отримати користь від визначення специфічної чутливості. Шкірна алергологічна проба є швидким і відносно зручним способом діагностики на декілька антигенів, яка за точністю подібна до інших доступних методів діагностики.
Рівень впровадження: рекомендація.
Втручання: шкірна алергологічна проба рекомендується для оцінки чутливості до алергену у відповідних відібраних пацієнтів. Регулярне використання одного і того ж пристрою для проведення шкірної алергологічної проби дозволить клінічно ознайомитися з ним, а інтерпретація результатів буде більш послідовною. Використання стандартизованих екстрактів алергенів може додатково покращити точність інтерпретації.
VIII.E.2. Внутрішньошкірні проби
Внутрішньошкірні ін’єкції алергенних білків часто використовуються для діагностики АР. Внутрішньо-шкірна проба також було описана для оцінки чутливості зв’язку з іншими речовинами, включаючи місцеві знеболюючі засоби, блокатори нервово-м’язової передачі, антибіотики і речовини, що застосовуються для контрастування [837–840]. У той час як у поперед-ніх протоколах було описано використання внутрішньошкірної проби для харчових та хімічних алергенів, цей тип діагностики наразі не рекомендовано для застосування у повсякденній практиці. Внутрішньошкірну пробу можна використовувати як первинний метод діагностики або як вторинний тест після шкірного прик-тесту [841, 842]. Внутрішньошкірна проба також використовується в оториноларингології-алергології з метою визначення конкретного алергену для АІТ і для визначення безпечності флакона перед першою ін’єкцією, хоча рівень доказів, що підтверджує ці рекомендації, є низьким [843, 844]. Тяжкі побічні явища, пов’язані з внутрішньошкірними пробами, спостерігаються рідко. Протягом 42-річного періоду, з 1945 по 1987 рік, тільки 5 смертельних випадків були пов’язані з внутрішньошкірними пробами без попередніх шкірних скарифікаційних проб [848].
Внутрішньошкірні проби також можна проводити з використанням декількох розведень того ж самого алергену для більш точного визначення рівня чутливості до цього алергену, і запропонувати дозу алергену для початку імунотерапії [849]. Серія розведень концентрованого екстракту алергену (зазвичай у розведенні 1 : 20) може бути приготовлена у співвідношенні 1 : 5 або 1 : 10. Внутрішньошкірна проба з розведенням (ВПР, що раніше визначалася як титрування кінцевої точки шкіри — ТКТ) починається з внутрішньошкірного введення розведеного алергену, разом із відповідним контролем, подальшим введенням більш концентрованих розведень цього алергену. Розведення, що дає перший позитивний тест (визначене раніше в цьому розділі як папула діаметром щонайменше 7 мм і щонайменше на 2 мм ширше за гліцериновий контроль), після якого спостерігають більш виражені позитивні результати, називають кінцевою точкою. Папула від наступної більш високої концентрації має бути принаймні на 2 мм ширше, ніж папула кінцевої точки. Кінцева точка ВПР корелює з результатом шкірного прик-тесту [844, 850, 851]. У той час, як було показано, що кінцеві точки ВПР корелюють з відповідними біологічними показниками, як вивільнення гістаміну базофілами, чіткої кореляції з іншими показниками, такими як рівні сироваткового IgE in vitro, ще не встановлено [852, 853]. Жодне дослідження не продемонструвало чіткої переваги внутрішньошкірних проб із розведенням над одноразовою внутрішньошкірною пробою з точки зору діагностики симптоматичної алергії або оцінки ефективності специфічної імунотерапії.
За оцінками, чутливість внутрішньошкірної проби як єдиного діагностичного тесту для АР варіює від 60 % (95% ДІ 31–83) до 79 % (95% ДІ 63–90), а специфічність — від 68 % (95% ДІ 49–82) до 69 % (95% ДІ 52–86) [793, 833]. Це нижче, ніж чутливість (85–88 %) та специфічність (77 %) шкірних прик-тестів, оцінені за результатами недавніх метааналізів [830, 854]. Фактори, що впливають на прогностичну цінність внутрішньо-шкірної проби, включають вимірювальний пристрій, що використовується для порівняння, і концентрацію алергену, що використовується при внутрішньошкірній пробі [855].
Було висунуто припущення, що внутрішньошкірна проба дозволить підвищити чутливість прик-тесту шляхом ін’єкції алергенних білків у більш глибокі тканинні шари під кератинізованим епідермісом [847]. Однак дані літератури не підтримали чітку користь від проведення внутрішньошкірної проби з цією метою. Застосування внутрішньошкірної проби разом із прик-тестом для прогнозування позитивної відповіді назальної проби з алергеном тимофіївки лугової підвищило чутливість з 87 % тільки до 93 % [832]. В аналогічному дослідженні Krouse та співавт. [831] визначили, що додавання внутрішньошкірної проби до прик-тесту для прогнозування позитивної назальної проби з алергеном цвілі Alternaria підвищило чутливість з 42 до 58 %. Ці дослідження свідчать про граничне збільшення чутливості, яке варіює залежно від алергену, що досліджується.
Nelson та співавт. [856] досліджували 28 осіб з анамнезом САР. Одна група мала негативний результат прик-тесту до алергену тимофіївки лугової та бермудської трави, але позитивний результат внутрішньо-шкірної проби до алергену тимофіївки, тоді як друга група мала негативні результати прик-тесту і внутрішньошкірної проби до алергенів тимофіївки та бермудської трави. В обох групах 11 % осіб мали позитивний результат назальної проби з алергеном тимофіївки. Аналогічно, коли 39 особам із симптомами алергії на котів та негативним результатом прик-тесту було виконано пробу з котом, не було різниці у розвитку симптомів з боку верхніх дихальних шляхів у тих, хто мав позитивний або негативний результат внутрішньо-шкірної проби (24 % проти 31 %, p = 0,35) [793]. Reddy та співавт. [857] оцінювали результати алергічної проби у 34 пацієнтів із хронічним ринітом. Пацієнти з позитивним результатом тільки внутрішньошкірних проб (і негативних — скарифікаційних) мали негативний результат радіоалергосорбентного тесту (РАСТ) або проби на вивільнення гістаміну. На противагу цьому позитивний результат прик-тесту був пов’язаний з позитивним результатом РАСТ та проби на вивільнення гістаміну [857]. Schwindt та співавт. [858] досліджували 97 осіб із симптомами алергічного ринокон’юнктивіту. Після прик-тесту проводили внутрішньошкірну пробу, якщо результат прик-тесту був негативним. Якщо пацієнти мали негативний результат прик-тесту та позитивний внутрішньошкірної проби, їм проводили назальну пробу з 5 різними алергенами. Серед пацієнтів з негативним результатом прик-тесту із застосуванням приладу Multi-test II тільки 17 % мали позитивний результат внутрішньошкірної проби, що відповідала би анамнезу хвороби. Жодна з цих позитивних внутрішньошкірних проб не відповідала позитивній назальній пробі [858]. Загалом ці дослідження свідчать про те, що проведення внутрішньошкірних проб не покращує діагностику алергії в осіб з негативним результатом прик-тесту.
Nevis та співавт. [830] провели систематичний огляд 4 досліджень для визначення чутливості та специфічності внутрішньошкірних проб як підтверджувального тесту після негативного результату прик-тесту. Чутливість коливалася від 27 % (95% ДІ 10–57) до 50 % (розміри вибірки були занадто малі для розрахунку ДІ), тоді як специфічність коливалася від 69 % (95% ДІ 51–83) до 100 % (95% ДІ 83–100). Згідно з ретроспективним дослідженням, проведеним Larrabee і Reisacher [859], в якому лікар мав підозру, засновану на клінічних даних, частота позитивних внутрішньошкірних проб після негативного прик-тесту становила 36,9 % для домашніх алергенів (D. pteronyssinus, D. farinae, алергенів котів, собак і тарганів), 12,7 % для алергенів зовнішнього середовища (амброзія, червона береза, тимофіївка, білий дуб і червоний клен) і 9,2 % для алергенів цвільових грибків (Aspergillus, Candida, Penicillium, Alternaria, Cladosporium). Однак у цьому дослідженні не було проведено кореляції між позитивною внутрішньо-шкірною пробою і назальними пробами. Escudero та співавт. [860] виявили, що у пацієнтів з ринітом прик-тест, внутрішньошкірна та кон’юнктивальна проби були більш чутливими, ніж визначення рівня специфічних sIgE у сироватці. Всі методи діагностики мали однакову специфічність.
Таким чином, наявні на сьогодні дані свідчать на користь використання внутрішньошкірних проб для діагностики АР внаслідок аерогенних алергенів як самостійного тесту, однак цей метод діагностики не демонструє чіткої переваги над прик-тестом при порівнянні чутливості та специфічності. Не було проведено жодних досліджень, які би безпосередньо порівнювали внутрішньошкірні проби з одним розведенням із ВПР з точки зору чутливості, специфічності або наслідків для пацієнтів. Відзначається невелике підвищення чутливості при використанні внутрішньошкірної проби як підтверджувального тесту після негативного прик-тесту; однак позитивні результати внутрішньо-шкірних проб у таких ситуаціях можуть бути хибно-позитивними. Також імовірніше, що результат внутрішньошкірної проби після негативного прик-тесту буде позитивним при застосуванні домашніх алергенів і найменш вірогідно буде позитивним при використанні антигенів цвільових грибів. Невідомо, чи впливає тип алергену на чутливість і специфічність, оскільки більшість досліджень використовували тільки один алерген, але внутрішньошкірні проби виявилися найменш чутливими і специфічними при використанні антигенів цвілі. Іншими обмеженнями досліджень, включених до цього огляду, є невеликі розміри вибірки (найбільша з них — 120 учасників), різний дизайн дослідження та відсутність рандомізованих контрольованих досліджень.
Загальний рівень доказовості: B (рівень 1a: 1 дослідження; рівень 2b: 11 досліджень; рівень 3b: 4 дослідження; рівень 4: 1 дослідження).
Користь: зазвичай добре переноситься, легко виконується, має сприятливий рівень чутливості та специфічності при використанні як самостійного діагностичного тесту.
Шкода: дуже низький ризик серйозних побічних реакцій.
Вартість: низька.
Оцінка співвідношення користь/шкода: користь переважає над шкодою при використанні як самостійного діагностичного тесту. Баланс користі та шкоди при використанні для підтвердження результатів прик-тесту як кількісного діагностичного тесту або тесту на безпечність флакона для введення.
Висновки про цінність: важливо визначити наявність IgE-опосередкованої сенсибілізації для осіб із підо-зрою на АР. Якщо прик-тест негативний, існує обмежена клінічна користь від проведення внутрішньо-шкірної проби з метою підтвердження.
Рівень впровадження: можливим є використання внутрішньошкірної проби як єдиного діагностичного тесту для осіб із підозрою на АР. Можливим є використання внутрішньошкірної проби як підтверджувального методу після негативного прик-тесту для нестандартизованих алергенів. Докази переваги кількісної ВПР є розрізненими і не дозволяють рекомендувати цю специфічну методику.
Втручання: внутрішньошкірні проби можна використовувати для визначення специфічної алергенної сенсибілізації аерогенними алергенами для осіб із пі-дозрою на АР.
VIII.E.3. Змішані методики шкірних алергологічних проб
Змішана методика шкірних алергологічних проб передбачає комбіноване застосування прик-тесту і внутрішньошкірної проби для встановлення «кінцевої точки» для конкретного антигену [844, 847, 850]. Протокол проведення, вперше описаний Krouse і Krouse [861] під назвою «модифікований кількісний тест» (МКТ), служить прикладом виконання змішаної техніки. МКТ включає алгоритм, в якому прик-тест спочатку використовується для введення антигену. Залежно від результату прик-тесту внутрішньошкірна проба проводиться або ні [844, 847, 850, 861]. За допомогою цих результатів алгоритм використовується для визначення кінцевої точки для кожного антигену, який досліджувався [844, 847, 850, 861]. Кінцева точка визначає реактивність шкіри на введений антиген за шкалою з поділками та вважається безпечною початковою дозою для AIT [861]. Існує невелика кількість літературних даних зі змішаної техніки, однак AIT, заснована на результатах МКТ, є успішною, а зміни з боку імунної системи відповідають результатам інших методик [861].
Переваги змішаних методик, таких як МКТ, полягають у тому, що вони надають лікарям як якісні дані (пацієнт демонструє чутливість), так і кількісні дані (кінцева точка; безпечна початкова доза для AIT) для специфічної чутливості антигену протягом меншого часу, ніж ВПР [844, 847, 850]. Недоліки включають додатковий ризик і час, необхідні для проведення внутрішньошкірних проб. Порівняно з методом ВПР та аналізами in vitro МКТ виявився більш вигідним з економічної точки зору, якщо поширеність АР у популяції становить щонайменше 20 % [862]. Хоча змішані методики можуть бути розглянуті для оцінки АР, особливо для визначення початкової дози для АСІТ, сильні докази на користь цієї методики відсутні.
Загальний рівень доказовості: D (рівень 3b: 1 дослідження; рівень 4: 4 дослідження).
Користь: можливість встановити кінцеву точку за менший час, ніж ВПР.
Шкода: додаткові ризики, включаючи системні або анафілактичні реакції внутрішньошкірних проб; додатковий час і дискомфорт.
Вартість: подібна до вартості внутрішньошкірних проб.
Оцінка співвідношення користь/шкода: користь перевищує шкоду.
Висновки про цінність: AIT можна розпочинати, базуючись на результатах тільки прик-тесту; однак AIT на основі кінцевої точки може зменшити час до досягнення терапевтичної дози.
Рівень впровадження: є можливим методом діагностики.
Втручання: МКТ — це метод проведення шкірної алергологічної проби, який може бути використаний для визначення початкової дози для AIT.
VIII.E.4. Фактори, які впливають на проведення або інтерпретацію шкірних алергологічних проб
VIII.E.4.a. Медикаменти
Шкірна реакція за типом цвітіння, що спостерігається при проведенні шкірних алергологічних проб, залежить від фізіологічної дії гістаміну, що виділяється з тучних клітин при їх дегрануляції. Таким чином, будь-які лікарські засоби, що пригнічують дегрануляцію мастоцитів або функціонують як антагоністи H1-рецепторів гістаміну, мають потенціал для пригнічення відповіді на шкірні алергологічні проби. Супресивні ефекти антигістамінних препаратів на алерген-індуковані реакції за типом цвітіння сильно варіюють [863, 864], і тривалість цього ефекту пригнічення залежить від концентрації у шкірі та періоду напіввиведення цих препаратів [865, 866]. Фактично, пригнічення шкірних проб можна використовувати як біологічну пробу початку і тривалості дії антигістамінних препаратів [865]. Такі препарати, як астемізол (на сьогодні вилучений з ринку через пролонгацію QT), мають потенціал для пригнічення шкірних алергологічних проб протягом декількох тижнів після відміни [867]. Хоча більшість антигістамінних препаратів мають пригнічуючий ефект на шкірні алергологічні проби протягом 2–7 днів після відміни [867, 868]. Топічні антигістамінні препарати також мають потенціал пригнічення відповіді на шкірні алергологічні проби. В одному рандомізованому плацебо-контрольованому дослідженні було продемонстровано, що лікування назальним спреєм азеластину протягом 14 днів зменшило гістамін-індуковану шкірну реакцію, і це пригнічення зникло через 48 годин після відміни [869].
У рандомізованих плацебо-контрольованих дослідженнях було показано, що антагоністи Н2-рецепторів, такі як ранітидин, можуть зменшити реакцію шкіри [870, 871], а в одному дослідженні було показано адитивний ефект антагоністів H1- і H2-рецепторів гістаміну на пригнічення реакції шкіри [872]. Деякі антидепресанти мають потенціал пригнічувати реакцію шкіри, зокрема трициклічні антидепресанти, що мають антигістамінні властивості (наприклад, доксепін) [873]. Однак нові класи антидепресантів, такі як селективні інгібітори зворотного захоплення серотоніну (СІЗЗС), не впливають на результат шкірних алергологічних проб [874].
Рекомбінантне гуманізоване моноклональне антитіло анти-IgE (mAb), омалізумаб, перешкоджає IgE-опосередкованим реакціям дегрануляції мастоцитів під час розвитку реакції на шкірну алергологічну пробу. Рандомізоване плацебо-контрольоване дослідження продемонструвало значне пригнічення алерген-індукованої реакції шкіри після 4 місяців лікування [874]. Імовірно, що омалізумаб пригнічує реакцію шкіри разом зі значним зниженням рівня вільного IgE у сироватці, а реакції на шкірні алергологічні проби повертаються до нормального результату через 8 тижнів припинення лікування [875].
Антагоністи лейкотрієнових рецепторів не впливають на результати шкірних алергологічних проб. Hill та Krouse [876], а також Simons та співавт. [866] не виявили впливу монтелукасту на результати внутрішньошкірних проб у пацієнтів з алергією. Cuhadaroglu та співавт. [877] не виявили змін результатів прик-тесту у пацієнтів з алергією до і після лікування зафірлукастом.
Загалом, докази найвищої якості свідчать, що системне лікування стероїдами не впливає на результати прик-тесту і внутрішньошкірних проб [878, 879], хоча деякі менш точні ретроспективні дослідження свідчать про те, що системне лікування стероїдами може вплинути на реакцію шкіри [880, 881]. Було продемонстровано, що лікування місцевими кортикостероїдами пригнічує розвиток реакції шкіри на оброблених ділянках шкіри, що створює можливість виникнення псевдонегативних результатів [882–885]. Не було знай-дено досліджень, в яких би розглядали вплив назальних або інгаляційних кортикостероїдів на результати шкірних проб.
Вплив багатьох класів ліків на результат шкірних алергологічних проб залишається вивченим недостатньо. Було висунуто припущення про можливу пригнічуючу дію бензодіазепінів на розвиток реакції на шкірні алергологічні проби [886, 887]. Показано, що інгібітор кальциневрину такролімус інгібує розвиток шкірної реакції на прик-тест [885], у той час як дослідження аналогічного препарату, пімекролімусу, не виявило жодного впливу на реакцію [888]. Фармакологічні ефекти рослинних препаратів, як правило, не вивчені, і залишається незрозумілим, які з цих засобів можуть впливати на результат шкірних алергологічних проб. More та співавт. [889] провели подвійне сліпе плацебо-контрольоване однодозове перехресне дослідження у 15 здорових добровольців, вивчаючи гістамін-індуковану реакцію на шкірні алергологічні проби. Жодна з 23 досліджуваних рослинних добавок не призвела до пригнічення розвитку індукованої гістаміном відповіді.
Існує багато класів ліків, фактичний вплив яких на результат шкірних алергологічних проб невідомий. Щоб знизити ризик хибнонегативних результатів шкірних алергологічних проб, спричинених медикаментами, алергологічні проби слід проводити після застосування відповідних позитивних контролів (як правило, гістамінових) для забезпечення того, що на момент тестування гістамін-індукована реакція шкіри є інтактною.
VIII.E.4.b. Стан шкіри
Користь шкірних алергологічних проб залежить від здатності виявити реакцію гіперчутливості I типу після введення алергену у шкіру. Змінена шкіра (наприклад, при наявності дерматиту) може не відповідати належним чином на гістамін, гліцерин або алерген. Крім того, фізична травма від скарифікаційної або внутрішньошкірної проби може спричинити місцеву запальну реакцію. Реакцію шкіри за типом цвітіння також може бути важко виявити через наявні зміни шкіри. Крім того, колір шкіри може впливати на здатність розпі-знати реакцію, особливо у темношкірих пацієнтів.
Загальні принципи диктують не проводити шкірні алергологічні проби на ділянках активного дерматиту, але клінічних досліджень для вивчення цього явища бракує. Особи з дерматографізмом можуть мати більш яскраву реакцію на шкірні алергологічні проби, що вимагає пильної уваги до результатів негативних контролів. У деяких випадках бажано визначати специфічний IgE in vitro у пацієнтів зі шкірними захворюваннями або дерматографізмом, але ця рекомендація не заснована на даних або результатах контрольованих досліджень.
У зв’язку з відсутністю опублікованих досліджень з даної теми неможливо надати загальний рівень доказовості та рекомендації.
Далі буде
Друкується у скороченні