Журнал «Медицина неотложных состояний» №7(102), 2019
Вернуться к номеру
Клінічний випадок катастрофічного антифосфоліпідного синдрому
Авторы: Фесенко У.А.(1), Кльофа Т.Г.(2), Скуратівський Ю.Є.(2), Якимович Ю.С.(2), Павчак Р.М.(2), Родзоняк А.І.(2)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Військово-медичний клінічний центр Західного регіону, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У статті описаний клінічний випадок тромбофілії з тромбоцитопенією в пацієнта 75 років з клінічними ознаками катастрофічного антифосфоліпідного синдрому у вигляді мультифокального венозного й артеріального тромбозу, поліорганної недостатності (ниркова, печінкова, церебральна, серцево-судинна), дистальних некрозів на усіх кінцівках, тромбоцитопенії. Лікування антикоагулянтами, антиагрегантами, кортикостероїдами, плазмаферезом привело до покращення стану. Через дистальні некрози ампутовані пальці на обох кистях, права нижня кінцівка на рівні середньої третини гомілки. Наведено аналіз літератури, клінічних рекомендацій і можливі варіанти діагнозу, на тлі якого, імовірно, виникла тромбофілія з тромбоцитопенією. Обговорені дискусійні питання й складні рішення у веденні таких пацієнтів.
В статье описан клинический случай тромбофилии с тромбоцитопенией у пациента 75 лет с клиническими проявлениями катастрофического антифосфолипидного синдрома в виде мультифокального венозного и артериального тромбоза, полиорганной недостаточности (почечная, печеночная, церебральная, сердечно-сосудистая), дистальных некрозов на всех конечностях, тромбоцитопении. Лечение антикоагулянтами, антиагрегантами, кортикостероидами, плазмаферезом привело к улучшению состояния. Из-за дистальных некрозов ампутированы пальцы на обеих кистях, правая нижняя конечность на уровне средней трети голени. Приведен анализ литературы, клинических рекомендаций и возможные варианты диагноза, на фоне которого, вероятно, возникла тромбофилия с тромбоцитопенией. Обсуждаются дискуссионные вопросы и сложные решения в ведении таких пациентов.
The case report of the patient with thrombophilia and thrombocytopenia is presented. A 75-year-old man had clinical manifestations of catastrophic antiphospholipid syndrome as multifocal venous and arterial thrombosis which lead to multiple organ dysfunction (renal, hepatic, cerebral and cardiovascular), distal necrosis in all extremities, thrombocytopenia. The treatment with anticoagulant, antiplatelet agents and corticosteroid therapy, plasma exchange led to improvement of patient’s state. Due to distal necrosis, fingers on both hands were amputated, and the right lower limb — at the level of the middle third. The literature data and clinical guidelines are analyzed and variants of diseases, which can be possible causing factors of thrombophilia with thrombocytopenia, are discussed. The most difficult points in the management of such patients are described.
тромбофілія; тромбоцитопенія; катастрофічний антифосфоліпідний синдром
тромбофилия; тромбоцитопения; катастрофический антифосфолипидный синдром
thrombophilia; thrombocytopenia; catastrophic antiphospholipid syndrome
Вступ
Катастрофічний антифосфоліпідний синдром (КАФС) — це найтяжчий варіант антифосфоліпідного синдрому (АФС), що характеризується поширеним тромбозом у багатьох органах і цитокіновим штормом, які розвиваються протягом короткого періоду, з гістологічними проявами мікротромбозу й лабораторним підтвердженням титрів антифосфоліпідних антитіл (АФА) [1].
КАФС становить приблизно 1 % серед усіх випадків АФС. Летальність при КАФС за останні роки дещо знизилась — із 50 до 36 %. Сучасні рекомендації з цієї проблеми ґрунтуються на аналізі випадків з міжнародного реєстру КАФС (CAPS Registry). Лікування КАФС включає антикоагулянти, глюкокортикоїди, плазмозамінну терапію і/або внутрішньовенні імуноглобуліни. При неефективності такої терапії можна розглянути застосування таких препаратів, як ритуксимаб та екулізумаб [2].
Опис випадку
Чоловік, 75 років, госпіталізований у відділення анестезіології та інтенсивної терапії Військово–медичного клінічного центру Західного регіону (ВМКЦ ЗР) у тяжкому стані. З анамнезу відомо, що хворіє протягом 12 діб, коли з’явилися скарги на нападоподібний біль в епігастрії, пожовтіння шкіри й слизових оболонок. Описані вище скарги прогресували, тому на 10–й день хвороби звернувся по медичну допомогу й був госпіталізований у центральну районну лікарню (ЦРЛ). На тлі лікування стан погіршився: з’явились ознаки гострої ішемії пальців на верхніх і нижніх кінцівках, пригнічення свідомості. На 3–й день після госпіталізації в ЦРЛ був переведений у ВМКЦ ЗР.
З анамнезу: мав епізод флеботромбозу на лівій нижній кінцівці, панкреонекроз і хронічний панкреатит, жовчнокам’яну хворобу, хронічний калькульозний холецистит, подагру, ішемічну хворобу серця, гіпертонію. Не хворів на інфекції (гепатити, туберкульоз, червоний вовчак, сифіліс, гонорея тощо). Алергічні реакції та автоімунні захворювання заперечує. Медикаменти не приймав.
Об’єктивно при надходженні стан хворого тяжкий. Свідомість — сопор. Шкіра, склери й видимі слизові оболонки іктеричні. Наявні некротичні зміни нігтьових фаланг обох верхніх кінцівок. Права нижня кінцівка бліда, прохолодна на дотик у ділянці дистальніше від колінного суглоба. Температура тіла 36,8 °С. Частота дихання 20/хв, SpO2 96 % при FiO2 0,3. Частота серцевих скорочень (ЧСС) 150/хв. Артеріальний тиск 120/80 мм рт.ст. Центральний венозний тиск 5 мм рт.ст. Живіт чутливий в епігастрії.
Клінічний аналіз крові: еритроцити — 4,35 Т/л, лейкоцити — 11,4 Г/л, гемоглобін — 140 г/л, гематокрит — 0,39, тромбоцити — 34 Г/л.
Біохімічний аналіз крові: загальний білок — 59 г/л, білірубін загальний — 125 мкмоль/л, білірубін прямий — 105 мкмоль/л, креатинін — 374 мкмоль/л, сечовина — 24,1 ммоль/л, АЛТ — 75 Од/л, АСТ — 106 Од/л, лактатдегідрогеназа (ЛДГ) — 833 Од/л, креатинфосфокіназа (КФК) — 493 Од/л, КФК–МВ — 126,6 Од/л, лужна фосфатаза — 441 Од/л, амілаза — 38 Од/л, глюкоза — 4,4 ммоль/л.
Електроліти: натрій — 134,8 ммоль/л, калій — 4,34 ммоль/л, хлор — 103,2 ммоль/л, кальцій — 2,2 ммоль/л.
Коагулограма: протромбіновий індекс — 74 %, фібриноген — 2 г/л.
Кислотно–основний стан: рН 7,35, pO2 105 мм рт.ст., pCO2 29,8 мм рт.ст., ВЕ –9,3, HCO3 16,7 ммоль/л (компенсований метаболічний ацидоз). На 6–й день захворювання — метаболічний алкалоз, що нормалізувався на 8–й день.
Аналіз на вірусні гепатити: негативний. Аналіз на малярійний плазмодій: не виявлено. Аналіз на антинуклеарні антитіла (на системний червоний вовчак (СЧВ)): негативний. Аналіз на α–фетопротеїн (онкомаркер гепатоцелюлярного раку): норма. Аналіз на СА 19–9 (онкомаркер підшлункової залози): норма.
Електрокардіографія (ЕКГ): при госпіталізації — правильна форма тріпотіння передсердь із проведенням 2 : 1. У динаміці з 2–го по 5–й день захворювання — неправильна форма тріпотіння передсердь із проведенням 2 : 1, 4 : 1, 5 : 1. Із 6–го дня захворювання — правильний синусовий ритм.
Ехокардіографія (ЕхоКГ): при госпіталізації — дифузне зниження скоротливої здатності лівого шлуночка (фракція викиду (ФВ) 40 %). Стеноз аортального клапана легкого ступеня. Діастолічна дисфункція міокарда лівого шлуночка, І тип. У динаміці на 9–й день — зростання ФВ до 46 %.
Ультразвукове дослідження (УЗД) органів черевної порожнини при госпіталізації — ознаки гепатоспленомегалії; застійний жовчний міхур, конкременти шийки жовчного міхура, тромбоз лівої гілки ворітної вени. На 9–й день захворювання — ознаки гепатоспленомегалії, асцит, двобічний гідроторакс.
Фіброгастродуоденоскопія: дуоденогастральний рефлюкс.
Дуплексне сканування артерій верхніх і нижніх кінцівок: ознаки тромботичної оклюзії дистальних третин ліктьових артерій з обох боків, передніх великогомілкових артерій з обох боків і задньої великогомілкової артерії справа.
Діагноз клінічний при надходженні: гостра поліорганна (ниркова, печінкова, церебральна, серцево–судинна) недостатність. Жовтяниця змішаного генезу. Холестатичний синдром. Тромбоз дистальних сегментів правої та лівої ліктьових, правої та лівої передніх великогомілкових артерій, правої задньої великогомілкової артерії. Внутрішньопечінковий тромбоз лівої гілки ворітної вени.
У процесі лікування хворий консультований абдомінальним хірургом (діагноз: механічна жовтяниця), невропатологом, гематологом (діагноз: імунна тромбоцитопенічна пурпура?), гастроентерологом, інфекціоністом (виключення вірусних гепатитів, лептоспірозу).
На 10–ту добу лікування діагностовано тромбоз обох внутрішніх яремних, стеноз правої підключичної вен.
Консервативне лікування:
— плазмаферез, 4 сеанси через день;
— метилпреднізолон у дозі 2 мг/кг/добу протягом 6 діб;
— нефракціонований гепарин у дозі 750–2000 ОД/год залежно від показника часу згортання крові протягом 10 днів, з подальшим переходом на прийом ривароксабану 20 мг 1 р/д протягом 15 днів і подальшим прийомом апіксабану 2,5 мг 2 рази на добу протягом 3 місяців;
— антибактеріальна терапія (іміпенем з переходом на цефоперазон/сульбактам за результатами визначення збудника і його чутливості до антибіотиків);
— антиаритмічна терапія: аміодарон в/в з переходом на пероральний прийом з метою контролю ритму та ЧСС;
— антиагрегантна терапія: клопідогрель, цилостазол перорально;
— препарати заліза;
— анальгетики;
— профілактика стрес–виразок шлунково–кишкового тракту: інгібітори протонної помпи;
— нейротропна терапія (цитиколін).
Хірургічне лікування:
— ампутація правої нижньої кінцівки на рівні середньої третини гомілки (анестезія — блокада сідничного й стегнового нервів);
— ампутація I–V пальців правої кисті на рівні проксимальних фаланг (анестезія — блокада плечового сплетення з пахвового доступу);
— ампутація II–V пальців лівої кисті на рівні середніх фаланг (анестезія — блокада плечового сплетення з пахвового доступу).
Дистальні некрози мали місце на усіх кінцівках (рис. 1, 2). На правій руці була проведена катетеризація променевої артерії для інвазивного моніторингу артеріального тиску. Некротичні зміни на правій кисті поширились на І палець, чого не спостерігалось на лівій кисті (рис. 1).
Ішемічно–некротичні зміни на пальцях лівої стопи регресували й не потребували оперативного втручання.
Кінцевий результат лікування: пацієнт виписаний додому на підтримуючій терапії: ривароксабан, цилостазол, аміодарон.
Дискутабельні питання
Катетеризація периферичних і центральних вен, артерій на фоні генералізованого тромбозу: периферичний або центральний венозний доступ?
На УЗД виявлені тромби в підключичній, яремній венах, що неповністю обтурували просвіт цих судин. Зрозуміло, що за таких умов катетеризація центральної вени є дуже ризикованою в плані тромбозу. Але тяжкість стану пацієнта потребувала центрального венозного доступу. Через дистальні некрози на кінцівках була загроза і при катетеризації периферичних вен. Пацієнт був переведений з катетером у ліктьовій вені з проявами флебіту й тромбозу. Катетеризація променевої артерії для інвазивного моніторингу гемодинаміки показана при поліорганній недостатності. Але в даному випадку вона сприяла погіршенню кровообігу в кисті на тлі тромбозу судин.
Стан тромбофілії на фоні тромбоцитопенії. Важким є питання вибору препаратів для лікування таких пацієнтів. Зрозуміло, що пацієнт із тромбофілією і проявами генералізованого артеріального й венозного тромбозу потребує потужної антикоагулянтної терапії. Який гепарин — простий чи низькомолекулярний? Дози? За яким показником контролювати ефект? Антитромбоцитарні препарати? Непрямі антикоагулянти? Пероральні антикоагулянти? Наскільки ризикованим є застосування всіх цих препаратів на тлі тромбоцитопенії 34–22 ´ 109/л?
Ми вирішили починати лікування з нефракціонованого гепарину через його більш контрольований ефект: шляхом постійного введення за допомогою шприц–насосу, дозу підбирали за показником часу згортання крові за Лі — Уайтом, який підтримували на рівні приблизно 12 хв. Швидкість введення гепарину становила 750–2000 Од/год залежно від показника часу згортання крові. Пацієнт отримував гепарин протягом 10 днів. Після цього був переведений на прийом ривароксабану 20 мг 1 р/д протягом 15 днів і подальший прийомом апіксабану 2,5 мг 2 рази на добу протягом 3 місяців.
За шкалою Caprini ризик тромбозу в пацієнта становив 13 балів, що є дуже високим рівнем ризику тромбоутворення [3]. У пацієнта мало місце тріпотіння передсердь, ускладнене порушенням атріовентрикулярної провідності. Знижена фракція викиду лівого шлуночка (40 %) була зумовлена зниженням контрактильності міокарда й порушенням серцевого ритму. Ми застосовували антиаритмічний препарат аміодарон на початку довенно, з поступовим переходом на пероральний прийом, що дало змогу швидко відновити й ефективно конт–ролювати синусовий ритм.
Ризик кровотечі за шкалою HAS–BLED у нашого пацієнта становив 5 балів, що відповідає високому ризику [4]. Ведення таких пацієнтів, які мають високі ризики як тромбозу, так і кровотечі, італійські автори називають «балансуванням між Сциллою та Харибдою» [5]. Кровотечі в нашого пацієнта не спостерігалось. Кількість тромбоцитів поступово підвищувалась і протягом тижня нормалізувалась (рис. 3).
Прояви печінкової дисфункції (підвищення білірубіну, в основному за рахунок прямої фракції, трансаміназ, ЛДГ, КФК, лужної фосфатази) вірогідно були зумовлені тромбозом ворітної вени й регресували на тлі лікування (рис. 4). Даних про вірусні гепатити не було.
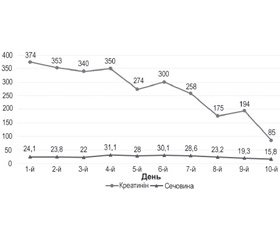
Прояви ниркової недостатності (підвищення креатиніну, сечовини) також могли бути проявом тромбозу ниркових судин (що не було встановлено наявними методами діагностики). Рівень креатиніну нормалізувався на 10–й день лікування, а нормалізація рівня сечовини спостерігалась лише на 14–й день (рис. 5), що, швидше за все, було зумовлене наявністю некротичних змін дистальних ділянок на всіх кінцівках.
За шкалою SOFA при надходженні наш пацієнт набирав 12 балів, що відповідає прогнозованій летальності 69 %. Чи можна було діагностувати в даному випадку сепсис? Пацієнт при переведенні до нашого госпіталю мав нормальну температуру тіла, лейкоцитоз — 11,4 Г/л, що не дає підстави говорити про інфекцію як основну причину всіх проявів. Спочатку була підозра на лептоспіроз, через що пацієнт отримував пеніцилін. Але аналіз крові на лептоспіроз був негативним. Якби мала місце тяжка інфекція, яка б призвела до таких тяжких ускладнень, навряд чи стан пацієнта покращився б на терапії пеніциліном. Це підтверджує нашу думку про відсутність сепсису в нашого пацієнта, принаймні, що сепсис не був пусковим фактором усіх проявів, які мали місце у даному випадку.
Причини тромбофілії
Тромбофілія — генетично детермінована або набута схильність до розвитку венозних і артеріальних тромбозів. Частота відомих причин вродженої тромбофілії становить ≈ 8 % у загальній популяції і 30–50 % випадків венозного тромбозу серед осіб віком < 50 років.
Класифікація тромбофілій:
1) вроджені тромбофілії — фактор V Лейдена, варіант G20210A гена протромбіну, зниження рівня або активності протеїну С, протеїну S і антитромбіну, деякі види дисфібриногенемії, гомозиготна форма гомоцистеїнурії (дефіциту цистатіонін–β–синтази), дефіцит плазміногену, підвищена активність фактора VIII;
2) набуті тромбофілії — антифосфоліпідний синдром, гіпергомоцистеїнемія (спричинена негенетичними чинниками: пов’язана з нирковою недостатністю, гіпотиреозом або лікуванням антагоністами фолатів, зокрема метотрексатом), підвищений рівень фактора ІХ або ХІ, підвищена активність фактора VIII, набута резистентність до активованого протеїну C (наприклад, під час вагітності, під час прийому оральних контрацеп–тивів).
З огляду на вік у нашому випадку можна одразу виключити вроджені тромбофілії. Серед усіх можливих причин набутої тромбофілії в нашого пацієнта, на нашу думку, найбільш імовірним виглядає АФС, хоч і інші варіанти не можна виключити без поглибленого лабораторного обстеження.
Генез тромбоцитопенії: антифосфоліпідний синдром? Автоімунна тромбоцитопенія? Тромбоцитопенія споживання? Ураження кісткового мозку? Гепариніндукована тромбоцитопенія?
При автоімунній тромбоцитопенічній пурпурі пацієнти мають схильність до кровотечі, а в нашого пацієнта, навпаки, мала місце тромбофілія. Тромбоцитопенія споживання також мала б призвести до кровотечі при кількості тромбоцитів 22 × 109/л. У нашого пацієнта прогресував генералізований тромбоз на тлі такої тромбоцитопенії. Ураження кісткового мозку мало б проявитись пригніченням і інших ланок кровотворення: анемією, лейкопе– нією. Але цього не було в нашого пацієнта. Пацієнт не отримував гепарин перед виникненням тромбоцитопенії, тому можна виключити гепариніндуковану тромбоцитопенію.
Серед усіх причин, що теоретично могли викликати тромбоцитопенію, ми зупинились на антифосфоліпідному синдромі. Для АФС характерні: тромбоцитопенія, тромбофілія, ураження печінки, нирок. У нашого пацієнта при першій госпіталізації не проводився аналіз на антифосфоліпідні антитіла, що є лабораторними діагностичними критеріями АФС. Це пов’язане з обмеженими можливостями нашої лабораторії, з одного боку, а з іншого боку, наш пацієнт з моменту надходження був на потужній гепаринотерапії, що знижує інформативність аналізу на АФА. Аналіз на антинуклеарні антитіла (на системний червоний вовчак) був негативним. Але цей показник не є діагностичним критерієм АФС. Позитивний ефект від плазмаферезу, гепарину й глюкокортикоїдної терапії, що є основними ланками лікування АФС, також свідчить на користь цього діагнозу.
Антифосфоліпідний синдром (синдром Х’юза)
АФС — це захворювання, викликане автоантитілами до білково–фосфоліпідних комплексів. Інцидентність АФС становить 5 нових випадків на 100 000 населення на рік, його частота становить 40–50 на 100 000 населення. АФС як основну причину набутої тромбофілії описав британський учений G. Hughes у 1983 р., він назвав цей стан «синдромом липкої крові». АФС є причиною невиношування вагітності у 20 % випадків. [6].
Діагноз АФС по суті ґрунтується на наявності в крові циркулюючих антифосфоліпідних антитіл: вовчакового антикоагулянту, антикардіоліпіну (АКЛ) і анти–β2–глікопротеїну I. Позитивний тест на АФА має місце в 13 % пацієнтів з інсультом, 11 % — з інфарктом міокарда, 9 % — з тромбозом глибоких вен і 6 % — із патологією вагітності. Складність діагностики зумовлена тим, що ці антитіла можуть бути присутні і в крові здорових людей. Саме тому аналізи потрібно трактувати через призму клінічних симптомів. Антитіла до кардіоліпінів виявляють у 2–4 % людей у загальній популяції. АФА у 2–5 разів частіше зустрічаються в жінок, проте їх наявність у сироватці крові не завжди свідчить про АФС. Клінічні прояви цього синдрому спостерігаються в 30 % хворих із вовчаковими антитілами і 30–50 % пацієнтів із помірним або підвищеним рівнем АФА. Тому однократне виявлення АФА у крові не є підставою для встановлення остаточного діагнозу. Окрім хворих із АФС, АФА виявляють також у пацієнтів з інфекційними захворюваннями, на фоні медикаментозного лікування (при прийомі метилдопи, комбінованих оральних контрацептивів) і навіть у здорових людей [6].
В Україні ведення пацієнтів з АФС регламентоване Наказом МОЗ України від 08.10.2007 № 626 «Про затвердження клінічних протоколів надання медичної допомоги хворим з імунними захворюваннями», у якому є розділ «Клінічний протокол надання медичної допомоги хворим з АФС». У даному документі наведене таке визначення: «Антифосфоліпідний синдром — хронічний вазооклюзивний процес з розвитком поліорганної ішемії, а в ряді випадків і поліорганної недостатності внаслідок рецидивуючого тромбоутворення в дрібних внутрішньоорганних судинах на тлі циркуляції в крові вовчакового антикоагулянту та присутності антифосфоліпідних антитіл». Виділено два типи АФС: первинний АФС (генетично–детермінований) — сімейні випадки, ессенціальний (7–12 %), і вторинний АФС, зумовлений автоімунними хворобами, хронічними інфекціями, онкопатологією, медикаментозним впливом тощо (88–93 %).
Критерії діагностики АФС
Клінічні:
— судинний тромбоз артерій і/або вен будь–якої локалізації в тканині чи окремих органах (доплер– чи морфологічно підтверджений);
— патологія вагітності — внутрішньоутробна смерть плода після 10 тижнів з нормальними морфологічними ознаками, передчасні пологи до 34 тижнів із вираженою плацентарною недостатністю чи прееклампсією), три і більше самовільні аборти до 10 тижнів без гормональних порушень, дефектів матки чи хромосомних вад;
— Livedo reticulares (сітчастий рисунок шкіри);
— геморагічний синдром.
Лабораторні:
— антикардіоліпінові антитіла класів IgG і IgM (підвищений рівень) у трьох дослідженнях протягом місяця;
— наявний вовчаковий антикоагулянт плазми;
— тромбоцитопенія;
— хибнопозитивна RW.
АФС є вірогідно підтвердженим, якщо є один клінічний і два лабораторних критерії (формула «1 + 2»).
Ступені тяжкості АФС:
І ступінь — один клінічний критерій, тромбоцити понад 100–150 Г/л, АКЛ IgG підвищені до 30 % понад норму;
ІІ ступінь — один клінічний критерій, тромбоцити 50–100 Г/л, АКЛ IgG підвищені до 30–50 % понад норму;
ІІІ ступінь — один клінічний критерій, тромбоцити нижче від 50 Г/л, АКЛ IgG підвищені більше ніж на 100 % від норми.
Лікувальні заходи при АФС:
— первинний АФС без клініки — спостереження, профілактика тромбозів;
— первинний із тромбозом — низькомолекулярні гепарини або гепарин;
— вторинний АФС — лікування основної патології, профілактика тромбозів;
— вторинний АФС із тромбозом — лікування основної патології, низькомолекулярні гепарини або гепарин;
— вагітність з АФС — з першого дня вагітності аспірин, курсами низькомолекулярні гепарини з 10–го по 34–й тиждень один раз на місяць;
— АФС із тромбоцитопенією (> 50 Г/л) — системні глюкокортикостероїди, імуноглобуліни довенно.
Існують деякі відмінності у визначенні діагностичних критеріїв, ступенів тяжкості АФС згідно з даним наказом і рекомендаціями міжнародних експертів.
У 2003 році були запропоновані попередні критерії класифікації катастрофічного антифосфоліпідного синдрому [7].
Критерії:
1. Докази ураження трьох або більше органів, систем і/або тканин. Зазвичай клінічні ознаки оклюзії судин підтверджуються методами візуалізації, коли це можливо. Ниркова недостатність визначається як зростання на 50 % сироваткового креатиніну, тяжка системна гіпертензія (> 180/100 мм рт.ст.) і/або протеїнурія (> 500 мг/добу).
2. Розвиток проявів одночасно або менше ніж за тиждень.
3. Гістологічне підтвердження оклюзії малих судин принаймні в одному органі або тканині. Для гістологічного підтвердження повинні бути присутні значні ознаки тромбозу, хоча васкуліт також може бути присутнім.
4. Лабораторне підтвердження наявності антифосфоліпідних антитіл (вовчаковий антикоагулянт і/або антитіла до антикардіоліпіну). Якщо пацієнту раніше не було встановлено діагноз AФС, лабораторне підтвердження вимагає присутності антифосфоліпідних антитіл у двох або більше зразках крові з інтервалом принаймні шість тижнів (необов’язкова умова під час хвороби).
Визначений катастрофічний АФС:
— усі чотири критерії присутні.
Можливий катастрофічний АФС:
— усі чотири критерії, за винятком лише двох залучених органів, систем і/або тканин;
— усі чотири критерії, за винятком лабораторного підтвердження принаймні протягом шести тижнів через ранню смерть пацієнта, який не проходив тестування на АФС перед катастрофічним АФС;
— перший, другий і четвертий критерії;
— перший, третій і четвертий критерії і розвиток третьої події за більше ніж тиждень, але менше ніж за місяць, незважаючи на антикоагуляцію.
У нашого пацієнта маніфестація хвороби вкладається в картину катастрофічного АФС (синдром Ашерсона (R.A. Asherson)): мультифокальний венозний і артеріальний тромбоз із картиною поліорганної недостатності. Мали місце прояви з боку печінки, нирок, центральної нервової системи, серцево–судинної системи, периферичних судин усіх кінцівок.
У 2006 р. на конгресі Міжнародного товариства з вивчення тромбозів і гемостазу (ISTH) у м. Сіднеї були подані клінічні критерії АФС, які умовно можна розподілити на дві великі групи: тромботичний АФС — судинний тромбоз вен і артерій будь–якої локалізації, окрім поверхневих венозних тромбозів; акушерський АФС — патологія вагітності (внутрішньоутробна загибель морфологічно нормального плода в терміні 10 тижнів і більше, передчасні пологи до 34–го тижня вагітності, перебіг якої супроводжувався тяжкою прееклампсією, еклампсією чи вираженою плацентарною дисфункцією, а також 3 і більше самовільні викидні у терміні до 10 тижнів вагітності за умови виключення гормональних, анатомічних причин і хромосомних аномалій). Лабораторним критерієм АФС є наявність одного з трьох маркерів, яка визначається принаймні двічі з інтервалом не менше від 12 тижнів після появи клінічних ознак (вовчакових антитіл, антитіл до кардіоліпіну і β2–глікопротеїну I). Раціональний підхід у діагностиці АФС відповідно до вказаних критеріїв можна умовно описати як «1 + 1»: АФС діагностують тільки за наявності одного клінічного й одного лабораторного критеріїв; діагноз АФС не підтверджується, якщо інтервал між періодом, протягом якого спостерігалися клінічні ознаки, і позитивним тестом на АФА становить менше від 12 тижнів або більше від 5 років [6].
При повторній госпіталізації нашого пацієнта з інтервалом у 5 місяців після першої госпіталізації ми провели обстеження на АФА: вовчаковий антикоагулянт: скринінговий тест — 133,9 с (норма — 31–44 с), підтверджуючий тест — 75,9 с (норма — 30–38 с), LA–AUTO — 1,7642 індекс (0,8–1,2 — відсутність ризику, 1,2–1,5 — слабо виражений ризик, 1,5–2,0 — помірний ризик, > 2,0 — сильно виражений ризик); АФА IgG — 1,07 Од/мл (норма — до 10 Од/мл), IgM — 2,37 Од/мл (норма — до 10 Од/мл); β2–глікопротеїн I, IgG < 1,4 Од/мл (< 20 — негативний результат), IgM — 2,7 Од/мл (< 20 — негативний результат). Ми також виявили в нашого пацієнта підвищений рівень у сироватці крові гомоцистеїну — 20,2 мкмоль/л, а також гіперфібриногенемію — 9,5 г/л. Протромбін — 83 %. Тромбоцити в нормі — 330 × 109/л. Анемія: гемоглобін — 104 г/л, еритроцити — 3,59 × 1012/л, Ht — 0,26. Креатинін — 105 мкмоль/л.
Отже, наявність вовчакового антикоагулянту, гіперфібриногенемія підтверджують наш попередній діагноз катастрофічного АФС. Пацієнту додатково призначено фолієву кислоту, вітаміни групи В з приводу гіпергомоцистеїнемії.
АФС належить до категорії рідкісних тяжких захворювань (як гемофілія, серпоподібноклітинна анемія), стосовно яких неможливо провести великі рандомізовані, контрольовані дослідження. Результатом роботи групи експертів, двох узгоджувальних засідань став Консенсус із діагностики й лікування АФС. Діагноз АФС ґрунтується на комбінації випадків тромбозу й наявності в крові АФА. «Потрійно позитивні» пацієнти мають найвищий ризик повторних тромбозів. Титри АФА > 99 перцентиля мають бути оцінені як позитивні. При першому або повторному епізоді венозного тромбозу, асоційованого з АФС, першою лінією лікування має бути застосування антагоністів вітаміну К з дозуванням до міжнародного нормалізованого відношення (МНВ) 2,0–3,0. Пацієнтів із першим епізодом артеріального тромбозу необхідно лікувати клопідогрелем або антагоністами вітаміну К із цільовим показником МНВ 2,0–3,0. Застосування пероральних прямих антикоагулянтів при АФС не рекомендоване. Пацієнти з КАФС, повторними тромбозами або повторними ускладненнями вагітності мають бути направлені до експертних центрів. Цей консенсус, за висловом авторів, заповнює порожнечу між доказовою медициною та щоденною клінічною практикою для ведення пацієнтів з АФС [8].
Створення реєстру КАФС сприяло розробці рекомендацій щодо факторів ризику, діагностичних критеріїв і шляхів лікування цього синдрому [9]. Аналіз 500 випадків КАФС із CAPS Registry показав, що серед цих пацієнтів 69 % становили жінки, 31 % — чоловіки, середній вік 38 ± 17 років. 40 % пацієнтів мали асоційовану автоімунну патологію, найчастіше — системний червоний вовчак (75 %). У 65 % випадків епізод КАФС був викликаний провокуючим фактором, в основному (49 %) інфекцією. Клінічні прояви мали місце з боку різних органів і систем: нирок (73 %), легенів (60 %), головного мозку (56 %), серця (50 %) і шкіри (47 %). Вовчаковий антикоагулянт був виявлений у 83 % випадків, антикардіоліпінові антитіла — у 81 % і анти–β2–антитіла класу IgG — у 78 %. Смертність становила 37 %. Тригерними факторами були: в пацієнтів старшого віку — онкопатологія, а в молодших пацієнтів — інфекції. При КАФС на тлі системного червоного вовчака частіше реєструвались тяжкі прояви ураження серця й головного мозку, і смертність у цій категорії була вищою — 48 % [10].
Деякі дослідники доводять діагностичну цінність нетрадиційних антитіл при АФС. Особливо інформативними в діагностиці АФС можуть бути антитіла до фосфатидилсерину–протромбіну (aPS/PT — anti–phosphatidylserine–prothrombin antibodies). Перевага цих антитіл перед вовчаковим антикоагулянтом у тому, що їх можна виявити в крові на тлі прийому прямих пероральних антикоагулянтів, тоді як вовчаковий антикоагулянт у таких умовах не виявляється. Критичні пацієнти потребують прийому антикоагулянтів із самого початку надходження до стаціонару, а діагностику потрібно проводити на тлі лікування [11].
A.D. Makatsariya et al. проаналізували 17 випадків КАФС за 2001–2016 роки, серед яких летальність становила 30 % [12]. КАФС є загрозливим для життя станом, особливо у вагітних [13]. J. Gebhart et al. проаналізували перебіг хвороби у 82 жінок репродуктивного віку, які мали постійно позитивні тести на вовчаковий антикоагулянт. Серед цієї популяції 23 жінки мали 40 епізодів вагітності. Ускладнення вагітності мали місце у 28/40 (70 %) випадках, серед яких 22 (55 %) — випадки спонтанних абортів, 6 (15 %) — дострокових пологів до 34 тижнів гестації. В одному випадку після аборту розвинувся КАФС. Живонароджуваність становила 15/28 (54 %) у жінок, яких лікували поєднанням низькомолекулярного гепарину й низьких доз аспірину, і 3/12 (25 %) у тих, у яких не проводилося лікування або лікували одним із цих препаратів (гепарин або аспірин). Автори дійшли висновку, що ризик тяжких, навіть небезпечних для життя ускладнень вагітності й несприятливих наслідків вагітності є дуже високим у жінок зі стійким титром вовчакового антикоагулянту в крові [14].
Стандартне лікування КАФС антикоагулянтами, стероїдами й плазмозаміщенням демонструє найкращі результати [15]. Але щодо методів плазмозамісної терапії ще немає узгодженої думки [16, 17]. Для тривалого лікування пацієнтів з АФС рекомендовані пероральні антикоагулянти, а для запобігання маніфестації проявів АФС у вагітних — аспірин і гепарин [6]. У пацієнтів із системним червоним вовчаком рекомендований циклофосфамід [9]. Також розглядається як альтернативна терапія застосування таких препаратів: гідроксихлорохін, сиролімус, дефібротид [18].
У тяжких, рефрактерних до стандартної потрійної терапії (антикоагулянти, глюкокортикоїди, плазмаферез і/або в/в імуноглобуліни) випадках КАФС застосовують моноклональні антитіла ритуксимаб і екулізумаб. Ритуксимаб блокує CD20 (поверхневий протеїн цитоплазматичної мембрани В–клітин) і знижує утворення автоантитіл, таких як антифосфоліпідні антитіла. Екулізумаб має високу афінність до C5–комплемент–протеїну, інгібує його розщеплення і тим самим запобігає утворенню комплексу С5b–С9 [19].
Описаний випадок КАФС у пацієнта, який раніше мав епізод дистального венозного тромбозу з трофічними виразками, який, на думку авторів, міг бути проявом АФС. Цей епізод починався з картини повторного мезентеріального тромбозу. Консультація експерта світового рівня Dr. Ricard Cervera сприяла швидкому встановленню діагнозу КАФС, і пацієнт був успішно вилікуваний застосуванням ритуксимабу й екулізумабу [20].
D. Aguirre–Valencia et al. проаналізували причини смерті пацієнтів із СЧВ, які лікувались в одній лікарні в Колумбії у 2011–2017 роках. Серед 1776 пацієнтів із СЧВ померло 49, з них 44 (89,8 %) — жінки. Середній вік померлих — 40,6 ± 17,4 року. Середня тривалість хвороби до моменту смерті — 4,5 року. 89,9 % померлих мали лімфопенію, біопсія виявила вовчаковий нефрит у 38 (77,6 %) пацієнтів. КАФС був діагностований у 8 (16,3 %), персистуюча гіпокомплементемія (C3 і C4) — у 8 (16,3 %). Середній індекс активності хвороби СЧВ (SLEDAI–2K) на момент смерті пацієнтів становив 19 (IQR 11–39). Головною причиною смерті були активність СЧВ і вовчакові ураження органів — у 22 (44,9 %) пацієнтів. Автори дійшли висновку, що головними причинами смерті в пацієнтів із СЧВ є висока активність хвороби, рефрактерність до імуносупресивної терапії та нозокоміальні бактеріальні інфекції [21].
S.A. Tucker et al. описали випадок КАФС у 59–річної жінки, спровокований полімікробним сепсисом. Дискутабельним є питання застосування високих доз стероїдів на тлі сепсису [22]. М. Benger et al. описали випадок КАФС у 63–річної жінки з АФС в анамнезі. КАФС з поліорганною недостатністю розвинувся після переводу з варфарину на ривароксабан. Автори вважають, що пероральні прямі антикоагулянти можуть бути менш ефективними у вторинній профілактиці тромбозів у пацієнтів з АФС порівняно з варфарином [23]. Описані тяжкі випадки КАФС у дітей [24].
На сьогодні патогенез АФС пояснюють в основному за допомогою гіпотези подвійного удару, згідно з якою наявність АФА розглядається лише як фоновий чинник розвитку гіперкоагуляції, а патогенетичний механізм ініціюється пусковими факторами (травми, інфекції, хірургічні втручання тощо).
S. Chaturvedi et al. вказують на роль активації комплементу в патофізіології АФС. Комплемент — це система ензимів і регуляторних білків вродженої імунної системи, що відіграє ключову роль у запальній реакції на патогенні стимули. Шляхи комплементу й коагуляції тісно пов’язані між собою, і сучасні дані свідчать про те, що комплемент може бути активований у пацієнтів з АФА і може функціонувати як кофактор у патогенезі клінічних проявів АФС. Активація комплементу за допомогою АФА генерує C5a, який індукує прокоагулянтну активність нейтрофілів, що залежить від тканинного фактора. Бета–2–глікопротеїн I, первинний антиген для АФА, демонструє комплемент–регуляторні ефекти in vitro. Крім того, у диких мишей АФА індукує загибель плода, але в мишей з дефіцитом специфічних компонентів комплементу (C3, C5) такий ефект АФА відсутній. АФА також індукують тромбоз у диких мишей, і цей ефект послаблюється в мишей з дефіцитом С3 або С6 або за присутності інгібітора С5. Підвищені рівні продуктів активації комплементу були продемонстровані в сироватках пацієнтів з АФА, хоча зв’язок із клінічними проявами залишається неясним. Екулізумаб, кінцевий інгібітор комплементу, успішно застосовувався для лікування КАФС і запобігання тромботичній мікроангіопатії, пов’язаній з АФС, при трансплантації нирки. Однак механізми активації комплементу при АФС, його роль у патогенезі ускладнень, пов’язаних з АФА у людини, і потенціал інгібування комплементу як терапевтичної мішені при АФС потребують подальшого вивчення [25]. Інші дослідники також демонструють активацію комплементу в пацієнта з мікротромбозами на тлі КАФС, який отримував екулізумаб [26].
Рекомендації з лікування тромботичної мікроангіопатії (ТМА) на тлі СЧВ та АФС ґрунтуються на описах клінічних випадків і думках експертів. Оскільки активація комплементу відіграє ключову роль у патогенезі вторинної ТМА внаслідок СЧВ і АФС, то терапія, спрямована на шлях комплементу, є привабливою. Екулізумаб — рекомбінантні, повністю людські моноклональні антитіла IgG2/IgG4, що інгібують активацію С5 і схвалені FDA для лікування гемолітично–уремічного синдрому. Доступні обмежені дані про його використання в лікуванні вторинних ТМА. N. Kello et al. подали опис серії випадків, що включає 9 пацієнтів із СЧВ і/або АФС, у яких успішно застосовували екулізумаб для лікування рефрактерної вторинної ТМА. У цій серії випадків виявлене значне покращення гематологічних показників, функції нирок та інших органів після лікування екулізумабом. Автори дійшли висновку, що екулізумаб може бути потенційним варіантом лікування для тяжких хворих із вторинною ТМА на тлі СЧВ і/або АФС, у яких стандартне лікування не дає позитивного результату [27].
Рідко зустрічаються епізоди кровотечі при АФС, якщо є мультифокальні тромбози. Факторами ризику кровотечі є тромбоцитопенія й антикоагулянтна терапія. Описаний випадок КАФС у пацієнтки з АФС, у якої були нудота, блювання, слабкість і прогресивно розвинулась поліорганна недостатність. У пацієнтки виявлена нетравматична інтракраніальна кровотеча, що потребувала припинення антикоагулянтної терапії. Пацієнтка отримувала високі дози стероїдів, в/в імуноглобулін з подальшою інфузією ритуксимабу раз на тиждень. Хоча провокуючий фактор КАФС і не був виявлений протягом перебування в лікарні, після виписки додому в пацієнтки була діагностована гостра цитомегаловірусна інфекція. Автори акцентують увагу на ризиках антикоагулянтної терапії і на можливій ролі цитомегаловірусної інфекції як тригерного фактора КАФС [28].
Описаний випадок 46–річної жінки, у якої домінуючою ознакою КАФС була застійна серцева недостатність. Цільова терапія КАФС привела до покращання стану пацієнтки [29]. Проявом КАФС може бути навіть гострий інфаркт міокарда. Наприклад, описаний випадок 51–річної жінки, у якої раніше був діагностований АФС, яка мала загрудинний і абдомінальний біль протягом 4 днів, елевацію сегмента ST на ЕКГ у нижніх відведеннях і субтерапевтичний рівень МНВ. Рівень hs–тропоніну–I був підвищений, на трансторакальній ЕхоКГ виявлена гіпокінезія нижньої стінки. Незважаючи на відсутність обструкції епікардіальних судин на ургентній коронарографії, був діагностований гострий інфаркт міокарда. Крім того, у пацієнтки виник крововилив в обидві надниркові залози, унаслідок чого розвинулась гостра адреналова недостатність. Також мало місце мікроваскулярне ураження нирок. Отже, пацієнтці був встановлений діагноз КАФС із проявами з боку серця, ендокринної та сечовидільної систем. Рання діагностика дозволила починати ранню прицільну терапію: антикоагулянт, подвійна антитромбоцитарна терапія, кортикостероїди, що призвело до повного регресу симптомів [30]. Тригерами КАФС можуть слугувати різні фактори. Описаний випадок розвитку КАФС у пацієнта із СЧВ після укусу кобри [31].
Отже, лікування АФС в основному полягає в антикоагулянтній терапії як для контролю клінічних проявів, так і для лабораторного контролю коагуляції. Дозу антикоагулянтів (нефракціонований гепарин, низькомолекулярні гепарини, пероральні прямі антикоагулянти, антагоністи вітаміну К), антиагрегантів (ацетилсаліцилова кислота, інші антитромбоцитарні засоби (клопідогрель, тикагрелор, прасугрель) підбирають індивідуально з орієнтиром на цільовий рівень міжнародного нормалізованого відношення на рівні 2,0–3,0 при венозних тромбозах і 2,5–3,5 — при артеріальних тромбозах. Глюкокортикоїди рекомендовані при рівні тромбоцитопенії менше від 50 000/мкл і за наявності системного запалення сполучної тканини. При КАФС рекомендовані: гепарин у терапевтичних дозах, глюкокортикоїди у високих дозах, плазмаферез або в/в імуноглобуліни, при підозрі або за наявності інфекції — антибіотики широкого спектра дії. Наш пацієнт отримав увесь спектр лікувальних заходів згідно з рекомендаціями при КАФС, окрім імуноглобулінів довенно.
Висновки
1. Пацієнти з тромбофілією в поєднанні з тромбоцитопенією потребують ретельного обстеження на предмет виявлення причини даного стану.
2. Антифосфоліпідний синдром може бути причиною тяжких випадків тромбофілії з тромбоцитопенією.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Пацієнт дав інформовану згоду на публікацію даного клінічного випадку.
Інформація про внесок кожного автора: Фесенко У.А. — аналіз літератури, концепція і дизайн статті, консультація пацієнта; Кльофа Т.Г. — лікування пацієнта, аналіз літератури, аналіз історії хвороби; Скуратівський Ю.Є. — лікування пацієнта, аналіз історії хвороби, отримання згоди пацієнта на публікацію; Якимович Ю.С. — збирання й обробка матеріалів, оформлення ілюстрацій, тексту; Павчак Р.М. — хірургічне лікування пацієнта, аналіз історії хвороби, оформлення ілюстрацій; Родзоняк А.І. — лікування пацієнта, аналіз клінічних і лабораторних даних.
1. Carmi O., Berla M., Shoenfeld Y., Levy Y. Diagnosis and management of catastrophic antiphospholipid syndrome. Expert Rev. Hematol. 2017. 10(4). 365–374. doi: 10.1080/17474086.2017.1300522.
2. Espinosa G., Rodríguez–Pintó I., Cervera R. Catastrophic antiphospholipid syndrome: an update. Panminerva Med. 2017. 59(3). 254–268. doi: 10.23736/S0031–0808.17.03324–9.
3. Caprini J.A. Thrombosis risk assessment as a guide to quality patient care. Dis. Mon. 2005. 51 (2–3). 70–8. PMID 15900257. doi: 10.1016/j.disamonth.2005.02.003.
4. Pisters R., Lane D.A., Nieuwlaat R., de Vos C.B., Crijns H.J., Lip G.Y. A novel user–friendly score (HAS–BLED) to assess 1–year risk of major bleedingin patients with atrial fibrillation: The Euro Heart Survey. Chest. 2010. 138(5). 1093–100. PMID: 20299623. doi: 10.1378/chest.10–0134.
5. Boriani G., Diemberger I., Biffi M., Martignani C.M. Ba–lancing the Risk of Hemorrhage vs Thromboembolism in Patients With Atrial Fibrillation. How To Navigate Between Scylla and Charybdis? Chest. 2010. 138(5). 1032–1033. doi: 10.1378/chest.10–0808.
6. Cervera R. Antiphospholipid syndrome. Thromb. Res. 2017. 151 Suppl. 1. S43–S47. doi: 10.1016/S0049–3848(17)30066–X.
7. Asherson R.A., Cervera R., de Groot P.G., Erkan D., Boffa M.C., Piette J.C., Khamashta M.A., Shoenfeld Y. Catastrophic antiphospholipid syndrome: international consensus statement on classification criteria and treatment guidelines. Lupus. 2003. 12. 530–534. doi: 10.1191/0961203303lu394oa.
8. Limper M., de Leeuw K., Lely A.T., Westerink J., Teng Y.K.O., Eikenboom J., Otter S., Jansen A.J.G., V.D. Ree M., Spierings J., Kruyt N.D., van der Molen R., Middeldorp S., Leebeek F.W.G., Bijl M., Urbanus RT. Diagnosing and treating antiphospholipid syndrome: a consensus paper. Neth. J. Med. 2019. 77(3). 98–108. PMID: 31012427.
9. Kazzaz N.M., McCune W.J., Knight J.S. Treatment of catastrophic antiphospholipid syndrome. Curr. Opin. Rheumatol. 2016. 28(3). 218–27. doi: 10.1097/BOR.0000000000000269.
10. Rodríguez–Pintó I., Moitinho M., Santacreu I., Shoenfeld Y., Erkan D., Espinosa G., Cervera R. CAPS Registry Pro–ject Group (European Forum on Antiphospholipid Antibodies). Catastrophic antiphospholipid syndrome (CAPS): Descriptive analysis of 500 patients from the International CAPS Registry. Autoimmun. Rev. 2016. 15(12). 1120–1124. doi: 10.1016/j.autrev.2016.09.010.
11. Litvinova E., Darnige L., Kirilovsky A., Burnel Y., de Luna G., Dragon–Durey M.A. Prevalence and Significance of Non–conventional Antiphospholipid Antibodies in Patients With Clinical APS Criteria. Front Immunol. 2018. 9. 2971. doi: 10.3389/fimmu.2018.02971.
12. Makatsariya A.D., Khizroeva J., Bitsadze V.O. Catastrophic antiphospholipid syndrome (Ronald Asherson syndrome) and obstetric pathology. J. Perinat. Med. 2018. 46(4). 387–400. doi: 10.1515/jpm–2017–0092.
13. Silver R.M. Catastrophic antiphospholipid syndrome and pregnancy. Semin. Perinatol. 2018. 42(1). 26–32. doi: 10.1053/j.semperi.2017.11.006.
14. Gebhart J., Posch F., Koder S., Quehenberger P., Perkmann T., Kuessel L., Ay C., Pabinger I. High risk of adverse pregnancy outcomes in women with a persistent lupus anticoagulant. Blood Adv. 2019. 3(5). 769–776. doi: 10.1182/bloodadvan–ces.2018026948.
15. Wang J.Z., Beroukhim K., Chen Y.C., Tartar D., Fung M., Brassard A. Tumid lupus erythematosus–like pseudovasculitic lesions in catastrophic antiphospholipid syndrome. JAAD Case Rep. 2019. 5(2). 198–200. doi: 10.1016/j.jdcr.2018.11.008.
16. Özgür G., Beyan C. Therapeutic apheresis in the treatment of catastrophic antiphospholipid syndrome. Transfus. Apher. Sci. 2018 Feb. 57(1). 13–15. doi: 10.1016/j.transci.2018.02.008.
17. Peedin A.R., Karp J.K. Revisiting the role of therapeutic plasma exchange in the management of catastrophic antiphospholipid syndrome. J. Thromb. Haemost. 2019. doi: 10.1111/jth.14400.
18. Unlu O., Erkan D. Catastrophic Antiphospholipid Syndrome: Candidate Therapies for a Potentially Lethal Disease. Annu. Rev. Med. 2017. 68. 287–296. doi: 10.1146/annurev–med–042915–102529.
19. Rodriguez–Pintó I., Espinosa G., Cervera R. Catastrophic antiphospholipid syndrome: The current management approach. Best Pract. Res. Clin. Rheumatol. 2016. 30(2). 239–249. doi: 10.1016/j.berh.2016.07.004.
20. del Carpio–Orantes L., Martínez–Anaya C.C., Bonilla–Casas E. Catastrophic antiphospholipid syndrome. Case report and literature review. Gac. Med. Mex. 2017. 153(4). 531–536. doi: 10.24875/GMM.17003124.
21. Aguirre–Valencia D., Suárez–Avellaneda A., Ocampo–Piraquive V., Posso–Osorio I., Naranjo–Escobar J., Nieto–Aristizábal I., Tobón G.J., Cañas C.A. Mortality in patients with systemic lupus erythematosus in Colombia: a case series. Clin. Rheumatol. 2019. doi: 10.1007/s10067–019–04546–w.
22. Tucker S.A., Choi J., Khullar D. A probable case of catastrophic antiphospholipid syndrome: Should high–dose steroids be gi–ven in the setting of polymicrobial sepsis? SAGE Open. Med. Case Rep. 2019. 7. 2050313X19839531. doi: 10.1177/2050313X19839531.
23. Benger M., Vink J., Snell L.B., Breen K. Comparing APLS and oranges: caution with the use of direct–acting oral anticoagulants (DOACs) instead of warfarin in the treatment of antiphospholipid syndrome (APLS). BMJ Case Rep. 2019. 12(4). pii: e227695. doi: 10.1136/bcr–2018–227695.
24. Kulkarni S., Zawar V., Mukherjee S., Pawar M. Сatastrophic antiphospholipid antibody syndrome in a young child. Int. J. Dermatol. 2019. doi: 10.1111/ijd.14450.
25. Chaturvedi S., Brodsky R.A., McCrae K.R. Complement in the Pathophysiology of the Antiphospholipid Syndrome. Front Immunol. 2019. 10. 449. doi: 10.3389/fimmu.2019.00449.
26. Ruffatti A., Tarzia V., Fedrigo M., Calligaro A., Favaro M., Macor P., Tison T., Cucchini U., Cosmi E., Tedesco F., Angelini A, Gerosa G. Evidence of complement activation in the thrombotic small vessels of a patient with catastrophic antiphospholipid syndrome treated with eculizumab. Autoimmun. Rev. 2019. 18(5). 561–563. doi: 10.1016/j.autrev.2019.03.015.
27. Kello N., Khoury L.E., Marder G., Furie R., Zapantis E., Horowitz D.L. Secondary thrombotic microangiopathy in systemic lupus erythematosus and antiphospholipid syndrome, the role of complement and use of eculizumab: Case series and review of lite– rature. Semin Arthritis Rheum. 2018. pii: S0049–0172(18)30493–1. doi: 10.1016/j.semarthrit.2018.11.005.
28. Jang S.K., Sitek A., Said S., Shields R.C. Catastrophic Antiphospholipid Syndrome as a Cause of Severe Gastrointestinal Bleeding. Am. J. Med. 2019. pii: S0002–9343(19)30239–6. doi: 10.1016/j.amjmed.2019.02.043.
29. Tulai I.M., Penciu O.M., Raut R., Rudinskaya A. Catastrophic Antiphospholipid Syndrome Presenting as Congestive Heart Failure in a Patient with Thrombotic Microangiopathy. Tex. Heart Inst. J. 2019. 46(1). 48–52. doi: 10.14503/THIJ–17–6472.
30. Cranley J., Krishnan U., Tweed K., Duehmke R.M. Catastrophic antiphospholipid syndrome causing ST–segment elevation myocardial infarction with non–obstructive coronary arteries. BMJ Case Rep. 2019. 12(1). pii: bcr–2018–225495. doi: 10.1136/bcr–2018–225495.
31. Singh M., Pawar M. Catastrophic Antiphospholipid Antibody Syndrome After Cobra Bite in a Patient With Systemic Lupus Erythematosus. J. Clin. Rheumatol. 2018. doi: 10.1097/RHU.0000000000000969.

/99-1.jpg)
/100-1.jpg)
/101-1.jpg)
/101-2.jpg)