Газета «Новости медицины и фармации» №10 (697), 2019
Вернуться к номеру
Оценка диагностической эффективности биомаркеров для инсульта
Авторы: Мельник А.А., к.б.н.,
руководитель проекта специализированного медицинского центра «Оптима Фарм», г. Киев, Украина
Разделы: Справочник специалиста
Версия для печати
Всемирная организация здравоохранения (ВОЗ) определяет инсульт как клинический синдром, характеризующийся быстро развивающимися признаками очаговых (двигательных, речевых, координантных, зрительных) или общемозговых (изменение сознания, головная боль, рвота и др.) нарушений функции головного мозга, которые сохраняются более 24 часов или приводят к смерти больного за более короткий промежуток времени вследствие причин цереброваскулярного происхождения. По данным ВОЗ, от инсульта в мире ежегодно умирает около 6,3 миллиона человек (10,8 % от общего числа смертей). Летальность при этой патологии занимает второе место, уступая лишь заболеваниям сердечно-сосудистой системы, и составляет 8 % среди мужчин, 16 % среди женщин; показатель инвалидизации составляет 3,2 на 1 тыс. населения, из которых 1/3 являются лицами трудоспособного возраста
[1, 2]. При этом отмечается «омоложение» инсульта с увеличением его распространенности среди людей трудоспособного возраста. Последствия инсульта носят не только медико-социальный, но и экономический характер. Например, в Англии на лечение и реабилитацию больного, перенесшего инсульт, расходуется в среднем 22 000 фунтов стерлингов в год [3].
Слово «инсульт» связано с древнегреческим словом «апоплексия» (смертельный удар). Однако параллели между современной концепцией инсульта и апоплексией не существует, так как «апоплексия» во времена Гиппократа (460–370 гг. до н.э.) и Галена (130–201 гг. н.э.) была общим термином, описывающим состояние, при котором у пациента внезапно прекращалась мозговая деятельность, с сохранением пульса и дыхания [4, 5]. Считается, что слово «инсульт» произошло от позднелатинского insultus (приступ, нападение, удар). Этот термин объединяет различные по этиологии и патогенезу состояния, основным звеном которых является острая сосудисто-мозговая катастрофа.
Инсульты классифицируют на два основных типа: ишемический (вызванный образованием сгустка в кровеносном русле мозга) и геморрагический (внутримозговые кровоизлияния), которые разделяются на подтипы (рис. 1).
Ишемический инсульт определяется как эпизод неврологической дисфункции, обусловленный очаговым инфарктом мозга, с симптомами, сохраняющимися более 24 часов, тогда как транзиторная ишемическая атака (ТИА) определяется как транзиторный эпизод неврологической дисфункции, которая относится к преходящим нарушениям мозгового кровообращения вследствие очаговой ишемии без острого инфаркта [6]. ТИА обычно называют мини-инсультом с продолжительностью от нескольких минут до нескольких часов, но менее 24 ч. На долю ишемических инсультов приходится около 80 % всех видов острых нарушений мозгового кровообращения. К геморрагическим вариантам инсульта относятся субарахноидальное и внутрицеребральное кровоизлияния, которые составляют приблизительно 5 и 10 % соответственно.
Факторы риска инсульта
Факторы риска развития инсульта классифицируют на модифицируемые и немодифицируемые. Модифицируемые факторы риска, среди которых — гипертония, диабет, табакокурение, считаются неспецифичными, однако являются более распространенными. К немодифицируемым факторам риска относятся возраст (с каждым десятилетием жизни после 55 лет риск инсульта удваивается), пол (у мужчин инсульт встречается на 30 % чаще, но у женщин смертность выше) и др. [7] (табл. 1).
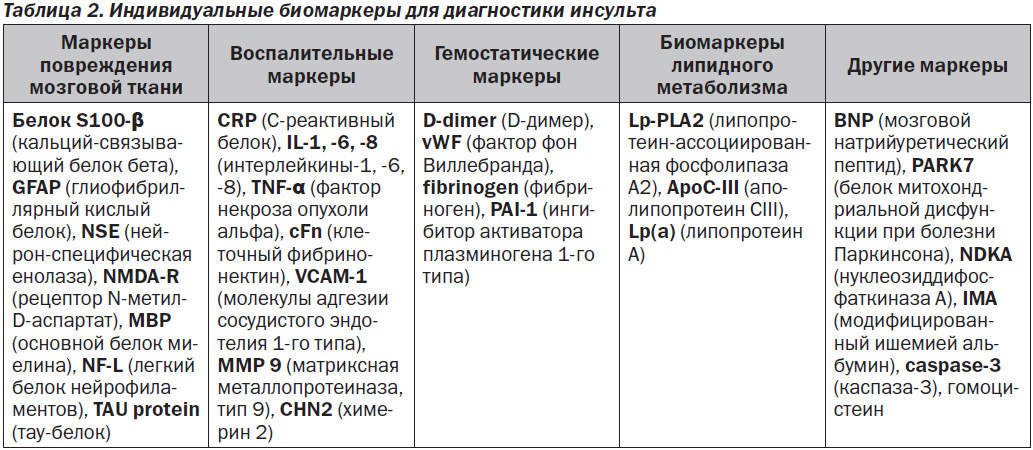
Врачу-клиницисту в остром периоде инсульта необходимо максимально быстро провести дифференциальную диагностику ишемического и геморрагического инсультов, так как правильно поставленный диагноз позволит определить дальнейшую стратегию лечения. На сегодняшний день единственным высокочувствительным и специфичным инструментом для этого являются методы визуализации (магнитно-резонансная томография (МРТ) и компьютерная томография (КТ)) головного мозга, которые позволяют диагностировать характер инсульта в первые 2–3 часа, т.е. в период терапевтического окна. Однако эти методы оказываются малоинформативными в случае функциональных и метаболических изменений, имитирующих инсульт. Так, среди случаев, казалось бы, очевидного клинического диагноза инсульта в 20–25 % им оказываются инсультоподобные состояния. Более того, такое высокотехнологическое оборудование, как МРТ и КТ, имеется только в крупных медицинских учреждениях, поэтому в остром периоде инсульта на ранних стадиях не всегда возможно применить эти методы диагностки. Поэтому сейчас одним из наиболее приоритетных направлений исследований в области диагностики инсульта является разработка и внедрение дополнительных методов, к которым относится лабораторная дифференциальная диагностика с использованием биомаркеров сыворотки крови. Основанием для этого является то, что инсульт сопровождается повреждением и гибелью нервных клеток с повышением проницаемости гематоэнцефалического барьера, в результате чего нейроспецифические белки попадают в кровоток. Обнаружение этих белков в сыворотке крови или спинномозговой жидкости может указывать на повреждение нервной ткани и позволяет прижизненно оценить состояние нервных клеток. В последние годы проводится активный поиск и изучение маркеров для лабораторной диагностики инсульта. Сложность этого процесса состоит в том, что инсульт — это гетерогенное заболевание, связанное с различными патофизиологическими изменениями, которые вызывают различные биохимические изменения в организме [8]. Биомаркеры инсульта включают белковые, генетические и метаболические маркеры, каждый из которых имеет свои преимущества и недостатки. Удобным способом категоризации биомаркеров инсульта считается разделение их по происхождению на группы: маркеры повреждения мозговой ткани, воспалительные, гемостатические, маркеры липидного метаболизма и другие (табл. 2).
В настоящее время наиболее хорошо изучены и используются для диагностки инсульта следующие биомаркеры: GFAP, белок S100-β, MBP, NSE, пептид NR2, NR2-аутоантитела, тay-белок, CRP, ММР-9, PARK7, Lp-PLA2, microRNA.
I. Белковые биомаркеры, связанные с глиальными и нейрональными клетками
1. Глиофибриллярный кислый белок
Глиофибриллярный кислый белок (glial fibrillary acidic protein, GFAP) является специфическим для клеточного скелета дифференцированных астроцитов внутрицитоплазматическим филаментозным белком, имеющим в своем составе большое количество дикарбоновых кислот. Впервые он был выделен из астроцитов в 1971 году L. Eng et al. [9]. GFAP – это полипептид, состоящий из 432 аминокислот с м.в. 50 кДа, который служит маркером для скрининга астроглиального повреждения. В многочисленных исследованиях было показано, что GFAP имеет клиническую значимость при инсульте и может не только предоставить уникальную информацию о тяжести заболевания, но и дифференцировать различные виды инсульта [10, 11]. Так, в исследовании C. Foerch et al. [12] GFAP определен как маркер дифференциации внутрицеребрального геморрагического инсульта от ишемического в течение 6 часов после появления симптомов с cut-off 2,9 нг/л (чувствительнось — 79 %, специфичность — 98 %). Эти данные были подтверждены в других многоцентровых клинических исследованиях [13–15].
2. Белок S100-β
Белок S100-β — это низкомолекурный глиальный белок с м.в. 10 кДа. Принадлежит к мультигенному семейству Са2+-связывающих белков (к которому относится как минимум 25 белков) и участвует в регуляции внутриклеточного уровня кальция [16]. S100-β, состоящий из форм бета-бета и альфа-бета, высокоспецифичен для нервной ткани и находится в цитоплазме астроцитов и клетках Шванна, участвуя в регуляторных функциях цитоскелетной структуры и пролиферации клеток [17]. Кроме этого, белок обнаружен в клетках костного мозга, хондроцитах, лимфоцитах, адипоцитах и меланоцитах. Из организма элиминируется почечной экскрецией [18]. Играет ключевую роль в разнообразных клеточных процессах, состоящих в связывании синаптических белков путем ингибирования их фосфорилирования. Внеклеточная форма S100-β физиологически участвует в поддержании гомеостаза центральной нервной системы. При структурных повреждениях нейронов S100-β высвобождается в спинномозговую жидкость (СМЖ), где его концентрация в 40 раз выше по сравнению с сывороткой. В исследованиях было показано, что уровень S100-β значительно повышается при инсульте [19, 20]. Установлено, что уровень данного белка в сыворотке увеличивается при ишемическом инсульте от 10 часов до 2–3 дней от его начала, а пиковые значения отмечаются на 3–4-й день [21]. Уровень S100-β, измеренный в образцах сыворотки, взятых более чем через 24 часа после начала инсульта, имеет сильную корреляцию со степенью неврологического повреждения и конечным объемом инфаркта. При ишемическом и геморрагическом инсульте S100-β выделяется в кровь. При субарахноидальном кровоизлиянии уровни белка могут оказать помощь врачам для определения тяжести кровотечения [22, 23]. Тем не менее необходимо отметить, что концентрация белка S100-β не является специфичной для дифференциальной диагностики ишемического и геморрагического инсульта, а его диагностическое и прогностическое значение как единичного биомаркера ограничено (находит применение в панели биомаркеров инсульта) [24, 25].
3. Основной белок миелина
Основной белок миелина (MBP) — это гидрофильный белок, определяющий правильную структуру миелиновых оболочек. Повышенные уровни MBP встречаются при различных неврологических патологиях. Например, уровни этого белка в спинномозговой жидкости используются в качестве показателя активности заболевания при рассеянном склерозе. Также было обнаружено, что MBP незначительно повышен в СМЖ у пациентов в течение 1 недели после инсульта с возвращением к нормальному уровню через 3 недели [26, 27]. Лимитирующим фактором при использовании этого маркера является его латентное увеличение.
4. Нейрон-специфическая енолаза
Нейрон-специфическая енолаза (NSE) — это гликолитический изофермент нейронов и нейроэндокринных клеток. Аналогично белку S100-β концентрация NSE повышается после ишемического инсульта, а также других повреждений мозговой ткани, таких как субарахноидальное кровоизлияние, травма головы, и определяется между 4 и 8 часами после начала инсульта. Содержание NSE в СМЖ пропорционально травме головного мозга в отличие от ее уровней в сыворотке, которые очень широко варьируют в нормальной популяции [28, 29].
5. Легкий белок нейрофиламентов
Легкий белок нейрофиламентов (NF-L) является частью структурного каркаса нейронов и представляет собой субъединицу, которая формирует ядро филамента. Повышенные уровни NF-L наблюдаются при различных нейродегенеративных заболеваниях, в том числе у пациентов с ишемическим инсультом [30].
6. NR2-пептид и NR2-аутоантитела
Рецептор N-метил-D-аспартат (NMDA) является субтипом ионотропного глутаматного рецептора, который играет важную роль в обучении и памяти. NMDA-рецептор представляет собой тетрамер, включающий две глицин-связывающие субъединицы NR1 и две глутамат-связывающие субъединицы NR2 [31]. NMDA-рецепторы экспрессируются преимущественно в нейронах ЦНС, а также в церебральных эпителиальных клетках, олигодендроцитах и нейронах энтеральной нервной системы. При некоторых неврологических расстройствах происходит изменение экспрессии субъединиц рецептора NMDA (при церебральной ишемии NR2 повышается, а NR1 снижается) [32, 33]. Механизм этого процесса состоит в том, что на ранних стадиях ишемии активируются сериновые протеазы, которые расщепляют NMDA-рецепторы, расположенные на поверхности синаптической мембраны, в результате чего образовавшиеся пептидные фрагменты рецептора (NR2-пептид) попадают в кровоток и вызывают реакцию иммунной системы с образованием специфических NR2-антител. Таким образом, пептиды NR2 являются диагностическими биомаркерами при остром инсульте, а антитела NR2 могут быть одним из маркеров инсульта, позволяющим достоверно дифференцировать геморрагический и ишемический инсульты наряду с уровнями Аро СI/CIII [34].
7. Tay-белок
Tay-белок (TAU-protein) является растворимым структурным белком, который относится к нейрон-специфическому семейству белков, связанных с микротрубочками типа II. В ЦНС тау-белок преимущественно экспрессируется в нейронах и в меньшей степени — в астроцитах и олигодендроцитах. Играет важную роль в структурной стабилизации миротрубочек путем взаимодействия с тубулином. При патологических состояних тау-белок образует нерастворимые агрегаты, известные как таупатии, которые наблюдаются при патофизиологии многих нейродегенеративных заболеваний. Впервые агрегаты тау-белка были описаны при болезни Альцгеймера. В дальнейшем исследования показали, что тау-белок также повышается в СМЖ после острой травмы головного мозга, включая инсульт [35]. При ишемическом инсульте уровни тау-белка увеличиваются через 2–3 дня после появления симптомов, достигают пика через 7 дней и возвращаются к исходному уровню через 3–5 месяцев [36]. Наряду с GFAP и MBP уровни тау-белка коррелируют с клинической тяжестью инсульта [37].
II. Маркеры воспаления и тканевой деструкции
У пациентов с ишемическим инсультом наблюдается повышение многих цитокиновых маркеров, включая IL-1, IL-6, IL-8, TGF-β, TNF-α, а также ICAM-1, VCAM-1, E-селектина и L-селектина [38].
1. С-реактивный белок
C-реактивный белок (CRP) является белком острой фазы, связанным с воспалением. Вырабатывается в печени, связывает и агрегирует различные растворимые лиганды и активирует классический путь комплемента. Вследствие воспалительного характера атеросклероза умеренно повышенные уровни CRP связаны с повышенным риском развития инсульта независимо от сердечно-сосудистых факторов риска [39]. Как и в случае многих других воспалительных биомаркеров, уровни CRP коррелируют с объемом инфаркта и тяжестью инсульта [40]. Концентрация CRP вместе с таким показателем острой фазы воспаления, как скорость оседания эритроцитов, остается высокой до 3 месяцев после инсульта [41].
2. Матриксная металлопротеиназа
Матриксные металлопротеиназы (ММР) относятся к семейству цинк- и кальцийзависимых эндопептидаз, участвуют в воспалительном ответе, стимулируя высвобождение протеаз, которые разрушают внеклеточный матрикс. Семейство ММР состоит из 14 ферментов, обнаруженных в тканях мозга. Матриксные металлопротеиназы функционируют как стромелизины, желатиназы, коллагеназы, протеиназы мембранного типа. Проявляя активность, ММР принимают участие в повреждении капилляров и воспалении, способствуя тем самым прогрессированию ишемии и геморрагии [42]. Уровни ММР-9 повышаются при ишемиическом и геморрагичеком инсультах и коррелируют с экспрессией провоспалительных цитокинов [43–45]. Быстрое повышение ММР-9 связано с размером инфаркта и неблагоприятным исходом, что может использоваться как прогностический фактор при госпитализации пациентов [46].
3. Дезоксирибонуклеиновая кислота
Циркулирующие уровни дезоксирибонуклеиновой кислоты (ДНК), измеренные в плазме, повышаются в ответ на различные патологические состояния, в том числе при инсульте. Концентрация ДНК увеличивается в течение 3 часов от начала геморрагического или ишемического инсульта в отличие от пациентов, у которых нет инсульта. Уровень ДНК также коррелирует с объемом гематомы при геморрагическом инсульте [47]. Одновременное определение уровней ДНК и S100-β предложено в качестве дифференциальной диагностики геморрагического и ишемического инсультов [48].
III. Гемостатические маркеры
Ограничение использования маркеров коагуляции заключается в том, что они имеют неспецифический характер. Тем не менее показано, что увеличение уровня фибриногена наблюдается после ишемического инсульта и связано с размером инфаркта [49]. Высокие уровни D-димера отмечены при прогрессировании ишемического инсульта и неблагоприятном прогнозе при геморрагическом инсульте [50–52]. Уровень D-димера — очень чувствительный к инсульту биомаркер, который может дифференцировать этиологию инсульта, выступая сильным прогностическим показателем ухудшения или рецидива в течение подострого периода. Аналогичное повышение концентрации наблюдается в отнощении фибринопептида А, β-тромбомодулина, фрагментов протромбина 1 и 2, тромбин-антитромбинового комплекса, фактора 4 тромбоцитов и фактора фон Виллебранда, что в дальнейшем связано с неблагоприятным клиническим течением при ишемическом инсульте и повышенной смертности [53]. В острой фазе инсульта повышены активируемый тромбином ингибитор фибринолиза (TAFI) и активатор ингибитора плазминогена (PAI-1), которые указывают на прогрессирование внутричерепного атеросклероза наряду с другими маркерами [54, 55]. Пациенты с высоким уровнем PAI-1 имеют меньшую вероятность достижения реканализации после лечения с использованием тканевого активатора плазминогена (tPA) и худшие результаты [56]. Исходные уровни TAFI и PAI-1 предсказывают симптоматическое кровотечение после лечения tPA [57]. Поэтому измерение активности этих ингибиторов фибринолиза может позволить корректировать дозу тромболитического препарата, увеличивая его эффективность путем снижения вероятности кровотечения.
IV. Биомаркеры липидного метаболизма
1. Липопротеин-ассоциированная фосфолипаза А2
Липопротеин-ассоциированная фосфолипаза А2 (Lp-PLA2), также известная как тромбоцит-активирующий фактор ацетилгидролазы (PAFAH), имеет м.в. 50 кДа и относится к суперсемейству фосфолипаз А2. Продуцируется в основном макрофагами и моноцитами, которые связаны с атерогенными липопротеинами в циркуляции крови [58]. Lp-PLA2 гидролизует фосфолипиды на поверхности окисленных липопротеинов низкой плотности (ЛПНП) в субэндотелиальном пространстве. При этом высвобождаются провоспалительные и проатерогенные метаболиты. Гидролизу подвергается центральная эфирная связь фосфолипидов, в результате чего образуются окисленные жирные кислоты и лизофосфатидилхолин, который является медиатором воспаления и проатерогенным фактором. Лизофосфатидилхолин увеличивает экспрессию молекул сосудистой адгезии, активирует цитокины, лиганд CD40 и стимулирует пролиферацию макрофагов. Таким образом, повышенный уровень Lp-PLA2 играет роль в развитии атеросклероза и способствует разрыву атресклеротической бляшки, что связано с риском возникновения ишемической болезни сердца и инсульта [59]. В 2005 г. FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов, США) утвердило тест Lp-PLA2 для оценки пациентов с риском развития ишемического инсульта, что связано с повышением его уровня в 2 раза [60]. Существует два метода определения Lp-PLA2 в плазме и сыворотке человека, которые включают определение концентрации (по массе) и ферментативную активность. Для стратификации риска метод измерения Lp-PLA2 по массе оказался менее точным по сравнению с оценкой ферментативной активности [61].
2. Аполипопротеин
Аполипопротеин С-III (ApoC-III) принадлежит к семейству аполипопротеинов, экспрессируемых печенью. В небольшом исследовании «случай — контроль» измеряли уровнь ApoC-III у пациентов с инсультом в течение 6 часов от начала клинических симптомов. Была обнаружена относительная избыточная экспрессия ApoC-III у пациентов с ишемическим инсультом по сравнению с геморрагическим, что позволило дифференцировать их с чувствительностью 94 % и специфичностью 87 % [62].
3. Липопротеин (а)
Липопротеин (а) (Lp(a)) относится к липопротеинам низкой плотности, синтезируется в печени и состоит из ApoB-100, ковалентно связанного с очень большим гликопротеином, известным как Apo(a). Повышенные уровни Lp(a) способствуют тромбогенному потенциалу и антифибринолитической активности. Было показано, что высокий уровень Lp(a) и низкий уровень Apo(a)-I являются независимыми факторами риска ишемического инсульта [63].
IV. Другие биомаркеры
1. Белок митохондриальной дисфункции при болезни Паркинсона
Белок митохондриальной дисфункции при болезни Паркинсона (PARK7), известный также как DJ-1, участвует в восстановительной функции при неврологических нарушениях, вызванных окислительным стрессом. Отмечено значимое повышение в плазме крови PARK7 у пациентов с инсультом в течение от 30 мин до 3 часов после начала клинических симптомов [64]. Однако увеличение концентрации PARK7 не позволяет дифференцировать тип инсульта.
2. Нуклеозиддифосфаткиназа A
Нуклеозиддифосфаткиназа A (NDKA) представляет собой киназу, которая катализирует перенос концевого фосфата от АТФ в нуклеотиды. Подобно PARK7, концентрация NDKA повышается в течение 3 часов после появления симптомов.
Необходимо отметить, что PARK7 и NDKA участвуют в патогенезе различных нейродегенеративных нарушений, которые могут осложнить их применение для диагностики инсульта.
3. Модифицированный ишемией альбумин
Модифицированный ишемией альбумин (IMA) является наиболее распространенным белком в плазме, основная роль которого состоит в поддержании онкотического давления плазмы и объема циркулирующей крови. При ишемии происходят изменения на N-конце белка в результате воздействия активных форм кислорода (ROS). Эти изменения альбумина определяются с помощью кобальт-связывающего теста. В последнее время в ряде исследований отмечается увеличение IMA при ишемиях миокарда, конечностей, брыжейки и тромбозе глубоких вен [65, 66]. Уровни IMA повышены у пациентов с ишемической болезнью и геморрагическим инсультом [67].
4. Микрорибонуклеиновая кислота
Микрорибонуклеиновая кислота (микроРНК) представляет собой короткие некодирующие РНК (18–23 нуклеотида), которые приводят к регрессии экспрессии генов-мишеней путем деградации мРНК и ингибирования трансляции. Нарушение регуляции микроРНК связано с развитием различных заболеваний. В связи с тем, что определяемые уровни микроРНК в сыворотке обладают хорошей стабильностью, они могут служить новым классом биомаркеров при ряде патологических состояний [68]. У пациентов с ишемическим инсультом зарегистрировано повышение или снижение некоторых циркулирующих микроРНК. Например, уровень микроРНК-424 снижался у пациентов с острым инсультом, а микроРНК-200с, наоборот, повышался [69–71]. МикроРНК используют не только в качестве диагностического биомаркера, но и для терапии инсульта [72].
Панели мультимаркеров
В настоящее время не существует единичных био-маркеров для предсказания, диагностики и дифференцирования инсульта. Для улучшения чувствительности и специфичности индивидуальных маркеров были разработаны соответствующие панели биомаркеров. Например, для быстрой диагностики инсульта используют следующую панель: биомаркеры белков, связанные с глиальными и нейрональными клетками (S100-β, GFAP, NSE, MBP), биомаркеры воспаления (CRP, MMP-9, VCAM, TNF-α, IL-6, VEGF), тромбоза (vWF, D-dimer) и другие (BNP, гомоцистеин) [73–75].
Заключение
Инсульт является гетерогенным и очень сложным заболеванием, патогенез которого включает множество механизмов. Необходимость улучшения диагностики этой патологии мотивировала исследователей к поиску соответстствующих биомаркеров инсульта. В многочисленных работах было показано, что хотя многие из биомаркеров демонстрируют диагностическую и прогностическую ценность при ишемическом и геморрагическом инсультах, тем не менее полезную в практическом отношении информацию можно получить только используя панели биомаркеров, т.е. необходим комплексный подход с применением нескольких биомаркеров. Уже на уровне первичного звена (семейный врач) необходимо проводить оценку риска нарушений мозгового кровообращения в группе пациентов с артериальной гипертензией, сахарным диабетом, атеросклерозом, сердечно-сосудистыми заболеваниями. Внедрение биомаркеров инсульта на догоспитальном этапе при отсутствии патологических изменений на КТ, наличии противопоказний к МРТ или недоступности такого сложного оборудования позволит по данным анализа крови поставить правильный диагноз и определить тактику лечения пациента. И, наконец, использование биомаркеров во время серьезных хирургических вмешательств или после них даст возможность прогнозировать и предупредить развитие церебральных сосудистых катастроф. Поэтому знания врачей-клиницистов о биомаркерах инсульта позволят грамотно проводить диагностические и лечебные мероприятия среди этой категории пациентов.
1. Johnson W., Onuma O., Owolabi M. et al. Stroke: a global response is needed. Bulletin of the Word Helath Organization. 2016. 94. 634-634A.
2. Lopez A.D., Mathers C.D., Ezzati M. et al. Global and regional burden of disease and risk factors, 2001: Systematic analysis of population health data. Lancet. 2006. 367. 1747-1757.
3. Royal College of Physicians Sentinel Stroke National Audit Programme (SSNAP). Stroke health economics: cost and cost-effectiveness analysis 2016.
4. Schutta H.S., Howe H.M. Seventeenth century concepts of ‘‘apoplexy’’ as reflected in Bonet’s ‘‘Sepulchretum’’. J. Hist. Neurosci. 2006. 15. 250-268.
5. Schutta H.S. Morgagni on apoplexy in De Sedibus: a historical perspective. J. Hist. Neurosci. 2009. 18. 1-24.
6. Sacco R., Kasner S., Broderick J. et al. An updated definition of stroke for the 21st Century: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013. 44. 2064-2089.
7. Allen C., Bayraktutan U. Risk factors for ischaemic stroke. Int. J. Stroke. 2008. 3 (2). 105-116.
8. Jickling G.C., Sharp F.R. Biomarker Panels in Ischemic Stroke. Stroke. 2015. Vol. 46. 915-920.
9. Eng L.F., Vanderhaeghen J.J., Bignami A. et al. An acidic protein isolated from fibrous astrocytes. Brain Res. 1971. 28. 351-354.
10. Schiff L., Hadker N., Weiser S. et al. A literature review of the feasibility of glial fi brillary acidic protein as a biomarker for stroke and traumatic brain injury. Mol. Diagn. Ther. 2012. 16. 79-92.
11. Foerch C., Pfeilschifter W., Zeiner P. et al. Glial fi brillary acidic protein in patients with symptoms of acute stroke: Diagnostic marker of cerebral hemorrhage. Nervenarzt. 2014. 85. 982-9.
12. Foerch C., Curdt I., Yan B. et al. Serum glial fi brillary acidic protein as a biomarker for intracerebral haemorrhage in patients with acute stroke. J. Neurol. Neurosurg. Psychiatry. 2006. 77. 181-4.
13. Unden J., Strandberg K., Malm J. et al. Explorative investigation of biomarkers of brain damage and coagulation system activation in clinical stroke differentiation. J. Neurol. 2009. 256. 72-7.
14. Ehrenreich H., Kästner A., Weissenborn K. et al. Circulating damage marker profi les support a neuroprotective effect of erythropoietin in ischemic stroke patients. Mol. Med. 2011. 17. 1306-10.
15. Dvorak F., Haberer I., Sitzer M. et al. Characterisation of the diagnostic window of serum glial fibrillary acidic protein for the differentiation of intracerebral haemorrhage and ischaemic stroke. Cerebrovasc. Dis. 2009. 27. 37-41.
16. Zetterberg H., Smith D.H., Blennow K. Biomarkers of mild traumatic brain injury in cerebrospinal fluid and blood. Nat. Rev. Neurol. 2013. 9 (4). 201-10.
17. Donato R. S100: a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles. Int. J. Biochem. Cell Biol. 2001. 33. 637-68.
18. Lam V., Albrecht M.A., Takechi R. et al. The serum concentration of the calcium binding protein s100b is positively associated with cognitive performance in older adults. Front. Aging Neurosci. 2013. 5. 61.
19. Elting J.W., de Jager A.E., Teelken A.W. et al. Comparison of serum S-100 protein levels following stroke and traumatic brain injury. J. Neurol. Sci. 2000. 181. 104-10.
20. Kapural M., Krizanac-Bengez L., Barnett G. et al. Serum S-100beta as a possible marker of blood-brain barrier disruption. Brain Res. 2002. 94C. 102-4.
21. Nash D.L., Bellolio M.F., Stead L.G. S100 as a marker of acute brain ischemia: A systematic review. Neurocrit. Care. 2008. 8(2). 301-7.
22. Chong Z.Z. S100B raises the alert in subarachnoid hemorrhage. Rev. Neurosci. 2016. 27 (7). 745-59.
23. Kellermann I., Kleindienst A., Hore N. et al. Early CSF and serum S100B concentrations for outcome prediction in traumatic brain injury and subarachnoid hemorrhage. Clin. Neurol. Neurosurg. 2016. 145. 79-83.
24. Undén J., Strandberg K., Malm J. et al. Explorative investigation of biomarkers of brain damage and coagulation system activation in clinical stroke differentiation. J. Neurol. 2009. Vol. 256, № 1. 72-77.
25. Montaner J., Mendioroz M., Delgado P. et al. Differentiating ischemic from hemorrhagic stroke using plasma biomarkers: The S100B/RAGE pathway. J. Proteomics. 2012. 75. 4758-65.
26. Matias-Guiu J., Martinez-Vazquez J., Ruibal A. et al. Myelin basic protein and creatine kinase BB isoenzyme as CSF markers of intracranial tumors and stroke. Acta Neurol. Scand. 1986. 73 (5). 461-465.
27. Aurell A., Rosengren L.E., Karlsson B. et al. Determination of S-100 and glial fibrillary acidic protein concentrations in cerebrospinal fluid after brain infarction. Stroke. 1991. 22 (10). 1254-1258.
28. Anand N., Stead L.G. Neuron-specific enolase as a marker for acute ischemic stroke: a systematic review. Cerebrovasc. Dis. 2005. 20 (4). 213-219.
29. Casmiro M., Maitan S., De Pasquale F. et al. Cerebrospinal fluid and serum neuron-specific enolase concentrations in a normal population. Eur. J. Neurol. 2005. 12 (5). 369-374.
30. Rosengren L.E., Karlsson J.E., Karlsson J.O. et al. Patients with myotrophic lateral sclerosis and other neurodegenerative diseases have increased levels of neurofilament protein in CSF. J. Neurochem. 1996. 67 (5). 2013-2018.
31. Furukawa H., Singh S.K., Mancusso R. et al. Subunit arrangement and function in NMDA receptors. Nature. 2005. 438. 185-92.
32. Gappoeva M.U., Izykenova G.A., Granstrem O.K. et al. Expression of NMDA neuroreceptors in experimental ischemia. Biochemistry (Mosc.). 2003. 68. 696-702.
33. Gascon S., Deogracias R., Sobrado M. et al. Transcription of the NR1 subunit of the N-methyl-D-aspartate receptor is down-regulated by excitotoxic stimulationand cerebral ischemia. J. Biol. Chem. 2005. 280. 35018-27.
34. Allard L., Lescuyer P., Burgess J. et al. ApoC-I and ApoC-III as potential plasmatic markers to distinguish between ischemic and hemorrhagic stroke. Proteomics. 2004. 4 (8). 2242-2251.
35. Bielewicz J., Kurzepa J., Czekajska-Chehab E. et al. Does serum Tau protein predict the outcome of patients with ischemic stroke? J. Mol. Neurosci. 2011. 43. 241-5.
36. Hesse C., Rosengren L., Andreasen N. et al. Transient increase in total tau but not phospho-tau in human cerebrospinal fluid after acute stroke. Neurosci. Lett. 2001. 297. 187-90.
37. Hjalmarsson C., Bjerke M., Andersson B. et al. Neuronal and glia-related biomarkers in cerebrospinal fl uid of patients with acute ischemic stroke. J. Cent. Nerv. Syst. Dis. 2014. 6. 51-8.
38. Sotgiu S., Zanda B., Marchetti B. et al. Inflammatory biomarkers in blood of patients with acute brain ischemia. Eur. J. Neurol. 2006. 13 (5). 505-513.
39. Kuhlmann C.R., Librizzi L., Closhen D. et al. Mechanisms of C-reactive protein-induced blood-brain barrier disruption. Stroke. 2009. 40 (4). 1458-1466.
40. Smith C.J., Emsley H.C., Gavin C.M. et al. Peak plasma interleukin-6 and other peripheral markers of inflammation in the first week of ischaemic stroke correlate with brain infarct volume, stroke severity and long-term outcome. BMC Neurol. 2004. 4. 2.
41. Emsley H.C., Smith C.J., Gavin C.M. et al. An early and sustained peripheral inflammatory response in acute ischaemic stroke: relationships with infection and atherosclerosis. J. Neuroimmunol. 2003. 139 (1–2). 93-101.
42. Mun-Bryce S., Rosenberg G.A. Matrix metalloproteinases in cerebrovascular disease. J. Cereb. Blood Flow Metab. 1998. 18 (11). 1163-1172.
43. Rosell A., Ortega-Aznar A., Alvarez-Sabán J. et al. Increased brain expression of matrix metalloproteinase-9 after ischemic and hemorrhagic human stroke. Stroke. 2006. 37 (6). 1399-1406.
44. Abilleira S., Montaner J., Molina C.A. et al. Matrix metalloproteinase-9 concentration after spontaneous intracerebral hemorrhage. J. Neurosurg. 2003. 99 (1). 65-70.
45. Vukasovic I., Tesija-Kuna A., Topic E. et al. Matrix metalloproteinases and their inhibitors in different acute stroke subtypes. Clin. Сhem. Lab. Med. 2006. 44. 428-34.
46. Montaner J., Molina C.A., Monasterio J. et al. Matrix metalloproteinase-9 pretreatment level predicts intracranial hemorrhagic complications after thrombolysis in human stroke. Circulation. 2003. 107. 598-603.
47. Rainer T.H., Wong L.K., Lam W. et al. Prognostic use of circulating plasma nucleic acid concentrations in patients with acute stroke. Clin. Chem. 2003. 49 (4). 562-569.
48. Rainer T.H., Wong K.S., Lam W. et al. Comparison of plasma β-globin DNA and S-100 protein concentrations in acute stroke. Clin. Chim. Acta. 2007. 376 (1–2). 190-196.
49. Di Napoli M., Singh P. Is plasma fibrinogen useful in evaluating ischemic stroke patients? Why, how, and when. Stroke. 2009. 40 (5). 1549-1552.
50. Barber M., Langhorne P., Rumley A. et al. D-dimer predicts early clinical progression in ischemic stroke: confirmation using routine clinical assays. Stroke. 2006. 37 (4). 1113-1115.
51. Delgado P., Alvarez-Sabín J., Abilleira S. et al. Plasma d-dimer predicts poor outcome after acute intracerebral hemorrhage. Neurology. 2006. 67 (1). 94-98.
52. Welsh P., Barber M., Langhorne P. et al. Associations of inflammatory and haemostatic biomarkers with poor outcome in acute ischaemic stroke. Cerebrovasc. Dis. 2009. 27 (3). 247-253.
53. Carter A.M., Catto A.J., Mansfield M.W. et al. Predictive variables for mortality after acute ischemic stroke. Stroke. 2007. 38 (6). 1873-1880.
54. Montaner J., Ribó M., Monasterio J. et al. Thrombin-activable fibrinolysis inhibitor levels in the acute phase of ischemic stroke. Stroke. 2003. 34 (4). 1038-1040.
55. Arenillas J.F., Alvarez-Sabín J., Molina C.A. et al. Progression of symptomatic intracranial large artery atherosclerosis is associated with a proinflammatory state and impaired fibrinolysis. Stroke. 2008. 39 (5). 1456-1463.
56. Ribó M., Montaner J., Molina C.A. et al. Admission fibrinolytic profile predicts clot lysis resistance in stroke patients treated with tissue plasminogen activator. Thromb. Haemost. 2004. 91 (6). 1146-1151.
57. Fernandez-Cadenas I., Alvarez-Sabín J., Ribo M. et al. Influence of thrombin-activatable fibrinolysis inhibitor and plasminogen activator inhibitor-1 gene polymorphisms on tissue-type plasminogen activator-induced recanalization in ischemic stroke patients. J. Thromb. Haemost. 2007. 5 (9). 1862-1868.
58. Zalewski A., Nelson J.J., Hegg L. et al. Lp-PLA2: a new kid on the block. Clin. Chem. 2006. 52 (9). 1645e1650.
59. Zalewski A., Macphee C. Role of lipoprotein-associated phospholipase A2 in atherosclerosis: Biology, epidemiology, and possible therapeutic target. Arteriosclerosis, Thrombosis, and Vascular Biology. 2005. Vol. 25, № 5. 923-931.
60. Gorelick P.B. Lipoprotein-associated phospholipase A2 and risk of stroke. Am. J. Cardiol. 2008. 101. 34F-40F.
61. De Stefano A., Mannucci L., Tamburi F. et al. Lp-PLA2, a new biomarker of vascular disorders in metabolic diseases. International Journal of Immunopathology and Pharmacology. 2019. Vol. 33. Article ID 205873841982715.
62. Allard L., Lescuyer P., Burgess J. et al. ApoC-I and ApoC-III as potential plasmatic markers to distinguish between ischemic and hemorrhagic stroke. Proteomics. 2004. 4. 2242-2251.
63. Milionis H.J., Filippatos T.D., Loukas T. et al. Serum lipoprotein(a) levels and apolipoprotein(a) isoform size and risk for first-ever acute ischaemic nonembolic stroke in elderly individuals. Atherosclerosis. 2006 Jul. 187 (1). 170-6. Epub 2005 Sep 28.
64. Allard L., Burkhard P.R., Lescuyer P. et al. PARK7 and nucleoside diphosphate kinase A as plasma markers for the early diagnosis of stroke. Clin. Chem. 2005. 51. 2043-51.
65. Sinha M.K., Gaze D.C., Tippins J.R. et al. Ischemia modified albumin is a sensitive marker of myocardial ischemia after percutaneous coronary intervention. Circulation. 2003. 107 (19). 2403-2405.
66. Gunduz A., Mentese A., Turedi S. et al. Serum ischaemia-modified albumin increases in critical lower limb ischaemia. Emerg. Med. J. 2008. 25 (6). 351-353.
67. Abboud H., Labreuche J., Meseguer E. et al. Ischemia-modified albumin in acute stroke. Cerebrovasc. Dis. 2007. 23 (2–3). 216-220.
68. Chen X., Ba Y., Ma L. et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 2008. 18. 997-1006.
69. Zhao H., Wang J., Gao L. et al. MiRNA-424 protects against permanent focal cerebral ischemia injury in mice involving suppressing microglia activation. Stroke. 2013. 44. 1706-13.
70. Sepramaniam S., Tan J.R., Tan K.S. et al. Circulating microRNAs as biomarkers of acute stroke. Int. J. Mol. Sci. 2014. 15. 1418-32.
71. Stary C.M., Xu L., Sun X. et al. MicroRNA-200c contributes to injury from transient focal cerebral ischemia by targeting Reelin. Stroke. 2015. 46. 551-6.
72. Van Rooij E., Olson E.N. MicroRNA therapeutics for cardiovascular disease: opportunities and obstacles. Nat. Rev. Drug Discov. 2012. 11. 860-72.
73. Reynolds M.A., Kirchick H.J., Dahlen J.R. et al. Early biomarkers of stroke. Clin. Chem. 2003. 49. 1733-9.
74. Jauch E.C., Lindsell C., Broderick J. et al. Association of serial biochemical markers with acute ischemic stroke: the National Institute of Neurological Disorders and Stroke recombinant tissue plas¬minogen activator Stroke Study. Stroke. 2006. 37. 2508-13.
75. Montaner J., Rovira A., Molina C.A. et al. Plasmatic level of neuroinflammatory markers predict the extent of diffusion-weighted image lesions in hyperacute stroke. J. Cereb. Blood Flow Metab. 2003. 23. 1403-7.