Международный неврологический журнал №6 (108), 2019
Вернуться к номеру
Роль кверцетина в лечении ишемического инсульта у пациентов с коморбидной патологией и его влияние на функциональный исход острого периода
Авторы: Прокопив М.М. (1), Рогоза С.В. (1), Поливода М.В. (2)
1 - Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина
2 - Больница Днепровского района г. Херсона, г. Херсон, Украина
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальність. На сьогодні існує необхідність впровадження ефективного і безпечного патогенетичного лікування мозкового інсульту, спрямованого на захист нейронів від ішемічного пошкодження. Коморбідна патологія у пацієнтів з ішемічним інсультом може чинити істотний вплив на перебіг захворювання і впливати на ефективність відновлення порушених функцій. Метою дослідження було вивчення впливу кверцетину на функціональний кінець гострого періоду ішемічного інсульту, що виник у хворих на фоні соматичної патології. Матеріали та методи. Наведені результати аналізу 639 випадків гострого мозкового ішемічного інсульту залежно від застосованої схеми лікування і рівня коморбідності. Результати. Досліджувані групи пацієнтів були співставними за показниками вихідного неврологічного дефіциту. 98 % з них мали коморбідну патологію з діапазоном значень від 1 до 8 балів за індексом Чарлсона (середні значення 3,75 ± 1,40 бала). Пацієнти з високим рівнем коморбідності продемонстрували гірші показники функціонального відновлення в гострому періоді ішемічного інсульту за модифікованою шкалою Ренкіна (3,3 ± 1,6 бала) порівняно з пацієнтами з низьким рівнем коморбідності (2,2 ± 1,4 бала) (p < 0,01, U). Вивчення ефективності різних схем лікування на фоні коморбідної патології показало вірогідну ефективність призначення кверцетину у пацієнтів із високою коморбідністю. Серед пацієнтів із низькою коморбідністю не було відмічено статистично значущих відмінностей за показниками інвалідизації і виживання хворих у гострому періоді ішемічного інсульту. Висновки. У 98 % хворих з ішемічним інсультом виявляється коморбідна патологія, що негативно впливає на показники виживання і функціонального відновлення у хворих у гострому періоді ішемічного інсульту. Гірші показники функціонального відновлення продемонстрували пацієнти з високим рівнем коморбідності за індексом Чарлсона. Застосування кверцетину в гострому періоді ішемічного інсульту показало високу ефективність у хворих із високим рівнем коморбідності, що підтвердило мультимодальний спектр його терапевтичних ефектів. Індивідуальний підбір лікувальних заходів у хворих з ішемічним інсультом з урахуванням супутньої патології підвищує ефективність лікування.
Актуальность. На сегодняшний день существует необходимость внедрения эффективного и безопасного патогенетического лечения мозгового инсульта, направленного на защиту нейронов от ишемического повреждения. Коморбидная патология у пациентов с ишемическим инсультом может оказывать существенное воздействие на течение заболевания и влиять на эффективность восстановления нарушенных функций. Целью исследования было изучение влияния кверцетина на функциональный исход острого периода ишемического инсульта, возникшего у больных на фоне соматической патологии. Материалы и методы. Представлены результаты анализа 639 случаев острого мозгового ишемического инсульта в зависимости от применявшейся схемы лечения и уровня коморбидности. Результаты. Исследуемые группы пациентов были сопоставимы по показателям исходного неврологического дефицита. 98 % из них имели коморбидную патологию с диапазоном значений от 1 до 8 баллов по шкале Чарлсона (среднее значение 3,75 ± 1,40). Пациенты с высоким уровнем коморбидности продемонстрировали худшие показатели функционального восстановления в остром периоде ишемического инсульта по шкале инвалидизации (3,3 ± 1,6 балла) по сравнению с пациентами с низким уровнем коморбидности (2,2 ± 1,4 балла) (p < 0,01, U). Изучение эффективности разных схем лечения на фоне коморбидной патологии показало достоверную эффективность назначения кверцетина у пациентов с высокой коморбидностью. Среди пациентов с низкой коморбидностью не было отмечено статистически значимых различий по показателю инвалидизации и выживаемости больных в остром периоде ишемического инсульта. Выводы. У 98 % больных с ишемическим инсультом выявляется коморбидная патология, которая негативно влияет на показатели выживания и функционального восстановления у больных в остром периоде ишемического инсульта. Худшие показатели функционального восстановления продемонстрировали пациенты с высоким уровнем коморбидности по индексу Чарлсона. Применение кверцетина в остром периоде ишемического инсульта показало высокую эффективность у больных с высоким уровнем коморбидности, что подтвердило мультимодальный спектр его терапевтических эффектов. Индивидуальный подбор лечебных мероприятий у больных с ишемическим инсультом с учетом сопутствующей патологии повышает эффективность лечения.
Background. Nowadays, there is a necessity to introduce effective and safe pathogenetic treatment of cerebral stroke, aimed to protect neurons from ischemic damage. Comorbidity in patients with ischemic stroke may have a significant effect on the disease course and the effectiveness of the recovery of impaired functions. The purpose of the study was to investigate the effectiveness of quercetin on the functional outcome in the acute period of ischemic stroke in patients with comorbidity. Materials and methods. Six-hundred and thirty-nine cases of the acute cerebral ischemic stroke depending on the treatment regimen and the level of comorbidity were analyzed. Results. The groups of patients were comparable in terms of the initial neurological deficit. Ninety-eight per cent of them had comorbid pathology with a range of values from 1 to 8 points on the Charlson Comorbidity Index (average values of 3.75 ± 1.4). The patients with a high level of comorbidity had worse functional recovery in the acute period of ischemic stroke on a Rankin scale (3.3 ± 1.6 points) compared with patients with a low level of comorbidity (2.2 ± 1.4 points) (p < 0.01 U). The quercetin usage in patients with ischemic stroke and high comorbidity demonstrated effectiveness. Among the patients with low comorbidity, there were no statistically significant differences in terms of disability and survival in the acute period of ischemic stroke. Conclusions. In 98 % of patients with ischemic stroke, a comorbid pathology was detected. The negative effect of comorbidity on survival and functional recovery in patients with acute ischemic stroke was shown. The worst indicators of functional recovery in patients with a high level of comorbidity by the Charlson Comorbidity Index were demonstrated. The use of quercetin in the acute period of ischemic stroke showed high efficiency in patients with high levels of comorbidity, which confirmed the multimodal spectrum of its therapeutic effects. Individual choice of therapeutic measures in patients with ischemic stroke and comorbidities increases the efficacy of treatment.
ішемічний інсульт; кверцетин; лікування; функціональний кінець; індекс коморбідності Чарлсона; соматична патологія
ишемический инсульт; кверцетин; лечение; функциональный исход; индекс коморбидности Чарлсона; соматическая патология
ischemic stroke; quercetin; treatment; functional outcome; Charlson Comorbidity Index; somatic pathology
Введение
Мозговой инсульт (МИ) остается одной из наиболее важных медико–социальных проблем современности. В Украине он является второй по частоте причиной смертности населения после ишемической болезни сердца и инфаркта миокарда и остается ведущей причиной инвалидизации населения. Актуальность МИ также обусловлена высокой распространенностью и сложностью лечения. Вместе с тем следует отметить, что течение любого типа инсульта предопределяют такие факторы, как возраст пациента, локализация и объем поражения, наличие отека мозга и сопутствующей соматической патологии. Понятие коморбидности впервые предложил A.R. Feinstein в 1970 г., описав ее как сочетание двух или нескольких самостоятельных заболеваний или синдромов, которые дают дополнительную клиническую картину к вновь возникшему заболеванию [18]. Наличие коморбидной патологии у пациентов с МИ может оказывать существенное воздействие на течение заболевания и влиять на эффективность восстановления нарушенных функций. В связи с этим представляется актуальным изучение особенностей коморбидности у пациентов с ишемическим инсультом (ИИ) с целью оптимизации и индивидуализации в подходе к лечению.
Большое влияние на функциональный исход оказывает также вид лечения и его своевременное начало. Проблема успешного лечения мозгового инсульта является одной из наиболее важных в ангионеврологии. На сегодняшний день в лечении ишемического инсульта самыми высокими уровнями доказательности обладают неотложная госпитализация пациента с инсультом в специализированное неврологическое отделение, проведение тромболитической терапии в первые 4,5 часа от развития неврологической симптоматики, применение эндоваскулярных методик реперфузии с использованием механической тромбэкстракции у определенной категории пациентов, применение препаратов ацетилсалициловой кислоты в первые 48 часов, а также гемикраниэктомия для профилактики злокачественного отека головного мозга. Вместе с тем существует также потребность во внедрении эффективного и безопасного патогенетического лечения, направленного на блокирование всех этапов ишемического каскада [14]. Эту функцию, вероятно, могут выполнять нейропротекторы. Они должны предупреждать гибель нейронов, способствовать их восстановлению и, таким образом, улучшать качество лечения. На сегодняшний день безопасный и эффективный нейропротектор принес бы большую пользу для лечения больных с ИИ [13]. Результаты многих клинических наблюдений свидетельствуют о том, что своевременное назначение нейропротекторных средств в комплексной терапии ишемического инсульта уменьшает выраженность неврологического дефицита и улучшает функциональный исход инсульта [2, 9, 15, 17].
Группой украинских ученых на основе биофлавоноида кверцетина была впервые в мире создана его водорастворимая форма для внутривенного введения производства ПАО «Научно–производственный центр «Борщаговский химико–фармацевтический завод» — препарат под названием Корвитин®. Кверцетин имеет различные механизмы действия при ишемическом инсульте: стабилизирует клеточные биомембраны (за счет блокирования активности фосфолипазы С и 5–липоксигеназы, которые участвуют в деградации фосфолипидов), обладает антиоксидантными свойствами (уменьшает продукцию свободных радикалов кислорода и повышает антиоксидантную защиту), противовоспалительным эффектом (тормозит синтез лейкотриенов C4 и B4), антиагрегантным действием (блокирует каталитическую активность тромбина и реакцию связывания фибриногена — антикоагулянтный эффект; тормозит адгезию и агрегацию, улучшает микроциркуляцию и предотвращает внутрисосудистое тромбообразование, таким образом улучшая микроциркуляцию), антиапоптозным действием (замедляет апоптозный эффект) [1, 7, 10, 11, 23]. Кверцетин имеет достаточную доказательную базу в лечении ИИ путем влияния его на ишемический каскад изменений. Кроме того, имеются доказательства его эффективности в случае острого нарушения коронарного кровообращения [10–12, 21, 24], сахарного диабета [20], нарушений липидного обмена [25], наличия злокачественных новообразований [21].
В течение 2006–2009 гг. в Украине было проведено открытое рандомизированное сравнительное клиническое исследование эффективности и безопасности применения кверцетина у больных с острым ишемическим инсультом, результаты которого показали достоверное увеличение степени полного восстановления неврологических функций в течение 3 месяцев от начала наблюдения на фоне назначения препарата в течение первых 12 часов от начала заболевания [3]. Клинические исследования подтвердили его эффективность в случае ишемического инсульта на фоне метаболического синдрома [4], изучалось влияние препарата на когнитивные и эмоциональные функции в остром периоде инфаркта мозга [6], были попытки одновременного использования комбинации различных нейропротекторов, в том числе цитиколина и кверцетина [5, 9], имеются также исследования по эффективности препарата у больных, перенесших ишемический инсульт [8]. Все вышесказанное свидетельствует о том, что кверцетин имеет мультимодальный спектр терапевтических эффектов, и подтверждает перспективность его применения в случае лечения сосудистых заболеваний головного мозга.
Цель. С учетом влияния артериальной гипертензии, атеросклероза, ишемической болезни сердца, нарушений сердечного ритма, сахарного диабета и других факторов на исход инсульта целью нашего исследования было изучение влияния кверцетина на функциональный исход острого периода ишемического инсульта, возникшего у больных на фоне соматической патологии.
Материалы и методы
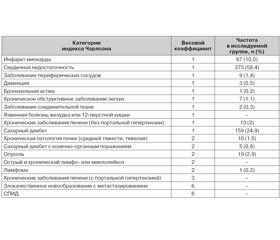
Исследование проведено на базе неврологических отделений г. Киева. Изучали все случаи мозгового инсульта у пациентов с 1 июня по 31 декабря 2016 года. Использовали специально разработанную регистрационную карту случая инсульта для прагматического наблюдения, которую заполнял лечащий врач пациента, используя данные анамнеза, медицинской документации и результаты осмотра пациента. В карту заносили данные демографических показателей, факторов сосудистого риска, информацию, касающуюся наличия сопутствующей патологии, сроки и обстоятельства госпитализации пациентов, выполнение Унифицированного клинического протокола оказания помощи пациентам с мозговым инсультом [13, 14]. Диагноз инсульта устанавливали в соответствии с критериями ВОЗ на основании подробного неврологического осмотра и/или результатов нейровизуализации — КТ или МРТ головного мозга. В нашем исследовании нейровизуализация была проведена у 81,1 % пациентов. Коморбидность у больных мозговым инсультом изучали с помощью индекса Чарлсона (ИЧ) [16], модифицированного L.B. Goldstein и соавторами [19]. При расчете ИЧ суммируются весовые коэффициенты, которые соответствуют имеющейся в наличии соматической патологии (табл. 2), а также прибавляется один балл на каждые 10 лет жизни при превышении пациентом 40–летнего возраста (то есть в 50 лет — 1 балл, в 60 лет — 2 балла и т.д.). Согласно ИЧ риск летального исхода в течение года при отсутствии коморбидности оценивают в 12 %, в случае 1–2 баллов по ИЧ — 26 %, 3–4 баллов — 52 %, 5 баллов и более — 85 %. Согласно полученным результатам пациенты были разделены на группы с низкой (0–1 балл по ИЧ) и высокой (≥ 2 баллов по ИЧ) коморбидностью [19]. Для оценки состояния сознания использовали шкалу комы Глазго, тяжесть инсульта оценивали по шкале Национального института здоровья США (NIHSS) в день госпитализации и на момент выписки пациента из стационара. Степень инвалидизации оценивали с использованием модифицированной шкалы Рэнкина (мШР) в 1–й и 21–й день заболевания. Благоприятным функциональным исходом считали достижение 0–2 баллов по мШР на 21–й день болезни, неблагоприятным — если на 21–й день заболевания оценка по мШР составляла 3–5 баллов [22].
Проведен анализ 1575 регистрационных карт случаев острого мозгового инсульта. В данной работе представлены результаты анализа 639 случаев острого мозгового ишемического инсульта в зависимости от применявшейся схемы лечения. В 1–ю группу вошли 235 пациентов, которые дополнительно к стандартной терапии получали цитиколин, 2–ю группу составили 87 пациентов, которым на фоне стандартной терапии дополнительно назначали кверцетин, в 3–ю группу вошли 109 пациентов, которые дополнительно к стандартной терапии получали кверцетин в сочетании с цитиколином. Контрольную группу составили 208 пациентов, которым назначали стандартную терапию.
Статистический анализ данных проводили с использованием программы SPSS 23.0. Нормальность распределения оценивали с помощью метода Шапиро — Уилка. Количественные признаки, имевшие нормальное распределение, описывали средними значениями (М) и среднеквадратическими отклонениями (SD). Анализ качественных параметров проводили с использованием частотных характеристик. Для сравнения средних значений в двух несвязанных группах, не имевших правильного распределения, использовали U–критерий Манна — Уитни (U). Сравнение средних значений в трех и более несвязанных группах, не имевших нормального распределения, проводили с использованием критерия Краскела — Уоллиса (ККУ). Оценку статистической достоверности результатов определяли с граничным риском погрешности не выше 5 % (р < 0,05).
Результаты и обсуждение
У 439 (68,7 %) пациентов ишемический инсульт возник впервые в возрасте от 26 до 100 лет, средний возраст составил 70,3 ± 10,8 года; 42,4 % пациентов были мужского пола. Повторный инсульт был зарегистрирован у 169 (26,4 %) пациентов в возрасте от 39 до 95 лет, средний возраст составил 70,7 ± 10,4 года; 43,8 % пациентов были мужского пола. У 31 (4,9 %) пациента не получено данных анамнеза о перенесенном ранее инсульте. Исследуемые группы пациентов были сопоставимы по показателям исходного неврологического дефицита (табл. 1).
Наиболее весомым фактором сосудистого риска была артериальная гипертензия в анамнезе у 603 (94,4 %) пациентов. Среди других факторов риска инсульта была выявлена фибрилляция предсердий у 210 (32,9 %) пациентов, нарушение липидного обмена — у 207 (32,4 %), сахарный диабет — у 159 (24,9 %), табакокурение — у 72 (11,3 %), хронический или острый стресс накануне инсульта перенесли 45 (7 %) пациентов. В результате проведенного исследования было установлено, что 98 % обследованных пациентов имеют коморбидную патологию с диапазоном значений по ИЧ 1–8 баллов, средние значения 3,75 ± 1,40 балла (табл. 2). У остальных 13 (2 %) пациентов ИЧ составил 0 баллов, среди них 4 пациента перенесли повторный инсульт.
Доказано негативное влияние коморбидности на показатели выживания и функционального восстановления у больных в остром периоде мозгового инсульта по мШР. Среди лиц с низкой коморбидностью был зарегистрирован один случай летального исхода в остром периоде ишемического инсульта у пациента контрольной группы (рис. 1а). Среди пациентов с высокой коморбидностью в остром периоде ишемического инсульта летальный исход отмечался у 65 (11,1 %) (рис. 1б). Пациенты с высоким уровнем коморбидности по ИЧ продемонстрировали худшие показатели функционального восстановления в остром периоде ишемического инсульта по мШР (3,3 ± 1,6 балла) по сравнению с пациентами с низким уровнем коморбидности по ИЧ (2,2 ± 1,4 балла) (p < 0,01, U).
Изучение эффективности разных схем лечения на фоне коморбидной патологии показало эффективность назначения кверцетина у пациентов с высокой коморбидностью по ИЧ (p < 0,001, ККУ). Среди пациентов с низкой коморбидностью по ИЧ не отмечено статистически значимых отличий по показателю инвалидизации мШР и выживаемости больных в остром периоде ишемического инсульта (p > 0,05, ККУ) (рис. 1).
Выводы
У 98 % больных с ишемическим инсультом выявляется коморбидная патология, которая негативно влияет на показатели выживания и функционального восстановления у больных в остром периоде ишемического инсульта. Худшие показатели функционального восстановления продемонстрировали пациенты с высоким уровнем коморбидности по индексу Чарлсона. Применение кверцетина в остром периоде ишемического инсульта показало высокую эффективность у больных с высоким уровнем коморбидности, что подтвердило мультимодальный спектр его терапевтических эффектов. Индивидуальный подбор лечебных мероприятий у больных с ишемическим инсультом с учетом сопутствующей патологии повышает эффективность лечения.
Конфликт интересов. Не заявлен.
1. Барабой В.А. Биоантиоксиданты. Киев: Книга плюс, 2006. 461 с.
2. Виничук С.М., Мохнач В.А., Прокопив М.М., Турчина Н.С., Унич П.П., Трепет Л.Н. Окислительный стресс при остром ишемическом инсульте и его коррекция с внедрением антиоксиданта мексидола. Междунар. невролог. журн. 2006. № 1 (5). С. 18–22.
3. Виничук С.М., Прокопив М.М., Черенько ТМ. Поиск новых подходов в лечении острого ишемического инсульта. Укр. неврол. журн. 2010. № 1 (14). С. 8–19.
4. Вирстюк А.А., Герасимчук Р.Д. Клиническая эффективность комплексной терапии острого ишемического инсульта на фоне метаболического синдрома с внедрением препарата Корвитин®. Украинский неврологический журнал. 2009. № 3. С. 18–29.
5. Виничук С.М., Прокопив М.М., Трепет С. Клиническое и биохимическое обоснование целесообразности комплексного использования Цераксона и Корвитина® в лечении острого ишемического инсульта. Международный неврологический журнал. 2011. № 1 (39). С. 67–79.
6. Зозуля И.С., Сыч Н.С., Боброва В.И. Возможности лечения когнитивных и эмоциональных нарушений в остром периоде инфаркта мозга. Международный неврологический журнал. 2013. № 5 (59). С. 23–31.
7. Ковалев В.Б., Ковчан В.В., Колчина Е.Ю. Механизмы лечебного действия биофлавоноида кверцетина (обзор литературы). Укр. мед. альманах. 1999. Т. 2, № 4. С. 176–184.
8. Кузнецова С.М., Егорова М.С., Скрипченко А.Г. Клинические аспекты применения кверцетина у больных, перенесших ишемический инсульт. Журнал неврологии им. Б.М. Маньковского. 2014. Т. 1, № 3. С. 34–40.
9. Мищенко Т.С., Дмитриева Е.В. Комбинированная терапия препаратами Корвитин® и Аксотилин в лечении больных с ишемическим инсультом. Междунар. неврол. журн. 2018. № 1 (95). С. 31–36.
10. Мойбенко А.А. Патогенетическое обоснование эффективности нового отечественного кардиопротектора Корвитин® (водорастворимого кверцетина) при остром инфаркте миокарда. Вестник фармакологии и фармации. 2007. № 5. С. 38–47.
11. Мойбенко А.А. Эндогенные механизмы кардиопротекции как основа патогенетической терапии заболеваний сердца. Киев: Наукова думка, 2008. 511 с.
12. Пархоменко А.Н., Кожухов С.Н. Эффективность внутривенной формы блокатора 5–липоксигеназы кверцетина у больных с инфарктом миокарда и синдромом острой сердечной недостаточности. Возможная связь с коррекцией метаболизма оксида азота. Украинский медицинский журнал. 2005. Т. 46, № 3–4. С. 45–51.
13. Сучасні принципи діагностики і лікування пацієнтів із гострим ішемічним інсультом і ТІА: клінічні рекомендації, засновані на доказах. Київ, 2018 р.
14. Уніфікований клінічний протокол медичної допомоги. Ішемічний інсульт (екстрена, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація). Наказ Міністерства охорони здоров’я України від 03.08.2012 № 602 «Про затвердження та впровадження медико–технологічних документів зі стандартизації медичної допомоги при ішемічному інсульті» [Електронний ресурс]. Режим доступу: http. //www.dec.gov.ua/mtd/reestr.html
15. Barreca D., Bellocco E., D’Onofrio G., Nabavi S.F., Daglia M., Rastrelli L., Nabavi S.M. Neuroprotective Effects of Quercetin. From Chemistry to Medicine. CNS & Neurological Disorders. Drug Targets. 2016. 15 (8). 964–975.
16. Charlson M.E., Pompei P., Ales K.L., MacKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies. development and validation. J. Chronic Dis. 1987. Vol. 40. P. 373–383.
17. Costa L.G., Garrick J.M., Roquè P.J., Pellacani C. Mecha–nisms of Neuroprotection by Quercetin. Counteracting Oxidative Stress and More. Oxid Med Cell Longev. 2016. 2986796. doi. 10.1155/2016/2986796
18. Feinstein A.R. The pre–therapeutic classification of comorbidity in chronic disease. J. Chronic. Dis. 1970. Vol. 23 (7). P. 455–468.
19. Goldstein L.B., Samsa G.P., Matchar D.B., Horner R.D. Charlson index comorbidity adjustment for ischemic stroke outcome studies. Stroke. 2004. Vol. 35. P. 1941–1945.
20. Eid H.M., Haddad P.S. The Antidiabetic Potential of Quercetin. Underlying Mechanisms. Current MedicinalChemistry. 2017. 24. 355.
21. Middleton E.Jr., Kandaswami C. Theoharides T.C. The effects of plant flavonoids on mammalian cells. implications for inflammation, heart disease, and cancer. Pharmacol. Rev. 2000. Vol. 52, № 4. P. 673–751.
22. Rankin J. Cerebral vascular accidents in patients over the age of 60. II. Prognosis. Scottish Med. J. 1957. Vol. 2. P. 200–213.
23. Oboh G., Ademosun A.O., Ogunsuyi O.B. Quercetin and Its Role in Chronic Diseases. Drug Discovery from Mother Nature (Advances in Experimental Medicine and Biology) / Gupta S., Prasad S., Aggarwal B. (eds). 2016. Vol. 929. Springer, Cham.
24. Patel R.V., Mistry B.M., Shinde S.K., Syed R., Singh V., Shin H.S. Therapeutic potential of quercetin as a cardiovascular agent. Eur. J. Med. Chem. 2018 Jul 15. 155. 889–904.
25. Sahebkar A. Effects of quercetin supplementation on lipid profile. A systematic review and meta–analysis of randomized controlled trials. Critical Reviews in Food Science and Nutrition. 2017. 57, 4. 666–676.

/13-1.jpg)
/14-2.jpg)
/14-1.jpg)