Газета «Новости медицины и фармации» №7 (694), 2019
Вернуться к номеру
Прогностические биохимические маркеры преэклампсии
Авторы: Мельник А.А.,
к.б.н., руководитель проекта специализированного медицинского центра «Оптима Фарм», г. Киев, Украина
Рубрики: Акушерство и гинекология, Урология
Разделы: Справочник специалиста
Версия для печати
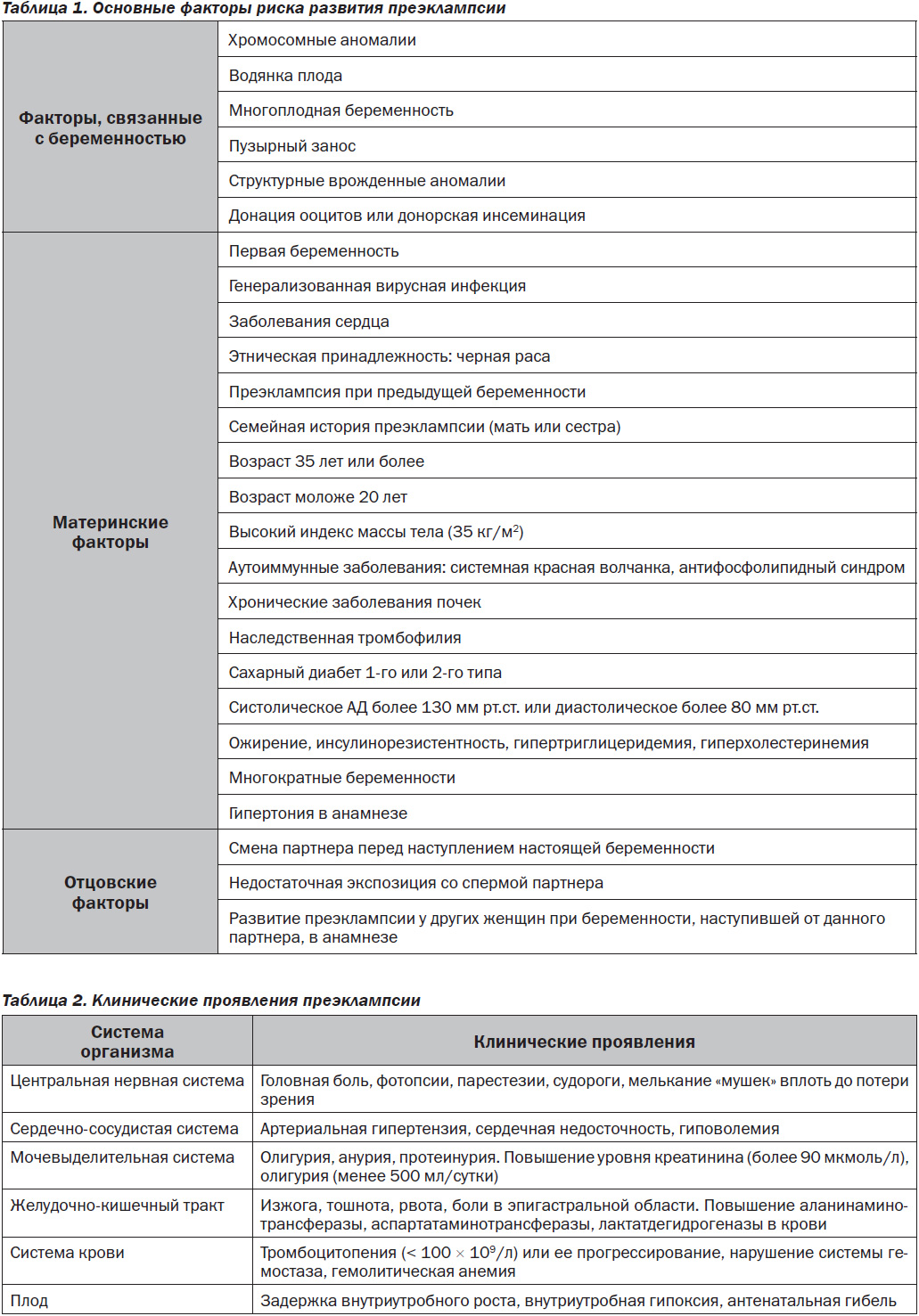
Преэклампсия (ПЭ) — мультисистемное патологическое состояние, возникающее во второй половине беременности (после 20-й недели), характеризующееся артериальной гипертензией de novo (≥ 140/90 мм рт.ст.) в сочетании с протеинурией (≥ 0,3 г/л в суточной пробе) и проявлениями полиорганной недостаточности [1, 2]. Ежегодно в мире регистрируется более 8 миллионов случаев преэклампсии, от чего умирают 60 000 женщин [3]. Фактически в структуре акушерских причин материнской смертности преэклампсия занимает второе место после тромбоэмболических осложнений. Частота ПЭ достигает 3–8 % от всех беременностей с существенными различиями в зависимости от страны проживания [4]. Так, в развивающихся странах с ограниченным доступом к высококачественной медицинской помощи показатели смертности достигают 15 % среди пациенток с ПЭ, а в высокоразвитых странах этот показатель составляет всего 0–1,8 % [5]. В настоящее время отмечается рост заболеваемости ПЭ даже в странах с высоким уровнем дохода [6]. Причиной этому является увеличение частоты таких заболеваний, как ожирение, диабет, хроническая артериальная гипертензия. Преэклампсия является мультифакторным тяжелейшим осложнением беременности. Среди факторов риска преэклампсии выделяют непосредственно факторы, связанные с беременностью, а также материнские и отцовские [7–10] (табл. 1).
Преэклампсия имеет широкий спектр клинических проявлений, которые могут оказывать влияние на центральную нервную систему, сердечно-сосудистую и мочевыделительную системы, желудочно-кишечный тракт, систему крови, плод (табл. 2).
Патогенез преэклампсии
Существует несколько десятков этиопатогенетических теорий о возникновении преэклампсии, однако ни одна из них не объясняет в полной мере многообразие происходящих при данной патологии беременности морфофункциональных изменений и клинических манифестаций. В качестве основы и первопричины формирования преэклампсии были изучены генетические, иммунологические, сосудистые и гуморальные факторы. По мнению многих исследователей, развитие ПЭ у беременных является результатом множества патогенетических факторов [11].
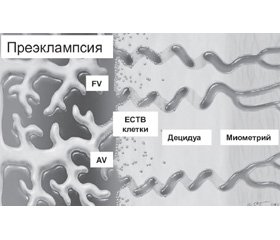
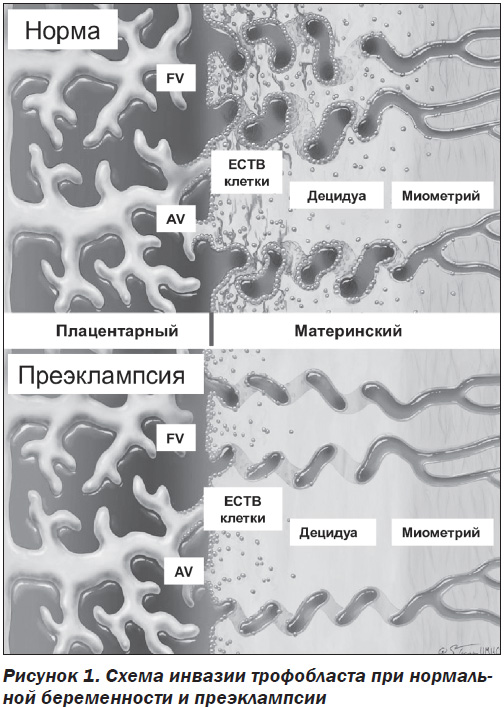
Развитие плаценты является строго регулируемым процессом, который необходим для нормального развития плода и поддержания успешной беременности. Кровоснабжение плаценты осуществляется по спиральным артериям, которые, в свою очередь, являются ветвями маточных артерий. В начале нормальной беременности цитотрофобластические клетки развивающейся плаценты проникают в стенку матки через эндотелий и средний слой спиральных артерий. При этом сосудистая стенка спиральных артерий ремоделируется, что приводит к превращению спиральных артерий из сосудов с низким потоком и высокой устойчивостью в сосуды с высоким потоком и низким сопротивлением, которые необходимы для нормального развития плаценты. Инвазия цитотрофобластов в децидуальные сегменты спиральных артерий происходит примерно на 10–12-й неделе беременности, а в сегменты миометрия — на 15–16-й неделе. При преэклампсии цитотрофобластическая инвазия сегментов миометрия нарушается, и кровоснабжение развивающегося плода оказывается недостаточным. В плаценте пациенток с преэклампсией интерстициальная инвазия неглубокая и ограниченная. Многие вневорсинчатые клетки цитотрофобласта (ECTB-клетки) остаются прикрепленными к анкерным ворсинкам (AV). Эндоваскулярная инвазия почти отсутствует, спиральные артериолы становятся «жесткими» (рис. 1).
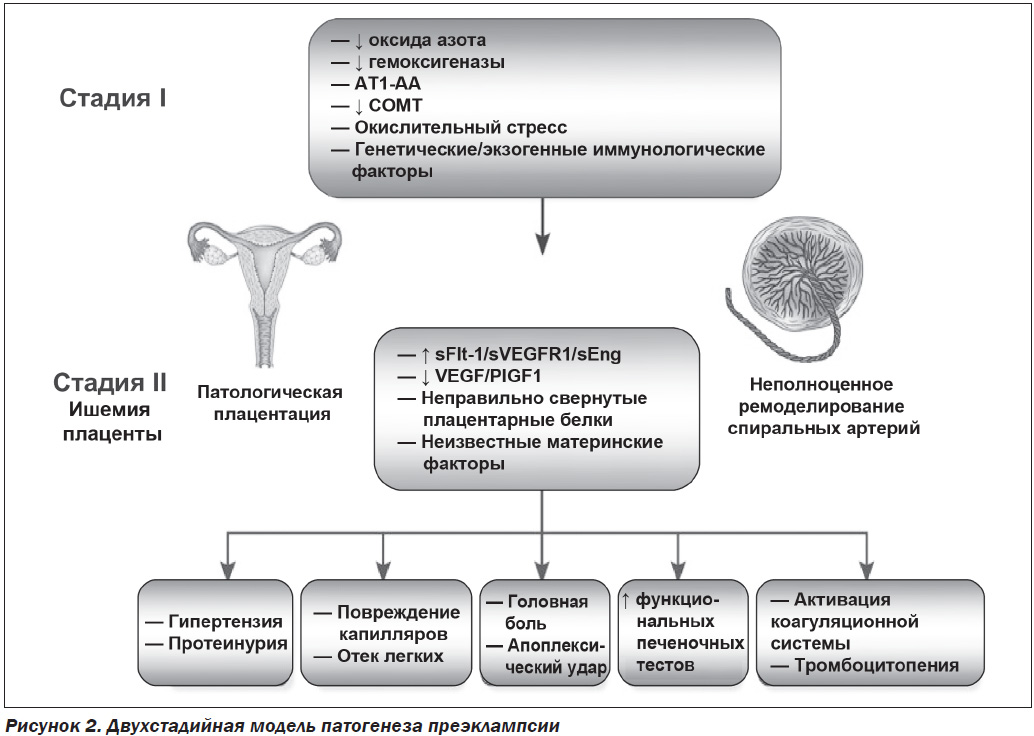
В настоящее время считается, что развитие преэклампсии имеет две стадии. На первом этапе происходит неполное ремоделирование спиральной артерии в матке, которое способствует плацентарной ишемии, а на втором — высвобождение ангиогенных факторов из ишемической плаценты в материнское кровообращение, что приводит к повреждению эндотелия [12, 13] (рис. 2). Клинические симптомы преэклампсии возникают в результате развития эндотелиальной дисфункции в организме беременной вследствие оксидативного стресса, вазоспазма, гипоксически-ишемических изменений органов-мишеней [14, 15].
Одной из важнейших задач современной медицины является определение групп риска развития преэклампсии, а также своевременная дифференциальная диагностика. Скрининг и раннее выявление женщин с риском ПЭ может обеспечить надлежащее применение дородового наблюдения и лечения [16]. На сегодняшний день скрининг преэклампсии состоит из оценки клинического риска таких факторов, как возраст, индекс массы тела, семейной истории в сочетании с ультразвуковым исследованием для выявления группы высокого риска на ранних сроках беременности и проведения профилактического лечения. К сожалению, прогностическая значимость этих факторов невелика [17]. Поэтому для диагностики ПЭ используют материнские сывороточные маркеры, измерение которых является чрезвычайно эффективным при прогнозировании ПЭ.
Прогностические маркеры развития преэклампсии
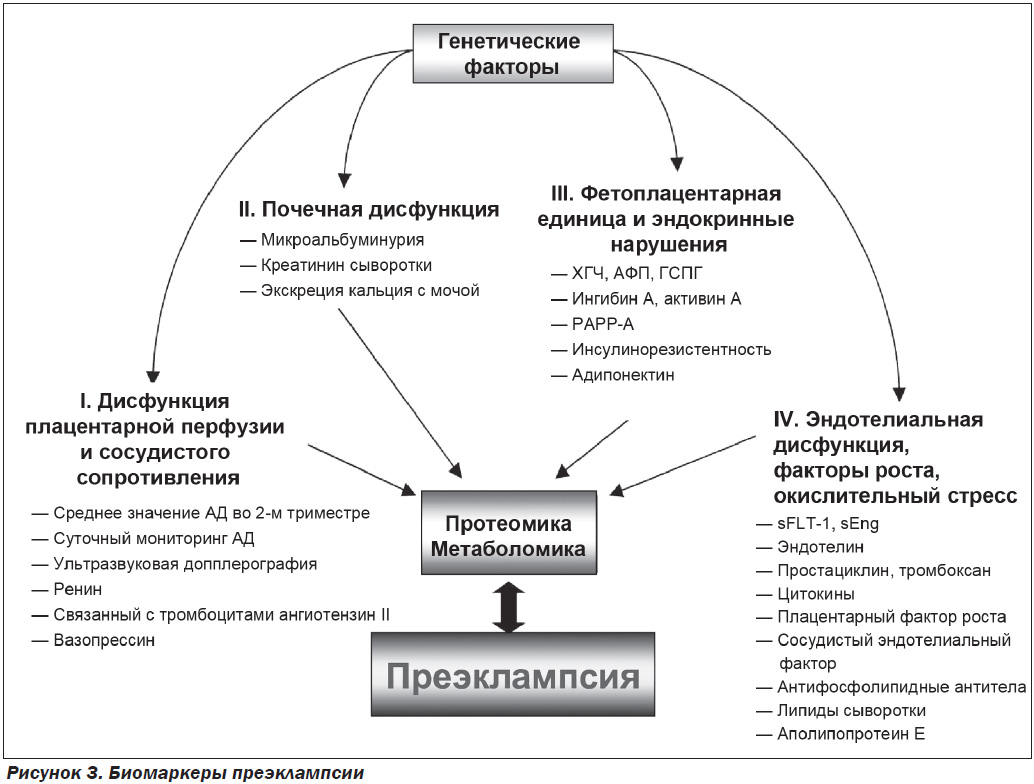
Биомаркеры преэклампсии условно разделяют на четыре основные группы (рис. 3) [18]. Продуцирование и уровни биомаркеров зависят от генетических факторов. Однако в отличие от статического генома протеом является динамическим. В то время как геном не изменяется во время беременности или при связанной с беременностью преэклампсии, протеом претерпевает изменения. Поэтому для оценки риска преэклампсии используют определение протеомных и метаболических биомаркеров и их уровней.
I. Ангиогенные факторы
Плацентарное кровообращение представляет собой динамическую сеть кровеносных сосудов, которая во время беременности изменяется в соответствии с потребностями растущего плода. Плацентарный ангиогенез (процесс образования новых кровеносных сосудов в органе или ткани, при котором происходит реорганизация капиллярной сети) тщательно регулируется путем баланса между проангиогенными и антиангиогенными факторами. На ранних сроках беременности трофобласты проникают в плаценту, что приводит к ремоделированию спиральных артерий и позволяет крови свободно течь к плоду. При ПЭ цитотрофобластическая инвазия спиральных артерий нарушается, из-за чего они становятся узкими и ограничивают кровоснабжение плода. По мере развития беременности последствия ограниченного кровоснабжения становятся более значительными. Нарушение кровоснабжения и питания приводит к ишемии плаценты, что способствует высвобождению различных факторов плаценты и про- и антиангиогенных факторов. Некоторые из них могут быть потенциальными биомаркерами при преэклампсии [19].
1. Проангиогенные маркеры
Проангиогенные факторы представлены сосудистым эндотелиальным фактором роста (Vascular Endothelial Growth Factor, VEGF) и плацентарным фактором роста (Placental Grows Factor, PlGF), которые стимулируют рост сосудов и принимают участие в формировании плацентарного кровообращения.
1.1. Сосудистый эндотелиальный фактор роста
Семейство VEGF состоит из пяти родственных белков: VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-Е и плацентарного фактора роста. Лучше всего изучен VEGF-A, который в литературе называют просто VEGF. VEGF является стимулятором ангиогенеза, повышает проницаемость сосудов внутри плацентарного ложа, регулирует дифференцировку, пролиферацию и инвазию клеток цитотрофобласта во время плацентации. Нарастание уровня VEGF при физиологической беременности свидетельствует о вовлечении его в процесс развития сосудов плаценты. У пациенток, беременность которых осложняется преэклампсией, отмечаются нарушение VEGF с начала второго триместра беременности и достоверно низкие его показатели в течение всего периода гестации.
1.2. Плацентарный фактор роста
Плацентарный фактор роста — это гликопротеин с м.в. 45–50 кДа, продуцируемый синцитиотрофо–бластом [20, 21]. Относится к семейству VEGF и имеет 42% гомологию с VEGF. Ген находится на длинном плече 14q24 хромосомы и кодирует четыре изоформы PlGF 1–4, включающие аминокислоты 131, 152, 203 и 224 соответственно. Основным различием между этими четырьмя изоформами является то, что PlGF-1 и PlGF-3 не имеют гепаринсвязывающего участка, в то время как PlGF-2 и PlGF-4 имеют дополнительный гепаринсвязывающий домен [22]. PlGF экспрессируется плацентарной тканью, клетками хориокарциномы и эндотелиальными клетками [23]. При нормально протекающей беременности продукция PlGF начинается с 8–10-й недели гестации и характеризуется резким ее увеличением, которая достигает своих самых высоких значений на 28–30-й неделе, а к концу беременности снижается.
Референтные значения PlGF:
— женщины (небеременные): 20,3–85,9 пг/мл;
— женщины (беременные) (табл. 3).
У женщин с развившейся впоследствии преэклампсией отмечено снижение концентрации PlGF уже на 13–16-й неделе гестации [24]. Пограничный уровень PlGF, являющийся границей между нормально протекающей беременностью и преэклампсией, на сроке беременности 15–18 недель составляет 42,7 ± 23,2 пг/мл (без признаков преэклампсии — 80,6 ± 35,2 пг/мл). Таким образом, прогностическим маркером преэклампсии является уровень PlGF в сыворотке крови 50–100 пг/мл, который служит ранним ценным маркером при диагностике этого заболевания и показывает начальные признаки нарушений в фетоплацентарном комплексе, возникающие задолго до клинической плацентарной недостаточности.
Лабораторные методы для измерения PlGF
Для измерения уровней плацентарного фактора роста используют иммуноферментные коммерческие наборы (метод ELISA) различных производителей, например компании DRG (Германия), IBL (США) и др. Кроме этого, широкое применение нашли такие анализаторы, как Triage MeterPro, компания Alere International, США (тест-система Triage PlGF), автоматический электрохемилюминесцентный анализатор Cobas E411, компания Roche Diagnostics, Швейцария (набор Elecsys PlGF), флуориметрический анализатор DELFIA Express, компания Perkin Elmer, США (набор PlGF 1–2–3), иммунохимический анализатор BRAHMS Kryptor compact Рlus, компания Thermo Fisher Scientific, США (набор BRAHMS PlGF plus Kryptor).
2. Антиангиогенные маркеры
Неотъемлемой частью нормального ангиогенеза является продукция антиангиогенных факторов, которые характеризуются высокой специфической экспрессией на эндотелии. К ним относятся s-Flt-1, или растворимая fms-подобная тирозинкиназа-1, VEGF-R2, VEGF-3 и эндолгин. Растворимые формы этих рецепторов способны связывать сосудистые факторы роста в циркуляции крови, замедляя или блокируя процессы ангиогенеза.
2.1. Растворимая fms-подобная тирозинкиназа-1
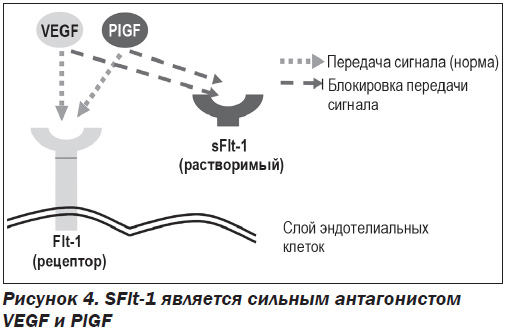
Факторы семейства VEGF взаимодействуют с клеткой через тирозинкиназные рецепторы. Рецептор VEGF 1-го типа (VEGF-R1, Flt-1) экспрессируется гемопоэтическими стволовыми клетками, моноцитами, макрофагами и эндотелиальными клетками сосудов. sFlt-1 представляет собой гликозилированный белок с м.в. 90–100 кДа. Является усеченным сплайс-вариантом мембраносвязанного Flt-1 (трансмембранный рецептор VEGF), свободно циркулирует в плазме, действуя как рецептор-ловушка для VEGF и PlGF и выступая в роли их мощного антагониста (рис. 4). В результате этих свойств sFlt-1 проявляет антиангиогенный эффект [25].
В исследованиях была обнаружена связь между повышенными уровнями sFlt-1 и преэклампсией. Уже за 5–6 недель до начала ПЭ уровни sFlt-1 увеличиваются и остаются повышенными по сравнению с нормальной физиологической беременностью. В 2003 году белок sFlt-1 был предложен в качестве возможного фактора, повреждающего эндотелий при беременности [26, 27].
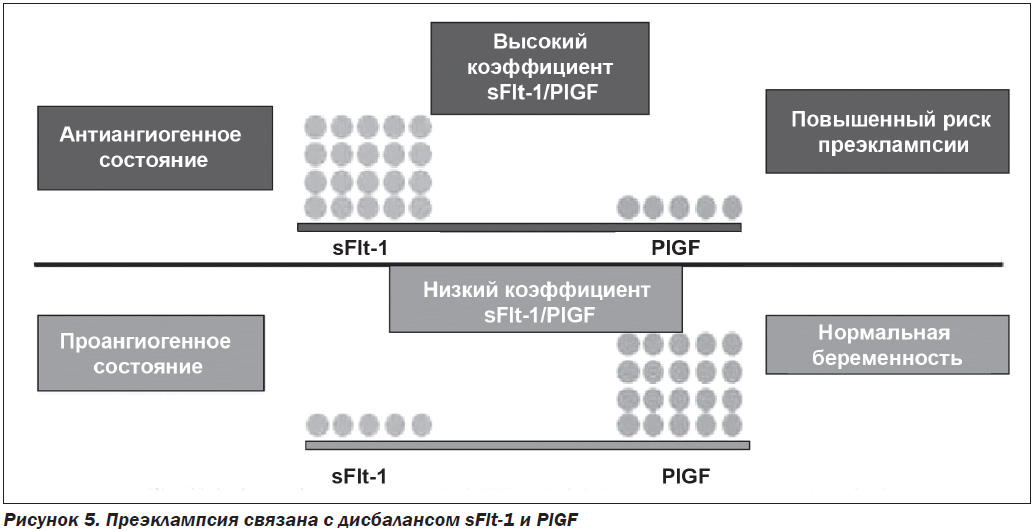
Определение содержания PlGF и sFlt-1 в кровотоке матери позволяет прогнозировать развитие преэклампсии, так как эти показатели отражают дисбаланс между проангиогенными и антиангиогенными факторами. Обнаружено достоверное снижение PlGF и увеличение концентрации sFlt-1 у беременных с ПЭ по сравнению со здоровыми беременными (рис. 5).
В последнее время в лабораторную практику начали внедрять определение соотношения sFlt-1/PlGF с целью диагностики и краткосрочного прогнозирования развития ПЭ у беременных женщин. По данным многих авторов, соотношение уровней sFlt-1 и PlGF оказалось более надежным прогностическим и диагностическим маркером преэклампсии, чем каждый из этих показателей по отдельности [28–30].
Соотношение sFlt-1/PlGF
Изменения маркеров sFlt-1 и PlGF наблюдаются уже во 2-м триместре беременности, что позволяет использовать соотношение sFlt-1/PlGF для диагностки и прогнозирования преэклампсии. Подтверждением ПЭ являются предельные значения соотношения sFlt-1/PlGF > 85 (срок беременности от 20 + 0 до 35 + + 6 недель) и sFlt-1/PlGF > 110 (34 + 0 недель до родов) [31]. Повышенное соотношение sFlt-1/PlGF отражает патологию неэффективной плацентации, плацентарной ишемии и считается перспективным биомаркером для прогнозирования и диагностики заболевания [32]. В 2016 г. данный анализ был рекомендован Национальным институтом клинического совершенствования (National Institute for Clinical Excellence, NICE) для исключения преэклампсии у пациенток с подозрением на данную патологию [33]. Кроме того, соотношение может также применяться для прогнозирования эклампсии и HELLP-синдрома.
Интерпретация результатов:
— соотношение sFlt-1/PlGF < 38 исключает ПЭ по меньшей мере в течение одной недели независимо от срока беременности. У более чем 80 % пациенток, принадлежащих к этой группе, клиницисты могут исключить ПЭ и проводить в дальнейшем дородовое наблюдение;
— соотношение sFlt-1/PlGF > 85 (ПЭ с ранним началом) или > 110 (ПЭ с поздним началом) является очень показательным при ПЭ;
— соотношение sFlt-1/PlGF 38–85 (ПЭ с ранним началом) или 38–110 (ПЭ с поздним началом) предоставляет дополнительную информацию о том, какие женщины подвергаются умеренному или высокому риску развития ПЭ в течение четырех недель (рис. 6).
2.2. Растворимый эндолгин
Растворимый эндолгин (sEng) представляет собой усеченную форму рецепторов трансформирующих факторов роста TGF-β1 и TGF-β3 и является потенциальным антиангиогенным фактором, который препятствует связыванию TGF-β1 с его рецептором и тем самым влияет на выработку оксида азота, вазодилатацию и образование капилляров эндотелиальными клетками [34]. Эндолгин участвует в регуляции основных клеточных процессов, включая пролиферацию, дифференцировку, миграцию, апоптоз, адгезию, организацию цитоскелета и ремоделирование внеклеточного матрикса. Растворимая изоформа эндолгина связывает циркулирующий TGF-β, так как содержит TGF-β-связывающий домен. TGF-β является проангиогенной молекулой, но при повышенном уровне sEng он утрачивает свои свойства и инактивируется. SEng играет большую роль в развитии дисфункции эндотелия и в патогенезе преэклампсии. Было показано, что sEng увеличивается при преэклампсии, причем уровень sEng коррелирует с тяжестью заболевания и снижается после родов. При нормальной беременности уровень sEng снижается между первым и вторым триместрами и повышается во втором триместре у пациенток с предрасположенностью к преэклампсии [35].
II. Другие биомаркеры преэклампсии
1. Протеин А плазмы, ассоциированный с беременностью
Протеин А плазмы, ассоциированный с беременностью (PАPP-А) — это большой высокогликозилированный белок, относящийся к цинксодержащим ферментам (металлопротеиназам), который синтезируется трофобластами [36]. PAPP-А отщепляет от инсулиноподобного фактора роста белковые фрагменты и повышает его биологическую активность. Благодаря этому процессу обеспечивается полноценный рост и развитие плаценты. Его содержание в крови увеличивается при физиологической беременности. Снижение уровня PАРР-А в плазме крови отмечается в первом триместре беременности, связаной с ПЭ [37]. По данным многих исследователей, сывороточные уровни PАРР-А и PlGF — два наиболее изученных биохимических маркера, которые возможно использовать для раннего предсказания преэклампсии [38–40].
2. Плацентарный белок 13
Плацентарный белок 13 (РР-13) — относительно небольшой димерный белок с м.в. 32 кДа. Является членом суперсемейства галектинов (галектин 13), секретируется в большом количестве в плаценте. При нормальной беременности уровень PP-13 постепенно увеличивается до момента рождения. Снижение концентрации РР-13 в сыворотке крови в первом триместре прогнозирует преэклампсию как у беременных с умеренным и низким уровнем риска, так и у беременных высокого риска [41, 42].
3. Ингибин А и активин А
Ингибин А и активин А являются гликопротеинами и членами семейства трансформирующих факторов роста β. Оба в значительной степени выделяются фетоплацентарной единицей во время беременности. Ингибин А играет важную эндокринную роль, участвуя в процессах регуляции отрицательной обратной связи гонадотропинов, а активин А действует на различные биологические процессы [43]. Основным источником этих циркулирующих белков является плацента. Концентрации ингибина А и активина А увеличиваются в третьем триместре у пациенток с физиологической беременностью. При тяжелой преэклампсии их уровни повышаются примерно в 10 раз [44]. При ПЭ наблюдается повышение окислительного стресса и системное воспаление, что стимулирует выработку активина А и его секрецию плацентарными эксплантами и эндотелиальными клетками [45].
4. Пентраксин 3
Пентраксины — это семейство эволюционно-консервативных белков. В зависимости от их первичной структуры они делятся на короткие (25 кДа) и длинные (40–50 кДа). Короткие пентраксины, такие как С-реактивный белок, вырабатываются печенью, длинные пентраксины (пентраксин 3, PTX3) экспрессируются сердцем. Пентраксин 3 (фактором некроза опухоли α стимулируемый ген 14) состоит из 318 аминокислот, является членом суперсемейства пентраксина, включающего С-реактивный белок и компонент амилоида Р сыворотки [46]. Синтезируется в ответ на провоспалительное действие и секретируется клетками различных типов, включая макрофаги, нейтрофилы, клетки яичника, эндотелиальные клетки, фибробласты, альвеолярные, эпителиальные и глиальные клетки. –Пентраксин 3 — острофазный белок, уровень которого в плазме возрастает при воспалении и различных инфекциях. При преэклампсии в ответ на воспаление его уровень повышается [47].
5. Дизинтегрин и металлопротеиназа 12
Дизинтегрин и металлопротеиназа 12 (англ. A Disintegrin And Metalloproteinase 12, ADAM12) является цинкзависимой мембраносвязанной протеазой, представителем семейства ADAM — группы белков, принимающих участие в межклеточном взаимодействии при оплодотворении. Для гена, кодирующего ADAM, свойственен альтернативный сплайсинг, в результате которого образуются две формы белка. Недавние исследования обнаружили связь между повышенным уровнем ADAM12 и преэклампсией [48].
6. МикроРНК
МикроРНК — это класс нуклеотидных коротких последовательностей РНК, которые не участвуют в синтезе белка. МикроРНК играют роль в механизме посттранскрипционной экспрессии генов, связываясь со специфическими участками матричных РНК в цитоплазме, и обеспечивают репрессию трансляции или деградацию транскриптов мишеней. МикроРНК могут регулировать до 60 % генома человека. Они способны управлять сложными процессами, такими как рост клеток, дифференцировка, стресс-реакция и ремоделирование тканей, что в определенных условиях может играть ключевую роль при многих патологических процессах, включая преэклампсию. В последнее время особое внимание уделяется определению уровней микроРНК как возможному предиктору преэклампсии на ранних сроках [49].
7. Лептин
Лептин представляет собой белок, состоящий из 167 аминокислот, относящийся к цитокинам и имеющий общую молекулярную массу 16 кДа. Лептин играет важную роль в некоторых физиологических процессах, включая размножение, ангиогенез, воспаление и регуляцию эндокринной и иммунной функций. Основным источником лептина является жировая ткань, но во время беременности лептин также продуцируется плацентой. При нормальной беременности экспрессия плацентарного лептина увеличивается по сравнению с небеременными и поддерживает имплантацию, выработку гонадотропина человека, рост плаценты и митогенез. Дисрегуляция уровня лептина может указывать на гестационные осложнения или приводить к ним. По данным ряда авторов, уровень лептина повышается при преэклампсии по сравнению с женщинами с физиологическим течением беременности [50, 51]. В связи с этим лептин может быть потенциальным биомаркером для прогнозирования преэклампсии и выступать как инструмент скрининга на ранних сроках гестации.
8. Чемерин
Чемерин — сравнительно недавно обнаруженный адипокин, который участвует в патогенезе ожирения и воспаления. Было показано, что его уровень может резко возрастать в первом триместре беременности и служить маркером преэклампсии [52, 53].
9. Цистатин С
Цистатин С является хорошо исследованным маркером функции почек. Цистатин С — негликозилированный белок с молекулярной массой 13,4 кДа, относится к семейству ингибиторов цистеиновых протеиназ, идентичен пост-гамма-глобулину. Впервые был идентифицирован у пациентов с почечной недостаточностью. Цистатин С с постоянной скоростью синтезируется клетками, содержащими ядра, полностью метаболизируется в почках, свободно фильтруется через клубочковую мембрану, не секретируется проксимальными почечными канальцами. Плацентарная экспрессия цистатина С увеличивается при развитии преэклампсии, что может приводить к повышенному уровню цистатина С в плазме крови [54].
10. Адипонектин
Адипонектин — это выделенный из адипоцитов коллагеноподобный белок, обладающий инсулинсенсибилизирующими, антиатерогенными и противовоспалительными свойствами, который участвует в патогенезе ожирения. Экспрессия адипонектина встречается исключительно в жировой ткани. Многочисленные исследования последних лет подтверждают повышение уровня адипонектина у женщин с преэклампсией [55].
11. Висфатин
Висфатин — недавно обнаруженный адипокин 52 кДа, вовлеченный в регуляцию гомеостаза глюкозы и выступающий как маркер эндотелиальной дисфункции. W. Hu с соавторами [56] в своем исследовании обнаружили низкую концентрацию висфатина при преэклампсии. Более того, было показано, что беременные с тяжелой преэклампсией имели значительно более низкую концентрацию висфатина в сыворотке крови, чем те, у которых преэклампсия была умеренной.
12. Матриксная металлопротеиназа 2
Матриксная металлопротеиназа 2 (ММР-2) экспрессируется в мезенхимальных клетках (главным образом в фибробластах) в период развития и репарации ткани, а также синтезируется нейтрофилами, макрофагами и моноцитами. Имеются указания на то, что на развитие осложнений беременности, в том числе и ПЭ, влияет как избыточная продукция протеаз, так и их недостаточность. В ряде работ было показано, что уровень MMP-2 значительно выше в сыворотке крови женщин с ПЭ по сравнению с небеременными или при физиологически протекающей беременности.
13. Аполипопротеин Е
Одним из механизмов развития преэклампсии является нарушение метаболизма липидов, связанное с окислительным стрессом. Женщины с преэклампсией имеют аномальный липидный профиль с повышенными концентрациями липопротеинов, богатых триглицеридами, которые могут способствовать эндотелиальной дисфункции. Аполипопротеин Е (ApoE) является основным компонентом липопротеинов очень низкой плотности, роль которого заключается в изменении воспалительных реакций и удалении избыточного холестерина из кровообращения посредством регуляции поглощения в печени. Ген ApoE на 19-й хромосоме имеет 3 общих аллеля, кодирующих 3 изоформы ApoE в плазме: e2, e3 и e4. Было высказано предположение, что уровни ApoE и полиморфизмы его гена связаны с повышенным риском преэклампсии. Обнаружена более высокая частота аллеля ApoE e2 среди женщин с преэклампсией по сравнению с контрольной группой [57]. Эти данные не были подтверждены в других исследованиях [58, 59]. Роль данного направления исследований в прогнозировании преэклампсии в настоящее время считается неопределенной.
14. Внеклеточная ДНК
Фрагменты ДНК, циркулирующие вне клеток в межклеточной среде организма, называют внеклеточной ДНК (вкДНК) [60]. Существует несколько гипотез о происхождении вкДНК, основными из которых являются образование пула внеклеточных нуклеиновых кислот в результате гибели клеток (гипотеза клеточной гибели) и активная секреция ДНК живыми клетками (гипотеза метаболической ДНК) [61]. Повышенный интерес к вкДНК связан с возможностью ее использования в качестве маркера для диагностики. В составе вкДНК, выделенной из плазмы или периферической крови, обнаруживается ДНК плода (при беременности), что позволяет анализировать геном плода, не прибегая к биопсии.
Недавно была изучена связь между фетальной ДНК и преэклампсией. В группе пациенток с высоким риском развития преэклампсии наблюдалось более высокое содержание фетальной ДНК [62, 63]. Другие исследователи [64] наблюдали увеличение в 5 раз вкДНК плазмы у женщин с преэклампсией по сравнению с беременными контрольной группы. Из 13 исследований, в которых определяли количество внеклеточной ДНК для прогнозирования ПЭ, в 11 обнаружили более высокую вкДНК [65].
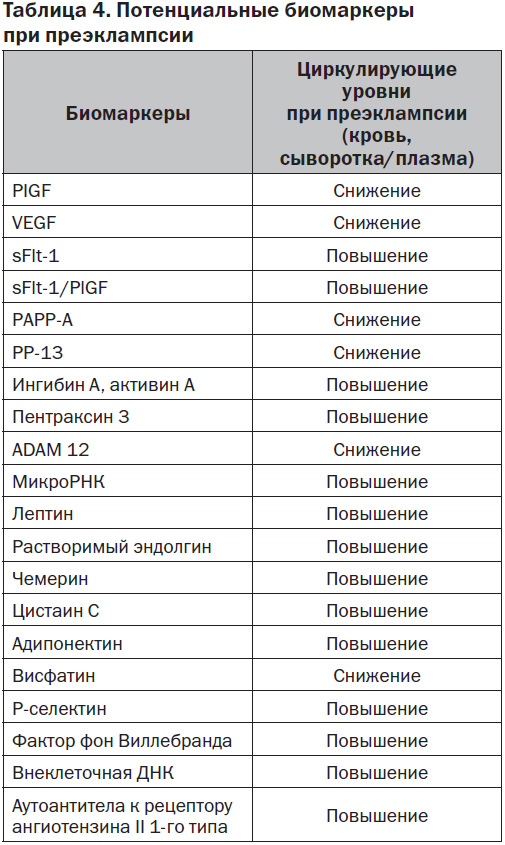
Таким образом, за последнее десятилетие появился целый ряд перспективных и интересных биохимических маркеров, которые могут быть использованы для своевременной и ранней диагностики группы риска, т.е. выявления беременных, у которых вероятность развития преэклампсии будет очень высокой (табл. 4).
Заключение
Преэклампсия — это сложное и специфическое заболевание при беременности, механизмы которого еще не полностью понятны. Считается, что центральным звеном ПЭ является системное повреждение эндотелия сосудов микроциркуляции с развитием эндотелиальной дисфункции. Однако эндотелиальная дисфункция регистрируется при многих соматических заболеваниях и патологических состояниях, таких как сахарный диабет, атеросклероз, сепсис, хронические заболевания почек, гиперлипидемия, артериальная гипертензия, легочная гипертензия и др. В связи с этим исследовано большое количество биохимических маркеров для прогнозирования ранней диагностики и оценки степени тяжести преэклампсии. Однако ни один из них официально не рекомендован к практическому применению в связи с достаточно низкой чувствительностью и специфичностью для преэклампсии. Более того, определение уровня лишь одного какого-либо маркера не позволяет получить полноценную информацию обо всех функциях эндотелия, нарушенных при преэклампсии в той или иной степени.
Результаты современных исследований свидетельствуют о том, что лучшей предсказательной ценностью обладает сочетание клинических данных и биохимических параметров. На сегодняшний день поиск как клинических данных, так и лучших по своей предсказательной ценности биомаркеров продолжается, оставаясь одной из главных тенденций научных исследований в акушерстве и гинекологии, учитывая тяжесть этого грозного осложнения беременности.
1. ACOG. ACOG practice bulletin. Diagnosis and ma-nagement of preeclampsia and eclampsia // Obstetrics and gynecology. — Jan 2002. — 99(1). — Р. 159-167.
2. Magee L.A., Pels A., Helewa M., Rey E., von Dadelszen P.; Group CHDoPW. Diagnosis, evaluation, and ma-nagement of the hypertensive disorders of pregnancy // Pregnancy hypertension. — 2014. — 4(2). — Р. 105-45.
3. WHO. The World Health Report 2005: Make every mother and child count. — Geneva. WHO, 2005.
4. Sibai B., Dekker G., Kupferminc M. Pre-eclampsia // Lancet. — 2005. — 365(9461). — Р. 785-99.
5. Ghulmiyyah L., Sibai B. Maternal mortality from preeclampsia/eclampsia // Seminars in perinatology. — 2012. — 36(1). — Р. 56-9.
6. Sween L.K., Althouse A.D., Roberts J.M. Early-pregnancy percent body fat in relation to preeclampsia risk in obese women // Am. J. Obstet. Gynecol. — 2014.
7. National Collaborating Centre for Women’s and Children’s Health (UK), Hypertension in Pregnancy: The Ma-nagement of Hypertensive Disorders During Pregnancy. — RCOG Press, London, UK, 2010.
8. World Health Organization, Department of Reproductive Health and Research, Department of Maternal, Newborn, Child and Adolescent Health, and Department of Nutrition for Health and Development, WHO Recommendations for Prevention and Treatment of Pre-Eclampsia and Eclampsia,World Health Organization, 2011.
9. Magee L.A., Helewa M., Moutquin J.M., von Dadelszen P. Diagnosis, evaluation, and management of the hypertensive disorders of pregnancy // Journal of Obstetrics & Gynaecology. — 2008. — Vol. 30, № 3 (suppl.). — Р. S1-S48.
10. American College of Obstetricians and Gynecologists, and Task Force on Hypertension in Pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists. Task Force on Hypertension in Pregnancy // Obstetrics and Gynecology. — 2013. — Vol. 122, № 5. — Р. 1122-1131.
11. Shenoy V. Preeclampsia: connecting angiogenic and metabolic pathways / V. Shenoy, K. Kanasaki, R. Kalluri // Trends Endocrinol. Metab. — 2010. — Vol. 21, № 9. — Р. 529-536.
12. Redman C.W. Placental stress and preeclampsia: a revised view / C.W. Redman, I.L. Sargent // Placenta. — 2009. — Vol. 30. — P. 38-42.
13. Roberts J.M. The Two Stage Model of Preeclampsia: Variations on the Theme / J.M. Roberts, C.A. Hubel // Placenta. — 2009. — Vol. 23. — P. 32-33.
14. Lee S.M. et al. Systemic inflammatory stimulation by microparticles derived from hypoxic trophoblast as a model for inflammatory response in preeclampsia // Am. J. Obstet. Gynecol. — 2012. — Vol. 207, № 4. — P. 337-346.
15. Harris L.K. Association of inflammatory cytokines, lipid peroxidation end products and nitric oxide with the clinical severity and fetal outcome in preeclampsia in Indian women // Indian J. Clin. Biochem. — 2014. — Vol. 29, № 2. — Р. 139-144.
16. Hyde C., Thornton S. Does screening for pre-eclampsia make sense? // BJOG. — 2013. — 120(10). — Р. 1168-70.
17. North R.A., McCowan L.M., Dekker G.A., Poston L., Chan E.H., Stewart A.W. et al. Clinical risk prediction for pre-eclampsia in nulliparous women: development of model in international prospective cohort // BMJ. — 2011. — 7(342). — d1875.
18. Сarty D., Delles C., Dominiczak A. Novel Biomar-kers for Predicting Preeclampsia // Cardiovasc. Med. — 2008. — 18. — Р. 186-194.
19. Pensée Wu, Caroline van den Berg, Zarko Alfirevic et al. Early Pregnancy Biomarkers in Pre-Eclampsia: A Systematic Review and Meta-Analysis // Int. J. Mol. Sci. — 2015. — 16. — Р. 23035-23056.
20. Ghosh S.K., Raheja S., Tuli A., Raghunandan C., Agarwal S. Can maternal serum placental growth factor estimation in early second trimester predict the occurrence of early onset preeclampsia and/or early onset intrauterine growth restriction? A prospective cohort study // J. Obstet. Gynaecol. Res. — 2013. — 39(5). — Р. 881-890.
21. McElrath T., Lim K., Pare E., Rich-Edwards J., Pucci D., Troisi R. et al. Longitudinal evaluation of predictive value for preeclampsia of circulating angiogenic factors through pregnancy // Am. J. Obstet. Gynecol. — 2012. — 207(5). — 407. — e1-e7.
22. De Falco S. The discovery of placenta growth factor and its biological activity// Experimantal and Molecular Medicine. — 2012. — Vol. 44, № 1. — P. 1-9.
23. Muy-Rivera M., Vadachkoria S., Woelk G.B
et al. Maternal Plasma VEGF, sVEGF-R1 and PlGF Concentrations in Preeclamptic and Normotensive Pregnant Zimbabwean Women // Physiol.Res. — 2005. — Vol. 54. — P. 611-622.
24. Chappell L.C., Duckworth S., Seed P.T., Griffin M., Myers J., Mackillop L. et al. Diagnostic Accuracy of Placental Growth Factor in Women With Suspected Preeclampsia: A Prospective Multicenter Study // Circulation. — 2013. — 128(19). — Р. 2121-2131.
25. Kar M. Role of biomarkers in early detection of preeclampsia // J. Clin. Diagn. Res. — 2014. — 8. — BE01-4.
26. Levine R.J., Maynard S.E., Qian C., Lim K.H., England L.J., Yu K.F. Circulating angiogenic factors and the risk of preeclampsia // N. Engl. J. Med. — 2004. — 350. — Р. 672-83.
27. Maynard S.E., Min J.Y., Merchan J., Lim K.H., Li J., Mondal S. Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia // J. Clin. Invest. — 2003. — 111. — Р. 649-58.
28. Verlohren S. et al. The sFlt-1/PlGF ratio in different types of hypertensive pregnancy disorders and its prognostic potential in preeclamptic patients // Am. J. Obstet. Gynecol. — 2012. — Vol. 206. — P. 58.
29. Rana S. et al. Clinical characterization and outcomes of preeclampsia with normal angiogenic profile // Hypert. Pregn. — 2013. — Vol. 32(2). — P. 189-201.
30. Verlohren S. et al. An automated method for the determination of the sFlt-1/PIGF ratio in the assessment of preeclampsia // Am. J. Obstet. Gynecol. — 2010. — Vol. 202(161). — P. 1-11.
31. Verlohren S., Herraiz I., Lapaire O., Schlembach D., Zeisler H., Calda P. et al. New gestational phase-specific cutoff values for the use of the soluble fms-like tyrosine kinase-1/placental growth factor ratio as a diagnostic test for pre-eclampsia // Hypertension. — 2014. — 63(2). — Р. 346-52.
32. Rana S., Powe C.E., Salahuddin S., Verlohren S., Perschel F.H., Levine R.J. et al. Angiogenic factors and the risk of adverse outcomes in women with suspected preeclampsia // Circulation. — 2012. — 125. — Р. 911-9.
33. NICE Guidance. PlGF-based testing to help diagnose suspected pre-eclampsia (Triage PlGF test, Elecsys immunoassay sFlt-1/PlGF ratio, DELFIA Xpress PlGF 1-2-3 test, and BRAHMS sFlt-1 Kryptor/BRAHMS PlGF plus Kryptor PE ratio) // Diagnostics Guidance. — 2016. — 23.
34. Mutter W.P., Karumanchi S.A. Molecular mechanisms of preeclampsia // Microvas. Res. — 2008. — 75. — Р. 1-8.
35. Robinson C.J., Johnson D.D. Soluble endoglin as a second-trimester marker for preeclampsia // Am. J. Obstet. Gynecol. — 2007. — 197(2). — 174. — e1-5.
36. Bersinger N.A., Smarason A.K., Muttukrishna S. Women with preeclampsia have increased serum levels of pregnancy-associated plasma protein A (PAPP-A), inhibin A, activin A, and soluble E-selectin // Hypertens. Pregnancy. — 2003. — 22. — Р. 45-55.
37. Yaron Y., Heifetz S., Ochshorn Y., Lehavi O., Orr-Urteger A. Decreased first trimester PAPP-A is a predictor of adverse pregnancy outcome // Prenat. Diagn. — 2002. — 22. — Р. 778-82.
38. Poon L.C. et al. First-trimester maternal serum pregnancy-associated plasma protein-A and preeclampsia // Ultrasound Obstet. Gynecol. — 2009. — Vol. 33. — P. 23-33.
39. Poon L.C. et al. Hypertensive disorders in pregnancy: Screening by biophysical and biochemical markers at 11–13 weeks / L.C. Poon [et al.] // Ultrasound Obstet. Gynecol. — 2010. — Vol. 35. — P. 662-670.
40. Akolekar R. et al. Prediction of early, intermediate and late preeclampsia from maternal factors, biophysical and biochemical markers at 11–13 weeks // Prenat. Diagn. — 2011. — Vol. 31. — P. 66-74.
41. Spencer К. et al. First-trimester maternal serum PP-13, PAPP-A and second-trimester uterine artery Doppler pulsatility index as markers of preeclampsia // Ultrasound Obstet. Gynecol. — 2007. — Vol. 29, № 2. — P. 128-134.
42. Khalil А. et al. First trimester maternal serum placental protein 13 for the prediction of preeclampsia in women with a priori high risk // Prenat. Diagn. — 2009. — Vol. 29, № 8. — P. 781-789.
43. Muttukrishna S., North R.A., Morris J. Serum inhibin A and activin A are elevated prior to the onset of pre-eclampsia // Hum. Reprod. — 2000. — 15. — Р. 1640-5.
44. Muttukrishna S., Knight P.G., Groome N.P. Activin A and inhibin A as possible endocrine markers for pre-eclampsia // Lancet. — 1997. — 349. — Р. 1285-8.
45. Mandang S., Maneulpillai U., Wallace E.M. Oxidative stress increases placental and endothelial cell activin A secretion // J. Endocrinol. — 2007. — 192. — Р. 485-93.
46. Souza D.G., Soares A.C., Pinho V., Torloni H., Reis L.F., Teixeira M.M. et al. Increased mortality and inflammation in tumor necrosis factorstimulated gene-14 transgenic mice after ischemia and reperfusion injury // Am. J. Pathol. — 2002. — 160. — Р. 1755-65.
47. Cetin I., Cozzi V., Pasqualini F., Nebuloni M., Garlanda C., Vago L. et al. Elevated maternal levels of the long pentraxin 3 (PTX3) in preeclampsia and intrauterine growth restriction // Am. J. Obstet. Gynecol. — 2006. — 194. — Р. 1347-53.
48. Spencer K. ADAM12 sin maternal serum as a potential marker of pre-eclampsia / K. Spencer, N.J. Cowans, A. Stamatopoulou // Prenat. Diagn. — 2008. — Vol. 28. — P. 212-216.
49. Li H. Maternal plasma miRNAs expression in preeclamptic pregnancies / H. Li, Q. Ge, L. Guo, Z. Lu // BioMed Research. Intern. — 2013. — Vol. 2013. — P. 9.
50. Sharma A., Satyam A., Sharma J.B. Leptin, il-10 and inflammatory markers (tnf-alpha, il-6 and il-8) in pre-eclamptic, normotensive pregnant and healthy non-pregnant women // Am. J. Reprod. Immunol. — 2007. — Vol. 58. — P. 21-30.
51. Herse F. et al. Circulating and uteroplacental adipocytokine concentrations in preeclampsia // Reprod. Sci. — 2009. — Vol. 16. — P. 584-590.
52. Stepan H. et al. Serum levels of the adipokine cheme-rin are increased in preeclampsia during and 6 months after pregnancy / Regul. Pept. — 2011. — Vol. 168. — P. 69-72.
53. Duan D.M. et al. Serum levels of the adipokine chemerin in preeclampsia // J. Perinat. Med. — 2012. — Vol. 40. — P. 121.
54. Thilaganathan B. et al. Raised maternal serum cystatin C: an early pregnancy marker for preeclampsia / Reprod. Sci. — 2009. — Vol. 16. — P. 788-793.
55. Nakatsukasa H., Masuyama H., Takamoto N., Hiramatsu Y. Circulating leptin and angiogenic factors in preeclampsia patients // Endocr. J. — 2008. — Vol. 55. — P. 565-557.
56. Hu W. et al. Serum visfatin levels in late pregnancy and pre-eclampsia // Acta Obstet. Gynecol. Scand. — 2008. — Vol. 87. — P. 413-418.
57. Nagy B., Rigo J., Fintor L. Apolipoprotein E alleles in women with severe pre-eclampsia // J. Clin. Pathol. — 1998. — 51. — Р. 324-325.
58. Makkonen N., Heinonen S., Hiltunen M. et al. Apolipoprotein E alleles in women with pre-eclampsia // J. Clin. Pathol. — 2001. — 54. — Р. 652-654.
59. Belo L., Gaffney D., Caslake M. et al. Apolipoprotein E and cholesteryl ester transfer protein polymorphisms in normal and preeclamptic pregnancies // Eur. J. Obstet. Gynecol. Reprod. Biol. — 2004. — 112. — Р. 9-15.
60. Galeazzi M. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders / M. Galeazzi, G. Morozzi, M. Piccini, J. Chen, F. Bellisai, S. Fineschi, R. Marcolongo // Autoimmun. Rev. — 2003. — Vol. 2, № 1. — P. 50-55.
61. Pisetsky D.S. The origin and properties of extracellular DNA: from PAMP to DAMP / D.S. Pisetsky // Clin. Immunol. — 2012. — Vol. 144. — P. 32-40.
62. Scharfe-Nugent A., Corr S.C., Carpenter S.B., Keogh L., Doyle B., Martin C. et al. TLR9 provokes inflammation in response to fetal DNA: mechanism for fetal loss in preterm birth and preeclampsia // J. Immunol. — 2012. — 188. — Р. 5706-12.
63. Miranda M.L., Macher H.C., Muñoz Hernández R., Vallejo-Vaz A., Moreno-Luna R., Villar J. et al. Role of circulating cell-free DNA levels in patients with severe preeclampsia and HELLP syndrome // Am. J. Hypertens. — 2013. — 26. — Р. 1377-80.
64. Lo Y.M., Leung T.N., Tein M.S., Sargent I.L., Zhang J., Lau T.K. et al. Quantitative abnormalities of fetal DNA in maternal serum in preeclampsia // Clin. Chem. — 1999. — 45. — Р. 184-8.
65. Martin A., Krishna I., Badell M., Samuel A. Can the quantity of cell-free fetal DNA predict preeclampsia: a systematic review // Prenat. Diagn. — 2014. — 34. — Р. 685-91.