Газета «Новости медицины и фармации» №7 (694), 2019
Вернуться к номеру
Особливості лікування запальних захворювань органів малого таза в жінок із коморбідністю: аналіз актуальних протоколів і оригінальних досліджень
Авторы: Татарчук Т.Ф., д.м.н., професор, завідувач відділення ендокринної гінекології, заступник директора з наукової роботи
Тутченко Т.М., к.м.н., старший науковий співробітник відділення ендокринної гінекології
ДУ «Інститут педіатрії, акушерства та гінекології НАМН України», м. Київ, Україна
Рубрики: Акушерство и гинекология, Урология
Разделы: Справочник специалиста
Версия для печати
Запальні захворювання органів малого таза (ЗЗОМТ) залишаються актуальною проблемою сучасної гінекології з огляду на їх значну поширеність (до 60 % причин звернень до гінеколога), клінічно значущі наслідки (неплідність, хронічні тазові болі), а також зміну складу й вірулентності збудників.
Зростання поширеності антибіотикорезистентності як патогенної, так і умовно-патогенної флори, а також станів макроорганізму, що сприяють персистенції патогенів, виводить проблему лікування ЗЗОМТ на новий рівень.
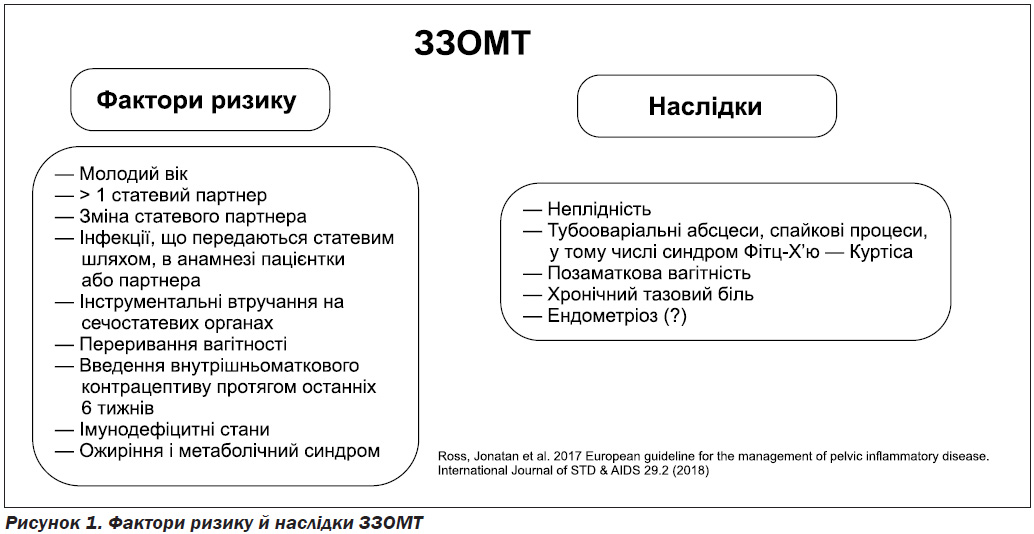
Відомо, що ЗЗОМТ, особливо за умови пізно розпочатої і/або субоптимальної терапії, призводять до серйозних наслідків: у 10–20 % випадків розвивається неплідність, у 40 % — синдром хронічного тазового болю, у 10 % — позаматкова вагітність (рис. 1) [1]. Нещодавно виникла теорія про можливий мікробний генез ендометріозу [2–4].
Симптоми ЗЗОМТ можуть варіювати від виражених (больовий синдром, гнійні виділення, гіпертермія, метрорагія) до асимптомних форм [1].
Останніми роками зареєстроване значне зростання стертих форм сальпінгоофоритів, клінічні прояви яких обмежуються помірними слизово-гнійними білями, помірними болями в нижніх відділах живота, порушеннями циклу, субфебрильною температурою.
З огляду на складнощі клінічної діагностики ЗЗОМТ ще у 2015 році в рекомендаціях Центру з контролю і запобігання захворюванням (Centre of Disease Сontrole and Prevention) були виділені мінімальні діагностичні критерії ЗЗОМТ, до яких належать:
— болючість при пальпації нижньої частини живота;
— болючість при пальпації ділянки придатків;
— болючість при тракціях за шийку матки [5].
Підвищена температура тіла, патологічні виділення з шийки матки або піхви, підвищення швидкості осідання еритроцитів і С-реактивного білка, а також лабораторне підтвердження цервікальної інфекції, викликаної гонококами, трихомонадами, хламідіями тощо, є додатковими критеріями ЗЗОМТ.
Важливим моментом є те, що відповідність малим діагностичним критеріям є підставою для ініціації емпіричної антибактеріальної терапії.
Симптоми ЗЗОМТ можуть бути ізольованими або поєднаними з декількома іншими [1, 6]. Незважаючи на слабко виражені симптоми, такі форми ЗЗОМТ теж призводять до негативних наслідків щодо фертильності й розвитку хронічних тазових болів [1].
Особливості ЗЗОМТ сьогодні:
— переважання умовно-патогенної вагінальної флори й набуття нею значної вірулентності;
— зростання частоти антибіотикорезистентних форм облігатних і умовно-патогенних збудників;
— зростаня частоти стертих, малосимптомних форм.
Основним механізмом розвитку ЗЗОМТ є висхідна інфекція: ендоцервіцит, ендометрит, сальпінгіт, параметрит, оофорит, тубооваріальний абсцес, пельвіоперитоніт [1].
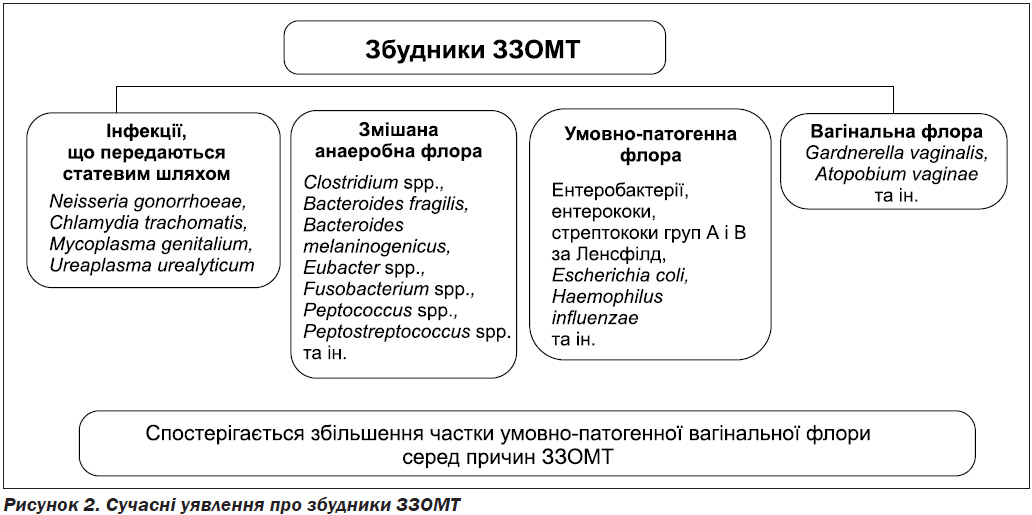
Neisseria gonorrhoeae, Chlamydia trachomatis і Mycoplasma genitalium все ще розглядаються як найпоширеніші збудники ЗЗОМТ (рис. 2) [1, 5, 7]. Проте останнім часом з’являється все більше даних про переважання форм ЗЗОМТ, спричинених вагінальною умовно-патогенною флорою (рис. 2) [6]. Переважання тих чи інших збудників, а також їх чутливість до антибіотиків залежить від географічного регіону, що має бути враховано при обранні терапії [8].
Окрім добре відомих факторів ризику ЗЗОМТ і їх рецидивного перебігу (велика кількість статевих партнерів, перенесені інфекції, що передаються статевим шляхом (ІПСШ), внутрішньоматкові втручання тощо) (рис. 1), є і менш відомі, проте досить потужні, такі як коморбідність у формі ожиріння й метаболічного синдрому (МС) [9–11].
Клінічні настанови з діагностики й лікування ЗЗОМТ
У 2017 році в International Journal of STD & AIDS були опубліковані клінічні настанови з менеджменту ЗЗОМТ, у яких подані основані на доказах рекомендації щодо діагностики й лікування [12]. На цьому документі основані опубліковані в 2018 і 2019 роках клінічні настанови NICE (National Institute of Health and Care Excellence) і Національного коледжу акушерства та гінекології Франції. Відповідно до зазначених рекомендацій, основними положеннями щодо діагностики є такі:
— усім пацієнткам із ЗЗОМТ необхідно рекомендувати обстеження на Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma genitalium, сифіліс і ВІЛ (рівень доказовості IV, C);
— у той же час відсутність поширених ІПСШ не виключає можливість ЗЗОМТ, викликаних умовно-патогенними мікроорганізмами;
— рівень С-реактивного білка і лейкемія можуть використовуватись у діагностиці ЗЗОМТ, проте цей маркер є неспецифічним. При ЗЗОМТ із легким або помірної тяжкості перебігом рівень може залишатись у межах норми;
— ультразвукове дослідження корисне в діагностиці тубооваріальних утворень. З цією ж метою, а також для діагностики інших причин пельвіоперитоніту можуть використовуватись магнітно-резонансна і комп’ютерна томографія;
— не рекомендується рутинне використання біопсії ендометрія;
— у пременопаузальних жінок необхідно виключити вагітність.
Терапія ЗЗОМТ має охоплювати поширені збудники інфекцій, що належать до ІПСШ, а також аеробний і анаеробний компоненти полімікробної флори [12]. Відповідно до даних кохранівського огляду 2019 року, немає даних щодо того, який режим антибактеріальної чи протимікробної терапії є найкращим [13].
Алгоритми терапії ЗЗОМТ згідно з клінічними настановами 2017–2019 рр. подані на рис. 3.
Особливості ЗЗОМТ у жінок із коморбідністю — ожирінням і метаболічним синдромом, досвід лікування ЗЗОМТ у цього контингенту
Метаболічний синдром — кластер кардіометаболічних факторів, що мають сильний зв’язок з ризиком виникнення тяжких хронічних захворювань [14, 15]. На жаль, незважаючи на зусилля з боку інститутів організації охорони здоров’я, державних органів і громадських організацій, поширеність МС продовжує зростати в усьому світі [14].
Згідно з даними різних авторів, поширеність МС становить 10–84 % і залежить від статі, віку, етнічної належності й використаних критеріїв діагностики [16–18].
Діагностичні критерії AHA/NHBLI (2009) увійшли в літературу як «гармонізовані» (harmonized), вони включають такі:
— збільшення окружності талії (≥ 88 см для жінок європейської популяції);
— підвищення тригліцеридів або гіполіпідемічна терапія (≥ 150 мг/дл (1,7 ммоль/л));
— зниження холестерину ліпопротеїдів високої щільності або гіполіпідемічна терапія (40 мг/дл (< 50 мг/дл (1,3 ммоль/л) у жінок));
— підвищений артеріальний тиск (АТ) або гіпотензивна терапія артеріальної гіпертензії (систолічний АТ ≥ 130 мм рт.ст. і/або діастолічний АТ ≥ 85 мм рт.ст.);
— підвищений рівень глюкози натще або гіпоглікемічна терапія (≥ 5,6 ммоль/л).
Для встановлення діагнозу МС необхідна відповідність будь-яким трьом із п’яти вищезазначених критеріїв [19].
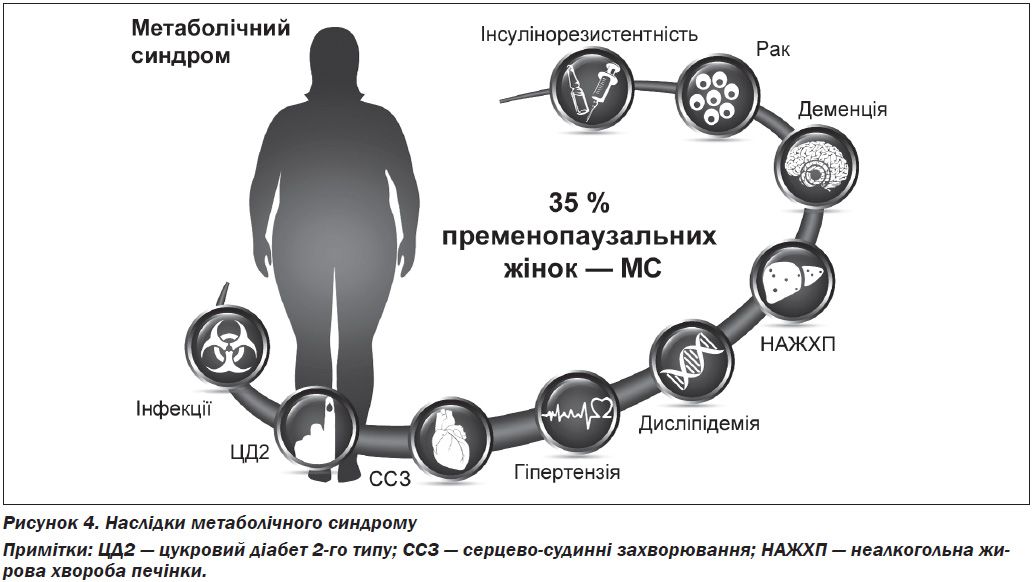
Останнім часом з’являється все більше даних щодо ширших наслідків ожиріння та МС, які включають зміни імунореактивності і пов’язані з ними ризики тяжкого перебігу інфекційних хвороб і онкологічні ризики (рис. 4).
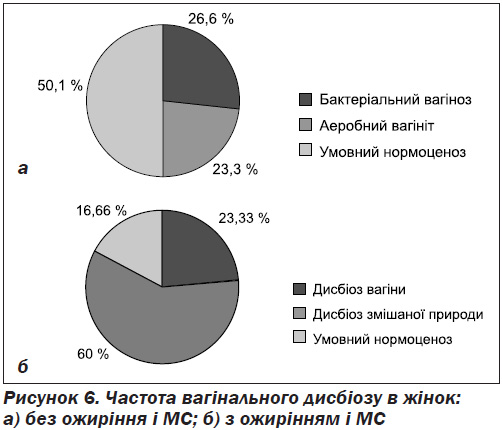
У дослідженні Ashrafian жінки з індексом маси тіла (ІМТ) > 30 мали вдвічі вищий ризик розвитку тубооваріальних абсцесів при ЗЗОМТ [10]. У великому кроссекційному дослідженні 5918 жінок із когорти CHOICE Project було продемонстровано, що жінки з ожирінням значно частіше мали вагінальний дисбіоз за критеріями Nugent [9]. Велике когортне дослідження в Данії показало більшу частоту інфекційно-запальних захворювань загалом у жінок з ожирінням і метаболічним синдромом [11]. Механізми, що сприяють більшій кількості й тяжкості запальних процесів при ожирінні та МС, достеменно невідомі. Найбільш вірогідно описано явище впливу адипоцитокінів на функцію імунних клітин, інсулінорезистентність й гіперінсулінемію.
У відділі репродуктивного здоров’я ДНУ «Центр інноваційних медичних технологій (ЦІМТ) НАНУ» було обстежено 60 жінок репродуктивного віку (середній вік 36,5 року) з ожирінням (ІМТ > 30) і метаболічним синдромом за критеріями 2009 р. [19], у яких протягом останніх 12 місяців мали місце 2 та більше клінічних епізоди ЗЗОМТ. Також було обстежено 30 жінок, порівнянних за віком (середній вік 36,2 року), соціоекономічними характеристиками і симптомами ЗЗОМТ, з ІМТ< 30 без жодних ознак МС (група порівняння).
Було проведене обстеження відповідно до клінічних настанов 2017 European guideline for the management of pelvic inflammatory disease: мікроскопічне дослідження вагінальних виділень з оцінкою ознак бактеріального вагінозу (Nugent score), визначення наявності Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma genitalium, Ureaplasma urealyticum методом полімеразної ланцюгової реакції, культуральне дослідження широкого спектра аеробних і анаеробних умовно-патогенних мікроорганізмів відповідно до настанов IDSA 2019 [8].
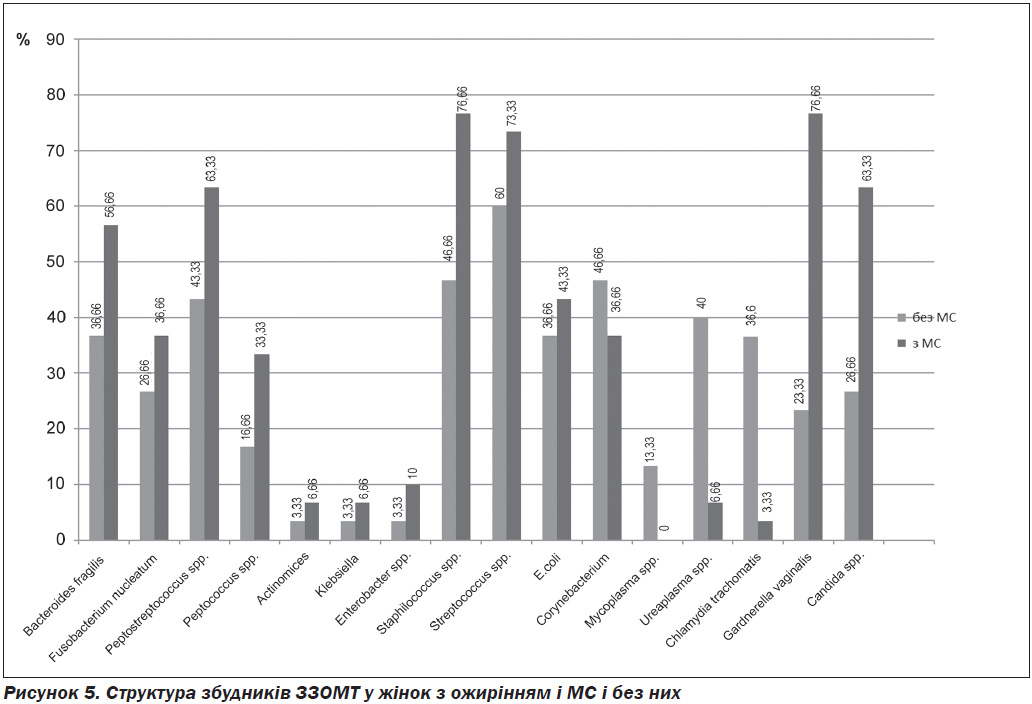
Результати обстеження показали значно більшу частоту бактеріального вагінозу й аеробного вагініту в жінок з ожирінням і МС, а також переважання в них змішаної патогенної та умовно-патогенної флори в поєднанні з низькою частотою ІПСШ (рис. 5, 6).
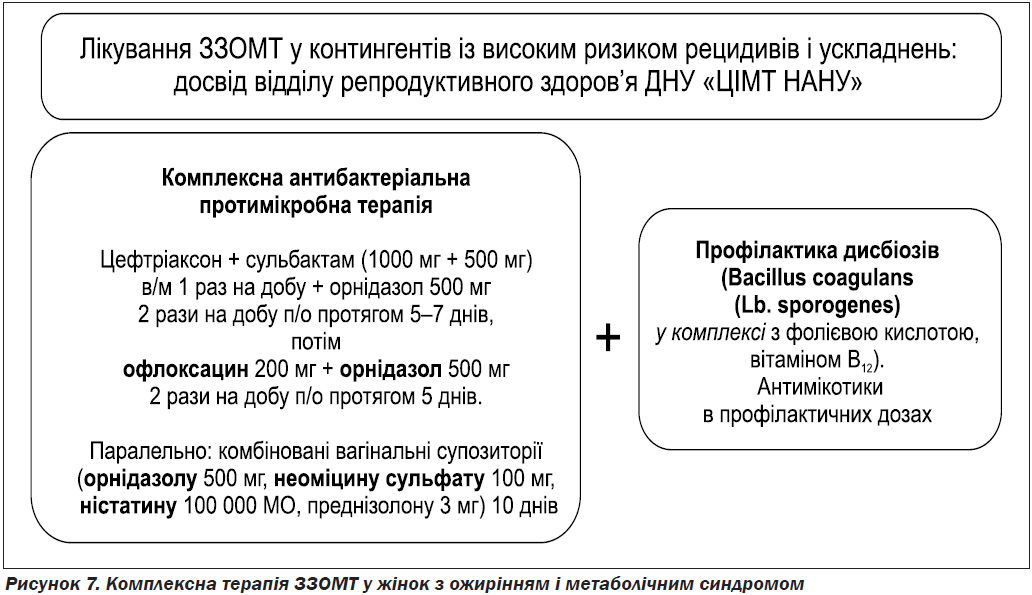
Зважаючи на виявлені особливості етіології ЗЗОМТ у жінок з ожирінням і МС, логічно припустити, що вони потребують відмінної від стандартної антибактеріальної терапії. Для перевірки цієї теорії жінки із ЗЗОМТ на фоні ожиріння та МС були рандомізовані на 2 групи лікування. Група І (n = 30) отримувала посилену терапію: цефтріаксон + сульбактам (Сульбактомакс,1000 мг + 500 мг) в/м 1 раз на добу + орнідазол 500 мг (Мератин) 2 рази на добу п/о протягом 5–7 днів, потім офлоксацин 200 мг + орнідазол 500 мг (Тифлокс) 2 рази на добу п/о протягом 5 днів, паралельно — комбіновані вагінальні супозиторії орнідазолу 500 мг, неоміцину сульфату 100 мг, ністатину 100 000 МО, преднізолону 3 мг (Мератин Комбі) 10 діб по одному супозиторію на ніч з подальшою реабілітацією кишкової та вагінальної мікрофлори (Лактовіт Форте, по 1 капсулі 2 рази на добу протягом 4 тижнів) і стандартною профілактикою дріжджової інфекції (рис. 7).
Сульбактомакс було обрано свідомо, як цефтріаксон, дія якого посилена сульбактамом, що забезпечує його підвищені антибіотикорезистентні властивості. Сульбактам є необоротним інгібітором більшості основних бета-лактамаз, що продукуються пеніцилінрезистентними мікроорганізмами. Саме тому бактерії проявляють підвищену чутливість до комбінації цефтріаксону із сульбактамом порівняно з монопрепаратом бета-лактамного антибіотика.
Група ІІ отримувала стандартну терапію згідно з європейськими клінічними настановами 2017 року (цефтріаксон в/м 500 мг, потім доксициклін п/о 100 мг + метронідазол 500 мг 2 рази на день протягом 14 днів).
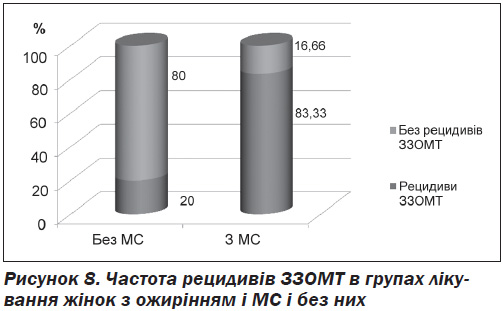
У результаті лікування в обох групах спостерігалось зменшення симптомів ЗЗОМТ, проте спостереження після лікування протягом 6 місяців з метою оцінки частоти рецидивів ЗЗОМТ показало їх значно нижчу частоту в групі І, яка отримувала посилену терапію, порівняно з групою ІІ, яка отримувала стандартну терапію (рис. 8).
Отже, запропонована посилена схема комплексної терапії (рис. 7) показала не лише високу ефективність у контексті усунення симптомів ЗЗОМТ, а й значно кращу ефективність щодо профілактики рецидивів порівняно зі стандартною терапією.
Висновки
Аналіз сучасних літературних даних і власних оригінальних досліджень демонструє значні відмінності клінічного перебігу й структури збудників ЗЗОМТ у жінок із коморбідністю, зокрема з ожирінням і метаболічним синдромом.
Вищезазначене обумовлює доцільність використання нестандартних схем емпіричної антибактеріальної та протимікробної терапії в даного контингенту для запобігання хронічно-рецидивному перебігу, віддаленим ускладненням і розвитку антибіотикорезистентності.
1. Brunham R.C., Gottlieb S.L., Paavonen J. Pelvic Inflammatory Disease. N. Engl. J. Med. May 2015. Vol. 372. № 21. Р. 2039-2048,.
2. Moreno I., Franasiak J.M. Endometrial microbiota — new player in town. Fertil. Steril. Jul. 2017. Vol. 108. № 1. Р. 32-39.
3. Khan K.N. et al. Bacterial contamination hypothesis: a new concept in endometriosis. Reprod. Med. Biol. Apr. 2018. Vol. 17. № 2. Р. 125-133.
4. Tai F.-W. et al. Association of Pelvic Inflammatory Disease with Risk of Endometriosis: A Nationwide Cohort Study Involving 141,460 Individuals. J. Clin. Med. Oct. 2018. Vol. 7. № 11. Р. 379.
5. Workowski K.A., Bolan G.A., and Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2015. MMWR. Recomm. reports Morb. Mortal. Wkly. report. Recomm. Reports. Jun. 2015. Vol. 64. № RR-03. Р. 1-137.
6. Haggerty C.L. et al. Identification of novel microbes associated with pelvic inflammatory disease and infertility. Sex. Transm. Infect. Sep. 2016. Vol. 92. № 6. Р. 441-6.
7. Soper D.E., Brockwell N.J., Dalton H.P., Johnson D. Observations concerning the microbial etiology of acute salpingitis. Am. J. Obstet. Gynecol. Apr. 1994. Vol. 170. № 4. Р. 1008-1017.
8. Miller J.M. et al. A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2018 Update by the Infectious Diseases Society of America and the American Society for Microbiologya. Clin. Infect. Dis. Aug. 2018. Vol. 67. № 6. Р. 813-816
9. Kaspersen K.A. et al. Obesity and Risk of Infection. Epidemiology. Jul. 2015. Vol. 26. № 4. Р. 580-589.
10. Ashrafian S., Uyar D. Impact of BMI on Pelvic Inflammatory Disease [32Q]. Obstet. Gynecol. May 2018. Vol. 131. Р. 192S-193S.
11. Brookheart R.T., Lewis W.G., Peipert J.F., Le–wis A.L., Allsworth J.E. Association between obesity and bacterial vaginosis as assessed by Nugent score. Am. J. Obstet. Gynecol. May 2019. Vol. 220. № 5. Р. 476.e1-476.e11.
12. Ross J., Guaschino S., Cusini M., Jensen J. 2017 European guideline for the management of pelvic inflammatory disease. Int. J. STD AIDS. Feb. 2018. Vol. 29. № 2. Р. 108-114.
13. Savaris R.F., Fuhrich D.G., Duarte R.V., Franik S., Ross J.D.C. Antibiotic therapy for pelvic inflammatory di-sease: an abridged version of a Cochrane systematic review and meta-analysis of randomised controlled trials. Sex. Transm. Infect. Feb. 2019. Vol. 95. № 1. Р. 21-27.
14. Pucci G., Alcidi R., Tap L., Battista F., Mattace-Raso F., Schillaci G. Sex- and gender-related prevalence, cardiovascular risk and therapeutic approach in metabolic syndrome: A review of the literature. Pharmacol. Res. Jun. 2017. Vol. 120. Р. 34-42.
15. O’Neill S., O’Driscoll L. Metabolic syndrome: a closer look at the growing epidemic and its associated pathologies. Obes. Rev. Jan. 2015. Vol. 16. № 1. Р. 1-12.
16. Alexander C.M., Landsman P.B., Teutsch S.M., Haffner S.M., Third National Health and Nutrition Exa-mination Survey (NHANES III), and National Cho-lesterol Education Program (NCEP). NCEP-Defined Metabolic Syndrome, Diabetes, and Prevalence of Coronary Heart Disease Among NHANES III Participants Age 50 Years and Older. Diabetes. May 2003. Vol. 52. № 5. Р. 1210-1214.
17. Ritchie S.A., Connell J.M.C. The link between abdominal obesity, metabolic syndrome and cardiovascular disease. Nutr. Metab. Cardiovasc. Dis. May 2007. Vol. 17. № 4. Р. 319-326.
18. Desroches S., Lamarche B. The evolving definitions and increasing prevalence of the metabolic syndrome. Appl. Physiol. Nutr. Metab. Feb. 2007. Vol. 32. № 1. Р. 23-32.
19. Alberti K.G.M.M. et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. Oct. 2009. Vol. 120. № 16. Р. 1640-5.