Журнал «Медицина неотложных состояний» №5(100), 2019
Вернуться к номеру
Динаміка маркерів автоімунної відповіді організму на маркери порушення нервової системи як реакція хворих на проведене оперативне втручання з використанням штучного кровообігу
Авторы: Хижняк К.А.(1, 2), Волкова Ю.В.(1), Шарлай К.Ю.(1)
(1) — Харківський національний медичний університет, м. Харків, Україна
(2) — Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Проблема ускладнень з боку центральної нервової системи в структурі кардіохірургічних ускладнень досі залишається актуальною. Тому мета цього дослідження — аналіз динаміки маркерів автоімунної відповіді організму на маркери порушення нервової системи як реакція хворих на проведене оперативне втручання з використанням штучного кровообігу (ШК). Матеріали та методи. В основі даного дослідження лежить аналіз результатів дослідження 118 хворих з хірургічною патологією аорти (ХПА). Пацієнти були розподілені на 2 групи за принципом застосування в складі інтенсивної терапії (ІТ) додаткових речовин. До групи І увійшли 46 пацієнтів, яким додатково до алгоритму ІТ було призначено розчин меглюміну натрію сукцинат (реамберин). До групи ІІ ввійшли 46 пацієнтів, яким додатково до алгоритму ІТ було призначено розчин D-фруктозо-1,6-дифосфат натрієвої солі гідрат (езафосфіна). Контрольну групу (К) становили 26 пацієнтів, які мали хірургічну патологію аорти, за всіма критеріями співпадали із пацієнтами групи І і ІІ, але не мали в складі ІТ додаткового призначення речовин з метою профілактики післяопераційної когнітивної дисфункції. Для вивчення автоімунної відповіді визначали рівні автоантитіл до мозкових антигенів (основного білка мієліну (ОБМ), кальційзв’язуючого білка S-100, нейроспецифічної енолази (НСЕ) та загального людського мозкового антигена (ЗЛМА)) у сироватці крові методом імуноферментного аналізу за день перед операцією і на 1-шу, 3-тю, 7-му і 14-ту добу після оперативного втручання. Результати. Виявлено, що сам по собі факт анестезіологічного забезпечення з використанням ШК негативно впливає на стан головного мозку в цілому. Це доведено динамікою показників А-ОБМ, А-S-100, А-НСЕ й А-ЗЛМА у хворих групи К, тобто без призначення додатково до чинного протоколу речовин з метою протидії наслідкам ШК. Зміни досліджуваних нами автоантитіл, які відповідають за різні гістолого-функціональні структури головного мозку, можна пояснити загальною реакцією організму на фізичні умови ШК. Але визначення найвпливовішого компонента штучної перфузії на функціональний стан головного мозку пацієнтів, який не залежить від вихідного їх стану, але є відмінним від стартового рівня імунних показників, ще потребує подальшого дослідження. Висновки. Таким чином, можна відзначити, що призначення розчину D-фруктозо-1,6-дифосфат натрієвої солі гідрат (езафосфіна) найбільш позитивно впливає на функціональний стан клітин, що відповідають за когнітивні функції пацієнтів з ХПА.
Актуальность. Проблема осложнений со стороны центральной нервной системы в структуре кардиохирургических осложнений по-прежнему остается актуальной. Поэтому цель данного исследования — анализ динамики маркеров аутоиммунного ответа организма на маркеры нарушения нервной системы как реакция больных на проведенное оперативное вмешательство с использованием искусственного кровообращения (ИК). Материалы и методы. В основе данного исследования лежит анализ результатов исследования 118 больных с хирургической патологией аорты (ХПА). Пациенты были разделены на 2 группы по принципу применения в составе интенсивной терапии (ИТ) дополнительных веществ. В группу I вошли 46 пациентов, которым дополнительно к алгоритму ИТ был назначен раствор меглюмина натрия сукцинат (реамберин). В группу II вошли 46 пациентов, которым дополнительно к алгоритму ИТ был назначен раствор D-фруктозо-1,6-дифосфат натриевой соли гидрат (эзафосфина). Контрольную группу (К) составили 26 пациентов с хирургической патологией аорты, которые по всем критериям совпадали с пациентами группы I и II, но не имели в составе ИТ дополнительного назначения веществ с целью профилактики послеоперационной когнитивной дисфункции (ПКД). Для изучения аутоиммунного ответа определяли уровни аутоантител к мозговым антигенам (основного белка миелина (ОБМ), кальцийсвязывающего белка S-100, нейроспецифической энолазы (НСЭ) и общего человеческого мозгового антигена (ОЧМА)) в сыворотке крови методом иммуноферментного анализа за день перед операцией и на 1-е, 3-и, 7-е и 14-е сутки после оперативного вмешательства. Результаты. Выявлено, что сам по себе факт анестезиологического обеспечения с использованием ИК негативно влияет на состояние головного мозга в целом. Это доказано динамикой показателей А-ОБМ, А-S-100, А-НСЭ и А-ОЧМА у больных группы К, то есть без назначения дополнительно к действующему протоколу веществ с целью противодействия последствиям ИК. Изменения исследуемых нами аутоантител, которые отвечают за различные гистолого-функциональные структуры головного мозга, можно объяснить общей реакцией организма на физические условия ИК. Но определение самого влиятельного компонента искусственной перфузии на функциональное состояние головного мозга пациентов, который не зависит от исходного их состояния, но отличается от стартового уровня иммунных показателей, еще требует дальнейшего исследования. Выводы. Таким образом, можно отметить, что назначение раствора D-фруктозо-1,6-дифосфат натриевой соли гидрат (эзафосфина) наиболее положительно влияет на функциональное состояние клеток, отвечающих за когнитивные функции пациентов с ХПА.
Background. The problem of central nervous system disorders in the structure of cardiac surgical complications remains relevant. Therefore, the purpose of this study is to analyze the dynamics of markers of the autoimmune response of the body to markers of nervous system disorders as a reaction of patients to surgical intervention performed using cardiopulmonary bypass (CPB). Materials and methods. The basis of this study is the analysis of the results of a survey of 118 patients with surgical aortic pathology. The patients were divided into 2 groups according to the principle of using additional substances as a part of intensive care (IC). Group I consisted of 46 patients who, in addition to the IC algorithm, received meglumine sodium succinate solution (reamberin). Group II included 46 persons who, in addition to the IC algorithm, received a solution of D-fructose-1,6-diphosphate sodium salt hydrate (esafosfina). The control group consisted of 26 patients who had surgical aortic pathology and the same criteria as patients of groups I and II, but they did not received additional supplements in IC for the purpose of preventing postoperative cognitive dysfunction. To study the autoimmune response, serum levels of autoantibodies to brain antigens (myelin basic protein (MBP), S-100 calcium binding protein, neuron-specific enolase (NSE) and total human brain antigen (THBA)) were determined by enzyme-linked immunosorbent assay the day before surgery, on days 1, 3, 7 and 14 after surgery. Results. It was found that the fact of anesthesia support with the use of CPB itself negatively affects the state of the brain as a whole. This is proved by the dynamics of A-MBP, A-S-100, A-NSE and A-THBA indicators in patients of control group, that is, without additional administration of substances as a part of current protocol in order to control CPB consequences. Changes in the studied autoantibodies, which are responsible for the various histological and functional structures of the brain, can be explained by the general reaction of the body to the physical conditions of CPB. But determination of the component of artificial perfusion, which most influences the functional state of patient’s brain, does not depend on their initial state, but makes a difference from the baseline level of immune parameters and requires further research. Conclusions. Thus, it can be noted that the administration of a solution of D-fructose-1,6-diphosphate sodium salt hydrate (esafosfina) has the most positive effect on the functional state of the cells responsible for the cognitive functions in patients with surgical aortic pathology.
маркери автоімунної відповіді; маркери пошкодження нервової системи; штучний кровообіг
маркеры аутоиммунного ответа; маркеры повреждения нервной системы; искусственное кровообращение
markers of autoimmune response; markers of damage to the nervous system; extracorporeal circulation
Вступ
Протягом останніх десятиліть кардіоанестезіологія досягла значних успіхів у питанні забезпечення безпеки пацієнта, звівши до мінімуму кількість неврологічних ускладнень при операціях, що проводяться в умовах штучного кровообігу (ШК). Це стало результатом вдосконалення хірургічної техніки, впровадження нової апаратури, поглиблення знань про патофізіологію ШК і штучної гіпотермії, застосування нейропротекторів. Усе це призвело до зниження тяжких, несумісних з життям неврологічних ускладнень [1, 2].
Однак проблема ускладнень з боку центральної нервової системи (ЦНС) в структурі кардіохірургічних ускладнень досі залишається актуальною. Високий ризик розвитку гострого порушення мозкового кровообігу під час операції або безпосередньо після неї, пов’язані з цим інвалідизація і в низці випадків настання летального результату вимагають встановлення провідних чинників ризику мозкового інсульту в цих умовах, виявлення груп пацієнтів із високою ймовірністю розвитку церебральних судинних ускладнень, розробки шляхів їх профілактики [3, 4].
У даний час на перший план виходять менш виражені церебральні порушення, що проявляються в першу чергу змінами вищих психічних (когнітивних) функцій. Частота виникнення енцефалопатії в післяопераційному періоді доходить до 40–90 % [5]. Ризик розвитку неврологічних ускладнень у хворих пов’язаний як із проведенням загальної анестезії, так і з низкою інших факторів. У сучасній літературі є дані про негативний вплив на ЦНС навіть середньотерапевтичних доз анестетиків і наркотичних анальгетиків [6]. Внаслідок значної кількості неврологічних ускладнень при все зростаючому обсязі хірургічних втручань важлива своєчасна оцінка неврологічного статусу і лікування виявлених ускладнень у хворих після операцій на серці [7].
Методи нейровізуалізації та електрофізіологічного обстеження є традиційними для діагностики станів, що пов’язані з ушкодженням тканин мозку. Останнім часом все більше уваги приділяється лабораторній діагностиці, що вміщує визначення нейроспецифічних білків (НСБ) — біологічно активних молекул, що є специфічними для нервової тканини і виконують функції, що характерні для нервової системи [8].
За останні 30 років охарактеризовано більше ніж 60 різних НСБ мозку. Їх можна класифікувати за локалізаційно–структурним принципом (нейрональні, гліальні, ті, що стабілізують мембрани, цитоплазматичні та ін.), функціональною роллю. Також виділяють підгрупу НСБ, що є присутніми в мозку і при нормі, і при патологіях [9].
Визначення рівня НСБ сприяє ранній діагностиці, бо зміни їх концентрації, що є значущими, часто виникають раніше, ніж ті ушкодження, що можна визначити інструментальними методами дослідження. Крім того, вони дозволяють проводити оцінку прогнозу перебігу і результату захворювання, здійснювати моніторинг лікування пацієнта [10, 11].
Метою нашої роботи був аналіз динаміки маркерів автоімунної відповіді організму на маркери порушення нервової системи як реакція хворих на проведене оперативне втручання з використанням штучного кровообігу.
Матеріали та методи
В основі даного дослідження лежить аналіз результатів дослідження 118 хворих з хірургічною патологією аорти (ХПА) терміном від 1 доби до 1 місяця з моменту проведення оперативного втручання, які знаходилися на лікуванні на базі відділення хірургічного лікування патології аорти Національного інституту серцево–судинної хірургії імені М.М. Амосова НАМН України в період 2015–2018 рр.
Пацієнти були розподілені на 2 групи за принципом застосування в складі інтенсивної терапії (ІТ) додаткових речовин, що за своїми заявленими властивостями можуть впливати на стан післяопераційної когнітивної функції.
До групи І увійшли 46 пацієнтів, яким додатково до алгоритму ІТ було призначено розчин меглюміну натрію сукцинат (реамберин) внутрішньовенно краплинно із швидкістю 90 крапель за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 200 мл 1,5% розчину (N–метілглюкамін (меглюмін) — 8,725 г, янтарна кислота — 5,28 г).
До групи ІІ ввійшли 46 пацієнтів, яким додатково до алгоритму ІТ було призначено розчин D–фруктозо–1,6–дифосфат натрієвої солі гідрат (езафосфіна) внутрішньовенно краплинно із швидкістю 10 мл за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 5 г у розведенні 50 мл розчинника.
Контрольну групу (К) становили 26 пацієнтів, які мали хірургічну патологію аорти, за всіма критеріями співпадали із пацієнтами групи І і ІІ, але не мали в складі ІТ додаткового призначення речовин з метою профілактики післяопераційної когнітивної дисфункції (ПКД).
Для вивчення автоімунної відповіді визначали рівні автоантитіл до мозкових антигенів (основного білка мієліну (ОБМ), кальційзв’язуючого білка S–100, нейроспецифічної енолази (НСЕ) та загального людського мозкового антигена (ЗЛМА)) у сироватці крові методом імуноферментного аналізу за день перед операцією і на 1–шу, 3–тю, 7–му і 14–ту добу після оперативного втручання.
Для можливості використання критерію Стьюдента обчислювали критерій Фішера — Снедекора — відношення більшої дисперсії до меншої. Для визначення наявності зв’язку та тісноти цього зв’язку між окремими подіями застосовано визначення величини коефіцієнта лінійної кореляції Пірсона.
Результати та обговорення
Для визначення впливу хірургічного лікування й анестезії з використанням ШК на динаміку НСБ у досліджуваних хворих за рівень порівняння ми прий–
мали середній їх показник між групами К, І і ІІ за день до проведення операції (табл. 1).
При цьому, враховуючи відсутність вірогідних відмінностей між групами щодо цифр автоантитіл до мозкових антигенів, ми розрахували їх середній показних між групами і, як відзначалося раніше, приймали його за стартовий рівень порівняння.
Відомо, що руйнування мієліну є універсальним механізмом реакції нервової тканини на пошкодження. Хвороби мієліну поділяються на дві основні групи: мієлінопатія і мієлінокластія. Мієлінопатії пов’язані з біохімічним дефектом будови мієліну, як правило, генетично обумовленим. В основі мієлінокластичних (або демієлінізуючих) захворювань лежить руйнування нормально синтезованого мієліну під впливом різних впливів (як зовнішніх, так і внутрішніх).
При пошкодженні ЦНС порушується функція гематоенцефалічного бар’єру, що супроводжується підвищенням концентрації ОБМ в сироватці крові. Численні дослідження показали, що ОБМ є чутливим маркером пошкодження гематоенцефалічного бар’єру.
ОБМ є на сьогодні одним із найбільш вивчених нейронспецифічних білків, показана його висока діагностична значимість при цілому ряді захворювань центральної нервової системи: травматичних, запальних, судинних, пухлинних і токсичних ураженнях.
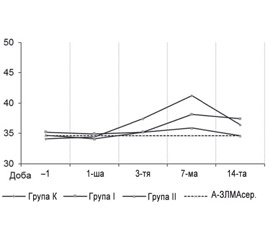
Динаміка А–ОБМ у досліджуваних пацієнтів наведена на рис. 1, у табл. 2.
Отже, за день до оперативного втручання рівень А–ОБМ не відрізнявся між групами К, І і ІІ. В подальшому у пацієнтів групи К цифри поступово збільшувалися відповідно до періодів спостереження, що становило через 12 годин після операції 34,6 ± 5,9 і практично співпадало з цифрами А–ОБМсер., на 3–тю добу — 36,8 ± 6,1, що було на 8 % вище від стартових цифр, з подальшою тенденцією до відновлення, що становило на 7–му і 14–ту добу 32,9 ± 8,4 і 33,8 ± 4,9 відповідно без вірогідної різниці між точками контролю і цифрами А–ОБМсер.
У групі І і ІІ спостерігалася ідентична динаміка, максимальний рівень А–ОБМ був зафіксований також на 3–тю добу: 37,4 ± 7,2 і 36,6 ± 4,9 у групах І і ІІ відповідно з подальшим зниженням і відсутністю вірогідної різниці між групами та цифрами А–ОБМсер.
Нейроспецифічна енолаза є нейроспецифічною ізоформою енолази, яка зустрічається в нейронах, клітинах нейроендокринного походження (хромафінних клітинах мозкової речовини, парафолікулярних клітинах щитоподібної залози та ін.). Рівень НСЕ підвищується при захворюваннях нервової системи, що супроводжуються досить швидким руйнуванням нейронів, тому використовується в діагностиці та оцінці прогнозу відновлення при ураженнях нервової системи різного генезу (травматичного, ішемічного).
Динаміка А–НСЕ у досліджуваних пацієнтів наведена на рис. 2, у табл. 2.
При проведенні статистичного аналізу вмісту А–НСЕ в обстежених хворих було визначено, що в групі К, де пацієнтам не призначали додатково препарати з метою профілактики ПКД, рівень А–НСЕ збільшувався починаючи з першої післяопераційної доби — 31,1 ± 1,6, що було на 5 % вище від А–НСЕсер. — стартового рівня. На 3–тю добу перебування у стаціонарі цифри А–НСЕ у хворих групи К становили 36,8 ± 2,2, що було на 24 % вище від А–НСЕсер. і вірогідно (р < 0,05) перевищувало як рівень А–НСЕсер., так і цифри даного показника в групах І і ІІ — 34,2 ± 1,7 і 31,6 ± 1,9 відповідно. Із 7–ї доби відзначалася тенденція до поступового зниження показника А–НСЕ в групі К: на 7–му добу його цифри становили 34,1 ± 1,8, що було на 15 % вище від стартового рівня, на 14–ту добу — через 2 тижні після проведення оперативного втручання — цифри А–НСЕ були 32,2 ± 2,7, на 8 % вище від А–НСЕсер.
У пацієнтів групи І, де з метою профілактики можливої ПКД ми призначали розчин меглюміну натрію сукцинат (реамберин) внутрішньовенно краплинно із швидкістю 90 крапель за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 200 мл 1,5% розчину, відзначалася схожа динаміка рівня А–НСЕ в крові. На першу добу післяопераційного періоду, через 12 годин після оперативного втручання, цифри А–НСЕ у даних пацієнтів становили 31,4 ± 1,9, що майже співпадало з цифрами в групі К — 31,1 ± 1,6 і було також на 5 % вище від А–НСЕсер. На 3–тю добу лікування концентрація А–НСЕ у хворих групи І становила 34,2 ± 1,7, що було на 15 % вище від стартового рівня і вірогідно (р < 0,05) менше за цифри А–НСЕ в групі К. Далі відзначалася тенденція до зниження рівня А–НСЕ в крові, цифри цього показника — 32,2 ± 1,4 і 29,8 ± 4,2 на 7–му і 14–ту добу відповідно.
Отже, можна відзначити, що цифри А–НСЕ в крові у пацієнтів, яким додатково призначали меглюміну натрію сукцинат, мали таку ж динаміку, як і у пацієнтів, яким у періопераційному періоді інтенсивну терапію проводили строго за протоколом, однак через тиждень перебування у стаціонарі цифри А–НСЕ у них були лише на 8 % вище від А–НСЕсер. на відміну від групи К, де вони перевищували стартовий рівень на 15 %. Можна стверджувати, що додаткове призначення пацієнтам з ХПА меглюміну натрію сукцинату як компонента оптимізації анестезіологічного забезпечення сприяє зниженню рівня А–НСЕ через тиждень після оперативного втручання з 15 % від А–НСЕсер. до 7 %, а через 2 тижні лікування приводить їх до стартового рівня.
У пацієнтів групи ІІ, де з метою профілактики можливої ПКД ми призначали розчин D–фруктозо–1,6–дифосфат натрієвої солі гідрат (езафосфіна) внутрішньовенно краплинно із швидкістю 10 мл за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 5 г у розведенні 50 мл розчинника, відзначалася також схожа динаміка рівня А–НСЕ в крові. На першу добу післяопераційного періоду, через 12 годин після оперативного втручання, цифри А–НСЕ у даних пацієнтів становили 30,9 ± 1,4, що також майже співпадало з цифрами в групі К (31,1 ± 1,6) і групі І (31,4 ± 1,9) і було також на 5 % вище від А–НСЕсер. На 3–тю добу лікування концентрація А–НСЕ у хворих групи ІІ становила 31,6 ± 1,9, що було на 7 % вище від стартового рівня, вірогідно (р < 0,05) менше за цифри А–НСЕ в групі К і на 8 % менше за цифри в групі І.
Далі відзначалася тенденція до зниження рівня А–НСЕ в крові, цифри цього показника становили 27,1 ± 2 і 27,6 ± 1,9 на 7–му і 14–ту добу і були менше за рівень А–НСЕсер. на 9 і 8 % відповідно.
Отже, можна відзначити, що цифри А–НСЕ в крові у пацієнтів, яким додатково призначали розчин D–фруктозо–1,6–дифосфат натрієвої солі гідрат (езафосфіна), мали таку ж динаміку, як і у пацієнтів, яким у періопераційному періоді інтенсивну терапію проводили строго за протоколом, однак через тиждень перебування у стаціонарі цифри А–НСЕ у них були вже на 8 % нижчими від А–НСЕсер. на відміну від групи К, де вони перевищували стартовий рівень на 15 %. Можна стверджувати, що додаткове призначення пацієнтам з ХПА розчину D–фруктозо–1,6–дифосфат натрієвої солі гідрат як компонента оптимізації анестезіологічного забезпечення сприяє зниженню рівня А–НСЕ через тиждень після оперативного втручання з 15 % вище від А–НСЕсер. до 7 % нижче від А–НСЕсер. з подальшим підтриманням цих цифр і протягом другого тижня перебування у стаціонарі.
Відомо, що білок S–100 бере активну участь у процесах клітинного поділу, диференціювання, гомеостазу іонів Са2+, проведенні внутрішньоклітинного регуляторного сигналу апоптозу. Збільшення рівня S–100 в плазмі є маркером пошкодження головного мозку. S–100 експресуються в основному клітинами центральної нервової системи, більшою мірою астрогліальними клітинами. Також рівень вмісту S–100 підвищується в спинномозковій рідині, потім потрапляє в периферичну кров при різних ураженнях мозку в анамнезі. S–100 може бути виявлений у пацієнтів з ушкодженнями мозку, отриманими в результаті декількох подій, наприклад травм головного мозку або інсульту.
При проведенні статистичного аналізу вмісту А–S–100 в обстежених хворих було визначено, що в групі К, де пацієнтам не призначали додатково препарати з метою профілактики ПКД, рівень
А–S–100 збільшувався починаючи з першої післяопераційної доби — 13,2 ± 2,2, що було на 5 % вище від А–S–100сер. — стартового рівня (табл. 2, рис. 3). На 3–тю добу перебування у стаціонарі цифри А–S–100
у хворих групи К становили 15,4 ± 1,1, що було на 22 % вище від А–S–100сер. і вірогідно (р < 0,05) перевищувало як рівень А–S–100сер., так і цифри даного показника в групі ІІ — 13,1 ± 1,1. Із 7–ї доби відзначалася тенденція до поступового зниження показника А–S–100 в групі К: на 7–му добу його цифри становили 14,1 ± 1,4, що було на 11 % вище від стартового рівня, на 14–ту добу — через 2 тижні після проведення оперативного втручання — цифри А–S–100 були 13,2 ± 1,2, на 4 % вище від А–S–100сер.
У пацієнтів групи І, де з метою профілактики можливої ПКД ми призначали розчин меглюміну натрію сукцинат (реамберин) внутрішньовенно краплинно із швидкістю 90 крапель за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 200 мл 1,5% розчину, відзначалася схожа динаміка рівня А–S–100 в крові. На першу добу післяопераційного періоду, через 12 годин після оперативного втручання, цифри А–S–100 у даних пацієнтів становили 13,4 ± 1,8, що майже співпадало з цифрами в групі К (13,2 ± 2,2) і було також на 5 % вище від А–S–100сер. На 3–тю добу лікування концентрація А–S–100 у хворих групи І становила 14,6 ± 1,2, що було на 13 % вище від стартового рівня і вірогідно (р < 0,05) менше за цифри А–S–100 в групі К. Далі відзначалася тенденція до зниження рівня А–S–100 в крові, цифри цього показника становили 13,7 ± 1,4 і 13,4 ± 1,2 на 7–му і 14–ту добу відповідно, що перевищувало стартовий рівень А–S–100сер. на 9 і 6 %.
Отже, можна відзначити, що цифри А–S–100 в крові у пацієнтів, яким додатково призначали меглюміну натрію сукцинат, мали таку ж динаміку, як і у пацієнтів, яким у періопераційному періоді інтенсивну терапію проводили строго за протоколом, однак через тиждень перебування у стаціонарі цифри А–S–100 у них були лише на 9 % вище від
А–S–100сер. на відміну від групи К, де вони перевищували стартовий рівень на 11 %. Можна стверджувати, що додаткове призначення пацієнтам з ХПА меглюміну натрію сукцинату як компонента оптимізації анестезіологічного забезпечення сприяє зниженню рівня А–S–100 через тиждень після оперативного втручання з 11 % від А–S–100сер. до 9 %.
У пацієнтів групи ІІ, де з метою профілактики можливої ПКД ми призначали розчин D–фруктозо–1,6–дифосфат натрієвої солі гідрат (езафосфіна) внутрішньовенно краплинно із швидкістю 10 мл за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 5 г у розведенні 50 мл розчинника, відзначалася також схожа динаміка рівня А–S–100 в крові. На першу добу післяопераційного періоду, через 12 годин після оперативного втручання, цифри А–S–100 у даних пацієнтів становили 12,8 ± 1,4, що було менше за цифри в групі К на 5 % і в групі І на 4 % і співпадало з А–S–100сер. На 3–тю добу лікування концентрація А–S–100 у хворих групи ІІ становила 13,1 ± 1,1, що було на 4 % вище від стартового рівня, вірогідно
(р < 0,05) менше за цифри А–S–100 в групі К і на 18 % менше за цифри в групі І.
Далі відзначалася тенденція до зниження рівня А–S–100 в крові, цифри цього показника становили 12,6 ± 1,4 і 12,6 ± 1,7 на 7–му і 14–ту добу, що майже співпадало із стартовим рівнем цього показника А–S–100сер. (12,6 ± 1,6) і свідчило про повне відновлення цієї регуляторної системи.
Отже, можна відзначити, що цифри А–S–100 в крові у пацієнтів, яким додатково призначали розчин D–фруктозо–1,6–дифосфат натрієвої солі гідрат (езафосфіна), мали таку ж динаміку, як і у пацієнтів, яким у періопераційному періоді інтенсивну терапію проводили строго за протоколом, однак через тиждень перебування у стаціонарі цифри А–S–100 у них повністю відновилися і досягли вихідного рівня. Можна стверджувати, що додаткове призначення пацієнтам з ХПА розчину D–фруктозо–1,6–дифосфат натрієвої солі гідрат як компонента оптимізації анестезіологічного забезпечення сприяє повному відновленню з подальшим підтриманням цих цифр і протягом другого тижня перебування у стаціонарі.
Відомо, що ЗЛМА є провідним діагностичним маркером автоімунних захворювань ЦНС, які розглядаються як паранеопластичні неврологічні захворювання, що виникають внаслідок протипухлинної відповіді імунної системи. Клінічні прояви включають втрату пам’яті, чутливості, дисфункцію мозкового стовбура, моторну або вегетативну дисфункцію, мимовільні судомні рухи ока, міоклонію й атаксію. Цей маркер допомагає провести диференціальну діагностику між істинним паранеопластичним синдромом і іншими запальними захворюваннями нервової системи, які на нього схожі.
Цікавим також є визначення діагностичної ролі ЗЛМА у клінічній картині перебігу післяопераційного періоду у хворих з ХПА, насамперед у характеристиці ПКД (табл. 2, рис. 4).
При проведенні статистичного аналізу вмісту А–ЗЛМА в обстежених хворих було визначено, що в групі К, де пацієнтам не призначали додатково препарати з метою профілактики ПКД, рівень А–ЗЛМА збільшувався починаючи з 3–ї післяопераційної доби — 37,4 ± 2,6, що було на 8 % вище від А–ЗЛМАсер. — стартового рівня. На 7–му добу, наприкінці першого тижня перебування у стаціонарі, цифри А–ЗЛМА у хворих групи К становили 41,2 ± ± 2,9, що було на 19 % вище від А–ЗЛМАсер. і вірогідно (р < 0,05) перевищувало рівень А–ЗЛМАсер. З 14–ї доби відзначалася тенденція до поступового зниження показника А–ЗЛМА в групі К, 36,4 ± 3,7, що було на 5 % вище від стартового рівня.
У пацієнтів групи І і ІІ до 3–ї доби лікування включно спостерігалася ідентична динаміка А–ЗЛМА в крові, а саме перебування його цифр майже поряд з вихідним рівнем: 34,9 ± 2,7 і 34,1 ± 1,9 через 12 годин після оперативного втручання і 35,2 ± 2,7 і 35,2 ± 1,9 на 3–тю добу відповідно.
В подальшому у пацієнтів групи І, де з метою профілактики можливої ПКД ми призначали розчин меглюміну натрію сукцинат (реамберин) внутрішньовенно краплинно із швидкістю 90 крапель за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 200 мл 1,5% розчину, максимальний рівень А–ЗЛМА в крові відзначався на 7–му добу — 38,1 ± 1,8, що було на 10 % вище від А–ЗЛМА без вірогідної різниці між показниками. Цей рівень зберігався навіть протягом другого тижня перебування пацієнтів групи І у стаціонарі і на 14–й день обстеження становив 37,4 ± 2,1, що на 8 % було вище від цифри А–ЗЛМА.
Отже, можна відзначити, що цифри А–ЗЛМА в крові у пацієнтів, яким додатково призначали меглюміну натрію сукцинат, мали таку ж динаміку, як і у пацієнтів, яким у періопераційному періоді інтенсивну терапію проводили строго за протоколом, але без вірогідного перевищення стартового рівня, що робить призначення реамберину як позитивного фактора профілактики ПКД в післяопераційному періоді у хворих з ХПА не досить переконливим.
У пацієнтів групи ІІ, де з метою профілактики можливої ПКД ми призначали розчин D–фруктозо–1,6–дифосфат натрієвої солі гідрат (езафосфіна) внутрішньовенно краплинно із швидкістю 10 мл за 1 хвилину безпосередньо перед початком перфузії і на 30–й хвилині штучного кровообігу по 5 г у розведенні 50 мл розчинника, відзначалася інша від групи К і групи І динаміка показника А–ЗЛМА в крові. Протягом усього періоду спостереження його цифри знаходилися близько до вихідного рівня — А–ЗЛМАсер. — з максимальним підвищенням на 7–му добу лікування, що становило 35,9 ± 2,2 і було лише на 4 % вище від стартового рівня.
Таким чином, можна відзначити, що призначення розчину D–фруктозо–1,6–дифосфат натрієвої солі гідрат (езафосфіна) найбільш позитивно впливає на функціональний стан клітин, що відповідають за когнітивні функції пацієнтів з ХПА.
Висновки
Можна стверджувати, що сам по собі факт анестезіологічного забезпечення з використанням ШК негативно впливає на стан головного мозку в цілому. Це доведено динамікою показників А–ОБМ, А–S–100, А–НСЕ і А–ЗЛМА у хворих групи К, тобто без призначення додатково до чинного протоколу речовин з метою протидії наслідкам ШК. Зміни досліджуваних нами автоантитіл, які відповідають за різні гістолого–функціональні структури головного мозку, можна пояснити загальною реакцією організму на фізичні умови ШК. Але визначення найвпливовішого компонента штучної перфузії на функціональний стан головного мозку пацієнтів, який не залежить від вихідного їх стану, але є відмінним від стартового рівня імунних показників, ще потребує подальшого дослідження.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Newman M.F., Kirchner J.L., Philips–Bute B. et al. Longitudinal assessment of neurocognitive function after coronary–artery bypass surgery. New England Journal of Medicine. 2001. Vol. 344. P. 395–402.
2. Давыдов В.В., Неймарк М.И. Состояние высших психических функций у больных, перенесших анестезию с применением дипривана и кетамина. Общая реаниматология. 2005. Т. 1, № 2. С. 48–52.
3. Усенко Л.В., Полинчук И.С. Когнитивные нарушения после общей анестезии при экстракардиальных вмешательствах и эффект раннего введения тиоцетама в послеоперационном периоде. Международный неврологический журнал. 2011. № 6(44). С. 132–136.
4. Monk T.G., Price C.C. Postoperative cognitive disorders.Current Opinion in Critical Care. 2011. Vol. 17, № 4. Access mode: doi: 10.1097/MCC.0b013e328348bece.
5. Parkin A.J. Memory: Phenomena, Experiment and Theory. Cornwell: Psychology Press, a member of the Taylor & Francis group, 2017. 226 p.
6. Шнайдер Н.А. Новый взгляд на проблему послеоперационной когнитивной дисфункции. Острые и неотложные состояния в практике врача. 2008. № 5–6. С. 64–68.
7. Шнайдер Н.А. Постоперационная когнитивная дисфункция. Неврологический журнал. 2005. Т. 10, № 4. С. 37–43.
8. Kadoi Y., Goto F. Sevoflurane anesthesia did not affect postoperative cognitive dysfunction in patients undergoing coronary artery bypass graft surgery. Journal of Anesthesiology. 2007. Vol. 21, № 3. P. 330–335.
9. Исаев С.В., Лихванцев В.В., Кичин В.В. Влияние периоперационных факторов и выбора метода анестезии на частоту когнитивных расстройств в послеоперационный период. Вестник интенсивной терапии. 2004. № 3.
С. 67–69.
10. Lawrence V.A., Hazuda H.P., Cornell J.E. et al. Functional independence after major abdominal surgery in the elderly. Journal of the American College of Surgeons. 2004. Vol. 199, № 5. P. 762–772. Access mode: DOI: 10.1016/j.jamcollsurg.2004.05.280.
11. Исаев С.В., Лихванцев В.В., Кичин В.В. и др. Влияние периоперационных факторов и выбора метода анестезии на частоту когнитивных расстройств в послеоперационном периоде. Материалы IX съезда анестезиологов и реаниматологов РФ. Иркутск, 27–29 сентября 2004. С. 113–114.

/69-1.jpg)
/69-2.jpg)
/70-1.jpg)
/71-1.jpg)