Журнал «Здоровье ребенка» Том 14, №4, 2019
Вернуться к номеру
Корекція мікробної флори кишечника в дітей, які народилися шляхом кесарева розтину
Авторы: Фролова Т.В.(1), Стенкова Н.Ф.(1), Сіняєва І.Р.(1), Терещенкова І.І.(1), Атаманова О.В.(1), Берус А.В.(2)
(1) — Харківський національний медичний університет, м. Харків, Україна
(2) — КНП «Міська клінічна багатопрофільна лікарня № 17» Харківської міської ради, м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У роботі наведено досвід застосування препарату Лактіалє GG з метою корекції гастроінтестинальних розладів у дітей, які народилися шляхом кесарева розтину. Показано, що в дітей, які народилися шляхом оперативного розродження, вірогідно частіше порівняно з дітьми, що народилися природним шляхом, спостерігаються такі скарги, як часте зригування, часте рідке випорожнення з надлишковою кількістю слизу, зеленуватий або темно-зелений колір калу, неприємний запах, метеоризм, частий немотивований плач, неспокій, порушення сну. Призначення препарату Лактіалє GG сприяло покращанню процесів травлення, нормалізації лабораторних показників калу та загального стану дитини.
В работе представлен опыт применения препарата Лактиале GG с целью коррекции гастроинтестинальных расстройств у детей, родившихся путем кесарева сечения. Показано, что у детей, родившихся путем оперативного родоразрешения, достоверно чаще по сравнению с детьми, родившимися естественным путем, наблюдаются такие жалобы, как частое срыгивание, частый жидкий стул с избыточным количеством слизи, зеленый или темно-зеленый цвет кала, неприятный запах, метеоризм, частый немотивированный плач, беспокойство, нарушение сна. Назначение препарата Лактиале GG способствовало улучшению процессов пищеварения, нормализации лабораторных показателей кала и общего состояния ребенка.
The paper deals with the experience of Lactiale GG application in order to cure gastrointestinal disorders in infants after cesarean delivery. It has been shown that the infants after cesarean delivery significantly more often presented with such complaints as frequent posseting and reflux, liquid stool with excess mucus, green or dark green feces, foul-smelling, flatulence, unmotivated crying, anxiety, sleep disorders compared to the children after vaginal birth. Lactiale GG prescription contributed to improvement of digestion, normalization of feces laboratory parameters and overall health of an infant.
діти; кесарів розтин; гастроінтестинальні розлади; Лактіалє GG
дети; кесарево сечение; гастроинтестинальные расстройства; Лактиале GG
infants; cesarean section; gastrointestinal disorders; Lactiale GG
Вступ
За останніми даними ВООЗ, частота виконання кесаревого розтину неухильно зростає, проте нерідко це відбувається за відсутності медичних показань, особливо в країнах із високим і середнім рівнем доходу [1].
У різних країнах світу цей показник становить від 12 до 27 % [2, 3]. Так, в Україні середній рівень абдомінального розродження коливається в межах 16–22 % [4, 5]; у США шляхом кесаревого розтину народжується майже кожна третя дитина [6].
Зростанню проведення кесаревих розтинів сприяють багато факторів: покращання рівня акушерської допомоги, удосконалення анестезіологічної підтримки, великий вибір лікувальних засобів для знеболювання, клініко-лабораторне та технологічне моніторування пре-, інтра- та післяопераційного періоду. Проте неможливо не враховувати факт, що порівняно з дітьми, народженими природним шляхом, ці діти більш схильні до розвитку респіраторної патології, атопічного дерматиту (АД), цукрового діабету І типу, автоімунних захворювань; вони мають більш високий ризик формування ожиріння, хвороби Крона, частіше страждають від підвищеного газоутворення, кольок та пов’язаного з ними шлунково-кишкового болю, мають підвищений ризик запальних захворювань кишечника (ЗЗК) [7, 8].
Датські науковці, аналізуючи результати великого когортного дослідження (2,1 мільйона чоловік, які народилися протягом 35 років), встановили, що 8142 обстежені мали ЗЗК у віці до 36 років, а одним з основних факторів їх розвитку був саме кесарів розтин. Більшість діагнозів була встановлена після 15-річного віку, що дозволило вченим дійти висновку, що дисбіоз, який мав місце в дітей, народжених шляхом кесаревого розтину, може мати наслідки для здоров’я людини протягом усього життя [9].
Під час природних пологів, коли відбувається контакт немовляти з бактеріями матері, починається становлення імунної системи дитини. Нещодавні дослідження виявили важливу роль кишкових мікроорганізмів у регуляції імунних процесів, включаючи імунну толерантність, завдяки модуляції Т-регуляторних клітин [10].
Стан мікробіоценозу кишечника, у процесі формування якого провідною ланкою є саме первинна колонізація бактеріями новонародженого, визначає в майбутньому стан здоров’я людини і резистентність до цілої низки захворювань [11].
Таким чином, результати численних досліджень свідчать про те, що сучасна тенденція до зростання кількості випадків кесаревого розтину, яка склалася останнім часом у різних країнах світу, призводить до дисбалансу всієї кишкової екосистеми і сприяє збільшенню ризику формування захворювань шлунково-кишкового тракту не тільки в дитячому, а й у дорослому віці.
Існують дані про те, що гормони, які продукуються мікробіотою кишечника, також діють як нейротрансмітери в ЦНС, включаючи гамма-аміномасляну кислоту, серотонін, гістамін, ацетилхолін і триптофан, які мають біологічно активні властивості та через систему кровообігу транспортуються по всьому організму, впливаючи не тільки на іннервацію кишечника, але й на центральну нервову систему [12, 13]. Імовірно, існує безліч систем, що одночасно беруть участь у двосторонній передачі інформації між мозком і кишечником; точні механізми, за допомогою яких це відбувається, ще й досі не визначені остаточно; проте відомо, що вони включають імунологічні, ендокринні, метаболічні й нервові шляхи [14]. Одним з основних джерел формування нормального мікробіоценозу кишечника новонародженої дитини є вміст піхви матері, який переважно містить бактерії Prevotella, Sneathia, Lactobacillus та під час природних пологів потрапляє в організм дитини [15, 16]. Якщо розродження відбувається шляхом кесаревого розтину, усі фізіологічні зміни й процеси підготовки до народження дитини, що відбуваються наприкінці вагітності, виключаються, і одними з перших організм новонародженого колонізують представники шкірного мікробіому матері та медичного персоналу; в основному це бактерії роду Propionibacterium, Corynebacterium і Streptococcus [15]. У таких немовлят спостерігаються уповільнення заселення кишечника індигенною флорою й низька бактеріальна різноманітність щонайменше протягом перших двох років життя [17].
Відомо, що біфідобактерії, які є сапрофітною флорою кишечника, потрапляють до організму дитини з початком грудного вигодовування, оскільки знаходяться в ділянці ареоли молочної залози та у грудному молоці, тоді як лактобактерії, що містяться майже виключно у вагінальному секреті, потрапляють до організму дитини тільки під час фізіологічних пологів.
На сьогодні у науковій літературі існують численні дослідження щодо способів відновлення кишкової флори дітей, народжених шляхом кесарева розтину. Один із них полягає навіть у безпосередньому заселенні порожнини рота дитини флорою з піхви матері [18]. Але безпека цих методів і відсутність достатньої доказової бази викликають занепокоєння. Результати проспективних досліджень, присвячених відновленню кишкової флори шляхом додавання до вигодовування культур пробіотиків, свідчать про здатність останніх збалансовувати кишкову екосистему [15].
Пробіотичні препарати сприяють нормалізації імунозахисних реакцій завдяки підвищенню рівня антитіл IgA, врівноважують імунну відповідь Th1 і Th2, що сприяє зниженню ризику розвитку алергічних захворювань, у тому числі й атопічного дерматиту. В інших дослідженнях показані доцільність та висока ефективність їх одночасного призначення матері й дитині, яка отримує грудне вигодовування [19]. Показано, що додавання пробіотиків, зокрема LGG, у період регенерації АД зменшує рівень IgE-антитіл до харчових алергенів, а також сприяє колонізації кишечника коменсальною флорою, зокрема біфідобактеріями [20].
Експерти ВООЗ та FDA вважають, що найбільш ефективними та безпечними штамами, а також схваленими для використання в дитячих молочних сумішах із народження є: Bifidobacterium, а саме B. longum (штам B. infantis; BB536), B. breve, B. lactis (штам Bb12), B. bifidum; Lactobacillus, а саме L. rhamnosus (GG), L. reuteri Protectis, L. acidophilus (штам L. gasseri), L. bulgaricum, L. casei (штам L. shirota); Streptococcus, а саме S. termophilus [21]. Усе зазначене вище обумовило актуальність проведеного дослідження, метою якого було визначення поширеності гастроінтестинальних розладів у дітей грудного віку, народжених шляхом кесарева розтину, і ефективності використання штамів L. rhamnosus GG щодо нормалізації процесів травлення у даної когорти дітей.
Матеріали та методи
Згідно з дизайном дослідження проводили в два етапи. На першому етапі обстежували 87 дітей віком від 1 до 6 місяців, із яких 45 дітей народжені шляхом кесаревого розтину, 42 — шляхом природних пологів. Термін гестації коливався від 36 до 41 тижня вагітності. Плановий кесарів розтин проводився в 15,4 % матерів, у 84,6 % випадків оперативне втручання проводилося за екстреними показаннями. Патологічних відхилень у стані здоров’я обстежених дітей (наявність будь-якої вродженої або іншої патології) не спостерігалося.
Усі діти, які знаходилися під спостереженням, отримували виключно грудне вигодовування, що дозволяло проводити порівняльний аналіз. Також на даному етапі проводився відбір дітей, які народилися шляхом кесарева розтину і мали порушення процесів травлення.
На другому етапі проводилося лабораторне обстеження дітей, батьки яких погодилися на участь у дослідженні (41 дитина): клінічний аналіз крові й сечі (за показаннями), копрологічне та мікробіологічне дослідження з метою визначення патогенних та умовно-патогенних збудників кишкових інфекцій.
За згодою батьків щодо участі в дослідженні, дітям із гастроінтестинальними розладами призначали препарат Лактіалє GG європейського виробництва «НОРД ФАРМ», Польща, який містить ліофілізовані життєздатні бактерії Lactobacillus rhamnosus GG (ATCC 53103); допоміжною речовиною служить тільки кукурудзяна олія, яка є гіпоалергенною і вигідно відрізняє дану форму пробіотика від інших. Лактіалє GG призначали в краплях, згідно з інструкцією, у віковому дозуванні 1 крапля 1 раз на добу протягом 30 діб. Вибір цього препарату був обумовлений високою ймовірністю нестачі саме лактобактерій у дітей, народжених шляхом кесарева розтину, що могло обумовлювати зазначені вище скарги [7]. До того ж зручність використання і дозування Лактіалє GG забезпечувала комплаєнтність учасників дослідження. Ефективність застосування препарату оцінювали за допомогою анкетно-опитувального способу спостереження, тобто батьки щодня визначали наявність та вираженість симптомів, які мали місце на початку дослідження. Спостереження за дітьми проводили в умовах стаціонару і/або амбулаторних відвідувань.
Результати та обговорення
За результатами проведеного дослідження з’ясовано, що в дітей, народжених шляхом кесарева розтину, часто мають місце скарги з боку травного тракту (83,3 % проти 16,7 % дітей, народжених через природні пологи): часте зригування, рідке, пінисте або з надлишковою кількістю слизу випорожнення, зеленуватий або темно-зелений колір калу, неприємний запах, метеоризм, частий немотивований, на думку батьків, плач, неспокій і пов’язане с цим порушення сну, які з різним ступенем вираженості мали місце в усіх дітей; у 7 дітей (17,1 %), разом зі згаданими вище симптомами, мало місце зниження маси тіла. Крім перелічених скарг, також досить часто, особливо в дітей перших місяців життя, відзначалися прояви пелюшкового дерматиту в ділянці промежини. Зі слів батьків, у більшості випадків дані скарги спостерігалися майже одразу після народження — на 2–3-му тижні життя й мали постійний або хвилеподібний перебіг.
Більше ніж половина (50,9 %) батьків зверталися зі скаргами до дільничного лікаря або обговорювали їх під час планових візитів. Решта батьків розцінювала цей стан як нормальний і не зверталася по допомогу, оскільки діти не мали відхилень у фізичному та нервово-психічному стані. 16 дітей (39,0 %) отримували симптоматичне лікування, яке не досягло бажаного результату (спазмолітичні препарати, сорбенти, поверхнево-активні силікони), пробіотики (переважно різні штами Bifidobacterium), імунобіологічні препарати з протимікробною дією; антибактеріальні препарати призначали 4,2 % обстежених дітей, однак, ураховуючи анамнестичні дані, доцільність їх застосування була сумнівною.
Результати лабораторних досліджень показали, що в 7 з 30 обстежених дітей (23,3 %) мала місце залізодефіцитна анемія легкого та середнього ступеня; в копрологічному дослідженні в 38 дітей (92,7 %) мала місце надлишкова кількість слизу; підвищений вміст лейкоцитів — в 11 (26,8 %), еритроцитів — у 3 (7,3 %) дітей; йодофільна флора переважала у 36,6 % випадків (15 дітей). При бактеріологічному дослідженні не було виявлено патогенної кишкової флори.
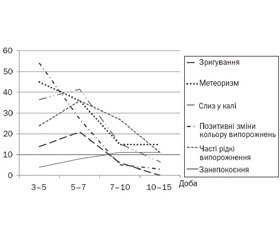
На тлі призначення препарату Лактіалє GG покращання стану спостерігалося у 38 (92,7 %) дітей (рис. 1). За даними опрацьованих анкет і динамічного спостереження за дітьми, позитивні зміни з боку характеру випорожнень (зменшення частоти, зміна зеленого кольору на жовтий, зменшення кількості слизу) відбувалися протягом перших трьох-п’яти днів у 15 (36,6 %) дітей; у 17 (41,5 %) — протягом 7–10 днів; у решти дітей — на 3-му тижні призначення Лактіалє GG. Але за умов спостереження прийом препарату продовжували.
Переносимість Лактіалє GG була доброю, ніякої побічної дії не спостерігалося в жодному випадку. Більшість батьків додавали препарат до невеликої кількості грудного молока або води й після цього давали дитині, що дозволяло їм бути впевненими в правильності дозування.
Такі зміни, як зменшення або зникнення безпричинного плачу та занепокоєння дитини, мали більш повільний характер і відзначалися в 28 (68,3 %) дітей, що, можливо, було обумовлене не тільки станом мікробіоти кишечника дитини, але й іншими причинами; до того ж ці скарги мають досить суб’єктивний характер порівняно з іншими проявами дисфункції кишечника. У той же час 18 (43,9 %) батьків дітей перших трьох місяців життя впевнено відзначали зменшення в дитини частоти кольок у животі та метеоризму.
Повторне копрологічне дослідження на 2–3-му тижні після прийому Лактіалє GG показало, що в усіх дітей, які знаходилися під спостереженням, наставало значне покращання показників клінічного дослідження калу: поліпшення консистенції та кольору, зменшення кількості слизу, кількості йодофільної флори.
Слід відзначити, що протягом катамнестичного нагляду за дітьми 3 дитини перенесли гостре респіраторне захворювання, після якого знов відмічалися вищезазначені скарги; після повторного курсу Лактіалє GG стан дітей нормалізувався. У 4 дітей через 2 місяці після курсу Лактіалє GG спостерігалися зміни характеру випорожнень, що також вимагало повторного призначення препарату, яке, у свою чергу, досить швидко призвело до їх нормалізації.
Висновки
1. У дітей, народжених шляхом кесарева розтину, має місце дефіцит лактобактерій, який клінічно може проявлятися гастроінтестинальними розладами: частими зригуваннями, частими рідкими випорожненнями з надлишковою кількістю слизу, метеоризмом, частим немотивованим плачем, занепокоєнням, порушенням сну.
2. Призначення препарату Лактіалє GG сприяє нормалізації гастроінтестинальних розладів у дітей, народжених шляхом кесарева розтину.
3. Дослідження щодо превентивного призначення препаратів, які містять лактобактерїї, дітям, народженим шляхом кесарева розтину, слід вважати перспективним.
Конфлікт інтересів. Не заявлений.
1. www.unian.ua/health/worldnews/1066824-vooz-initsiyue-mijnarodniy-monitoring-schodo-chastoti-vikonannya-kesarevogo-roztinu.html).
2. www.euro.who.int/ru/health-topics/Life-stages/sexual-and-reproductive-health/news/news/2015/06/dramatic-increase-in-caesarean-sections.
3. Boerma T., Ronsmans C., Dessalegn Y.M., Aluisio J.D. et al. Global epidemiology of caesarean sections. Lancet. October 13. 2018. doi: 10.1016/S0140-6736(18)31928-7.
4. Коломійцева А.Г., Скрипченко Н.Я. Сучасні принципи ведення пологів. Попередження агресії в пологах. Таврический медико-биологический вестник. 2012. 15. Т. 2, ч. 2 (58). С. 47-51.
5. Корчинська О.О., Гульпе К.Ю. Материнські та перинатальні наслідки, пов’язані з кесаревим розтином: порівняльний аналіз із досвідом колег зі Словаччини. Проблеми клінічної педіатрії. 2013. № 3 (21). С. 35-39.
6. Salas Garcia M.C., Yee A.L., Gilbert J.A., Dsouza M. Dysbiosis in Children Born by Caesarean Section. PubMed. 2018. 73 Suppl 3. P. 24-32. doi: 10.1159/000492168. Epub 2018 Jul 24.
7. Dapeng J., Hongyu Zhangand, Jun Sun. Intestinal Microbiome, Small Intestinal Bacterial Overgrowth and Inflammatory Bowel Diseases — What are the Connections. Curr. Health Sci. J. 2016 Apr-Jun. 42(2). P. 151-156. doi: 10.12865/CHSJ.42.02.06
8. Jin D., Jun Sun, Zhang H. Manipulation of Microbiome, a Promising Therapy for Inflammatory Bowel Diseases. J. Clin. Cell. Immunol. 2014. 5. P. 4.
9. Dieterich W., Schink M., and Yurdagül Zopf. Microbiota in the Gastrointestinal Tract. Med. Sci. (Basel). 2018 Dec. 6(4).
10. Geuking M.B., McCoy K.D., Macpherson A.J. Metabolites from intestinal microbes shape Treg. Cell. Res. 2013 Dec. 23(12). P. 1339-40.
11. Salas Garcia M.C., Yee A.L., Gilbert J.A., Dsouza M. Dysbiosis in Children Born by Caesarean Section. Ann. Nutr. Metab. 2018. 73 (suppl 3). P. 24-32. doi: 10.1159/000492168.
12. Nicholson J., Holmes E., Kinross J. et al. Host-gut microbiota metabolic interactions. Science. 2012. 336. P. 1262-1267.
13. McVey Neufeld K.A., Mao Y.K., Bienenstock J. et al. The microbiome is essential for normal gut intrinsic primary afferent neuron excitability in the mouse. Neurogastroenterol. Motil. 2013. 25. P. 183-e188.
14. Moya-Pérez A., Luczynski P., Renes I.B., Shugui Wang, Borre Y., Ryan C.A., Knol J., Stanton C., Dinan T.G., Cryan J.F. Intervention strategies for cesarean section-induced alterations in the microbiota-gut-brain axis. Nutr. Rev. 2017 Apr. 75(4). P. 225-240. doi: 10.1093/nutrit/nuw 069.
15. Ardissone A.N., de la Cruz D.M., Davis-Richardson A.G., Rechcigl K.T., Li N., Drew J.C. et al. Meconium microbiome analysisi dentifies bacteria correlated with premature birth. PLoS One. 2014. 9. e 90784.
16. Ravel J., Gajer P., Abdo Z., Schneider G.M., Koenig S.S., McCulle S.L. et al. Vaginal microbiome of reproductive-age women. Proc. Natl. Acad. Sci. USA. 2011. 108 Suppl 1. P. 4680-4687.
17. Гулямова М.А., Тухтаева У.Д., Ерназарова Б.Ж., Ходжиметов Х.А. Нарушение микрофлоры кишечника новорожденных детей, извлеченных путем кесарева сечения. Молодой ученый. 2017. № 12. С. 123-126.
18. De Weerdt S. How baby’s first microbes could be crucial to future health. Nature. 2018. 555. S18-S19. doi: 10.1038/d41586-018-02480-6.
19. Вackhed F., Roswall J., Peng Y., Feng Q., Jia H., Kovatcheva-Datchary P. et al. Dynamics and stabilization of the human gut microbiome during the first year of life. Cell Host Microbe. 2015. 17. P. 690-70.
20. Quin C., Estaki M., Vollman D.M., Barnett J.A., Gill S.K., Gibson D.L. Probiotics supplementation and associated infant gut microbiome and health: a cautionary retrospective clinical comparison. Sci. Rep. 2018. 8. 8283. doi: 10.1038/s41598-018-26423-3.
21. http://www.worldgastroenterology.org/UserFiles/file/guidelines/probiotics-and-prebiotics-russian-2017.

/67-1.jpg)