Журнал «Боль. Суставы. Позвоночник» Том 9, №2, 2019
Вернуться к номеру
Кальциноз при системной склеродермии: распространенность, клиника, менеджмент, осложнения
Авторы: Егудина Е.Д. (1), Головач И.Ю. (2)
1 - Государственное учреждение «Днепропетровская медицинская академия Министерства здравоохранения Украины», г. Днепр, Украина
2 - Клиническая больница «Феофания» Государственного управления делами, г. Киев, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
У даному літературному огляді підсумовано сучасні дані щодо епідеміології, патофізіології, діагностики та лікування шкірного кальцинозу у пацієнтів із системною склеродермією (ССД). Проведено аналіз обсерваційних досліджень, що описують частоту кальцинозу при ССД і асоційованих з ним клінічних ознак; молекулярних досліджень, що вивчають потенційні патогенетичні механізми; наведені клінічні випадки, що описують нові діагностичні підходи і методи лікування кальцинозу. Шкірний кальциноз — це відкладення нерозчинного кальцію в шкірі і підшкірних тканинах. Кальциноз — одна з основних, погано керованих клінічних проблем у пацієнтів із ССД, яка зачіпає щонайменше одну четверту частину хворих. Кальциноз асоційований з більшою тривалістю хвороби, дигітальними виразками, акроостеолізом, позитивними антицентромерними і антитопоізомеразними антитілами. Хоча патогенез кальцинозу остаточно невідомий, є докази, що підтверджують роль місцевої хронічної травматизації, хронічного запалення, судинної гіпоксії і дисрегуляції білків кісткового матриксу як потенційних механізмів розвитку цього патологічного стану у пацієнтів із ССД. Діагноз може бути встановлений на основі клінічних даних або за допомогою стандартної рентгенографії. Кілька фармакологічних методів лікування були застосовані у пацієнтів із кальцинозом зі змінними і не такими значущими результатами, у свою чергу, хірургічне видалення депозитів кальцію залишається основним методом лікування.
В данном литературном обзоре проанализированы современные данные, касающиеся эпидемиологии, патофизиологии, диагностики и лечения кожного кальциноза у пациентов с системной склеродермией (ССД). Проведен анализ обсервационных исследований, описывающих частоту кальциноза при ССД и ассоциированных клинических признаков; молекулярных исследований, изучающих потенциальные патогенетические механизмы; представлены клинические случаи, описывающие новые диагностические подходы и методы лечения кальциноза. Кожный кальциноз — это отложение нерастворимого кальция в коже и подкожных тканях. Кальциноз — одна из основных, трудно управляемых клинических проблем у пациентов с ССД, затрагивающая по крайней мере одну четвертую часть больных. Кальциноз ассоциирован с большей продолжительностью болезни, дигитальными язвами, акроостеолизом, положительными антицентромерными и антитопоизомеразными антителами. Хотя патогенез кальциноза до конца неизвестен, есть доказательства, подтверждающие роль местной хронической травматизации, хронического воспаления, сосудистой гипоксии и дисрегуляции белков костного матрикса как потенциальных механизмов развития этого патологического состояния у пациентов с ССД. Диагноз может быть поставлен на основе клинических данных или с помощью обычной рентгенографии. Несколько фармакологических методов лечения были применены у пациентов с кальцинозом с переменными и не столь значительными результатами, в свою очередь, хирургическое удаление депозитов кальция остается основным методом лечения.
This literature review summarizes current data on the epidemiology, pathophysiology, diagnosis and treatment of calcinosis cutis in patients with systemic sclerosis (SSc). The article deals with the analysis of observational studies of the frequency of calcinosis in SSc and associated clinical features, molecular research of potential pathogenetic mechanisms, clinical cases describing new diagnostic approaches and methods for the treatment of calcinosis. Calcinosis cutis is the deposition of insoluble calcium in the skin and subcutaneous tissues. Calcinosis is one of the main, poorly managed clinical problems in patients with SSc, affecting at least one quarter of patients with SSc. Calcinosis is associated with a longer disease duration, digital ulcers, acro-osteolysis, positive anticentromere and anti-topoisomerase antibodies. Although the pathogenesis of calcification is not fully known, there is evidence supporting the role of local chronic traumatization, chronic inflammation, vascular hypoxia and malregulation of bone matrix proteins as potential mechanisms for the development of this pathological condition in patients with SSc. The diagnosis can be established on the basis of clinical data or using plain X-ray. Several pharmacological treatment methods have been applied in patients with calcinosis with variable and not so significant results; in turn, surgical excision of calcium deposits remains mainstay of treatment.
кальцифікація; кальциноз шкіри; системна склеродермія; патофізіологія; клініка; менеджмент; огляд
кальцификации; кальциноз кожи; системная склеродермия; патофизиология; клиника; менеджмент; обзор
calcifications; calcinosis cutis; systemic sclerosis; pathophysiology; clinical picture; management; review
Введение
Кальциноз кожи — это отложение депозитов нерастворимого кальция в коже и подкожной клетчатке [1]. Наиболее яркие клинические примеры кожного кальциноза при системной склеродермии представлены на рис. 1.
Существует пять подтипов кальциноза: дистрофический, метастатический, ятрогенный, идиопатический и кальцифилаксия [3]. Метастатическая кальцификация — это депозиция кальция в нормальных тканях кожи или подкожной клетчатке при наличии повышенных уровней кальция и/или фосфатов в сыворотке крови, что довольно часто встречается при распаде злокачественных новообразований [3]. Дистрофический кальциноз является подтипом, связанным с аутоиммунными заболеваниями соединительной ткани (АЗСТ), такими как дерматомиозит (ДМ), особенно ювенильная его форма (ЮДМ), системная склеродермия (ССД), смешанное заболевание соединительной ткани и, реже, системная красная волчанка (СКВ) [4]. Чаще всего в патологический процесс вовлекаются верхние конечности, особенно пальцы; кальциноз сопровождается выраженным болевым синдромом, периодическими эпизодами местного воспаления и значительными функциональными нарушениями. Хотя детальная патофизиология кожного кальциноза остается недостаточно понятной, общий механизм для дистрофического кальциноза — это осаждение кальцинированного материала в поврежденной ткани при нормальных уровнях кальция и фосфатов в сыворотке крови [4]. В данной статье рассмотрены и обобщены последние данные литературы, касающиеся распространенности кальциноза, ассоциированных клинических факторов, патогенеза, диагностики и вариантов лечения дистрофического кальциноза при ССД.
Распространенность и ассоциированные клинические факторы кальциноза при ССД
Распространенность кальциноза при ССД колеблется от 18 до 49 %. Этот широкий диапазон, вероятно, обусловлен различными диагностическими методами определения кальциноза, которые основаны на клинических и/или рентгенографических данных, и различиями в популяции пациентов [5, 6]. Распространенность кальциноза увеличивается среди пациентов, которые болеют ССД в течение более длительного периода времени, кальциноз обычно появляется через 10 и более лет после постановки диагноза [4, 7]. Небольшие одноцентровые исследования показали, что факторы риска, ассоциированные с кальцинозом, включают мужской пол, дигитальные язвы, дигитальные рубцы, акроостеолиз, телеангиэктазии, наличие антицентромерных антител (АЦА) и антитопоизомеразные (Scl-70) антитела [8]. Международное когортное исследование 5218 пациентов подтвердило связь кальциноза с дигитальными язвами, телеангиэктазиями и AЦA вместе с обнаружением нового фактора предрасположенности — остеопороза [9].
Клинические особенности, ассоциированные с кальцинозом, при системной склеродермии
Демографические признаки:
— старший возраст;
— большая продолжительность болезни;
— лимитированная форма системной склеродермии.
Физикальные данные:
— дигитальные язвы;
— дигитальные рубцы;
— акроостеолиз;
— телеангиэктазии;
— поражение сердца;
— заболевания желудочно-кишечного тракта;
— легочная гипертензия;
— артриты;
— остеопороз.
Аутоантитела:
— положительные антицентромерные антитела;
— положительные антитопоизомеразные антитела;
— положительные антикардиолипиновые антитела.
Однако недавние исследования продемонстрировали различные клинические ассоциации кальциноза в зависимости от изучаемого контингента населения, что поставило под вопрос предикторы, обнаруженные ранее. Так, в одноцентровом исследовании 215 пациентов с ССД в США кальциноз был ассоциирован с лимитированной формой ССД (ЛТ-ССД) [10], а в мексиканской и малазийской когортах — с диффузной формой ССД (ДФ-ССД) [6]. Антинуклеарные и анти-Scl-70 антитела были более распространены, чем AЦA, у мексиканских пациентов с кальцинозом [6], а антитопоизомеразные (Scl-70) антитела были предиктором кальциноза в когорте 1305 пациентов с ССД, согласно данным регистра Канадской исследовательской группы по склеродермии (CSRG), который включал в себя пациентов из Канады и Мексики [11]. Кроме того, в многоцентровом исследовании 1009 афроамериканцев с ССД не было выявлено ассоциаций с кожной формой, мужским полом или AЦA [5].
Клиническая картина
Кальциноз при ССД представлен в виде подкожных узелков на пальцах или в местах давления, таких как локти, колени или седалищные бугры. Кальциноз чаще всего встречается на кистях и стопах (65–83 %), проксимальной части верхних конечностей (27 %), в области коленных суставов или проксимальных частях нижних конечностей (10–22 %) и бедрах (6,7 %) [6]. Участки кальциноза могут появляться на туловище, грудной клетке и ягодицах и во многих других нехарактерных казуистических местах, таких как верхнечелюстные пазухи, позвоночник и паравертебральные ткани [12]. Кальциноз может сопровождаться болезненными ощущениями и отеком мягких тканей, язвами с присоединяющейся инфекцией или деформациями, особенно в кистях, ведущими к значительным функциональным ограничениям [12]. Пациенты могут также предъявлять жалобы на выделение белесоватого вещества из очагов, подобного зубной пасте, являющегося входными воротами для инфекций.
Диагноз
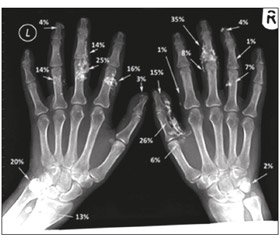
Хотя кальциноз часто легко пропальпировать или просто увидеть при объективном осмотре, визуализационные методы диагностики могут помочь подтвердить диагноз в случае субклинических отложений. Рентгенография — чувствительный метод исследования при обнаружении кальциноза, является методом визуализации первой линии для оценки пациентов с АЗСТ (рис. 2–5).
Рентгенографическая балльная система оценки кальциноза кистей была недавно разработана и предложена для стандартизации измерения размеров депозитов кальция для клинических и исследовательских целей [14]. Эта балльная система учитывает пораженную площадь тела, плотность, количество и анатомическое расположение участков поражения для оценки тяжести кальциноза, с характерными экспертными (меж- и интраэкспертными) оценками надежности заключений различных исследователей (рис. 6, 7).
Еще один метод категоризации кальциноза был предложен на основе клинических и рентгенографических характеристик формы и структуры поражений [15]. Этот подход делит кальциноз на четыре подтипа: «мусс», «камень», «сетка» и «тарелка». Авторы показали, что форма «сетка» характеризуется наибольшей длительностью терапии (в среднем 140 ± 22 дня), в то время как кальциноз «камень» — наименьшей (30 ± 12 дней), предполагая, что эта категоризация имеет клиническое значение в менеджменте и прогнозе кальциноза [15].
Существует также все больше доказательств эффективности использования ультразвукового исследования (УЗИ) в оценке кальциноза при ССД. V. Freire et al. (2013) показали, что УЗИ имеет чувствительность 89 % в обнаружении кальциноза без значительных отличий в чувствительности обнаружения по сравнению с рентгенографией [16]. Исходя из недавнего исследования 10 пациентов с ССД, было предложено использовать энергетическую допплерографию для выявления воспаления вокруг депозитов кальция, таким образом идентифицируя площадь поражений, которые могут быть целью для противовоспалительной терапии [17]. Кроме того, УЗИ-технологии, используемые для обнаружения микрокальцификатов в тканях молочной железы, дифференцируют гидроксиапатитные отложения, характерные для ССД, от других видов кальцификатов [17].
Другие экспериментальные методы исследования включают мультидетекторную компьютерную томо–графию (MДКТ), двухэнергетическую компьютерную томографию (ДЭКТ) и магнитно-резонансную томо–графию (МРТ). Имея большую степень разрешения и 3D-возможности по сравнению с традиционной КТ, MДКТ может лучше оценить степень и распространенность кальциноза [18]. На рис. 8 представлено сравнение визуализации кальциноза при помощи стандартной рентгенографии, МДКТ и МДКТ в 3D-режиме. Диагностика, проведенная при помощи ДЭКТ у 16 пациентов с ССД, продемонстрировала высокую эффективность в обнаружении кальциноза в подкожной клетчатке, сухожильных оболочках, карпальном канале и прилегающих мышцах [19]. МРТ также является высокоэффективным методом исследования в обнаружении депозитов кальциноза, обеспечивая лучшую визуализацию отека и/или воспаления окружающих тканей, которое может указывать на развитие кальциноза [20].
Патофизиология кальциноза
Наиболее изучена патофизиология развития дистрофического кальциноза. Предложено несколько патогенетических механизмов развития: хроническое воспаление, сосудистая гипоксия, рецидивирующая травма и аномалии белков костного матрикса. Высокие уровни сывороточного интерлейкина-1, -6, -1b и фактор некроза опухоли a (TNF-a) были обнаружены при кальцинозе у пациентов с ЮДМ, подтверждая, таким образом, роль воспаления в развитии этого патологического процесса [21].
Кроме того, в исследовании типа «случай — конт–роль» с участием 90 пациентов с ССД австралийской когорты и 90 подобранных пациентов группы конт–роля были исследованы уровни и полиморфизм маннозо–связывающего лектина и фиколина-2 в сыворотке крови — двух рецепторов лектинового пути комплемента. В результате была обнаружена ассоциация этих специфических маркеров у пациентов с ССД с процессами кальцификации и сосудистыми нарушениями. Кроме того, исследователи отметили, что уровень маннозосвязывающего лектина был значительно повышен у пациентов с ССД и кальцинозом в отличие от пациентов с ССД без кальциноза (2,1 против 0,8 мг/мл, р = 0,005), а также у пациентов с ССД и дигитальными язвами и рубцами (2,7 против 0,8 мг/мл, p = 0,007) [22].
Согласно ряду исследований сосудистая ишемия также способствует развитию кальциноза. С.А. Davies et al. продемонстрировали повышенную экспрессию гипоксия-ассоциированной молекулы транспортера глюкозы (GLUT-1) при биопсии кожи у пациентов с ССД и кальцинозом [23]. Кроме того, в нескольких исследованиях [9] показано, что наличие в настоящий момент или в анамнезе дигитальных язв [11] и/или
акроостеолиза [6] является предиктором развития кальциноза, что подчеркивает роль ишемии в развитии кальциноза. Другое исследование показало, что активация сосудистого эндотелиального фактора роста (VEGF) — потенциально ангиогенного фактора, индуцирующегося гипоксией, — была связана с повышенной активностью остеокластов у пациентов с ССД и с акроостеолизом, причем у 73 % пациентов был установлен кальциноз [24]. Эта индуцированная гипоксией активность остеокластов при ССД также участвует в развитии кальциноза, возможно, объясняя связь между кальцинозом и остеопорозом [10]. Аналогично, было обнаружено, что экспрессия доказанных маркеров окислительного стресса, конечных продуктов прогрессирующего гликирования/перекисного окисления липидов и их рецепторов была выше в дерме пациентов с ССД, особенно у пациентов с кальцинозом по сравнению со здоровым контролем [25].
Кальциноз преимущественно локализуется на доминантной верхней конечности и в других дистальных участках, что говорит о том, что повторяющаяся травма/перегрузка также могут способствовать его развитию [26]. Следует отметить, что области, подвергающиеся рецидивирующей травматизации, могут быть более восприимчивыми из-за нарушения компенсаторного ангиогенеза, характеризующегося пролиферативной облитерирующей васкулопатией, наблюдаемой при ССД [27]. С.А. Davies et al. также обнаружили повышенную экспрессию белков костного матрикса, таких как остеонектин и матриксный белок гамма-карбоксиглутаминовой кислоты (МГБ), в коже пациентов с ССД, пораженной кальцинозом [23]. Эти белки участвуют в эктопической кальцификации, активируя остеонектин — активатор кальцификации, наряду с супрессией и уменьшением уровней ингибиторов белка МГБ [28]. Кроме того, МГБ должен быть в своей гамма-карбоксилированной форме и связываться с костным морфогенным белком-2 для ингибирования кальцификации. Эта карбоксилированная форма является витамин-К-зависимой [28]. R. Wallin et al. предложили механизмы, в которых окислительный стресс, который имеет решающее значение для микрососудистых нарушений при ССД, может ингибировать витамин K, приводя к появлению не-гамма-карбоксилированного и неактивного МГБ и, таким образом, к неуправляемой кальцификации [29]. Необходимы дальнейшие исследования для лучшего понимания этих механизмов и выяснения других патогенетических построений, способствующих развитию кальциноза при ССД.
Лечение
Общие мероприятия и поддерживающая терапия
Кальциноз остается важной терапевтической проблемой у пациентов с ССД. Общие мероприятия включают улучшение кровотока в конечностях, избегание травматизации, стрессовых факторов и воздействия холода. При наличии подозрения об инфицировании кальцинозных поражений необходимо назначение антибиотиков с антистрептококковой и антистафилококковой активностью, нестероидных противовоспалительных препаратов и даже опиоидов для облегчения боли [30]. Если кальциноз приобретает язвенное течение, необходима стандартная обработка ран [31].
Медикаментозная терапия
Несколько групп лекарственных препаратов были предложены для менеджмента пациентов с кальцинозом, однако с переменными результатами эффективности. Доказательства, подтверждающие целесообразность их применения, получены в основном из небольших ретроспективных исследований, серий и единичных клинических случаев (табл. 1).
Блокаторы кальциевых каналов
Блокаторы кальциевых каналов (БКК) снижают внутриклеточную миграцию кальция в пораженные ткани, нарушая образование и кристаллизацию очагов кальция. Дилтиазем является наиболее используемым и изученым БКК для лечения кальциноза. Ранние исследования показали обнадеживающие результаты с применением 240–480 мг/д дилтиазема для лечения кальциноза у пациентов с ССД [32–34], что было подтверждено в ретроспективной когорте 78 пациентов с АЗСТ клиники Мэйо. Дилтиазем был эффективен у 9 из 17 пациентов как терапия первой линии [35]. Тем не менее большое ретроспективное исследование не показало положительного влияния дилтиазема, по данным рентгенографического исследования, у 12 пациентов с ССД, получавших 180 мг/д дилтиазема в течение от 1 до 15 лет [36]. Обсервационное исследование Канадской исследовательской группы по склеродермии (CSRG) с использованием данных 5-летнего наблюдения не выявило существенных ассоциаций между использованием БКК и разрешением кальциноза (отношение шансов (ОШ) 0,9; 95% доверительный интервал (ДИ) 0,73–1,05). Только у пациентов с продолжительностью заболевания менее 5 лет использование БКК было связано с низким риском возникновения кальциноза (ОШ 0,62; 95% ДИ 0,45–0,86) [37].
Бисфосфонаты
Бисфосфонаты могут быть полезны в лечении кальциноза с целью обратного развития процесса кальцификации путем ингибирования продукции провоспалительных цитокинов макрофагами и снижения темпов резорбции костной ткани [38]. Единичные клинические наблюдения описывают улучшение течения кальциноза при внутривенном введении памидроната у взрослых пациентов с ЮДМ [39] и ДМ [40]. Аналогично, серия случаев показала частичное снижение кальциноза при терапии алендронатом у шести из девяти пациентов с ЮДМ [41]. Клинический случай с пациентом с ЛТ-ССД описывает рассасывания кальцификатов вследствие кальциноза после 6 мес. терапии ризедронатом, назначенным для терапии глюкокортикоидиндуцированного остеопороза [42]. Учитывая недостаточность доказательных исследований, эффективность бисфосфонатов в лечении кальциноза остается неясной.
Варфарин
Учитывая, что варфарин снижает уровень матриксного белка гамма-карбоксиглутаминовой кислоты, предотвращая ее карбоксилирование, были проведены исследования назначения низких доз варфарина для лечения АЗСТ-кальциноза [12]. В серии клинических наблюдений трех пациентов с ССД, получавших варфарин, описано разрешение кальциноза у двух пациентов через 1 год терапии [43]. Двойное слепое плацебо-контролируемое исследование семи пациентов с АЗСТ и множественными подкожными кальцификатами продемонстрировало снижение внескелетного поглощения кальция при сцинтиграфии всего тела с введением технеция 99m-дифосфоната у двух из трех пациентов с ССД, получавших варфарин 1 мг/д в течение 18 мес. [44]. Дополнительные серии клинических случаев обнаружили, что у двух из трех пациентов с ССД разрешение их распространенного кальциноза было обнаружено при физикальном осмотре через 1 год лечения низкими дозами варфарина [43]. Однако существуют и абсолютно диаметрально противоположные наблюдения. В исследовании клиники Мэйо у 4 из 19 пациентов с кальцинозом и АЗСТ, принимавших варфарин по другим показаниям, не было отмечено улучшений или изменений в течении кальциноза по сравнению с группой пациентов, которая не получала варфарин [35]. Еще в одном исследовании 6 пациентов с обширным кальцинозом лечение варфарином в течение 14,6 мес. также не было эффективно: у 5 пациентов отмечено ухудшение кальциноза [45]. Действительно, есть некоторые опасения, что варфарин может способствовать кальцификации через недостаточно карбоксилированный МГБ [12].
Тиосульфат натрия
Топическое (локальное) внутриочаговое и внутривенное введение тиосульфата натрия (ТСН) также было изучено для лечения кальциноза. Есть данные, описывающие два случая язвенного дистрофического кальциноза, устойчивого к местному лечению, но которые имели положительные ответы на топическое назначение 25% ТСН в сочетании с оксидом цинка [46]. Четыре пациента с кальцинозом (два с ССД и два с ДМ) показали значительное уменьшение размеров, эритемы и болей при локальном применении 25% метабисульфита натрия (МН), метаболита ТСН. Авторы предположили, что топический МН может растворять отложения кальция и способствовать местному расширению сосудов и заживлению ран [47]. J. Goossens et al. сообщили о двух случаях применения ТСН в виде еженедельных вводимых внутри–очагово инъекций по 1–3 г, приведших к облегчению боли, улучшению функции и уменьшению размера очага в два раза через 12 мес. терапии [48]. Большая серия клинических случаев описывает лечение восьми участков поражений кальцинозом у шести пациентов (пять с ССД и один с нефрогенным системным фиброзом) инъекциями 12,5–275 мг ТСН (150 мг/мл) в течение более 4 нед. К 4-й и 12-й нед. поражения уменьшились в размере на 67 и 90 % соответственно, и все пациенты сообщили об уменьшении боли и нарушения функции [49]. Еще одна серия клинических случаев четырех пациентов (ЛТ-ССД, дерматомиозит, ЮДМ, СКВ) продемонстрировала улучшение кальциноза после 6 циклов внутривенного введения ТСН, за исключением пациента с ЛТ-ССД [50]. Необходимы дальнейшие исследования эффективности ТСН для накопления доказательной базы как варианта для лечения кальциноза.
Биологические агенты
Есть данные об эффективности инфликсимаба у пациента с оверлап-синдромом: ССД-миозит и рефрактерный кальциноз. Инфликсимаб 3 мг/кг вводили внутривенно на 0, 2 и 6-й неделях, а затем каждые 8 нед. При этом отмечено уменьшение в размере кальцификатов и отсутствие новых депозитов через 41 мес. при контроле серией КТ [51].
Большинство данных литературы относительно биологической терапии кальциноза были сфокусированы на использовании ритуксимаба (РТК). Описан клинический случай эффективности РТК, назначенного еженедельно внутривенно № 4
(375 мг/м2); исследователи наблюдали улучшение или полное разрешение кальцинированных поражений [52]. Кроме того, серия клинических наблюдений 10 пациентов с ССД, получавших лечение РТК по поводу интерстициального заболевания легких (ИЗЛ), фиброза кожи и/или артрита, продемонстрировала улучшения и разрешение кальциноза у трех из шести пациентов [53]. Тем не менее есть данные недавнего исследования, показавшего обострение кальциноза у пациента с ДФ-ССД, который получал РТК для лечения ИЗЛ и артрита [54]. Аналогично, у двух пациентов, получавших РТК, наблюдалось прогрессирование кальциноза через 6 и 12 месяцев после лечения [55]. Поэтому в настоящее время РТК не может быть рекомендован для лечения кальциноза в связи с отсутствием успешных контролируемых исследований.
Другие препараты
В серии клинических случаев девяти пациентов с ЛТ-ССД и кальцинозом назначение 50 или 100 мг/д миноциклина в среднем в течение 3,5 года привело к снижению изъязвления и воспаления с незначительным уменьшением размера депозитов у восьми пациентов [56]. Отдельные случаи документально также подтвердили эффективность цефтриаксона [57], алюминия гидроксида [58], триамцинолона ацетонида для инъекций [59], колхицина [35, 60] и внутривенного иммуноглобулина [61] при лечении кальциноза, ассоциированного с ССД. Новое потенциально эффективное лечение кальциноза предложено исходя из предварительных данных исследования «Оценка легочной гипертензии и установление исходов при склеродермии» (PHAROS), в котором отмечено, что у двух пациентов с ССД, легочной артериальной гипертензией (ЛАГ) и кальцинозом, которым был назначен подкожный трепростинил для лечения ЛАГ, наблюдалось улучшение течения кальциноза через 6 мес., что было подтверждено радиографическими методами исследования [62]. Пероральный трепростинил в настоящее время изучается в клиническом исследовании пациентов с ССД и с кальцинозом кистей (NCT02663895).
Процедуры
Согласно проспективному исследованию 9 пациентов с кальцинозом (трое с ССД) было установлено, что три сеанса гекстракорпоральной ударно-волновой литотрипсии (ГУВЛ) с интервалом 3 недели уменьшали размер поражения и боль, ассоциированную с кальцинозом, через 6 мес. [63]. Недавнее 12-недельное исследование, в котором было проведено три еженедельных сеанса ГУВЛ, направленных на очаги поражения кальцинозом у четырех пациентов с ССД, обнаружило уменьшение размера поражения у трех пациентов и уменьшение боли у двух [64]. Лазерно-тканевая вапоризация углекислым газом дает отличную визуализацию и вапоризацию депозитов кальция, кроме того, на фоне этой процедуры было показано уменьшение боли и улучшение функции у пациентов с ССД-кальцинозом [65].
Пациенты с большими, локализованными и симптоматическими поражениями, особенно расположенными над сухожилиями, кровеносными сосудами и нервами, должны быть направлены для оперативного лечения [66]. В исследовательской клинике Мэйо все 11 пациентов, которые перенесли только хирургическое удаление кальцинированных очагов, и 16 из 17 пациентов, которые получили и медикаментозную, и хирургическую терапию, ответили на лечение. И напротив, только 7 из 19 пациентов, получавших только медикаментозную терапию, имели какой-либо ответ на лечение [35]. Специфические методы лечения, такие как кюретаж очагов кальциноза [66] или циторедуктивная операция с помощью высокоскоростного микросверла [67], эффективно снижали болевые ощущения и нетрудоспособность пациентов с кальцинозом, однако все поражения имели тенденцию к рецидиву.
Выводы
Кальциноз является распространенной проблемой у пациентов с ССД. Чаще всего он связан с поражением верхних конечностей, особенно пальцев. Хотя патогенез этого поражения все еще остается неясным, существуют доказательства таких потенциальных патогенетических механизмов, как хроническое воспаление, сосудистая гипоксия, местная травматизация и нарушение регуляции белков костного матрикса. Не существует универсальных и эффективных методов лечения кальциноза у пациентов с ССД; тем не менее были опубликованы некоторые данные использования нескольких фармакологических методов лечения, включая БКК, бисфосфонаты, варфарин и тиосульфат натрия. Хирургическое удаление очагов кальциноза остается основой лечения. Необходимо проведение клинических испытаний для определения эффективности существующих и новых методов лечения кальциноза.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждений.
Информация о вкладе каждого участника: Егудина Е.Д. — обзор литературы по проблеме, написание текста, подготовка статьи к печати; Головач И.Ю. — концепция и дизайн работы, обзор литературы по проблеме, коррекция текста.

/109-1.jpg)
/110-1.jpg)
/110-2.jpg)
/110-3.jpg)
/111-1.jpg)
/111-2.jpg)
/111-3.jpg)
/112-1.jpg)
/113-1.jpg)
/114-1.jpg)