Международный эндокринологический журнал Том 15, №3, 2019
Вернуться к номеру
Порівняльна оцінка активності клітин вродженого імунітету в пацієнтів із доброякісними та злоякісними захворюваннями щитоподібної залози після радіойодотерапії
Авторы: Захарченко Т.Ф., Гулеватий С.В., Волинець І.П.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета: дослідити вплив радіойодотерапії (РЙТ) на цитотоксичну активність NK-клітин та метаболічну активність нейтрофілів (НФ) у хворих на токсичний зоб (ТЗ) та у хворих на диференційований рак щитоподібної залози (ДРЩЗ) у динаміці. Матеріали та методи. Визначали функцію імунологічних показників у двох групах хворих. У групу А ввійшли 30 хворих на ТЗ віком від 23 до 67 років. Пацієнти отримали курс терапії йодом-131 активністю від 380 до 784 МБк. Групу В становили 29 пацієнтів віком від 24 до 65 років після тиреоїдектомії, в яких було діагностовано папілярну карциному без віддалених метастазів. Пацієнти групи В отримали курс терапії йодом-131 активністю від 3900 до 4720 МБк. Імунологічне дослідження проводили напередодні та в три терміни після РЙТ: 1 (5 чи 6 діб), 2 (від 1,5 до 3 міс.), 3 (від 6 до 7 міс.). Контрольні групи становили донори відповідного віку і статі. Цитотоксичну активність NК-клітин проти індикаторних клітин-мішеней визначали, використовуючи спектрофотометрію. Метаболічну активність НФ досліджували в стандартному тесті відновлення НСТ (нітросиній тетразолій). Результати. Виявлено, що у хворих на ТЗ і у хворих на ДРЩЗ напередодні РЙТ активність NK-клітин знижена в обох групах, активність НФ збільшена у хворих на ТЗ і знижена у хворих на ДРЩЗ. У ранній термін після РЙТ активність NK-клітин у хворих на ТЗ істотно збільшується, тоді як у хворих на ДРЩЗ цей показник не зазнає істотної зміни, активність НФ у хворих на ТЗ залишається високою, а у хворих на ДРЩЗ збільшується. У терміни від 1,5 до 7 міс. після РЙТ активність NK-клітин у хворих на ТЗ знижується до початкового значення, а у хворих на ДРЩЗ залишається низькою, активність НФ у хворих обох груп знижується. Висновки. Порівняльний аналіз результатів виявив різну динаміку активності NК-клітин та метаболічної активності НФ після РЙТ у хворих на ТЗ і у хворих на ДРЩЗ.
Цель: исследовать влияние радиойодотерапии (РЙТ) на цитотоксическую активность NK-клеток и метаболическую активность нейтрофилов (НФ) у больных токсическим зобом (ТЗ) и у больных дифференцированным раком щитовидной железы (ДРЩЖ) в динамике. Материалы и методы. Определяли функцию иммунологических показателей в двух группах больных. В группу А вошли 30 пациентов с ТЗ в возрасте от 23 до 67 лет. Пациенты получили курс терапии йода-131 активностью от 380 до 784 МБк. Группу В составили 29 пациентов в возрасте от 24 до 65 лет после тиреоидэктомии, у которых была диагностирована папиллярная карцинома без отдаленных метастазов. Пациенты группы В получили курс терапии йода-131 активностью от 3900 до 4720 МБк. Иммунологическое исследование проводили накануне и в три срока после РЙТ: 1 (5 или 6 суток), 2 (от 1,5 до 3 мес.), 3 (от 6 до 7 мес.). Контрольные группы состояли из доноров соответствующего возраста и пола. Цитотоксическую активность NК-клеток против индикаторных клеток-мишеней определяли, используя спектрофотометрию. Метаболическую активность НФ исследовали в стандартном тесте восстановления НСТ (нитросиний тетразолий). Результаты. Выявлено, что у больных ТЗ и у больных ДРЩЖ накануне РЙТ активность NK-клеток снижена в обеих группах, активность НФ увеличена у больных ТЗ и снижена у больных ДРЩЖ. В ранние сроки после РЙТ активность NK-клеток у больных ТЗ существенно увеличивается, в то время как у больных ДРЩЖ этот показатель не претерпевает существенных изменений, активность НФ у больных ТЗ остается высокой, а у больных ДРЩЖ увеличивается. В сроки от 1,5 до 7 мес. после РЙТ активность NK-клеток у больных ТЗ снижается до исходного значения, а у больных ДРЩЖ остается низкой, активность НФ у больных обеих групп снижается. Выводы. Сравнительный анализ результатов показал различную динамику активности NК-клеток и метаболической активности НФ после РЙТ у больных ТЗ и у больных ДРЩЖ.
Background. The effects of radioiodine therapy (RIT) on the cytotoxic activity of NK cells and the metabolic activity of neutrophils (NPs) were studied in patients with toxic goiter (TG) and differentiated thyroid carcinoma (DTC) over time. Materials and methods. The function of immunological parameters was evaluated in 2 groups of patients. Group A consisted of 30 persons with TG aged 23 to 67 years. They received a course of iodine-131 therapy with activity from 380 to 784 MBq. Group B included 29 patients aged 24 to 65 years after thyroidectomy, who were diagnosed with papillary carcinoma without distant metastases. They received a course of iodine-131 therapy with activity from 3900 to 4720 MBq. The immunological study was performed on the eve of RIT and three times after it: 1 (5 or 6 days), 2 (from 1.5 to 3 months), 3 (from 6 to 7 months). The control groups consisted of donors of the corresponding age and gender. The cytotoxic activity of NK cells against indicator target cells was determined using spectrophotometry. The metabolic activity of NPs was investigated in the standard nitroblue tetrazolium reduction test. Results. It was found that in patients with TG and DTC on the eve of RIT, the activity of NK cells was reduced in both groups, the activity of NPs was increased in persons with TG and decreased in individuals with DTC. In the early periods after RIT, the activity of NK cells in patients with TG significantly increases, while in persons with DTC, this index does not undergo significant changes, the activity of NPs in patients with TG remains high, and in persons with DTC, it increases. In the period from 1.5 to 7 months after RIT, the activity of NK cells in individuals with TG is reduced to the baseline value, and in persons with DTC — remains low, the activity of NPs in patients of both groups decreases. Conclusions. Comparative analysis of the results showed different dynamics of NK cells activity and NPs metabolic activity after RIT in patients with TG and DTC.
тиреотоксикоз; рак щитоподібної залози; радіойодотерапія; активність NK-клітин; метаболічна активність нейтрофілів
тиреотоксикоз; рак щитовидной железы; радиойодотерапия; активность NK-клеток; метаболическая активность нейтрофилов
thyrotoxicosis; thyroid cancer; radioiodine therapy; NK-cell activity; metabolic activity of neutrophils
Робота виконана в рамках НДР «Визначити особливості змін системи імунітету у хворих на токсичний зоб і карциному щитоподібної залози за умов лікування радіойодом».
Вступ
Дифузний токсичний зоб (ДТЗ) та диференційований рак щитоподібної залози (ДРЩЗ) — захворювання з різною етіологією і патогенезом. ДТЗ, або хвороба Базедова — Грейвса, належить до захворювань автоімунної природи з вродженим дефектом у системі імунологічного нагляду. У хворих на ДТЗ відбувається зрив автотолерантності до антигенів щитоподібної залози (ЩЗ). Автоімунний процес виникає задовго до появи клінічних симптомів і в подальшому набуває хронізації. Тирео–специфічні автоантитіла взаємодіють з автоантигенами, здебільшого з рецептором тиреотропного гормона (ТТГ–р) на тиреоцитах, і виконують ТТГ–стимулювальну функцію. У хворих на ДТЗ збільшується неконтрольована продукція тиреоїдних гормонів, що клінічно проявляється симптомами тиреотоксикозу. Гормональні порушення за ДТЗ супроводжуються змінами гуморальних та клітинних показників імунної системи [1–5]. Однак детальний механізм патогенезу ДТЗ на сьогодні ще не з’ясований. Застосування тиреостатиків у лікуванні ДТЗ не завжди ефективне та негативно впливає на окремі імунологічні показники.
За автоімунного тиреоїдиту Хашимото та хвороби Грейвса NK–клітини (natural killer cells), нейтрофіли (НФ), Т–регуляторні лімфоцити (Treg) та ін. входять до складу клітинних інфільтратів ЩЗ. Зменшення кількості Treg–клітин (CD4+CD25(high) і CD4+FoxP3) пов’язують з ініціацією і розвитком автоімунного процесу захворювань ЩЗ [3]. Субпопуляції активованих NK–клітин (CD3–CD16+CD56+) та NKТ–клітин (CD3+CD16+CD56+) можуть бути учасниками автоімунної відповіді, в тому числі і в ЩЗ, і проявляти деструктивну дію [1, 2]. Шляхом цитотоксичної дії NK–клітин або через продукцію ними прозапальних цитокінів може відбуватись апоптоз клітин власного організму. Гіперактивовані НФ через секрецію в позаклітинний простір токсичних продуктів — активних форм оксигену (АФО) здатні викликати інтратиреоїдне запалення та включити програму апоптозу тиреоцитів та клітин інфільтрату ЩЗ [4]. У пацієнтів, які страждають від хвороби Грейвса, виникає оксидативний стрес, що може збільшити у них клінічні прояви тиреоїдасоційованої автоімунної офтальмопатії [5, 6]. Однак роль NK–клітин та НФ в імунопатогенезі автоімунних захворювань ЩЗ і, зокрема ДТЗ, залишається нез’ясованою.
Основною функцією NK–клітин та НФ в організмі як елементів вродженого імунітету є здійснення імунологічного нагляду, раннє знищення інфікованих та пухлинних клітин в організмі тощо. Завдяки продукції цитокінів (IFN–γ, TNF–α, IL–8, ІL–12 та ін.) ці клітини виконують регуляторну функцію в організмі. Взаємодіючи з дендритними клітинами (DCs), CD8+–ефекторними лімфоцитами, NK–клітини модифікують адаптивні (специфічні) реакції імунної системи на трансформовані клітини. NK–клітини знаходяться в реципроктних відношеннях із супресорними лімфоцитами (CD8+, Treg), взаємодіють із НФ. Реакція НФ на пухлину неоднозначна. На ранніх етапах імунної відповіді НФ проявляють протипухлинну дію, а пізніше можуть сприяти ангіогенезу, непластичній прогресії (пропухлинна дія). У хворих на ДРЩЗ здебільшого імунна система зазнає змін, що характеризуються недостатністю протипухлинного імунітету, активізацією запального процесу [7, 8]. Дисбаланс цитотоксичних і Treg–лімфоцитів у пухлиноасоційованих інфільтратах сприяє більш агресивній поведінці раку ЩЗ [9].
Радіойодотерапія (РЙТ) є ефективним методом лікування не тільки ДРЩЗ, але й тиреотоксикозу (ДТЗ та вузлових його форм). Особливо набирає актуальності лікування ДТЗ йодом–131, коли інші методи терапії недостатньо ефективні чи мають протипоказання (виражені супутні захворювання, непереносимість ліків, ризик рецидиву). Однак застосування РЙТ за доброякісних та зло–якісних захворювань ЩЗ має відмінності. Так, у прооперованих хворих на ДРЩЗ ліквідація залишкової тканини, виявлення і лікування регіонарних та віддалених метастазів потребує значних активностей 131І (від 100 до 200 мКі) на одне введення. У хворих на ДТЗ величина активності радіойоду для РЙТ залежить від розміру ЩЗ та тяжкості тиреотоксикозу. Але порівняно з лікуванням карциноми ЩЗ активність 131І для терапії тиреотоксикозу набагато менша (від 10 до 22 мКі). При цьому поглинена доза на все тіло, розрахована дозиметричним та біологічним методами у хворих на ДРЩЗ та у хворих на ДТЗ, корелює з величиною уведеної активності 131І [10].
Лімфоїдна система є надзвичайно радіочутливою. Певні популяції та субпопуляції лімфоцитів вважаються маркерами радіаційного ураження. Нейтрофіли, макрофаги, DCs є більш резистентними до опромінення, ніж лімфоцити [11]. У наукових публікаціях обговорюються опосередковані ефекти високих прозапальних та низьких протизапальних доз опромінення in vitro та in vivo на функцію цих клітин [12].
Надмірне утворення та виділення в плазму крові АФО нейтрофілами може збільшити радіоіндуковані ефекти (ушкодження мембран, ферментних систем) та посилити мутагенний процес у клітині. Після РЙТ і у хворих на ДРЩЗ, і у хворих на ДТЗ виявляється збільшення хромосомних ушкоджень лімфоцитів периферичної крові, поява мікроядер [10, 13].
У хворих на ДТЗ після РЙТ можуть відбуватися загострення автоімунного процесу, зміна деяких кількісних та якісних імунологічних показників, дисбаланс цитокінів. Однак наведені в літературі дані щодо впливу РЙТ на NK–клітини та НФ у хворих на ДТЗ конфліктні та вивчені недостатньо [14, 15].
Метою дослідження стало визначення активності NK–клітин та метаболічної активності НФ у хворих із токсичним зобом (ТЗ) до та в різні терміни після РЙТ та порівняння з активністю цих клітин у хворих на ДРЩЗ.
Матеріали та методи
Визначали функцію імунологічних показників у двох групах хворих. У групу А ввійшли 30 пацієнтів (23 — жінки) віком від 23 до 67 років (середній вік — 47,0 ± 2,2 року) із ТЗ, із них 2 хворі на багатовузловий ТЗ. ДТЗ I ступеня діагностований у двох осіб, у решти — II ступеня. У 9 хворих виявлено тяжку форму перебігу хвороби, у інших — середньої тяжкості. Стан декомпенсації був у трьох пацієнтів, у інших — субкомпенсації. Із супутніх захворювань автоімунний тиреоїдит (АІТ) діагностували у двох осіб, цукровий діабет (ЦД) — в одного хворого, тиреотоксичну офтальмопатію — у чотирьох хворих. Пацієнти отримали 1 курс терапії йодом–131 активністю від 380 до 784 МБк (у середньому 549 ± 29).
Групу В становили 29 пацієнтів після тиреоїд–ектомії віком від 24 до 65 років (середній вік — 47,0 ± 2,2 року), в яких було діагностовано папілярну карциному (в стадії Т4 — одна особа, в стадії Т1–3 — інші) без віддалених метастазів. Регіонарні метастази в лімфовузли шиї були у восьми осіб. Пацієнти групи В отримали 1 курс терапії йодом–131 активністю від 3900 до 4720 МБк (у середньому 4441 ± 72). Імунологічне дослідження проводили напередодні та в три терміни після РЙТ: 1 (5 чи 6 діб), 2 (від 1,5 до 3 міс.), 3 (від 6 до 7 міс.). Конт–рольні групи становили донори відповідного віку і статі. Цитотоксичну активність NК–клітин проти індикаторних клітин–мішеней визначали, використовуючи спектрофотометрію [8]. Метаболічну активність НФ досліджували в стандартному тесті відновлення НСТ (нітросиній тетразолій).
Cтатистичне опрацювання одержаних даних проводили з використанням комп’ютерних програм Microsoft Excel, BioStat та критерію (t) Стьюдента. Результати оцінювали за рівнем значущості (p < 0,05).
Результати
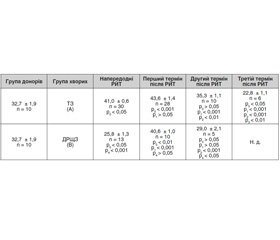
Результати дослідження активності NK–клітин у групі А хворих із тиреотоксикозом напередодні РЙТ (початкове значення) показали зниження показника на 25 % порівняно з групою донорів (контроль). У перший термін після РЙТ активність NK–клітин підвищується на 41 % відносно первинного значення і перевищує показник у донорів. У другий та третій терміни після РЙТ активність NK–клітин знижується на 24 та 28 % відповідно порівняно з показником у перший термін і статистично не відрізняється ні від початкового показника, ні від групи контролю.
У хворих на ДРЩЗ без віддалених метастазів (група В) активність NK–клітин напередодні РЙТ також нижча на 25 %, ніж у групі донорів. В усі терміни після РЙТ активність NK–клітин залишається низькою (табл. 1).
Проведення порівняльного аналізу активності NK–клітин у хворих на ТЗ і у хворих на ДРЩЗ без віддалених метастазів показало, що напередодні РЙТ активність цих клітин статистично не відрізняється в обох групах. У термін 5 чи 6 діб після РЙТ цей показник у хворих групи А істотно збільшується, тоді як у хворих групи В він не зазнає значної зміни. У другий та третій терміни після РЙТ активність NK–клітин у хворих на ТЗ (група А) знижується порівняно з показником у перший термін після РЙТ. На відміну від цього у хворих на ДРЩЗ (група В) активність цих клітин у другому та третьому термінах після РЙТ змінюється неістотно порівняно з показником у першому терміні. В усі терміни після РЙТ функція NK–клітин статистично значуще вища в групі А, ніж у групі В.
Дослідження впливу РЙТ на метаболічну активність НФ периферичної крові виявило, що цей показник у групі хворих на ТЗ напередодні РЙТ збільшений на 20 % порівняно з контролем. У ранній (1) термін після РЙТ активність НФ у хворих на ТЗ вірогідно не змінюється порівняно з початковим значенням і залишається збільшеною. У другий термін після РЙТ активність НФ у цих хворих знижується на 19 % і досягає норми. У третій термін після РЙТ активність НФ продовжує знижуватись: на 44 % порівняно з початковим значенням, на 48 % порівняно з першим терміном, на 35 % порівняно з другим терміном і навіть на 30 % порівняно з нормою (табл. 2).
У хворих на ДРЩЗ без віддалених метастазів (група В) активність НФ напередодні РЙТ знижена на 21 % порівняно з контролем. У ранній (1) термін після РЙТ активність НФ у хворих групи В значно (на 37 %) підвищується порівняно з початковим значенням. У другий термін після РЙТ активність НФ у цих хворих знижується на 29 % і досягає первинного значення та норми.
Результати дослідження показали, що в обох групах активність НФ збільшена в ранній термін після РЙТ із подальшим зниженням в інші терміни.
Порівняльний аналіз одержаних результатів у хворих на ТЗ (група А) та у хворих на ДРЩЗ без віддалених метастазів (група В) виявив, що напередодні РЙТ метаболічна активність НФ у хворих групи А на 37 % вища, ніж у хворих групи В. У перший термін після РЙТ активність НФ у групі А майже така, як у групі В. У другий термін після РЙТ показник активності НФ у групі А на 18 % більший, ніж у групі В. Тобто в усі терміни до і майже в усі після РЙТ активність НФ у хворих на ТЗ вища, ніж у хворих на ДРЩЗ без віддалених метастазів.
Обговорення
Тиреоїдні гормони (тироксин і трийодтиронін) діють як модулятори імунної відповіді. Імунні функції, в тому числі активність NK–клітин, НФ, синтез і вивільнення цитокінів, продукція АФО змінюються в умовах гіпо– та гіпертиреозу, хоча для багатьох імунних клітин чіткої кореляції між рівнем тиреоїдних гормонів і впливом їх на імунну відповідь не виявлено [16, 17].
У хворих на АІТ та ДТЗ дослідники відзначають зміни NK–клітин, НФ тощо [18]. Однак рівень показників NK–клітин за автоімунних тиреопатій до цього часу залишається неоднозначним. Одні автори повідомили про збільшення кількості чи активності NK–клітин у пацієнтів із хворобою Грейвса та тиреоїдитом Хашимото, інші наводять дані про незначні зміни NK–клітин у таких хворих [1, 18]. Наші результати узгоджуються з показниками, які свідчать про зниження кількості NK–клітин (CD16+, CD56+, CD16+CD56+CD3–), NKТ–клітин (CD16/56+CD3+) і/або активності NK–клітин у хворих на ДТЗ [2, 14]. Така розбіжність даних, можливо, пояснюється різними етапами дослідження автоімунного процесу (ініціація, загострення або ремісія хвороби), а також можливим перерозподілом лімфоцитів периферичної крові через інфільтрацію органа–мішені.
Підвищення активності НФ у хворих на ТЗ, виявлене в нашому дослідженні, може бути компенсаторним у відповідь на зниження кількості цих клітин у периферичній крові, про що свідчать результати досліджень інших авторів у хворих з автоімунними тиреопатіями [18].
З іншого боку, джерела літератури свідчать, що у хворих із гіпертиреозом функція НФ, зокрема продукція АФО, збільшується під впливом тиреоїдних гормонів [4, 5, 16]. Треба зазначити, що в нашому дослідженні більшість хворих на ТЗ до РЙТ перебували в стані субкомпенсації, а деякі з них — декомпенсації. Перед РЙТ тиреостатики відмінялися (за декілька днів) для кращого захвату радіойоду. Тобто хворі могли перебувати в стані гіпертиреозу, який впливав на активність НФ. Результати дослідження метаболічної активації НФ у хворих на ТЗ узгоджуються з даними літератури [4, 5].
Важливим чинником патогенезу автоімунних захворювань ЩЗ є оксидативний стрес, опосередкований АФО. Екпериментальні та клінічні дослідження показали, що збільшення прооксидантів та зниження антиоксидантів можуть безпосередньо сприяти певному клінічному прояву хвороби Грейвса, включаючи орбітопатію [6].
В науковій публікації показано, що у хворих на ДРЩЗ супресивна гормонотерапія левотироксином стимулює функцію Т–лімфоцитів, кількість NK–клітин [17]. Однак відзначимо, що у хворих на ДРЩЗ дослідження імунологічних показників проводилось у стані гіпотиреозу, оскільки підготовка до РЙТ у них передбачає відміну гормонотерапії для кращого накопичення йоду–131 залишковою тканиною та метастазами ЩЗ.
Хоча у хворих на ДРЩЗ і у хворих на ТЗ напередодні РЙТ різний гормональний стан, функціональний показник NK–клітин у хворих на ДРЩЗ і у хворих на ТЗ напередодні РЙТ змінюється в одному напрямку (знижується). Натомість активність НФ у хворих на ТЗ і на ДРЩЗ змінюється в різних напрямках (відповідно збільшується і зменшується).
Результати дослідження активності NK–клітин у хворих на ТЗ під впливом РЙТ збігаються з даними літератури. Після проведення РЙТ у пацієнтів із хворобою Грейвса було виявлено відновлення показника активності NK–клітин, який до цього був знижений [15]. Тобто після опромінення у цих хворих відбулось підвищення активності NK–клітин до рівня норми. Про існування активуючого ефекту низьких доз радіації на функцію NK–клітин повідомили й інші дослідники [19].
Збільшенню активності NK–клітин, зростанню автоімунності в організмі може сприяти порушення імунорегуляції. Враховуючи взаємовплив NK–клітин і Treg–лімфоцитів, можна опосередковано оцінити їх стан. Зниження кількості й активності супресорних Treg–лімфоцитів, яке може призвести до активації NK–клітин, було показано в пацієнтів з автоімунними захворюваннями ЩЗ [3].
Джерела літератури свідчать, що у пацієнтів із хворобою Грейвса незабаром після РЙТ змінюється кількість Treg– і NKT–лімфоцитів, знижується супресорна функція Treg–лімфоцитів [20]. NKT–клітини, як і NK–клітини, належать до імунорегуляторних лімфоцитів. За допомогою секреції цитокінів вони здатні активувати інші лімфоцити, в тому числі NK–клітини.
Дослідження, проведені нами раніше, показали, що у хворих без віддалених метастазів ДРЩЗ молодого віку ще до РЙТ в умовах відміни левотироксину активність NK–клітин нижча на 22 %, а у хворих старшого віку — нижча на 28 % за показник у донорів. Після РЙТ активність NК–клітин у хворих молодого віку не виявила значної зміни щодо початкового значення на відміну від показника NК–клітин у хворих старшого віку, в яких він додатково знижувався і залишався низьким впродовж 6 міс. [8].
Динаміка активності NK–клітин у хворих на ТЗ після РЙТ відрізняється від показників у хворих на ДРЩЗ. У хворих на ТЗ показане значне підвищення (на 41 %) щодо первинного значення активності NK–клітин у ранній термін після РЙТ із подальшою нормалізацією показника, тоді як у хворих на ДРЩЗ активність NK–клітин після РЙТ залишається низькою, що може бути зумовлено різним гормональним станом (гіпер– і гіпотиреозом відповідно).
Виявлені нами відмінності функції NK–клітин після РЙТ у хворих на ТЗ та на ДРЩЗ можуть бути спричинені впливом різної активності 131І та поглиненої дози на клітини крові, характером розподілу радіойоду в організмі. За даними літератури, у хворих на ДТЗ через 24 год після РЙТ поглинена доза 131I тканиною ЩЗ (uptake) становила 64 %, ефективний період напіврозпаду (Т–effective half–life) 131I в усьому тілі тривав 5,4 дня [21]. У той час у хворих на ДРЩЗ поглинання 131І залишковою тканиною ЩЗ значно менше (0,9 % через 48 год) і виведення його з організму значно швидше (15,7 год) [22]. Можливо, у хворих на ТЗ 131І зумовлює поступове (фракційне) опромінення клітин циркулюючої крові меншою дозою і протягом тривалішого часу, а у хворих на ДРЩЗ відбувається гостре опромінення клітин крові більшою дозою 131І.
До того ж після введення 431,5 ± 112,3 МБк 131І пацієнтам із хворобою Грейвса ушкодження ДНК лімфоцитів (утворення мікроядер) було значно нижчим, ніж після введення 4347,2 ± 693,8 МБк 131І для аблятивної РЙТ хворим на ДРЩЗ. Через 1 міс. після РЙТ кількість мікроядер в обох групах зменшувалася, причому у хворих на ДРЩЗ більшою мірою. Зниження кількості мікроядер пов’язують із загибеллю і вилученням із циркуляції клітин із значними радіоіндукованими ушкодженнями [10].
Літературні дані показали, що після введення йоду–131 пацієнтам із хворобою Грейвса ушкодження ДНК у лімфоцитах може бути прямим наслідком не тільки впливу опромінення на генетичний матеріал, але й порушення окисно–відновного балансу [13]. Хоча інші автори виявили, що лікування радіойодом (419 МБк) пацієнтів із доброякісним вузловим зобом ЩЗ не збільшувало системний оксидативний стрес, що визначався за допомогою метаболітів нуклеїнових кислот у сечі [23].
Існує думка, що інтенсивність оксидативного стресу у хворих із гіпертиреозом більшою мірою залежить не стільки від впливу радіойоду, скільки від тиреометаболічного стану [24]. Зважаючи на це, можна припустити, що високе значення активності НФ після РЙТ у хворих на ТЗ підтримується тимчасовим вивільненням значної кількості тиреоїдних гормонів із зруйнованих радіацією тиреоцитів.
У хворих на ДРЩЗ у ранній термін після РЙТ показано активацію НФ, що узгоджується з результатами дослідження інших авторів про збільшення продукції АФО та зниження антиоксидантів — вітамінів С, Е, мікроелементу селена [25]. Зростання оксигенозалежної активності НФ після РЙТ у даному випадку, можливо, значніше пов’язано з реакцією на опромінення.
Зіставлення одержаних даних показало, що активність NK–клітин в усі терміни після РЙТ та активність НФ до і майже в усі терміни після РЙТ вища у хворих на ТЗ, ніж у хворих на ДРЩЗ. Одним із пояснень цього може бути особливість патології (в одному випадку — доброякісне автоімунне захворювання, в іншому — злоякісне новоутворення), різна активність та характер накопичення введеного радіойоду.
Висновки
1. Порівняльний аналіз показників у хворих на ТЗ і у хворих на ДРЩЗ без віддалених метастазів виявив, що напередодні РЙТ активність NK–клітин знижена в обох групах, метаболічна активність НФ збільшена у хворих на ТЗ і знижена у хворих на ДРЩЗ.
2. У ранній термін після РЙТ активність NK–клітин у хворих на ТЗ істотно збільшується, тоді як у хворих на ДРЩЗ цей показник не зазнає істотної зміни, метаболічна активність НФ у хворих на ТЗ залишається високою, а у хворих на ДРЩЗ збільшується.
3. У терміни від 1,5 до 7 міс. після РЙТ активність NK–клітин у хворих на ТЗ знижується до початкового значення, а у хворих на ДРЩЗ вона залишається низькою, метаболічна активність НФ у хворих обох груп знижується.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/212-1.jpg)
/213-1.jpg)