Журнал «Здоровье ребенка» Том 14, Додаток 1, 2019 Дитяча гастроентерологія та нутриціологія
Вернуться к номеру
Особливості використання неінвазивних тестів оцінки фіброзу печінки у підлітків з ожирінням
Авторы: Пархоменко Л.К., Страшок Л.А., Хоменко М.А.
Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. На сьогодні поширеність ожиріння серед дітей набула масштабів глобальної епідемії. Значення цієї проблеми обумовлюється розвитком інсулінорезистентності (ІР) та метаболічного синдрому, печінковою маніфестацією якого вважають розвиток неалкогольної жирової хвороби печінки (НАЖХП), що може призводити до формування фібротичних змін в органі вже у дитячому віці. Застосування методів неінвазивної оцінки фіброзу печінки у дітей, хворих на ожиріння та НАЖХП, дозволяє уникнути призначення біопсії печінки у частини хворих, тому є актуальним питанням педіатрії. Мета дослідження — вивчити можливість використання неінвазивних тестів оцінки фіброзу печінки у підлітків з ожирінням залежно від наявності інсулінорезистентності. Матеріали та методи. В дослідження було включено 84 підлітки віком 12–17 років з ожирінням. Проводили клінічне та лабораторно-інструментальне обстеження. Для оцінки фіброзу печінки здійснювали розрахунок індексів: APRI (AST to Platelet Ratio Index), PNFI (pediatric NAFLD fibrosis index) та FIB-4 (Fibrosis-4). Результати. У підлітків з ожирінням переважали скарги на підвищений апетит — 78,6 %, диспептичні розлади — 54,8 %, біль у животі — 52,3 %. Залежно від наявності інсулінорезистентності хворих було розподілено на дві групи: 66,7 % підлітків з IP та 33,3 % підлітків без IP. При біохімічному аналізі крові у хворих з ІР були виявлені вірогідно вищі рівні тригліцеридів, холестерину ліпопротеїдів дуже низької щільності, коефіцієнта атерогенності, індексу HOMA-IR. У 82,1 % пацієнтів за даними ультразвукового дослідження спостерігалися ознаки НАЖХП. При оцінці фіброзу печінки за розрахунком індексу PNFI встановлені ознаки фіброзу у 35,7 % хворих, а його середні значення були вірогідно вищими у хворих з ІР. Не відмічено жодного хворого з ознаками значного фіброзу печінки на підставі розрахунку індексів FIB-4 та APRI незалежно від наявності ІР. Висновки. У 82,1 % підлітків, хворих на ожиріння, відмічаються ознаки НАЖХП, а у 66,7 % діагностується ІР. Використання індексів оцінки фіброзу печінки засвідчило, що найбільш інформативним був індекс PNFI, за допомогою якого було виявлено ознаки фіброзу у третини підлітків з ожирінням.
Актуальность. На сегодняшний день распространенность ожирения среди детей приобрела масштабы глобальной эпидемии. Значение этой проблемы обусловливается развитием инсулинорезистентности (ИР) и метаболического синдрома, печеночной манифестацией которого считают развитие неалкогольной жировой болезни печени (НАЖБП), что может приводить к формированию фибротических изменений в органе уже в детском возрасте. Применение методов неинвазивной оценки фиброза печени у детей, больных ожирением и НАЖБП, позволяет избежать назначения биопсии печени у части больных, поэтому является актуальным вопросом педиатрии. Цель исследования — изучить возможность использования неинвазивных тестов оценки фиброза печени у подростков с ожирением в зависимости от наличия инсулинорезистентности. Материалы и методы. В исследование было включено 84 подростка в возрасте 12–17 лет с ожирением. Проводили клиническое и лабораторно-инструментальное исследования. Для оценки фиброза печени осуществляли расчет индексов: APRI (AST to Platelet Ratio Index), PNFI (pediatric NAFLD fibrosis index) и FIB-4 (Fibrosis-4). Результаты. У подростков с ожирением преобладали жалобы на повышенный аппетит — 78,6 %, диспептические расстройства — 54,8 %, боль в животе — 52,3 %. В зависимости от наличия инсулинорезистентности больные были поделены на две группы: 66,7 % подростков с ИP и 33,3 % подростков без ИP. При биохимическом анализе крови у больных с ИP были обнаружены достоверно более высокие уровни триглицеридов, холестерина липопротеидов очень низкой плотности, коэффициента атерогенности, индекса HOMA-IR. У 82,1 % пациентов по данным ультразвукового исследования наблюдались признаки НАЖБП. При оценке фиброза печени по расчету индекса PNFI установлены признаки фиброза у 35,7 % больных, а его средние значения были достоверно выше у больных с ИР. Не отмечено ни одного больного с признаками значительного фиброза печени на основании расчета индексов FIB-4 и APRI независимо от наличия ИР. Выводы. У 82,1 % подростков, больных ожирением, отмечаются признаки НАЖБП, а у 66,7 % диагностируется ИР. Использование индексов оценки фиброза печени показало, что наиболее информативным был индекс PNFI, с помощью которого были выявлены признаки фиброза у трети подростков с ожирением.
Background. The prevalence of obesity among children has become a global epidemic today. The importance of this problem is caused by the development of insulin resistance and metabolic syndrome, the hepatic manifestation of which is considered the development of non-alcoholic fatty liver disease (NAFLD), which can lead to the formation of fibrotic changes in the organ already in childhood. The use of non-invasive assessment of liver fibrosis in obese children with NAFLD allows avoid the liver biopsy in some patients, therefore, it is an urgent issue of pediatrics. The purpose of the study was to examine the possibility of using non-invasive tests to assess liver fibrosis in obese adolescents, depending on the presence of insulin resistance. Materials and methods. The study involved 84 adolescents with obesity aged 12–17 years old. A clinical, laboratory and instrumental examination was conducted. For the assessment of liver fibrosis, the following indices were calculated: AST to Platelet Ratio Index (APRI), pediatric NAFLD fibrosis index (PNFI) и Fibrosis-4 (FIB-4). Results. The basic complains among obese adolescents were: increased appetite — 78.6 %, dyspepsia — 54.8 %, abdominal pain — 52.3 %. Depending on the presence of insulin resistance (IR), the patients were divided into two groups: 66.7 % of adolescents with IR and 33.3 % of adolescents without IR. Biochemical analysis of blood in patients with IR revealed significantly higher levels of triglycerides, very low density lipoprotein cholesterol, atherogenic coefficient, HOMA-IR. According to ultrasound examination results, 82.1 % of patients showed signs of NAFLD. When assessing liver fibrosis by calculating PNFI, 35.7 % of patients demonstrated fibrosis signs, and its mean values were significantly higher in patients with IR. There were no patients with signs of significant liver fibrosis on the basis of calculation of FIB-4 and APRI indices, regardless of IR presence. Conclusions. 82.1 % of obese adolescents had signs of NAFLD and 66.7 % were diagnosed with IR. The use of indices for assessing liver fibrosis revealed PNFI to be the most informative one, which showed signs of fibrosis in a one third of obese adolescents.
підлітки; ожиріння; неінвазивні тести оцінки фіброзу печінки; неалкогольна жирова хвороба печінки
подростки; ожирение; неинвазивные тесты оценки фиброза печени; неалкогольная жировая болезнь печени
adolescents; obesity; non-invasive tests for liver fibrosis assessment; non-alcoholic fatty liver disease
Вступ
Нещодавно оприлюднені дані Всесвітньої організації охорони здоров’я свідчать про стрімке зростання поширеності ожиріння та надлишкової маси тіла у дітей віком 5–19 років — з 11 мільйонів в 1975 році до 124 мільйонів у 2016 році [1]. Ожиріння та інсулінорезистентність (ІР) є основою для метаболічного синдрому та мають негативний вплив на низку органів і систем вже у дитячому віці: серцево-судинну, скелетно-м’язову, нервову системи, шлунково-кишковий тракт, підшлункову залозу, печінку тощо [2–4]. Патологічні зміни печінки при ожирінні характеризуються розвитком неалкогольної жирової хвороби печінки (НАЖХП), що може прогресувати до неалкогольного стеатогепатиту, фіброзу та навіть цирозу [5–7]. Поширеність НАЖХП коливається від 3 % у загальній дитячій популяції до 80 % у дітей з ожирінням [8]. Дослідниками широко обговорюється питання значення інсулінорезистентності в розвитку НАЖХП, і часто складно встановити, інсулінорезистентність є причиною чи наслідком захворювання. Однак на сьогодні провідною є думка, що це нерозривно пов’язані процеси [15, 16].
Наявність фібротичних змін у печінці — важливий фактор для прогнозування подальшого розвитку НАЖХП та передбачення ризику формування цирозу вже у дитячому віці [9]. Таким чином, постає необхідність ранньої діагностики фіброзу для попередження розвитку подальших тяжких ускладнень. Золотий стандарт для оцінки фіброзу печінки — біопсія. Але, зважаючи на те, що процедура є технічно вимогливою та пов’язана з ризиком ускладнень, застосування методів неінвазивної оцінки фіброзу печінки у дітей з ожирінням є актуальним питанням педіатрії.
На сьогодні розроблено ряд неінвазивних тестів для оцінки фіброзу печінки, в основі яких лежить розрахунок комбінацій прямих і непрямих маркерів фіброзу [10–15]. До прямих маркерів, що характеризують метаболізм у клітинному матриксі та/або зміни в зірчастих клітинах печінки, відносять колаген IV і VI, амінотермінальний фрагмент проколагену III (PIIINP), гіалуронову кислоту, матриксні металопротеїнази (ММР) і тканинні інгібітори металопротеїназ (TIMP). Непрямі маркери фіброзу представлені сполуками, що вивільняються в кров у результаті запального процесу в печінці: аланінамінотрансфераза (АЛТ), аспартатамінотрансфераза (АСТ), феритин, гаптоглобін, аполіпопротеїн А1, альфа-2-макроглобулін, фактори згортання крові, маркери холестазу, а саме холестерин, білірубін, лужна фосфатаза (ЛФ), g-глутамілтранспептидаза (ГГТ) тощо [16] (табл. 1).
Деякі з них вже використовуються і в педіатричній практиці [17, 18]. Проте головним недоліком таких тестів, як наприклад ELF, Fibrotest, Hepascore, є те, що всі вони потребують визначення специфічних біомаркерів, що робить їх дорогими і, отже, недоступними для застосування більшістю лікарів. Саме тому такі тести, як APRI, FIB-4, PNFI, що засновані на використанні клінічних і доступних рутинних лабораторних показників, є важливими інструментами для оцінки фіброзу печінки у дітей з ожирінням та НАЖХП.
Індекс PNFI розроблений спеціально для оцінки фіброзу у дитячому віці [10]. Показник ≥ 9 має прогностичне значення у більше ніж 90 % випадків фіброзу. Про присутність значних фібротичних змін у печінці свідчать значення FIB-4 ≥ 3,25 [11] та APRI > 1,5 [12]. Використання простих неінвазивних тестів оцінки фіброзу дозволяє виключити призначення біопсії печінки з діагностичної програми значної кількості підлітків, хворих на ожиріння та НАЖХП.
Мета: вивчити можливості використання неінвазивних тестів оцінки фіброзу печінки у підлітків з ожирінням залежно від наявності інсулінорезистентності.
Матеріали та методи
Проведено клініко-анамнестичне обстеження 84 підлітків, з яких 59,5 % юнаків та 40,5 % дівчат віком 12–17 років, хворих на ожиріння, які перебували на стаціонарному лікуванні в ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України». Діагноз встановлено згідно з Міжнародною класифікацією хвороб 10-го перегляду та на підставі протоколу надання медичної допомоги дітям, хворим на ожиріння (Наказ МОЗ України від 24.04.2006 № 254).
При лабораторному дослідженні визначались біохімічні показники: рівень аланінамінотрансферази, аспартатамінотрансферази, лужної фосфатази, загального білірубіну та його фракцій, глюкози натще, імунореактивного інсуліну, тригліцеридів (ТГ), загального холестерину (ЗХ), холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ), проводився розрахунок вмісту холестерину ліпопротеїдів низької (ХС ЛПНЩ) і дуже низької (ХС ЛПДНЩ) щільності, коефіцієнта атерогенності (КА), індексу HOMA-IR (Homeostasis Model Assessment of Insulin Resistance). Дослідження виконували за загальноприйнятими методиками.
Хворим проводили розрахунок індексів фіброзу печінки [10–12]:
— APRI, що розраховується як відношення рівня аспартатамінотрансферази до рівня тромбоцитів:
APRI = ([АСТ (Од/л) / верхня межа АСТ (Од/л)] × 100) / тромбоцити (109/л);
— PNFI, в основі обчислення якого лежать рівень тригліцеридів, вік та окружність талії:
PNFI = 1 / (1 + e–lp) ´ 10,
де lp = 6,539 ´ loge [вік(роки)] + 0,207 ´ окружність талії (см) + 1,957 ´ loge [ТГ (мг/дл)] – 10,074;
— FIB-4, значення якого залежить від рівня аланінамінотрансферази, аспартатамінотрансферази, тромбоцитів та віку:
FIB-4 = вік (роки) × АСТ (Од/л) / [тромбоцити (109/л) × АЛТ 1/2(Од/л)].
Отримані результати обробляли методом варіаційної статистики з використанням пакетів комп’ютерних програм Exсel 2010 (Microsoft), Statistica 6,0. Критичний рівень значущості при перевірці статистичних гіпотез приймався рівним p ≤ 0,05.
Результати та обговорення
Залежно від наявності інсулінорезистентності хворих розподілили на дві групи: 66,7 % підлітків з IP (I група) та 33,3 % підлітків без IP (II група). В результаті клініко-анамнестичного дослідження виявлено, що у 78,6 % хворих відмічався підвищений апетит, диспептичні симптоми — у 54,8 %, біль в животі різної локалізації — у 52,3 %, метеоризм — у 29,8 %, нестійкі випорожнення — у 23,8 %, запори — у 21,4 %. Об’єктивним обстеженням хворих було встановлено болючість в правому підребер’ї у 42,8 % підлітків, в епігастрії — у 32,1 %, збільшення печінки визначалося у 90,5 %. Частота зустрічальності скарг не відрізнялася залежно від наявності ІР. При визначенні антропометричних показників індекс маси тіла дорівнював 31,04 ± 0,47 кг/м2 (31,41 ± 0,56 кг/м2 у хворих з ІР, 30,31 ± 0,86 кг/м2 — без ІР, p > 0,05). У табл. 2 наведено результати біохімічного дослідження в обстежених хворих.
Серед показників ліпідного спектра вірогідно вищими у хворих I групи були рівні ТГ, ХС ЛПДНЩ, КА, а вміст ЗХ, ХС ЛПВЩ, ХС ЛПНЩ вірогідно не відрізнявся. Значення показників вуглеводного обміну очікувано були вірогідно вищими в групі хворих з ІР (табл. 2). Ознаки НАЖХП за даними ультразвукового дослідження у вигляді збільшення розмірів печінки, підвищення ехогенності її паренхіми, згладженості судинного рисунка виявлено у 82,1 % підлітків, хворих на ожиріння.
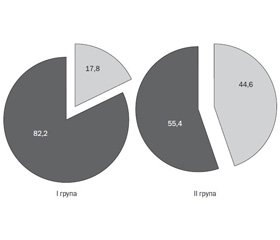
При оцінці фіброзу печінки методом підрахунку індексу PNFI встановлено, що показник ≥ 9 мали 35,7 % хворих: 44,60 % — з ІР та 17,8 % — без ІР, а його середні значення були вірогідно вищими у хворих I групи порівняно із підлітками II групи (8,02 ± 0,33 проти 5,96 ± 0,60, р < 0,01) (рис. 1, 2).
Значення індексів FIB-4 та APRI мали тенденцію до збільшення у хворих з ІР, але вірогідно не відрізнялися: 0,32 ± 0,02 проти 0,29 ± 0,02 (p > 0,05) та 0,30 ± 0,03 проти 0,26 ± 0,02 (p > 0,05) відповідно (рис. 3). При цьому не відмічено жодного хворого із значенням FIB-4 ≥ 3,25 та APRI > 1,5, що свідчило б про наявність значного фіброзу печінки.
Останнім часом обговорюється доцільність використання індексів, що базуються на застосуванні рівня трансаміназ для оцінки фіброзу печінки у хворих на ожиріння з НАЖХП [19, 20]. У нашому дослідженні при розрахунку індексів APRI та FIB-4 не отримано даних, що підтверджують наявність значного фіброзу у підлітків з ожирінням. Це може бути обумовлено тим, що у підлітків з НАЖХП рівень трансаміназ протягом тривалого часу може не перевищувати верхніх порогових значень або бути незначно підвищеним на фоні вже зміненої гістологічної картини печінки. Також треба зазначити, що індекси APRI та FIB-4 спрямовані на виявлення значних фібротичних змін у печінці, що не притаманні дитячому віку. Таким чином, при використанні індексів APRI та FIB-4 у підлітків, хворих на ожиріння, доцільним є їх розрахунок в комбінації з іншими індексами для уточнення отриманих результатів.
Висновки
1. У 66,7 % підлітків з ожирінням було виявлено наявність ІР. У цих хворих вірогідно вищими були рівні ТГ, ХС ЛПДНЩ, КА, глюкози натще, імунореактивного інсуліну, індексу HOMA.
2. Використання індексів оцінки фіброзу засвідчило, що найбільш інформативним був індекс PNFI, яким було виявлено ознаки фіброзу у третини підлітків з ожирінням, а саме у 44,6 % хворих з ІР та у 17,8 % хворих без ІР, що може свідчити про вплив ІР на розвиток та прогресування НАЖХП. Це дало змогу призначення своєчасного лікування підліткам, хворим на ожиріння.
3. При використанні у підлітків з ожирінням індексів FIB-4 та APRI не виявлено хворих з ознаками значних фібротичних змін печінки.
4. Безпечність та доступність використання тестів оцінки фіброзу печінки у підлітків, хворих на ожиріння, є підставою для включення їх у програми моніторингу захворювань печінки з тривалим періодом розвитку, таких як НАЖХП.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Commission on Ending Childhood Obesity. Facts and figures on childhood obesity / World Health Organization [et al.]. — World Health Organization: Geneva, Switzerland. — 2017.
2. Xu S. Pediatric obesity: Causes, symptoms, prevention and treatment / S. Xu, Y. Xue // Exp. Ther. Med. — 2016. — Vol. 11, № 1. — P. 15-20. doi: 10.1136/gutjnl-2014-308379.
3. Child and adolescent obesity: part of a bigger picture / T. Lobstein [et al.] // The Lancet. — 2015. — Vol. 385, № 9986. — P. 2510-2520. doi: 10.1016/S0140-6736(14)61746-3.
4. Kumar S. Review of childhood obesity: from epidemiology, etiology, and comorbidities to clinical assessment and treatment / S. Kumar, A.S. Kelly // Mayo Clin. Proc. — 2017. — Vol. 92, № 2. — P. 251-265. doi: 10.1016/j.mayocp.2016.09.017.
5. Selvakumar P.K. Nonalcoholic fatty liver disease in children: not a small matter / P.K. Selvakumar, M.N. Kabbany, N. Alkhouri // Pediatric Drugs. — 2018. — Vol. 20, № 4. — P. 315-329. doi: 10.1007/s40272-018-0292-2.
6. Неалкогольна жирова хвороба печінки в дітей: сучасний погляд на можливості діагностики та лікування (I частина) / Ю.М. Степанов, О.Є. Абатуров, Н.Ю. Завгородня, І.Ю. Скирда // Гастроентерологія. — 2015. — № 2. — С. 99-107.
7. The pharmacological management of NAFLD in children and adolescents / S. Liyanagedera [et al.] // Expert Rev. Clin. Pharmacol. — 2017. — Vol. 10, № 11. — P. 1225-1237. doi: 10.1080/17512433.2017.1365599.
8. Non-alcoholic fatty liver disease in children / Singer C. [et al.] // Current health sciences journal. — 2014. — Vol. 40, № 3. — P. 170-176. doi: 10.12865/CHSJ.40.03.03.
9. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Diseases / N. Chalasani [et al.] // Diseases Hepatology. — 2018. — Vol. 67, № 1. — P. 328-357. doi: 10.1002/hep.29367.
10. The pediatric NAFLD fibrosis index: a predictor of liver fibrosis in children with non-alcoholic fatty liver disease / V. Nobili [et al.] // BMC medicine. — 2009. — Vol. 7, № 1. — P. 21. doi: 10.1186/1741-7015-7-21.
11. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection / R.K. Sterling [et al.] // Hepatology. — 2006. — Vol. 43, № 6. — P. 1317-1325. doi: 10.1002/hep.21178.
12. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C / C.T. Wai [et al.] // Hepatology. — 2003. — Vol. 38, № 2. — P. 518-526. doi: 10.1053/jhep.2003.50346.
13. Novel serum biomarkers for noninvasive diagnosis and screening of nonalcoholic fatty liver disease-related hepatic fibrosis / B. Lin [et al.] // OMICS: a journal of integrative biology. — 2019. doi: 10.1089/omi.2019.0035.
14. Day J.W. The enhanced liver fibrosis (ELF) test in diagnosis and management of liver fibrosis / J.W. Day, W.M. Rosenberg // British Journal of Hospital Medicine. — 2018. — Vol. 79, № 12. — P. 694-699. doi: 10.12968/hmed.2018.79.12.694.
15. The ability of Hepascore to predict liver fibrosis in chronic liver disease: a meta analysis / Y. Huang [et al.] // Liver International. — 2017. — Vol. 37, № 1. — P. 121-131. doi: 10.1111/liv.13116.
16. Intrahepatic fat content and markers of hepatic fibrosis in obese children / W. Wu [et al.] // International journal of endocrinology. — 2016. — Vol. 2016. doi: 10.1155/2016/4890974.
17. A combination of the pediatric NAFLD fibrosis index and enhanced liver fibrosis test identifies children with fibrosis / N. Alkhouri [et al.] // Clinical Gastroenterology and Hepatology. — 2011. — Vol. 9, № 2. — P. 150-155. doi: 10.1016/j.cgh.2010.09.015.
18. Methods to improve the noninvasive diagnosis and assessment of disease severity in children with suspected nonalcoholic fatty liver disease (NAFLD): Study design / B. Rudolph [et al.] // Contemporary clinical trials. — 2018. — Vol. 75. — P. 51-58. doi: 10.1016/j.cct.2018.10.012.
19. Modified thresholds for fibrosis risk scores in nonalcoholic fatty liver disease are necessary in the obese / G.J. Ooi [et al.] // Obesity surgery. — 2017. — Vol. 27, № 1. — P. 115-125. doi: 10.1007/s11695-016-2246-5.
20. The evaluation of hepatic fibrosis scores in children with nonalcoholic fatty liver disease / S. Mansoor [et al.] // Digestive diseases and sciences. — 2015. — Vol. 60, № 5. — P. 1440-1447. doi: 10.1007/s10620-014-3494-7.

/73-1.jpg)
/74-1.jpg)
/75-1.jpg)