Журнал «Медицина неотложных состояний» №3(98), 2019
Вернуться к номеру
Клинический случай успешного лечения больного с разрывом аневризмы дистального отдела аорты и массивной кровопотерей
Авторы: Клигуненко Е.Н.(1), Площенко Ю.А.(1), Новиков С.П.(2), Василишин А.В.(2), Байда Ю.Б.(2), Бородай Л.В.(2), Бородина И.К.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — КУ «Днепропетровская городская клиническая многопрофильная больница № 4» ДОС, г. Днепр, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У статті наведений клінічний випадок успішного лікування масивної крововтрати, що перевищувала смертельну в 2 рази при оперативному втручанні з приводу розриву аневризми дистального відділу черевної аорти. Останнім часом при розвитку масивної кровотечі широкого поширення набула стратегія Damage control resuscitation, суть якої полягає у швидкій зупинці кровотечі хірургічним шляхом, до зупинки кровотечі в дотриманні рестриктивної стратегії заміщення об’єму з метою досягнення цільового рівня тиску до систолічного 80–90 мм рт.ст., що забезпечує мінімально безпечний рівень перфузії тканин, раннє застосування протоколу масивної трансфузії в співвідношенні «еритроцити — плазма — тромбоцити — кріопреципітат» 1 : 1 : 1 : 1 у ефективних лікувальних дозах (свіжозаморожена плазма — 20 мл/кг, еритроцитарна маса — 15–20 мл/кг), в ранній профілактиці коагулопатії із застосуванням інгібіторів фібринолізу. У статті наведені проведений об’єм та склад інфузійно-трансфузійної терапії, вплив її на показники гемодинаміки, діурезу, водного балансу та лабораторні дані. В результаті проведених комплексних дій лікарів-анестезіологів відділення дотримання тактики Damage control resuscitation випадок лікування хворого був успішний.
В статье приведен клинический случай успешного лечения массивной кровопотери, которая превышала смертельную в 2 раза, при оперативном вмешательстве по поводу разрыва аневризмы дистального отдела брюшной аорты. В последние годы при развитии массивного кровотечения широкое распространение получила стратегия Damage control resuscitation, суть которой заключается в быстрой остановке кровотечения хирургическим путем, до остановки кровотечения в соблюдении рестриктивной стратегии замещения объема с целью достижения целевого уровня давления до систолического 80–90 мм рт.ст., что обеспечивает минимально безопасный уровень перфузии тканей, раннее применение протокола массивной трансфузии в соотношении «эритроциты — плазма — тромбоциты — криопреципитат» 1 : 1 : 1 : 1 в эффективных лечебных дозах (свежезамороженная плазма — 20 мл/кг, эритроцитарная масса — 15–20 мл/кг), в ранней профилактике коагулопатии с применением ингибиторов фибринолиза. В статье представлены проведенный объем и состав инфузионно-трансфузионной терапии, влияние ее на показатели гемодинамики, диуреза, водного баланса и лабораторные данные. В результате проведенных комплексных действий врачей-анестезиологов отделения соблюдения тактики Damage control resuscitation случай лечения больного был успешен.
The article presents a clinical case of successful treatment of massive blood loss, which 2 times exceeded the fatal hemorrhage, in surgical intervention for distal abdominal aortic aneurysm rupture. In recent years, in case of massive bleeding, the Damage control resuscitation strategy has become widespread. It consist in the rapid arrest of bleeding surgically, before this — in adherence to the restrictive strategy of volume replacement in order to achieve the target pressure, with systolic one of 80–90 mmHg, which provides a minimum safe level of tissue perfusion, early application of the protocol of massive transfusion with the erythrocytes — plasma — platelets — cryoprecipitate ratio of 1 : 1 : 1 : 1 in effective therapeutic doses (fresh frozen plasma 20 ml/kg, packed red blood cells 15–20 ml/kg), early prophylaxis of coagulopathy with the use of inhibitors of fibrinolysis. The article presents the volume and composition of infusion and transfusion therapy, its effect on hemodynamics, diuresis, water balance and laboratory data. Due to the integrated actions of anesthesiologists of the department, adherence to the Damage control resuscitation, the treatment of the patient was successful.
аневризма; масивна крововтрата; інфузійно-трансфузійна терапія
аневризма; массивная кровопотеря; инфузионно-трансфузионная терапия
aneurysm; massive blood loss; infusion and transfusion therapy
Введение
Распространенность аневризмы брюшного отдела аорты (АБА) зависит от ряда демографических факторов, включая семейный анамнез, мужской пол, а также от наличия вредных привычек (курение) [1].
Данные аутопсий в Швеции, где вскрытие проводили сразу после смерти, показали, что распространенность аневризм диаметром больше 3,0 см увеличивается среди лиц старше 50 лет и достигает максимума среди мужчин в возрасте 80–85 лет (5,9 %) и среди женщин старше 90 лет (4,5 %). В целом распространенность AБА диаметром 2,9–4,9 см составляет от 1,3 % среди мужчин в возрасте 45–54 лет до 12,5 % среди мужчин 75–84 лет. Сравнительные показатели распространенности заболевания среди женщин составляют 0 и 5,2 % соответственно [1].
Аневризма брюшного отдела аорты может длительное время существовать без каких-либо серьезных симптомов. В то же время существует высокий риск различных осложнений. Разрыв аневризмы приводит к массивному кровотечению, которое заканчивается летальным исходом в 30–80 % случаев. Не менее высокая частота осложнений отмечается при состоявшемся оперативном вмешательстве. В течение многих лет уровень смертности остается на уровне 50 % и выше [1]. В недавних отчетах многоцентровых исследований, реестров и рандомизированных клинических исследований (РКИ) отмечается тенденция к снижению этих показателей. В реестре Swedvasc зарегистрировано снижение смертности с 38 до 28 % в период с 1994 по 2010 г. [2]. В трех РКИ у пациентов с разрывом брюшной аорты 30-дневная смертность составила 25–40 % [3–5]. Существует несколько прогностических факторов риска периоперационной смертности после открытого оперативного доступа. Известно, что внутрибрюшной разрыв аорты, значительная анемия, дооперационная тяжелая гемодинамическая нестабильность, почечная и застойная сердечная недостаточность при поступлении связаны с повышенной смертностью [1, 6]. Наконец, развивающиеся жизнеугрожающие осложнения, такие как кардиореспираторные осложнения, ишемический колит, острая ишемия нижних конечностей, тромбоэмболические осложнения и развитие компартмент-синдрома, вносят свою лепту в развитие госпитальной и ранней послеоперационной летальности [1]. Исход представленных ослож–нений зависит от проведенных на разных этапах лечебных мероприятий, включая раннюю диагностику разрыва аневризмы и обеспечение хирургического гемостаза, качественное и количественное восполнение дефицита объема циркулирующей крови (ОЦК), интенсивную терапию, направленную на профилактику осложнений, связанных с развившейся ишемией органов, после пережатия аорты во время оперативного вмешательства и синдрома реперфузии.
Материалы и методы
Представлен клинический случай успешного лечения разрыва аневризмы брюшного отдела аорты с развившейся массивной кровопотерей при оперативном вмешательстве резекции аневризмы с аорто-бифеморальным протезированием.
Описание клинического случая
Больной Т., 63 года, поступил в ургентном порядке с жалобами на боль в мезогастрии с иррадиацией в левую подвздошную область, выраженную общую слабость. Перечисленные жалобы появились внезапно 10 часов назад.
Наличие в отделении анестезиологии аппарата ультразвуковой диагностики экспертного класса Toshiba, диагностического комплекса РеоКом, а также благодаря специализации врачей-анестезиологов по функциональной диагностике позволили в кратчайшие сроки диагностировать разрыв аневризмы аорты, выполнить эхокардиографию, оценить состояние центральной гемодинамики.
Осмотрен ангиохирургом, проведено КТ-исследование с внутривенным контрастированием, по данным которого у больного наблюдалась расслаивающаяся мешотчатая аневризма брюшной аорты с признаками экстравазации и затека крови в левое паранефральное пространство.
С учетом клиники кровотечения из разрыва брюшного отдела аорты было принято решение об оперативной тактике ведения пациента в экстренном порядке.
Осмотрен анестезиологом. Сопутствующая патология: ишемическая болезнь сердца. Стабильная стенокардия напряжения II функционального класса, гипертоническая болезнь II ст., артериальная гипертензия 2-й ст., ССР 4 СН IIА; язвенная болезнь двенадцатиперстной кишки в стадии ремиссии.
Рост — 176 см, масса тела — 105 кг, индекс массы тела — 33,9 кг/м2. Дыхание самостоятельное, клинически адекватное. Гемодинамика на цифрах умеренной гипотензии: артериальное давление (АД) — 90/60 мм рт.ст., пульс — 95 уд. в 1 мин. По данным эхокардиографии: полости сердца не расширены, конечно-диастолический объем левого желудочка снижен, фракция выброса (ФВ) — 55 %, давление в легочной артерии — 20 мм рт.ст. Данные реографии: гипоциркуляторный тип кровообращения, ударный объем снижен на 27 % от возрастной и расчетной нормы по индивидуальному обмену. Преднагрузка левых отделов сердца по данным конечно-диастолического давления снижена на 24 %. Компенсаторно наблюдалось повышение общего периферического сопротивления сосудов (ОПСС). Лабораторные показатели: гемоглобин (Hb) — 119 г/л, гематокрит (Ht) — 37 %. Степень операционно-анестезиологического риска по ASA — VЕ.
Принято решение проведения ургентного оперативного вмешательства по жизненным показаниям под общей тотальной внутривенной анестезией с миорелаксацией и искусственной вентиляцией легких.
В 14:00 больной подан в операционную. Произведены пункция и катетеризация правой подключичной вены (без особенностей), начата инфузионная терапия сбалансированными кристаллоидными растворами. Проведена премедикация.
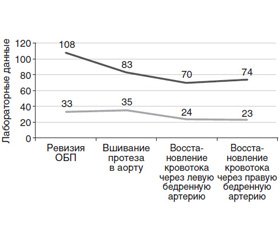
Индукция анестезии, интубация трахеи и перевод на респираторную поддержку без особенностей. После ревизии органов брюшной полости принято решение выполнить резекцию аневризмы брюшного отдела аорты, аорто-бифеморальное шунтирование. Уровень гемоглобина на данном этапе составил 108 г/л, гематокрита — 33 %. В 15:05 произведено пережатие аорты. Начата трансфузия эритроцитарной массы, свежезамороженной плазмы (СЗП). На этапе вшивания протеза в аорту (16:15) Hb — 83 г/л, Ht — 35 %. На фоне продолжающейся инфузионно-трансфузионной терапии проведена ранняя профилактика коагулопатии (СЗП, криопреципитат, транексамовая кислота 1000 мг в/в за 10 минут с последующей инфузией 1000 мг).
На этапе ревизии и вшивании протеза в левую бедренную артерию уровень гемоглобина составил 70 г/л, гематокрита — 24 % (17:20). В 18:10 произведено восстановление кровотока через левую бедренную артерию. С целью профилактики реперфузионного синдрома введены глюкокортикоиды в стандартной дозе, раствор соды буфер 200 мл. 19:30 — восстановление кровотока по правой бедренной артерии, Hb — 74 г/л, Ht — 23 %. 20:20 — конец оперативного вмешательства.
Длительность операции составила 5 ч 50 мин. Кровопотеря — 7500 мл, расчетный уровень дефицита объема циркулирующей крови — 152 %, что превышает смертельную кровопотерю в 2 раза. Восполнение кровопотери производилось согласно V уровню: сбалансированные кристаллоиды — 1000 мл, коллоиды — 1000 мл, эритроцитарная масса — 2200 мл, СЗП — 3140, криопреципитат — 3 дозы, альбумин 10% — 800 мл. Во время оперативного вмешательства гемодинамика на цифрах нормотензии, умеренной гипотензии без вазопрессорной поддержки (100/70–90/60 мм рт.ст.). Ди–урез — 1,5 мл/кг/ч. Через 15 минут после окончания операции больной переведен в отделение анестезио–логии и интенсивной терапии.
Динамика уровней гемоглобина и гематокрита интраоперационно представлена на рис. 1.
При поступлении состояние тяжелое. Уровень сознания — медикаментозный сон. Переведен на респираторную поддержку аппаратом Carina в режиме SIMV. Гемодинамика на цифрах нормотензии, АД — 130/70 мм рт.ст. PS — 78 уд. в 1 мин, центральное венозное давление (ЦВД) — 80 мм вод.ст. По дренажам скудное серозно-геморрагическое отделяемое. Мочеиспускание по катетеру, моча светлая. Продолжены трансфузия эритроцитарной массы — 300 мл, СЗП — 250 мл, криопреципитата — 5 доз, введение антифибринолитиков (апротинин — 200 тыс. Ед через перфузор). Назначена стандартная антибактериальная, гастропротекторная, гепатотропная терапия. Проведены обезболивание нестероидными противовоспалительными средствами в комбинации с наркотическими анальгетиками, профилактика тромбоэмболических осложнений низкомолекулярными гепаринами (эноксапарин 0,4 дважды в сутки).
Через 12 часов после операции: состояние больного тяжелое, стабильное.
Уровень сознания — медикаментозная седация. Продолжается продленная искусственная вентиляция легких через эндотрахеальную трубку респиратором Carina в режиме SIMV. Гемодинамически стабилен на цифрах умеренной гипертензии: АД — 140/90 мм рт.ст. PS — 92 уд. в 1 мин, ЦВД — 70 мм вод.ст. Нижние конечности теплые на ощупь, пульсация артерий на всех сегментах сохранена. Диурез за 12 часов составил 1700 мл, моча светлая, ВБ (-220).
В динамике на фоне восполненного ОЦК повторно выполнена эхокардиография: нормализация конечно-диастолического объема, повышение ФВ до 62 %, что свидетельствовало об адекватном восполнении дефицита ОЦК. По данным реографии: умеренный гиперциркуляторный тип кровообращения с незначительным снижением ОПСС от исходных значений.
Лабораторные показатели: Hb — 101 г/л, Ht — 31 %, лейкоциты — 7,4 × 109/л, сдвиг лейкоцитарной формулы влево — 34 %, общий белок — 61 г/л, умеренная гиперкреатинемия — 144 мкмоль/л, гипонатриемия — 110 ммоль/л, повышение аспартатаминотрансферазы — 110 Ед/л, гипербилирубинемия — 69 мкмоль/л за счет непрямой фракции. В коагулограмме протромбинованный индекс (ПТИ) — 91 %, фибриноген — 2,2 г/л.
С учетом вышеперечисленных лабораторных показателей назначены дополнительная трансфузия эритроцитарной массы — 300 мл, альбумина 10% — 400 мл, инфузия через перфузор ингибиторов фибринолиза (апротинин — 200 тыс. Ед в сутки), начата стимуляция перистальтики, продолжены антибактериальная, гепатотропная, гастропротекторная, симптоматическая терапия, профилактика тромбоэмболических осложнений, коррекция электролитных нарушений.
Первые — вторые сутки после операции. Через 15 часов после оперативного вмешательства на фоне стабильного состояния, устойчивых показателей гемодинамики произведена экстубация трахеи. Больной в сознании, доступен продуктивному контакту. Болевой синдром купирован. Жалоб не предъявляет.
Нижние конечности теплые на ощупь, видимых признаков нарушения микроциркуляции нет. Активные и пассивные движения в полном объеме. По дренажам за сутки 300 мл серозно-геморрагического отделяемого. Перистальтика не выслушивается. Диурез — 1900 мл. ВБ (-210). Объем инфузии — 2800 мл (1,4 мл/кг/ч). Лабораторные показатели: Hb — 115 г/л, Ht — 32 %, лейкоциты — 13,6 × 109/л, снижение сдвига лейкоцитарной формулы влево до 19 %, общий белок — 64 г/л, сохраняется умеренная гиперкреатинемия — 155 мкмоль/л, отмечаются нормализация уровня электролитов, повышение АСТ — 146 Ед/л, снижение гипербилирубинемии до 30 мкмоль/л. В коагулограмме протромбиновый индекс — 105 %, фибриноген — 2,6 г/л.
Вторые — третьи сутки послеоперационного периода. Состояние больного с положительной динамикой. Активен. Жалоб не предъявляет. Гемодинамика стабильная на цифрах нормотензии, ЦВД — 100 мм вод.ст. Признаков нарушения микроциркуляции нижних конечностей нет. Активизирован. Диурез — 1850 мл, ВБ (+280).
Лабораторные показатели: Hb — 110 г/л, Ht — 32 %, лейкоциты — 9,8 × 109/л, снижение сдвига лейкоцитарной формулы влево до 10 %, общий белок — 60 г/л, сохраняется умеренная гиперкреатинемия — 150 мкмоль/л, снижение уровня АСТ до 130 Ед/л, нормализация уровня билирубина. В коа–гулограмме ПТИ — 107 %, фибриноген — 3,74 г/л. Продолжены плановая инфузионная, антибактериальная, гастропротекторная, гепатотропная, антипаретическая, симптоматическая терапия, профилактика тромбоэмболических осложнений, трансфузия альбумина 10% — 100 мл. Объем инфузии — 2800 мл (1,4 мл/кг/ч). Проведен сеанс гипербарической оксигенации.
Третьи — четвертые сутки послеоперационного периода. Состояние больного стабильное. Активизирован. Движение в нижних конечностях в полном объеме. Нарушений микроциркуляции нет. Жалобы на периодическую тошноту, вздутие живота, задержку отхождения газов. Гемодинамика стабильная, АД — 140/80 мм рт.ст., пульс — 78 уд. в 1 мин. Аускультативно выслушивается вялая перистальтика. С целью улучшения микроциркуляции кишечника, стимуляции перистальтики больному выполнена катетеризация эпидурального пространства, начато введение местного анестетика (бупивакаин) в симпатолитических дозах, назначен второй сеанс гипербарической оксигенации. Ди–урез — 1600 мл, ВБ (-70). Лабораторные показатели: Hb — 113 г/л, Ht — 34 %, лейкоциты — 10,5 × 109/л, снижение сдвига лейкоцитарной формулы влево до 5 %; общий белок — 61 г/л, нормализация уровня креатинина, снижение уровня АСТ до 118 Ед/л. В коагулограмме ПТИ — 117 %, фибриноген — 3,8 г/л. Продолжена плановая инфузионная, антибактериальная, гастропротекторная, гепатотропная, антипаретическая, симптоматическая терапия, профилактика тромбоэмболических осложнений, трансфузия альбумина 10% — 200 мл, в состав инфузионной терапии включен L-аргинин D-аспартат. Объем инфузии — 2600 мл (1,4 мл/кг/ч).
Четвертые — пятые сутки послеоперационного периода. Состояние больного с положительной динамикой. Жалоб не предъявляет. Гемодинамически стабилен, наблюдается нормотензия. ЦВД — 120 мм вод.ст. По данным реографии: нормоциркуляторный тип кровообращения с незначительным снижением ОПСС на фоне медикаментозной симпатэктомии. Эвакуаторных нарушений со стороны желудочно-кишечного тракта нет. Расширено энтеральное питание, снижен объем инфузионной терапии. Диурез достаточный. ВБ (+160). По дренажам 350 мл серозно-геморрагического отделяемого.
Лабораторные показатели: Hb — 110 г/л, Ht — 34 %, лейкоциты — 13,2 × 109/л, снижение сдвига лейкоцитарной формулы влево до 3 %; общий белок — 58 г/л, нормализация уровня АСТ. В коагулограмме ПТИ — 117 %, фибриноген — 3,8 г/л. Продолжена терапия в прежнем объеме, проведен сеанс гипербарической оксигенации. Объем инфузии снижен до 2200 мл (1,2 мл/кг/ч).
Пятые — шестые — седьмые сутки послеоперационного периода. Состояние больного средней степени тяжести. Гемодинамика стабильная, ЦВД — 120 мм рт.ст. Активен. Эвакуаторных нарушений со стороны желудочно-кишечного тракта нет. Нижние конечности теплые на ощупь, признаков нарушения микроциркуляции нет. Движения в полном объеме. По дренажам 50 мл серозного отделяемого. Диурез — 1300 мл. ВБ (-400). Объем инфузии — 1850 мл (0,5 мл/кг/ч). Лабораторные показатели: Hb — 120 г/л, Ht — 37 %, лейкоциты — 9,8 × 109/л, сдвиг лейкоцитарной формулы влево — 4 %; нормализация уровня общего белка — 64 г/л. В коагулограмме ПТИ — 104 %, фибриноген — 3,74 г/л. Больной переведен в отделение сосудистой хирургии.
Динамика показателей общего и биохимического анализов крови в послеоперационном периоде представлена на рис. 2, 3.
Приведены объем и состав трансфузионных сред во время оперативного вмешательства и после–операционном периоде: эритроцитарная масса — 2800 мл, СЗП — 3390 мл, криопреципитат — 400 мл, альбумин — 2300 мл. Общий объем инфузии с учетом кристаллоидных и синтетических коллоидных растворов составил 20 540 мл (рис. 4).
Выводы
1. Успешный результат лечения больного Т. был возможен благодаря ранней диагностике расслоения аневризмы аорты, проведенному экстренному оперативному вмешательству с целью обеспечения неотложного хирургического гемостаза, восполненной адекватной по объему и составу заместительной инфузионно-трансфузионной терапии.
2. Достигнуть быстрого восполнения глобулярного объема помогло раннее применение СЗП, эритроцитарной массы в объеме 20 мл/кг в соотношении 1 : 1.
3. Ограничение объема инфузии, включение в состав инфузионной терапии L-аргинина D-аспартата, катетеризация эпидурального пространства и проведение врачами отделения анестезиологии сеансов гипербарической оксигенации помогли разрешить парез кишечника, индуцированный ишемией и реперфузией.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms.
2. Mani K., Venermo M., Beiles B., Menyhei G., Altreuther M., Loftus I. et al. Regional differences in case mix and perioperative outcome after elective abdominal aortic aneurysm repair in the vascunet database // Eur. J. Vasc. Endovasc. Surg. — 2015 Jun. — 49. — Р. 646-52.
3. Desgranges, ECAR Investigators. ECAR (Endovasculaire ou Chirurgie dans les Anévrysmes aorto-iliaques Rompus): a French randomized controlled trial of endovascular versus open surgical repair of ruptured aorto-iliac aneurysms // Eur. J. Vasc. Endovasc. Surg. — 2015. — 50. — 303e10.
4. IMPROVE trial investigators, Powell J.T., Sweeting M.J., Thompson M.M., Ashleigh R., Bell R. et al. Endovascular or open repair strategy for ruptured abdominal aortic aneurysm: 30 day outcomes from IMPROVE randomized trial // BMJ. — 2014. — 348. — 7661.
5. Reimerink J.J., Hoornweg L.L., Vahl A.C., Wisselink W., van den Broek T.A., Legemate D.A. et al. Amsterdam Acute Aneurysm Trial Collaborators. Endovascular repair versus open repair of ruptured abdominal aortic aneurysms: a multicenter randomi–zed controlled trial // Ann. Surg. — 2013a. — 258. — 248e56.
6. Markovic M., Tomic I., Ilic N., Dragas M., Koncar I., Bukumiric Z. et al. The rationale for continuing open repair of ruptured abdominal aortic aneurysm // Ann. Vasc. Surg. — 2016. — 36. — 64e73.
7. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology. — First update 2016. — Р. 332-395.
8. Клигуненко Е.Н., Сединкин В.А. Об эффективности рестриктивного типа восполнения острой акушерской кровопотери: Збірник наукових праць співробітників НМАПО ім. П.Л. Шупика. — К., 2015. — Вип. 26 (к. 6, ч. 2). — С. 132-136.
9. Клигуненко Е.Н., Кравец О.В. Интенсивная терапия кровопотери: Учебно-методическое пособие. — Днепропетровск: Пороги, 2005. — 2-е изд-е, доп. — 150 с.
10. Сединкин В.А., Клигуненко Е.Н. Обзор рекомендаций по интенсивной терапии острой массивной кровопотери в акушерстве // Медицина неотложных состояний. — 2017.

/178-1.jpg)
/179-1.jpg)
/180-1.jpg)