Международный эндокринологический журнал Том 14, №7, 2018
Вернуться к номеру
Показники ендотеліальної дисфункції при цукровому діабеті 2-го типу як визначальні чинники розвитку ускладнень
Авторы: Зябліцев С.В.(1), Чернобривцев О.П.(1), Зябліцев Д.С.(2)
1 - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
2 - Київський медичний університет, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Для з’ясування патогенетичної ролі основних чинників, що відображають розвиток ендотеліальної дисфункції (ЕДФ), була зроблена спроба у рамках одного дослідження розрахувати їх вплив на розвиток судинних ускладнень цукрового діабету (ЦД) 2-го типу. До числа таких показників увійшли ендотелін-1 (ЕТ-1), фактор некрозу пухлини (TNF-α) та дієнові кон’югати (ДК). Також було обрано два захисні фактори — оксид азоту (NO) і ендотеліальна NO-синтаза (eNOS). Мета дослідження: вивчити вплив показників ЕДФ при ЦД 2-го типу на розвиток його ускладнень. Матеріали та методи. До дослідження залучено дані 152 хворих на ЦД 2-го типу, вік пацієнтів становив від 34 до 80 років, у середньому 53,9 ± 8,4 року. Жінок було 95 (62,5 %), чоловіків — 57 (37,5 %). Відповідно до клінічних рекомендацій, за результатами клініко-лабораторних обстежень визначали наявність ретинопатії, нефропатії за рівнями мікроальбумінурії та швидкості клубочкової фільтрації (ШКФ), сенсорної полінейропатії, макроангіопатії нижніх кінцівок та артеріальної гіпертензії. У плазмі крові імуноферментним і біохімічним методами визначали вміст чинників ЕДФ. Для математичної обробки отриманих даних використовували програму Statistica 10 (StatSoft, Inc., США), пакет GLZ. Результати. На наявність ретинопатії сильно впливав рівень у крові ЕТ-1 (β = 3,1; р = 2,77Е-05), а також TNF-α (β = 0,019; р = 0,050). На наявність макроангіопатії нижніх кінцівок — рівень в крові NO (β = 27,5; р = 0,021) і TNF-α (β = –0,48; р = 0,017). Для полінейропатії значущим виявився тільки один показник — ЕТ-1 (β = 1,8; р = 0,016). На наявність нефропатії за ШКФ впливали рівні у крові ЕТ-1 (β = 2,7; р = 7,58Е-07) і TNF-α (β = 0,013; р = 0,047). Розвитку нефропатії за мікроальбумінурією сприяв ЕТ-1 (β = 4,5; р = 0,043). На наявність артеріальної гіпертензії впливали ЕТ-1 (β = 1,69; р = 2,54Е-04) і TNF-α (β = 0,017; р = 0,014). Шляхом багатофакторної логістичної регресії побудовані моделі прогнозування ймовірності розвитку ускладнень ЦД 2-го типу на підставні вивчених чинників ЕДФ. Усі моделі адекватні і мають високий рівень прогностичної точності (60,5–90,8 %). Висновки. На розвиток ускладнень ЦД 2-го типу по-різному впливали чинники ЕДФ: ЕТ-1 безпосередньо впливав на розвиток усіх ускладнень (окрім макроангіопатії нижніх кінцівок); TNF-α здійснював вплив на розвиток ретинопатії, нефропатії за ШКФ і артеріальної гіпертензії; накопичення у крові NO сприяло розвитку макроангіопатії нижніх кінцівок.
Актуальность. Для выяснения патогенетической роли основных факторов, отражающих развитие эндотелиальной дисфункции (ЭДФ), была предпринята попытка в рамках одного исследования определить их влияние на развитие сосудистых осложнений сахарного диабета (СД) 2-го типа. К числу таких показателей были отнесены: эндотелин-1 (ЭТ-1), фактор некроза опухоли α (TNF-α) и диеновые конъюгаты (ДК). Также были избраны два защитных фактора — оксид азота (NO) и эндотелиальная NO-синтаза (eNOS). Цель исследования: изучить влияние показателей ЭДФ при СД 2-го типа на развитие его осложнений. Материалы и методы. К исследованию привлечены данные 152 больных с СД 2-го типа, возраст пациентов составил от 34 до 80 лет, в среднем 53,9 ± 8,4 года. Женщин было 95 (62,5 %), мужчин — 57 (37,5 %). Согласно клиническим рекомендациям, по результатам клинико-лабораторных обследований определяли наличие ретинопатии, нефропатии по скорости клубочковой фильтрации (СКФ) и по уровню микроальбуминурии, сенсорной полинейропатии, макроангиопатии нижних конечностей и артериальной гипертензии. В плазме крови иммуноферментным и биохимическим методами определяли содержание факторов ЭДФ. Для математической обработки полученных данных использовали программу Statistica 10 (StatSoft, Inc., США), пакет GLZ. Результаты. На наличие ретинопатии сильно влиял уровень в крови ЭТ-1 (β = 3,1; р = 2,77Е-05), а также TNF-α (β = 0,019; р = 0,050). На наличие макроангиопатии нижних конечностей — уровень в крови NO (β = 27,5; р = 0,021) и TNF-α (β = –0,48; р = 0,017). Для полинейропатии значимым оказался только один показатель — ЭТ-1 (β = 1,8; р = 0,016). На наличие нефропатии по СКФ влияли уровни в крови ЭТ-1 (β = 2,7; р = 7,58Е-07) и TNF-α (β = 0,013; р = 0,047). Развитию нефропатии по микроальбуминурии способствовал ЭТ-1 (β = 4,5; р = 0,043). На наличие артериальной гипертензии влияли ЭТ-1 (β = 1,69, р = 2,54Е-04) и TNF-α (β = 0,017; р = 0,014). Путем многофакторной логистической регрессии построены модели прогнозирования вероятности развития осложнений СД 2-го типа на основе изученных факторов ЭДФ. Все модели адекватны и имеют высокий уровень прогностической точности (60,5–90,8 %). Выводы. На развитие осложнений СД 2-го типа по-разному влияли факторы ЭДФ: ЭТ-1 прямо влиял на развитие всех осложнений (кроме макроангиопатии нижних конечностей); TNF-α имел влияние на развитие ретинопатии, нефропатии по СКФ и артериальной гипертензии; накопление в крови NO способствовало развитию макроангиопатии нижних конечностей.
Background. To determine the pathogenetic role of the main factors reflecting the development of endothelial dysfunction (EDF), an attempt was made within the framework of one study to calculate their effect on the occurrence of vascular complications of diabetes mellitus 2 type (DM2T). These include endothelin-1 (ET1), tumor necrosis factor α (TNFα), and diene conjugates. Two protective factors were also chosen: nitric oxide (NO) and endothelial NO-synthase. The purpose of study was to investigate the effect of EDF indices in DM2T on the development of its complications. Materials and methods. The study involved 152 patients with DM2T, the age of patients ranged from 34 to 80 years, on average 53.9 ± 8.4 years. Women were 95 (62.5 %), men — 57 (37.5 %). According to the clinical recommendations, the results of clinical and laboratory tests determined the presence of retinopathy, nephropathy according to the levels of albuminuria and glomerular filtration rate (GFR), sensory polyneuropathy, macroangiopathy of the lower extremities, and arterial hypertension. The blood plasma content of EDF factors was determined by enzyme and biochemical methods. For mathematical processing of the obtained data, the program Statistica 10 (StatSoft, Inc., USA), GLZ package was used. Results. The presence of retinopathy was strongly influenced by blood levels of ET1 (β = 3.1; p = 2.77E-05), as well as TNFα (β = 0.019; p = 0.050). In the presence of macroangiopathy of the lower extremities — by the blood levels of NO (β = 27.5; p = 0.021) and TNFα (β = –0.48; p = 0.017). For polyneuropathy, only one indicator was significant — ET1 (β = 1.8; p = 0.016). The presence of nephropathy for GFR was influenced by the blood levels of ET1 (β = 2.7; p = 7.58E-07) and TNFα (β = 0.013; p = 0.047). ET1 led to the development of nephropathy on microalbuminuria (β = 4.5; p = 0.043). The presence of arterial hypertension was influenced by ET1 (β = 1.69; p = 2.54E-04) and TNFα (β = 0.017; p = 0.014). By means of multivariate logistic regression, models for predicting the risk of DM2T complications are constructed based on the studied factors of EDF. All models are adequate and have a high level of predictive accuracy (60.5–90.8 %). Conclusions. The development of DM2T complications was influenced differently by EDF factors: ET1 directly influenced the development of all complications of DM2T (in addition to macroangiopathy of the lower extremities); TNFα had an effect on the development of retinopathy, nephropathy for GFR and arterial hypertension; NO accumulation in the blood led to the development of macroangiopathy of the lower extremities.
цукровий діабет 2-го типу; ускладнення; ендотеліальна дисфункція; ендотелін-1; NO; TNF-α
сахарный диабет 2-го типа; осложнения; эндотелиальная дисфункция; эндотелин-1; NO; TNF-α
diabetes mellitus type 2; complications; endothelial dysfunction; endothelin-1; nitric oxide; tumor necrosis factor α
Вступ
На сьогодні цукровий діабет (ЦД) 2–го типу і діабетичні судинні ускладнення мають великий вплив на медико–демографічні показники, що пов’язано з ранньою інвалідизацією і передчасною смертністю населення в працездатному віці [1–3]. З’ясування ролі судинного ендотелію призвело до розвитку концепції ендотеліальної дисфукції (ЕДФ) як відображення порушення за патологічних умов бар’єрної, трофічної, регуляторної та інших функцій ендотелію [4, 5]. ЕДФ формується при запаленні судин, атеросклерозі, артеріальній гіпертензії (АГ), кардіоміопатії, ретинопатії, нейропатії [6, 7]. Гіперліпідемія, гіперглікемія та інші метаболічні чинники ЦД призводять до розвитку ЕДФ і судинних ускладнень [8, 9].
Відповідно до сучасних уявлень, тяжкість перебігу ЦД визначається саме наявністю ускладнень [10]: легкий перебіг визначається за відсутності макро– і мікросудинних ускладнень та полінейропатії; середній ступінь тяжкості — за наявності початкових стадій ретино– і нефропатії та полінейропатії; тяжкий перебіг — за наявності виражених стадій ретино– і нефропатії, вегетативної полінейропатії та макроангіопатії.
На жаль, конкретні механізми розвитку судинних ускладнень та їх патогенетичні чинники на даний момент висвітлено недостатньо [5, 8, 9]. Також не з’ясовано, чому в одному випадку у хворого прогресує ретинопатія, а у другому, в такого ж за клініко–лабораторними показниками хворого, прогресує нефропатія [1].
Отже, саме для з’ясування патогенетичної ролі основних чинників, що відображають розвиток ЕДФ, була зроблена спроба у рамках одного дослідження розрахувати вплив таких чинників на розвиток судинних ускладнень ЦД 2–го типу. До числа таких показників було обрано вміст в крові гормона ендотелію — ендотеліну–1 (ЕТ–1) (як потужного ендогенного вазоконстриктора), фактора некрозу пухлини α (TNF–α), що безпосередньо стосується розвитку запалення у ендотелії, та дієнових кон’югат (ДК), рівень яких в крові відображає активність вільнорадикальних процесів [3, 9]. Також на противагу їм було обрано два захисні фактори — оксид азоту (NO) – ендогенний активатор гуанілатциклази, що запобігає вазоконтрикції, та рівень в крові ендотеліальної NO–синтази (eNOS) [5].
Мета дослідження — вивчити вплив показників ЕДФ при ЦД 2–го типу на розвиток його ускладнень.
Матеріали та методи
До дослідження залучено дані 152 хворих на ЦД 2–го типу, які перебували на стаціонарному лікуванні у відділенні ендокринології Донецького обласного клінічного територіального медичного об’єднання у 2013–2014 рр. та на базі Українського науково–практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України у 2015–2016 рр. Вік пацієнтів становив від 34 до 80 років, у середньому 53,9 ± 8,4 року. Жінок було 95 (62,5 %), чоловіків — 57 (37,5 %). За тривалістю захворювання пацієнти розподілилися таким чином: до одного року — 5 (3,3 %), від 1 до 3 років — 40 (26,3 %), від 4 до 5 років — 23 (15,1 %), від 6 до 7 років — 12 (7,9 %), від 8 до 10 років — 31 (20,4 %), від 11 до 15 років — 26 (17,1 %) і понад 15 років — 15 (9,9 %) хворих. У близьких родичів ЦД 2–го типу було виявлено у 35 (23,0 %) хворих.
Відповідно до клінічних рекомендацій [2, 10], за результатами клініко–лабораторних обстежень визначали наявність ретинопатії, нефропатії за рівнями альбумінурії та швидкості клубочкової фільтрації (ШКФ), сенсорної полінейропатії, макроангіопатії нижніх кінцівок та АГ. Згідно із клінічною класифікацією [10], перший ступінь тяжкості не був виявлений у жодного пацієнта, другий ступінь — у 120 (78,9 %) та третій ступінь — у 32 (21,1 %) хворих.
У плазмі крові імуноферментним методом визначали вміст чинників ЕДФ: ЕТ–1 (Biomedica Immunoassays, Австрія), eNOS (BCM Diagnostics, США) і TNF–α (Bender Medsystems, Австрія). Інтенсивність забарвлення продукту ферментативної реакції кількісно вимірювали на фотометрі PR2100 Sanofi Diagnostic Pasteur (Франція). Рівень у крові NO визначали за його кінцевим метаболітом нітритом у реакції Гриса спектрофометрично (спектрофометр Specord, Німеччина) при довжині хвилі 546 нм. Рівень ДК ненасичених жирних кислот визначали методом Z. Placer у модифікації В.Б. Гаврилова (1983).
Для статистичної обробки отриманих даних використовували програму Statistica 10 (StatSoft, Inc., США). Для відбору показників ЕДФ, що впливають на наявність ускладнень у хворих ЦД 2–го типу, а також розробки математичних моделей прогнозування ймовірності розвитку цих ускладнень виконана серія багатофакторних логістичних регресійних розрахунків з використанням пакета GLZ (StatSoft, Inc., США) в режимі покрокового виключення предикторів. Як предиктори використовували безперервні кількісні значення ЕТ–1, NO, eNOS, TNF–α і ДК. Як залежна змінна для кожного рівняння були використані біномінальні категоріальні показники, які визначають наявність або відсутність одного з діабетичних ускладнень, таких як: ретинопатія, макроангіопатія нижніх кінцівок, полінейропатія, нефропатія за ШКФ і за мікроальбумінурією (МАУ), АГ. Відсутність ускладнення презентовано категоріальним значенням N і індикаторним 0, а наявність — Y і 1 відповідно.
Результати
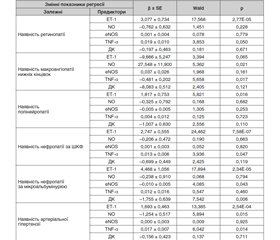
У табл. 1 наведені коефіцієнти регресії і статистична значущість їх відмінностей від нульової гіпотези, які були використані на етапі відбору значущих предикторів.
На наявність ретинопатії істотно впливав рівень у крові ЕТ–1 (β = 3,1; р = 2,77Е–05), а також TNF–α (β = 0,019; р = 0,050). На наявність макроангіопатії нижніх кінцівок сильно впливали рівень в крові NO (β = 27,5; р = 0,021) і TNF–α (β = –0,48; р = 0,017). Наявність від’ємного знака свідчила про обернену залежність, тобто високий рівень TNF–α запобігав розвитку макроангіопатії нижніх кінцівок.
Для полінейропатії значущим виявився тільки один показник — ЕТ–1 (β = 1,8; р = 0,016). На наявність нефропатії за ШКФ впливав рівень у крові ЕТ–1 (β = 2,7; р = 7,58Е–07) і TNF–α (β = 0,013; р = 0,047). Розвитку нефропатії за МАУ сприяв ЕТ–1 (β = 4,5; р = 0,043). Два чинники — eNOS і ДК мали від’ємні знаки регресії, тобто знижували ступінь нефропатії (відповідно β = –0,01; р = 0,043 і β = –1,8; р = 0,463). На наявність АГ впливав ЕТ–1 (β = 1,69; р = 2,54Е–04) і TNF–α (β = 0,017; р = 0,014). Від’ємний коефіцієнт регресії показав показник NO (β = –1,25; р = 0,015).
Такі результати дозволили зробити деякі узагальнення. По–перше, обрані чинники ЕДФ мали різний вплив на розвиток ускладнень ЦД 2–го типу. Так, ЕТ–1 безпосередньо впливав на розвиток всіх ускладнень ЦД 2–го типу (окрім мікроангіопатії ніжних кінцівок). Отже, його можна було вважати ключовим для розвитку діабетичних судинних ускладнень. Серед інших факторів було звернено увагу на TNF–α, який впливав на розвиток ретинопатії, нефропатії за ШКФ і АГ. Накопичення у крові NO сприяло розвитку макроангіопатії нижніх кінцівок.
По–друге, щодо деяких чинників ЕДФ спостерігалися від’ємні значення коефіцієнтів регресії. Так, приріст у крові TNF–α був обернено зв’язаний із ступенем макроангіопатії нижніх кінцівок; рівень ДК — із ступенем нефропатії за МАУ, а рівень NO — із ступенем АГ. Останній факт можна пояснити захисною роллю NO в розвитку АГ [5]. Вплив інших факторів на перший погляд здається парадоксальним. Доведено патогенетичне значення чинників ЕДФ, TNF–α і ДК [5, 9]. Отримані результати регресійного аналізу підтверджують таку думку. Наявність обернених взаємозв’язків вказувала на більш складні відношення чинників ЕДФ, що потребує свого подальшого вивчення.
По–третє, звертає на себе увагу відсутність патогенного впливу ДК на розвиток ускладнень ЦД 2–го типу. Загальновизнаною є патогенетична роль вільнорадикального окислення і, у тому числі, перекисного окислення ліпідів при ЦД 2–го типу [5]. Відсутність такого зв’язку, на наш погляд, відобра–жала загальну закономірність реакції — рівень ДК збільшувався у перші п’ять років хвороби, після чого лишався на стабільно високому рівні [11]. Це могло свідчити про перебудову метаболічного гомео–стазу на іншій рівень, з інтенсифікацією вільнорадикального окислення.
На наступному етапі було побудовано логістичні регресійні моделі прогнозування розвитку ускладнень та проведена оцінка кожної моделі. Це окреме дослідження включало три етапи: 1) розрахунок β–коефіцієнтів регресійних рівнянь для відібраних предикторів і вільного показника; 2) оцінка адекватності моделі за результатами побудови кривих операційної характеристики (ROC); 3) знаходження адекватної точки відсікання за ймовірнісною шкалою розвитку ускладнень.
Розрахунок β–коефіцієнтів регресійних рівнянь для відібраних предикторів та вільного показника наведений у табл. 2.
За всіма ускладненнями було розраховано рівняння розрахунку ймовірності розвитку ретинопатії
Р(РП) = 1 / (1 + e(5,873–2,711*ЕТ1–0,012*TNF–a)), (1)
де Р(РП) — ймовірність розвитку діабетичної ретинопатії; ЕТ–1 — вміст в крові ендотеліну–1 (фмоль/мл); TNF–α — вміст в крові фактора некрозу пухлини (пг/мл);
макроангіопатії нижніх кінцівок
P(АНК) = 1 / (1 + e(29,731 – 7,352NO + 0,140 * TNF–a)), (2)
де Р(АНК) — ймовірність розвитку діабетичної макроангіопатії нижніх кінцівок; NO — вміст в крові оксиду азоту (мкмоль/л); TNF–α — вміст в крові фактора некрозу пухлини (пг/мл);
полінейропатії
P(ПНП) = 1 / (1 + e(1,639 – 1,661ЕТ–1)), (3)
де Р(ПНП) — ймовірність розвитку діабетичної полінейропатії; ЕТ–1 — вміст в крові ендотеліну–1 (фмоль/мл);
нефропатії за швидкістю клубочкової фільтрації
Р(НПшкф) = 1 / (1 + e(6,757 – 2,312 * ЕТ–1 – 0,013 * TNF–a)), (4)
де Р(НПшкф) — ймовірність розвитку діабетичної нефропатії за швидкістю клубочкової фільтрації; ЕТ–1 — вміст в крові ендотеліну–1 (фмоль/мл); TNF–α — вміст в крові фактору некрозу пухлини (пг/мл);
нефропатії за мікроальбумінурією
Р(НПмау) = 1 / (1 + e–(5,09 + 4,352 * ЕТ–1 – 0,011 * еNOS – 1,893 * ДК)), (5)
де Р(НПмау) — ймовірність розвитку діабетичної нефропатії за мікроальбумінурією; ЕТ–1 — вміст в крові ендотеліну–1 (фмоль/мл); еNOS — вміст в крові ендотеліальнї синтази оксиду азоту (пг/мл);
артеріальної гіпертензії
Р(АГ) = 1 / (1 + e–(2,775 + 1,634 * ЕТ–1 – 1,370 * NO + 0,018 * TNF–a)), (6)
де Р(АГ) — ймовірність розвитку артеріальної гіпертензії; ЕТ–1 — вміст в крові ендотеліну–1 (фмоль/мл); NO — вміст в крові оксиду азоту (мкмоль/л); TNF–α — вміст в крові фактора некрозу пухлин (пг/мл).
Оцінка адекватності моделі прогнозування ймовірності розвитку ускладнень ЦД 2–го типу здійснювали за результатами побудови кривих операційної характеристики (ROC) і розрахунками площ (AUC) під кривою, а також обчислення показників найбільшої правдоподібності (–2Log), χ2 і р — для оцінки статистичної значущості відмінності моделі від нульової гіпотези (табл. 3).
Обговорення
Досить високі значення показників вірогідності при р < 0,05 у всіх порівняннях вказувало на адекватність усіх побудованих моделей. Цей факт мав велике значення для розуміння механізмів виникнення судинних ускладнень при ЦД 2–го типу. Основним механізмом виявився суттєвий приріст у крові ЕТ–1, який досягав 2,35 (1,87; 2,80) фмоль/л проти 0,55 (0,40; 0,75) фмоль/л в контролі (особи без ЦД), тобто у 4,3 раза (p < 0,001). У даному випадку був встановлений відмінний від нормального характер розподілу варіаційних рядів (p < 0,05), тому для описової статистики кількісних даних використовували медіану (Me) та перший і третій квартилі (Q1; Q3) варіаційних рядів із застосуванням критерію Kruskal–Wallis (ANOVA by Ranks test).
Такий багаторазовий приріст рівня ЕТ–1 і був патогенетичним чинником розвитку ускладнень ЦД 2–го типу. З іншого боку, цей показник можна вважати прогностичним критерієм для розрахунку ймовірності виникнення ускладнень (крім макроангіопатії нижніх кінцівок).
Іншим чинником ЕДФ, який виявив вплив на розвиток ускладнень, визначено TNF–α, рівень якого у хворих досягав 117,1 (70,1; 230,0) пг/мл проти 22,3 (16,2; 29,0) пг/мл, тобто у 5,3 раза (p < 0,001). Рівень в крові TNF–α мав значення для розвитку ретинопатії, нефропатії за ШКФ та АГ.
Надалі було проаналізовано критичні рівні показників чутливості, специфічності і правильності (точності) для рівнянь (1–6) прогнозу розвитку ускладнень (табл. 4). При проведенні таких розрахунків дані, отримані у хворих (факт), порівнювали з розрахованими (прогноз) за формулами (1–6).
Проведений аналіз дозволив розрахувати точки відсічі, тобто межові значення ймовірності (Р), при досягненні яких можна було прогнозувати розвиток того чи іншого ускладнення. Точність прогнозу становила від 60,5 % (для полінейропатії) до 90,8 % (для нефропатії за МАУ).
Висновки
1. Чинники ЕДФ впливають на розвиток ускладнень ЦД 2–го типу: ЕТ–1 безпосередньо впливає на розвиток усіх ускладнень ЦД 2–го типу (окрім макроангіопатії нижніх кінцівок); TNF–α впливав на розвиток ретинопатії, нефропатії за ШКФ і артеріальної гіпертензії; накопичення у крові NO сприяє розвитку макроангіопатії нижніх кінцівок.
2. Шляхом багатофакторної логістичної регресії побудовані адекватні моделі прогнозування ймовірності розвитку ускладнень ЦД 2–го типу на підставі вивчених чинників ЕДФ. Усі моделі мають високий рівень прогностичної точності (60,5–90,8 %).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/663-1.jpg)
/664-1.jpg)
/665-1.jpg)