Журнал «Медицина неотложных состояний» №6(93), 2018
Вернуться к номеру
Клинический случай операции гастроэнтеростомии с брауновским соустьем под эпидуральной анестезией
Авторы: Агафонов К.Е., Дубарь В.М., Федюшкин С.А.
КУ «Криворожская городская больница № 16» ДОС, г. Кривой Рог, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У статті описаний клінічний випадок операції гастроентеростомії, виконаної під епідуральною анестезією з внутрішньовенним потенціюванням кетаміном, у хворого з ішемічною хворобою серця, АВ-блокадою ІІІ ст., імплантованим електрокардіостимулятором.
В статье описан клинический случай операции гастроэнтеростомии, выполненной под эпидуральной анестезией с внутривенным потенцированием кетамином, у больного с ишемической болезнью сердца, АВ-блокадой ІІІ ст., имплантированным электрокардиостимулятором.
The article presents a clinical case of gastroenterostomy performed under epidural anesthesia with intravenous ketamine potentiation in a patient with ischemic heart disease, third-degree atrioventricular block, implanted pacemaker.
епідуральна анестезія; операція гастроентеростомія; АВ-блокада ІІІ ст.; декомпенсований стеноз вихідного відділу шлунка
эпидуральная анестезия; операция гастроэнтеростомия; АВ-блокада ІІІ ст.; декомпенсированный стеноз выходного отдела желудка
epidural anesthesia; gastroenterostomy; third-degree atrioventricular block; decompensated pyloric stenosis
Современные достижения фундаментальных наук в изучении патофизиологии боли и влияния хирургической агрессии на организм человека не случайно продиктовали широкое внедрение в анестезиологическую практику регионарных методов обезболивания. Достойное место среди них занимает эпидуральная анестезия (ЭА). Специалистов привлекает мощная антиноцицептивная защита, при которой афферентная патологическая импульсация надежно блокируется на уровне спинного мозга. Блокада ноцицептивной импульсации из операционной раны, обусловленная проведением ЭА с катетеризацией эпидурального пространства, гарантирует снижение влияний операционного стресса и позволяет продолжить комплексную антиноцицептивную защиту в послеоперационном периоде [1]. Известно, что регионарная анестезия имеет ряд преимуществ. Отмечены улучшение системного или регионарного кровотока, уменьшение агрегации тромбоцитов, что при операциях на желудочно-кишечном тракте улучшает кровообращение в анастомозах, при пластических операциях улучшает приживаемость тканей [2]. Доказано, что проводимые под регионарной анестезией операции сопровождаются меньшей кровопотерей, что снижает необходимость в переливании компонентов крови и, соответственно, уменьшает вероятность трансфузионных осложнений [3]. Эпидуральная анестезия способна устранять и предотвращать ишемию миокарда, вследствие чего у больных ишемической болезнью сердца с исходно нарушенной функцией сердца удается добиться улучшения сократимости миокарда [3–6]. Считается доказанным, что у пациентов с нарушенным коронарным кровотоком эпидуральная анестезия способствует снижению сосудистого сопротивления, частоты сердечных сокращений, что приводит к уменьшению потребности миокарда в кислороде. Выраженный антиаритмический эффект эпидуральной блокады связан как с противоишемическим действием, что улучшает кровоснабжение миокарда, так и с относительной ваготомией [5]. Наблюдающаяся при спинальной и эпидуральной анестезии симпатическая блокада благоприятно влияет на восстановление перистальтики желудочно-кишечного тракта [7, 8].
Доказано, что использование регионарной анестезии у пациентов высокого риска (класс по ASA 3 и выше) снижает периоперационную летальность примерно на 30 % [9].
В нашем случае больной С., 78 лет, поступил с жалобами на периодические тупые, спастические боли в верхних отделах живота, постоянную тошноту, рвоту ранее съеденной пищей, периодически изжогу, отрыжку воздухом с неприятным запахом. Болеет в течение трех недель, лечился в хирургическом отделении районной больницы по поводу декомпенсированного дуоденостеноза неясного генеза, откуда направлен в кардиологический центр для лечения, возникшей АВ-блокады ІІІ степени. В кардиоцентре имплантирован электрокардиостимулятор в режиме VVI, выписан с положительной динамикой.
В анамнезе: шесть лет назад операция по поводу обтурационной кишечной непроходимости — цекостомия, диагноз: заболевание толстого кишечника. Самостоятельно обратился в приемное отделение 16-й городской больницы.
Объективно: общее состояние средней степени тяжести. Сознание ясное. Кожные покровы бледноватые, сухие. Периферических отеков нет. Температура тела — 36,6 °С. Признаки гипотрофии, индекс массы тела — 17,7. Лимфоузлы не увеличены. При аускультации над легкими — везикулярное дыхание, чистое, проводится во все отделы. ЧДД — 22 в 1 мин. Тоны сердца приглушены, ритм правильный. АД — 100/60 мм рт.ст. ЧСС — 60 в 1 мин. Язык сухой, обложен грязно-белым налетом. Живот не вздут, симметричный, слегка напряжен, болезненный в эпигастральной области, симптомы раздражения брюшины негативные. Печень не увеличена, селезенка не пальпируется. Перистальтика выслушивается. В левой подвздошной области функционирующая цекостома.
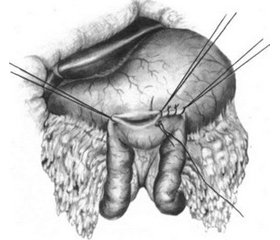
Пациент осмотрен консилиумом врачей, проведены лабораторные и дополнительные методы исследований, установлен диагноз: заболевание желудка с декомпенсированным стенозом выходного отдела, гастростаз. Ишемическая болезнь сердца: диффузный кардиосклероз, имплантированный электрокардиостимулятор по поводу АВ-блокады ІІІ ст., гипертоническая болезнь 1–2-й ст., риск 4, СН 2А, ФК ІІІ по NYHA. Степень операционно-наркозного риска по ASA — III. Больному проведена предоперационная подготовка в условиях ОАИТ в течение 2 суток, после чего в операционной предварительно выполнена премедикация: пантопразол 40 мг, метоклопрамид 10 мг, димедрол 10 мг, атропин 0,6 мг, в положении лежа на боку, по стандартной методике, выполнены пункция и катетеризация эпидурального пространства в промежутке Th12–L1, катетер введен краниально на 8 см, тест-доза — лидокаин 40 мг + адреналин 1 : 10 000, основная доза — бупивакаин 0,5% 15 мл, анестезия развилась на 16-й минуте, седация: сибазон 10 мг, кетамин 100 мг, введен назогастральный зонд, проведена операция в объеме: верхнесрединная лапаротомия, ревизия брюшной полости — опухоль поперечно-ободочной кишки с прорастанием и полным перекрытием пилоруса, гастроэнтеростомия с брауновским соустьем, санация, дренирование брюшной полости. Седация поддерживалась в/в введением кетамина по 50 мг каждые 20 мин с сохраненным спонтанным дыханием с подачей кислородно-воздушной смеси через маску, повторное эпидуральное введение бупивакаина через 2 часа. Послеоперационное обезболивание — продленная эпидуральная анальгезия 0,125% раствором бупивакаина. Перистальтика восстановилась в первые сутки послеоперационного периода, ко вторым суткам состояние больного с положительной динамикой, эпидуральный катетер удален, пациент переведен в отделение хирургии, на 7-е сутки после операции выписан из стационара на амбулаторное долечивание.
Выводы
Выбор данной методики анестезиологического обеспечения у больного с сопутствующей тяжелой кардиальной патологией является оптимальным, что позволило провести качественную антиноцицептивную защиту во время операции и в послеоперационном периоде, предотвратить эпизоды ишемии миокарда, способствовать раннему восстановлению перистальтики желудочно-кишечного тракта и адекватной состоятельности анастомоза.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Bauer M. et al. Recent advances in epidural analgesia / M. Bauer, J.E. George 3rd, J. Seif, E. Farag // Anesthesiol. Res. Pract. — 2012. — P. 309-319.
2. Michelet P. Effect of thoracic epidural analgesia on gastric blood flow after oesophagectomy / Michelet P., Roch A., D’Journo X.B. et al. // Acta Anaesthesiol. Scand. — 2007. — Vol. 51, № 5. — P. 587-594.
3. Sakura S. Epidural anesthesia and spinal anesthesia in the elderly / Sakura S. // Masui. — 2007. — Vol. 56, № 2. — P. 130-138.
4. Jakobsen C.J. High thoracic epidural analgesia improves left ventricular function in patients with ischemic heart / Jakobsen C.J., Bhavsar R., Nielsen D.V. et al. // Acta Anaesthesiol. Scand. — 2009. — Vol. 53, № 5. — P. 559-564.
5. Миербеков Е.М. Влияет ли высокая грудная эпидуральная анестезия на результаты операции реваскуляризации миокарда? / Е.М. Миербеков, Т.К. Куандыков, Т.Э. Тнымкулов // Анестезиология и реаниматология. — 2008. — № 5. — С. 80-83.
6. Wu S. Clinical observation of high thoracic epidural anesthesia therapy for patients with congestive heart failure secondary to ischemic cardiomyopathy / Wu Y., Li J., Zhang S.J. et al. // Zhonghua Yi Xue Za Zhi. — 2007. — Vol. 87, № 25. — P. 1752-1754.
7. Pedroviejo Saez V. Nonanalgesic effects of thoracic epidural anesthesia / Pedroviejo Saez V. // Rev. Esp. Anestesiol. Reanim. — 2011. — Vol. 58, № 8. — P. 499-507.
8. Freise H. Intestinal effects of thoracic epidural anesthesia / H. Freise, L.G. Fischer // Curr. Opin. Anaesthesiol. — 2009. — Vol. 22, № 5. — P. 644-648.
9. Power I. Regional anaesthesia and pain management / I. Power, J.G. McCormack, P.S. Myles // Anaesthesia. — 2010. — Vol. 65. — P. 38-47.