Журнал «Медицина неотложных состояний» №6(93), 2018
Вернуться к номеру
Некоторые вопросы гидродинамики и энергетики циркуляторного и гемического звеньев системы транспорта кислорода (часть 3)
Авторы: Михневич К.Г.
Харьковский национальный медицинский университет, г. Харьков, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У 3-й частині статті наведений оновлений підхід до вивчення кисневого бюджету з урахуванням енергетичного потенціалу кисню, що доставляється, і запропоновано принцип нормування гемодинамічних показників на основі розрахунку транспорту енергії. Розглянуті енергетичні аспекти варіантів гострого порушення кровообігу. Наведена розроблена біомедична система одиниць вимірювання.
В 3-й части статьи представлен обновленный подход к изучению кислородного бюджета с учетом энергетического потенциала доставляемого кислорода и предложен принцип нормировки гемодинамических показателей на основе расчета транспорта энергии. Рассмотрены энергетические аспекты вариантов острого нарушения кровообращения. Приведена разработанная биомедицинская система единиц измерения.
The 3rd part of the article presents an updated approach to the study of the oxygen budget taking into account the energy potential of the delivered oxygen and the principle of normalization of hemodynamic parameters based on the calculation of energy transport. Energy aspects of the types of acute circulatory failure are considered. The developed biomedical system of units of measurement is presented.
кисневий бюджет; недостатність кровообігу; коефіцієнт видобутку енергії; огляд
кислородный бюджет; недостаточность кровообращения; коэффициент добычи энергии; обзор
oxygen budget; circulatory insufficiency; energy production coefficient; review
4. Транспорт кислорода и энергии
Главнейшей задачей СК является доставка тканям кислорода, необходимого для получения энергии, а его доставка, в свою очередь, тоже требует энергии. Таким образом, представляется интересным определять у больных энергетическую цену добычи энергии, или кислородную цену энергоснабжения. Для этого требуется упорядочивание понимания взаимоотношений показателей кислородного бюджета и механико-энергетических параметров кровообращения.
4.1. Показатели кислородного бюджета
Методы расчета показателей кислородного бюджета хорошо известны. Мы приведем соответствующие формулы с некоторыми уточнениями [1].
Содержание кислорода в крови[1]:
CO2 [л/л] = KG [л/г] • CHb [г/л] • SO2 + KB [л/л • Торр] • (1-Ht) • pO2 [Торр], (4.1.1)
где KG = 0,00134 л/г — константа Гюфнера, отражающая объем кислорода, связываемый с 1 граммом гемоглобина; CHb — концентрация гемоглобина, г/л; SO2 — доля насыщенного кислородом гемоглобина; KB = 0,00031 л/л • Торр = 2,3259 • 10–6 л/л • Па — константа Бунзена, отражающая объем растворяющегося кислорода в единице объема плазмы при единичном парциальном давлении кислорода в ней; 1‑Ht — доля объема крови, приходящегося на плазму; pO2 — парциальное давление кислорода в плазме.
Транспорт (доставка) кислорода:
TO2 [л/мин • м2] = QI [л/мин • м2] × CaO2 [л/л], (4.1.2)
где CaO2 – CO2 в артериальной крови.
Потребление кислорода:
VO2 [л/мин • м2] = QI [л/мин • м2] × Ca‑vO2 [л/л], (4.1.3)
где Ca‑vO2 — артериовенозная разница в содержании кислорода.
Коэффициент экстракции кислорода тканями:
EO2 = VO2/TO2 = 1–CvO2/CaO2. (4.1.4)
При внимательном рассмотрении этих формул возникает вопрос по поводу констант Гюфнера и Бунзена. Константа Гюфнера показывает количество кислорода, связываемого одним граммом гемоглобина, и это количество отражается объемом. Уже давно некоторые исследователи [2] сомневались в точности и «постоянстве» этой постоянной. Обоснованность такого сомнения, на наш взгляд, может быть объяснена, в частности, и следующими соображениями.
Очевидно, что одна молекула кислорода обеспечивает получение определенного количества энергии. Количество молекул кислорода определяется количеством его молей, однако в вышеприведенных формулах количество кислорода выражается его объемом, причем проведенные нами расчеты показали, что имеется в виду объем кислорода при так называемых нормальных условиях (н.у.). Но нормальными условиями считаются такие, когда температура газа равна 0 °C, а его давление — 760 Торр. Известно, что при н.у. объем моля любого газа равен 22,4 л, но при 24 °C он уже равен 24,4 л, а при температуре альвеолярного воздуха (32 °C) — 25 л! Если еще учесть, что это объем моля воздуха, где на кислород приходится ≈ 21 %, и что парциальное давление кислорода снижается по пути из атмосферы до альвеолы со 159 до 106 Торр, то точность константы начинает вызывать серьезные сомнения.
Известно, что при SO2 = 100 % каждая молекула гемоглобина связывает 4 молекулы кислорода, то есть 1 моль гемоглобина связывает 4 моля кислорода. Молярная масса гемоглобина составляет, по разным данным, от 65 000 до 68 000 г (будем пользоваться средним значением 66 500 г), кислорода — 32 г, следовательно, 1 г гемоглобина (при SO2 = 100 %) связывает 1,92 мг ≈ 60 мкмоль O2 ~ 1,344 мл O2 (при н.у.!) — число, встречающееся во многих руководствах (если молярную массу гемоглобина принимают за 64 000 г, то 1,39 мл). При температуре альвеолярного воздуха 32 °C этот объем будет уже равен ≈ 1,5 мл (разница хоть и незначительная, но существенная — 12 %). Ясно, что более строгими будут являться расчеты, при которых используется не объем, а масса переносимого кислорода (которую, кстати, можно нормировать к массе тела). В этом случае константа Гюфнера равна 1,34 • 10–3 л/г = 1,91 • 10–3 г/г (граммов кислорода на 1 грамм гемоглобина), константа Бунзена — 3,1 • 10–4 л/л • Торр = 3,33 • 10–6 г/л • Па =
= 3,33 • 10–10 г/мл • б (граммов растворенного кислорода на 1 см3 плазмы при pO2 в плазме 1 б =
= 1 дин/см2), а CO2 будет измеряться в моль/мл (моли кислорода на миллилитры крови) или в г/мл (граммы кислорода на миллилитры крови). Используя пересчитанные значения констант и переведя все единицы измерения в СГС, выражение (4.1.1) следует переписать следующим образом:
CO2 [г/мл] = KG [г/г] • CHb [г/мл] • SO2 + KB [г/мл • б] • (1–Ht) • pO2 [б]. (4.1.5)
Подставив нормальные значения (CHb = 0,14 г/мл, SaO2 = 0,98, Ht = 0,45, pO2 = 100 Торр = 1,33 • 105 б) в 4.1.5, получим, что CaO2 = 2,87 • 10–4 г/мл (граммов кислорода на миллилитр крови) или 8,97 • 10–6 моль/мл (молей кислорода на миллилитр крови). Транспорт кислорода и его потребление, если их нормировать к ППТ, должны теперь измеряться в г/мин • м2 или моль/мин • м2 (в СГС — в г/с • см2).
4.2. Нормировка гемодинамических показателей по энергетическому принципу
Представленный взгляд на гемодинамику позволяет по-новому подойти к вопросу о нормировке показателей гемодинамики. Еще раз повторим, что кислород необходим для выработки энергии, а его доставка тканям также требует энергии, следовательно, нормировочный показатель должен отражать соотношение между скоростью затраты энергии (мощности) на транспорт кислорода и скоростью добычи энергии (получаемой мощности) тканями с помощью доставленного кислорода. Этот показатель можно назвать коэффициентом добычи энергии (КДЭ, ηДЭ). Для этого необходимо определить количество энергии, получаемое из единицы массы кислорода q. При окислении разных веществ одно и то же количество кислорода дает разное количество энергии. Так, при полном аэробном окислении 1 г глюкозы выделяется энергия 16 кДж = 1,6 • 1011 эрг, а при таком же окислении 1 г жиров — ≈ 38,9 кДж =
= 3,89 • 1011 эрг. В качестве стандарта мы выбрали энергию, выделяемую при окислении глюкозы как наиболее универсального и легкодоступного источника энергии. Согласно уравнению реакции аэробного окисления глюкозы
C6H12O6 + 6O2 = 6CO2 + 6H2O + 2880 кДж,
1 г кислорода при полном окислении обеспечивает получение 15 кДж энергии. Таким образом, массе транспортируемого кислорода можно поставить в соответствие энергию, получаемую при его использовании для окисления глюкозы. Глюкозный энергетический эквивалент кислорода (qO2/G) равен 15 кДж/г = 1,5 • 1011 эрг/г. Тогда скорость потребления тканями энергии (то есть потребляемая тканями мощность – ПТМ, W) равна
W [эрг/с] = qO2/G [эрг/г] • VO2 [г/с], (4.2.1)
а КДЭ, равный
ηДЭ = W/Psc, (4.2.2)
показывает, во сколько раз энергия, извлекаемая из потребленного кислорода, больше энергии, затраченной на транспорт потребленного кислорода.
Исходя из энергетических показателей движения крови по сосудам и кислородного бюджета, рассчитываются такие показатели, как энергетический коэффициент транспорта кислорода (ЭКТК, kТК) и энергетический коэффициент потребления кислорода (ЭКПК, kПК), показывающие количество энергии, затрачиваемое на перемещение 1 г транспортируемого и потребляемого кислорода:
Предлагаемые показатели энергетической эффективности кислородного бюджета (МК, TO2, VO2, ПТМ, ЭКТК, ЭКПК, КДЭ) в своей совокупности позволяют по-новому решить дискутабельный вопрос о нормировке показателей СТК. Так, давление крови является нормированным показателем по своей природе (работа по перемещению единичного объема крови). КДЭ показывает отношение потенциальной химической энергии потребленного кислорода к энергии, необходимой для его доставки тканям, и не зависит от антропометрических показателей, ЭКТК и ЭКПК показывают энергию, необходимую для единичной массы кислорода, и от антропометрических показателей тоже не зависят.
Рассчитаем для примера предложенные показатели у человека со средними нормальными параметрами циркуляторного и гемического звеньев транспорта кислорода. Стандартными будем считать следующие показатели:
Q = 4,8 л/мин = 80 мл/с,
psc = pAEF – pCVP = 1,14 • 105 б,
где pAEF = 90 мм рт.ст. = 1,2 • 105 б — эффективное АД,
pCVP = 62 мм вод.ст. = 6000 б — ЦВД,
CHb = 0,14 г/мл, Ht = 0,45, SaO2 = 0,98, SvO2 = 0,75,
paO2 = 100 мм рт.ст. = 1,33 • 105 б, pvO2 = 42 мм рт.ст. = 5,6 • 104 б.
Мощность движения крови по сосудам в таком случае равна 9,12 • 106 эрг/с (0,912 Вт), содержание кислорода в артериальной крови — 2,86 • 10–4 г/мл, содержание кислорода в венозной крови — 2,11 • 10–4 г/мл. Транспорт кислорода в этих условиях составляет 2,3 • 10–2 г/с, его потребление — 6,05 • 10–3 г/с, коэффициент экстракции кислорода — 0,26, потребляемая тканями мощность по глюкозному эквиваленту qO2/G W = 9,7 • 108 эрг/с (97 Вт), kТК = 3,97 • 108 эрг/г (39,7 Дж/г), kПК = 1,50 • 109 эрг/г (150 Дж/г), ηДЭ = 106,4.
КДЭ отличается от обычного физического КПД тем, что затраченная на транспорт кислорода энергия меньше энергии, которую можно получить при использовании доставленного кислорода, поэтому он больше 1, то есть, затратив определенную энергию на доставку усвоенного кислорода, можно с его помощью в рассматриваемом примере извлечь в 106,4 раза больше энергии.
Одним из важных преимуществ энергетического подхода является то, что предложенные выше показатели являются автоматически нормированными и к внутренним свойствам СК, и к антропометрическим показателям. Однако предложенные энергетические показатели не отражают соответствия доставки и потребления кислорода потребности в нем. Известно, что гиперметаболизм является обычным, если не универсальным, ответом организма на развитие критического состояния, при котором потребность в кислороде может возрастать до 4 раз по сравнению с нормальным уровнем [2]. Для оценки этого соответствия мы предлагаем ввести интегральный энергетический коэффициент (ИЭК, KSE), равный отношению скорости потребления тканями энергии к уровню лактата, который, как известно, возрастает при недостаточном удовлетворении потребностей тканей в кислороде:
KΣE = W/L, (4.2.7)
где L — уровень лактата в моль/мл. Поскольку результат получается слишком большим (порядка 1014), видимо, удобнее пользоваться показателем pKΣE, таким как
pKΣE = 10–14 • KΣE. (4.2.8)
В разобранном выше варианте нормы (при уровне лактата 1 ммоль/л = 10–6 моль/мл) pKΣE будет равным 9,68.
Развернутое выражение для интегрального показателя выглядит следующим образом:
/40-5.jpg)
Из этого соотношения видно, что, как и любой интегральный показатель, pKSE зависит от многих факторов, которые сами по себе являются взаимозависимыми, хотя эти зависимости не функциональные, а весьма сложные и неопределенные (еще одно проявление принципа биологической неопределенности), но с помощью pKE все они учитываются автоматически.
5. Нарушения кровообращения
Рассмотрим некоторые варианты нарушений кровообращения (острая недостаточность кровообращения и эссенциальная артериальная гипертензия) с точки зрения гемодинамического и энергетического подхода к ним.
Под острой недостаточностью кровообращения мы понимаем состояние, при котором сниженный СВ не удовлетворяет потребности тканей в кислороде. Причиной снижения СВ могут стать нарушения в одной или нескольких составляющих СК: 1) первичное снижение сократительной способности миокарда (ССМ), или, другими словами, снижение резерва мощности миокарда, что соответствует росту его внутреннего гидродинамического сопротивления; 2) первичное снижение ОЦК, что ведет к несоответствию ОЦК объему сосудов (острая гиповолемия); 3) первичное увеличение объема сосудов, что тоже ведет к несоответствию ОЦК объему сосудов (острая сосудистая недостаточность).
При эссенциальной артериальной гипертензии по до сих пор до конца не выясненным причинам повышается артериальное давление, что считается ведущим симптомом данного состояния.
В любом из этих случаев возникают явления, рассмотренные на примере неживой ЗЦГС с реактивными элементами, но в отличие от неживой ЗЦГС в СК развиваются и компенсаторные реакции, которые при не слишком глубоких нарушениях могут восстановить нормальное кровообращение в тканях; в противном случае компенсаторные реакции, оказавшиеся несостоятельными, начинают вредить организму.
5.1. Острая сердечная недостаточность
Острая сердечная недостаточность (ОСН) приводит к снижению нагнетательной способности миокарда, то есть давления, которое он мог бы создать при бесконечно большом ОПСС (см. подраздел 1.3). Вследствие этого давление в СВД превышает p0 на меньшую величину, чем у здорового индивида (клинически — артериальная гипотензия), а давление в ЕС становится ниже p0 на меньшую величину, чем у здорового (клинически — рост ЦВД).
Снижение нагнетательной способности миокарда означает рост внутреннего его сопротивления и снижение резерва его мощности. Как было показано выше (рис. 1.6.1), максимальную мощность насос может отдать при равенстве сопротивлений насоса и ЗЦГС, а для сохранения некоторого резерва мощности насоса сопротивление ЗЦГС, то есть в данном случае ОПСС, должно быть выше сопротивления насоса, в данном случае миокарда. На это и направлена одна из компенсаторных реакций — периферический сосудистый спазм, ведущий к росту ОПСС и повышению p0 (то есть давления крови при отсутствии ее движения по сосудам). Механизм этой реакции известен: снижение СВ ведет к гипоксии тканей, являющейся стрессорным фактором, что вызывает активацию симпатоадреналовой системы (САС), повышение уровня катехоламинов, на что реагируют АРС и ВРС, уменьшая свой просвет, но сохраняя круглой его форму. Последнее сохраняет соответствие объемов крови и сосудов, обеспечивая относительно удовлетворительные условия циркуляции крови в системе микроциркуляции и поддерживая относительно удовлетворительное снабжение тканей кислородом. Кроме того, известные процессы в капилляроне способствуют переходу жидкости из интерстиция в капилляры, облегчающему поддержание соответствия объемов крови и сосудов. В случае состоятельности описанной реакции перфузия тканей будет сохранена и развитие шока будет предотвращено, хотя, конечно, ССМ при этом не будет восстановлена.
Снижение ССМ снижает амплитуду колебаний АД (пульсовое АД), но если благодаря активации САС тонус сосудов-сопротивлений растет и АДД поэтому снижается незначительно или даже повышается, то снижению АДС ничего не препятствует (первичная сердечная слабость). Отсюда — нередко встречающийся при инфаркте миокарда симптом «обезглавленного АД», когда АД может быть около 100/90 мм рт.ст.
Снижение АДЭ с повышением ЦВД (то есть снижение ОПДСК) и рост ОПСС означают и снижение МК, однако оно без компенсаторных реакций могло бы быть еще большим. Действительно, не будь периферического сосудистого спазма, ОПСС не повысится и в сравнении с сопротивлением миокарда станет меньшим, и тогда большая, чем у здорового индивида, часть энергии кровотока будет теряться в самом миокарде, следовательно, польза «замысла природы» повышать в таком случае ОПСС очевидна. Понятно, что пределы возможностей такой реакции небезграничны, ведь повышение ОПСС предъявляет миокарду дополнительные требования в виде повышения требуемой энергии для поддержания движения крови, то есть повышения ОПДСК, а для этого требуется повышение силы сокращений миокарда, что при первичном его поражении труднодостижимо. С одной стороны, вазоконстрикция «выжимает» часть ОЦК в ЕС, что облегчает диастолическое наполнение, с другой — затрудняет изгнание крови в сосуды. Таким образом, взаимоотношения СВ, ОПДСК и ОПСС весьма сложны, поскольку все они взаимозависимы.
5.2. Острая гиповолемия
Острая гиповолемия (острая гиповолемическая недостаточность) первично не затрагивает ССМ, и нагнетательная способность миокарда, как и его внутреннее сопротивление, не меняется, но снижается p0. Это значит, что при сохраненном резерве мощности миокарду становится легче перемещать уменьшенный ОЦК, что равносильно снижению ОПСС, а это, в свою очередь, означает увеличение потери мощности кровотока в самом миокарде, поскольку его внутреннее сопротивление осталось прежним. С другой стороны, затрудняется диастолическое наполнение миокарда (напряжение диастолической функции), а снижение ОЦК ведет к такому же снижению объема сосудов. Если при этом длина сечения сосудов останется неизменной, они неизбежно спадутся и их сечение приобретет эллипсоидную форму, что повысит ОПСС. Если же сосуды сохранят соответствие своего объема уменьшенному ОЦК, то уменьшится радиус их сечения, а ОПСС растет пропорционально четвертой степени радиуса. Какие из описанных тенденций возобладают, зависит от многих факторов, в том числе от индивидуальных свойств организма (благодаря свойствам стенок сосудов при соответствии ОЦК и объема сосудов ЦВД, отражающее это соответствие, может находиться в довольно широких пределах — 60–120 мм вод.ст.), и предсказать изменение ОПСС практически невозможно (еще одно обстоятельство, вынуждающее рассматривать ОПСС только как коэффициент пропорциональности в выражении для СВ). При выраженной гиповолемии в любом случае для поддержания СВ потребуется повысить ОПДСК, что снова достигается благодаря активации САС, ведущей как к повышению тонуса сосудов, так и к положительным ино- и хронотропным эффектам. При адекватной компенсации внутреннее сопротивление миокарда и ОПСС «подбирается» организмом в соответствии с изменившимися условиями. Как и в предыдущем случае, взаимоотношения СВ, ОПДСК и ОПСС остаются сложными и труднопредсказуемыми.
5.3. Острая сосудистая недостаточность
Острая сосудистая недостаточность справедливо считается самым тяжелым видом острой недостаточности кровообращения, поскольку организм лишается возможности компенсации с помощью управления снизившимся ОПСС. При этом p0, как и в предыдущем случае, снижается, диастолическое наполнение затрудняется, и, хотя изгнание крови в сосуды облегчается, объем крови в ЕС — своеобразном гемоаккумуляторе — недостаточен для заполнения сосудов. Остается только один механизм компенсации — снижение внутреннего сопротивления миокарда (соответственно снизившемуся ОПСС) или повышение его производительности. Миокард вынужден с адекватной скоростью заполнять увеличившийся сосудистый объем, что в условиях сниженного венозного возврата возможно при усилении диастолической функции миокарда и увеличении ЧСС. Пока сохраняется возможность не слишком повышать ЧСС, СВ поддерживается за счет усиления силы сокращений и, следовательно, повышения АДС, АДД при этом остается низким, а АДП увеличивается. Такая ситуация характерна, например, для «теплой» фазы септического шока и определяет соответствующую клиническую картину (мягкий наполненный пульс, теплые розовые кожные покровы). Когда компенсация оказывается недостаточной, СВ уменьшается со всеми вытекающими последствиями в системе микроциркуляции (как, например, в «холодной» фазе септического шока).
5.4. Энергетика кровообращения при недистрибутивном шоке
Для недистрибутивного шока типично значимое увеличение ОПСС, степень которого линейно зависит от снижения СВ, если оно не превышает 40 % от исходного значения (Borgdorf Р., 1983). Это ведет к централизации кровообращения, физиологический смысл которой состоит в поддержании системного перфузионного давления, поскольку снижение СВ неизбежно приводит к артериальной гипотензии [3]. Если СВ снизился с 5 л/мин до 40 % этой величины, то есть в 2,5 раза — до 2 л/мин (33 мл/с), то ОПСС для поддержания прежнего АД повысится в 2,5 раза (с, например, 1,35 • 103 дин • с • см–5). В таком случае МК будет равна всего 0,378 Вт (!), то есть миокард не может сообщить ОЦК достаточной кинетической энергии.
5.5. Энергетика кровообращения при эссенциальной артериальной гипертензии
Эссенциальная артериальная гипертензия, или гипертоническая болезнь (ГБ), — заболевание, главным симптомом которого является беспричинное повышение АД. Но, как уже было показано выше, уровень АД или, точнее, ОПДСК является производным от ССМ и ОПСС, которые сами по себе зависят от многих факторов. Физиологическое повышение АД бывает вызвано только повышением потребности тканей в кислороде (или подготовкой организма к такой ситуации) и обеспечивается усилением силы сокращений миокарда и разнонаправленными изменениями ОПСС в разных органах, обусловливая удовлетворение разных тканей в кислороде в соответствии с их потребностями. Патологическое же повышение АД, которое может иметь разные этиологические факторы, может быть обусловлено изменением любых составляющих СВ: и силы сокращений миокарда, и тонуса сосудов, влияющего на ОПСС, и ОЦК. Если рассмотреть изменения каждого из патогенетических факторов по отдельности при постоянстве других, может получиться следующая картина.
Если по какой-либо нефизиологической причине возникает гиперпродукция катехоламинов (например, феохромоцитома), то изменения в СК, очевидно, сходны с изменениями при физиологическом повышении концентрации катехоламинов, но их выраженность значительно выше, а потребности в них нет. При феохромоцитоме увеличиваются концентрации адреналина, норадреналина и дофамина, то или иное соотношение которых обусловливает определенный уровень гемодинамических показателей — силы сокращений миокарда, ЧСС и ОПСС. АД может повышаться до 280/160 мм рт.ст. (то есть на перемещение единичного объема крови тратится огромная энергия). Каким при этом будет СВ, зависит от ОПСС, поскольку выраженная артериальная гипертензия — свидетельство сохраненной хорошей ССМ.
При ГБ также первоначально может нарастать сила сокращений миокарда без какой-либо ясной причины, хотя выраженность артериальной гипертензии в этом случае будет меньше, но все равно миокарду придется затрачивать бóльшую работу на перемещение ОЦК, даже если ОПСС не изменится (в этом случае СВ повысится, что мы будем называть гиперкинетическим типом кровообращения). При длительном существовании такой ситуации миокард постепенно истощается, сила его сокращений уменьшается, однако воздействие факторов, вызвавших развитие ГБ, продолжается, ОПСС постепенно нарастает. Пока у миокарда сохраняются некоторые резервы, СВ поддерживается на нормальном уровне (эукинетический тип кровообращения), но энергозатраты миокарда растут. В дальнейшем при воздействии этиологических факторов ГБ и продолжающемся росте ОПСС истощение миокарда усугубляется, и хотя артериальная гипертензия сохраняется (высокая энергетическая цена кровотока), СВ падает (гипокинетический режим кровообращения). Возможные значения мощности кровотока на разных стадиях ГБ представлены в табл. 5.5.1.
Заключение
Живые системы построены из тех же элементов, что и неживые, но первые отличаются от последних коренным образом тем, что, будучи предоставлены сами себе, стремятся поддерживать свою энтропию (то есть степень беспорядка) на низком уровне, а на это требуется энергия. Единственный источник энергии для живых — энергия химической связи питательных веществ, наиболее выгодным способом усвоить которую возможно только при аэробном окислении.
Наиболее совершенной системой транспорта кислорода обладают теплокровные организмы, одним из звеньев этой системы является система кровообращения. Ее главной функцией и является транспорт кислорода — средства для максимально выгодного получения энергии. На осуществление кислородтранспортной функции системы кровообращения тоже требуется энергия и, следовательно, кислород, что позволяет говорить об энергетической цене доставки энергии. В данной работе мы предложили ввести ряд показателей, отражающих соотношение между энергией, необходимой на транспорт кислорода, и энергией, освобождаемой при использовании потребленного кислорода. При этом необходимо контролировать не только общепринятые гемодинамические показатели (СВ, АД, ЦВД, ОПСС), но и энергетические параметры кровообращения, прежде всего мощность кровотока, которые необходимо рассматривать в связи с той энергией, которую можно извлечь при использовании кислорода, потребленного тканями.
Транспорт кислорода осуществляется благодаря перемещению его носителей (гемоглобин — основной, плазма — дополнительный) жидкой средой крови, следовательно, скорость движения кислорода от легких к тканям определяется скоростью кровотока и его содержанием в артериальной крови, не потребленный тканями кислород остается в венозной крови. СВ зависит от сократительной способности миокарда и степени соответствия объема сосудов объему циркулирующей крови. Под сократительной способностью, на наш взгляд, следует понимать разницу давлений до и после миокарда, которую он может создать при бесконечно большом ОПСС (то есть при перекрытых аорте и полых венах). Чем меньше ОПСС, тем ниже эта разница давлений при прежней сократительной способности. Нормальное соответствие объема сосудов и ОЦК обеспечивает круглую форму сечения сосудов, что снижает ОПСС при прочих равных условиях и, соответственно, необходимую разницу давлений для поддержания постоянного СВ. Разница давлений отражает энергетическую цену перемещения единичного объема крови, а мощность движущейся крови, расходуемая на преодоление ОПСС, равна произведению СВ на разницу давлений. Кислород, доставляемый тканям и потребляемый ими с определенной скоростью, которую мы предлагаем измерять в г/с, обеспечивает получение тканями определенной энергии. Доставка же кислорода тканям также требует энергии, определяемой мощностью кровотока, обеспечиваемой миокардом. Соотношение энергии, затрачиваемой на доставку кислорода, и энергетического потенциала потребленного кислорода позволяет рассчитать эффективность транспорта кислорода, а соотношение транспорта кислорода с уровнем лактата — адекватность снабжения тканей кислородом.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Михневич К.Г. О системе единиц измерения в медицине / К.Г. Михневич, Ю.В. Волкова, А.А. Хижняк // Медицина неотложных состояний. — 2017. — № 3(82). — С. 111-114.
2. Рябов Г.А. Гипоксия критических состояний / Г.А. Рябов. — М.: Медицина, 1988. — 288 с.
3. Шок: теория, клиника, организация противошоковой помощи / Под общ. ред. Г.С. Мазуркевича и С.Ф. Багненко. — СПб.: Политехника, 2004. — 544 с.

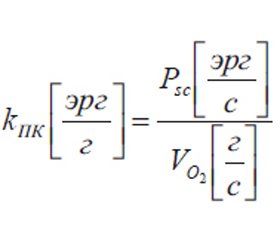
/40-1.jpg)
/43-1.jpg)
/43-2.jpg)