Резюме
Актуальність. Тяжкість опікової травми відображає ступінь судинних ушкоджень із паравазальними змінами, розвитком порушень функції ендотеліоцитів судин й еритроцитарно-тромбоцитарної ланки реологічних властивостей крові. Мета дослідження: вивчити клініко-патогенетичну значущість ендотеліальної дисфункції судин та реологічних властивостей сироватки крові при опіковій травмі. Матеріали та методи. Під наглядом перебували 117 потерпілих від опікової травми, серед яких було 83 % чоловіків і 17 % жінок віком від 14 до 79 років (в середньому — 44 роки). Термін обстеження після отримання опікової травми становив до 7 діб (в середньому — 2 доби). Показники ендотеліальної функції судин досліджували імуноферментним методом, а реологію крові — фізико-хімічним методом форми вісесиметричних крапель. Результати. У хворих з опіковою травмою показники судинного ендотеліального чинника зростання (VEGF) становили 465,0 ± 10,9 пг/мл, ендотеліну-1 (ET1) — 5,0 ± 0,2 пг/мл, тромбоксану A2 (TxA2) — 12,0 ± 0,9 нг/мл, простацикліну (PgI2) — 44,0 ± 4,2 нг/мл, поверхневої в’язкості (SV) — 14,00 ± 0,23 мН/м, пружності — 43,0 ± 0,6 мН/м, модуля в’язкоеластичності — 24,0 ± 0,8 мН/м, сурфактантного індексу — 48,0 ± 0,8 в.о. Порівняно з конт-рольною групою умовно здорових осіб опіки супроводжуються підвищенням вмісту VEGF у 5,2 раза, ET1 — на 28 %, TxA2 — на 69 % при зменшенні рівня PgI2 на 35 % і SV на 12 %, що спостерігається відповідно в 98, 54, 27, 32 і 42 % випадків, а показники корелюють між собою (SV ↔ ET1, SV ↔ PgI2) і лабораторними критеріями хвороби, залежать від тяжкості перебігу патологічного процесу (параметри ступеня респіраторного опіку, інтегральної тяжкості травми й шоку), впливають на виживаність потерпілих, а рівень VEGF має прогностичну значущість. Висновки. Порушення ендотеліальної функції судин і реологічних властивостей сироватки крові беруть участь у патогенетичних побудовах опікової травми.
Актуальность. Тяжесть ожоговой травмы отражает степень сосудистых повреждений c паравазальными изменениями, развитием нарушений функции эндотелиоцитов сосудов и эритроцитарно-тромбоцитарного звена реологических свойств крови. Цель исследования: изучить клинико-патогенетическую значимость эндотелиальной дисфункции сосудов и реологических свойств сыворотки крови при ожоговой травме. Материалы и методы. Под наблюдением находились 117 пострадавших от ожоговой травмы, среди которых было 83 % мужчин и 17 % женщин в возрасте от 14 до 79 лет (в среднем — 44 года). Срок обследования после получения ожоговой травмы составил до 7 суток (в среднем — 2 суток). Показатели эндотелиальной функции сосудов исследовали иммуноферментным методом, а реологию крови — физико-химическим методом формы осесимметричных капель. Результаты. У больных с ожоговой травмой показатели сосудистого эндотелиального фактора роста (VEGF) составили 465,0 ± 10,9 пг/мл, эндотелина-1 (ET1) — 5,0 ± 0,2 пг/мл, тромбоксана A2 (TxA2) — 12,0 ± 0,9 нг/мл, простациклина (PgI2) — 44,0 ± 4,2 нг/мл, поверхностной вязкости (SV) — 14,00 ± 0,23 мН/м, упругости — 43,0 ± 0,6 мН/м, модуля вязкоэластичности — 24,0 ± 0,8 мН/м, сурфактантного индекса — 48,0 ± 0,8 о.е. По сравнению с контрольной группой условно здоровых людей ожоги сопровождаются повышением содержания VEGF в 5,2 раза, ET1 — на 28 %, TxA2 — на 69 % при уменьшении уровня PgI2 на 35 % и SV на 12 %, что наблюдается соответственно в 98, 54, 27, 32 и 42 % случаев, а показатели коррелируют между собой (SV ↔ ET1, SV ↔ PgI2) и лабораторными критериями болезни, зависят от тяжести течения патологического процесса (параметров степеней респираторного ожога, интегральной тяжести травмы и шока), влияют на выживаемость пострадавших, а уровень VEGF обладает прогностической значимостью. Выводы. Нарушения эндотелиальной функции сосудов и реологических свойств сыворотки крови участвуют в патогенетических построениях ожоговой травмы.
Background. The severity of burn injury reflects the degree of vascular damages with paravasal changes, the development of the disturbances of vascular endotheliocyte function and the erythrocyte-platelet unit of rheological blood properties. The purpose of the research is to study the clinical and pathogenetic significance of vascular endothelial dysfunction and disturbances of the rheological properties of blood serum in case of burn injury. Materials and methods. Under survey, there were 117 patients with burns, 83 % of men and 17 % of women aged 14 to 79 years (44 years on the average). The examination period after burn injury was up to 7 days (2 days on the average). The indices of vascular endothelial function were studied by the immunoenzyme method and the rheology of blood — by the physicochemical method of axisymmetric drop shape. Results. In patients with burn injury, the indices of vascular endothelial growth factor (VEGF) were 465.0 ± 10.9 pg/ml, endothelin-1 (ET1) — 5.0 ± 0.2 pg/ml, thrombo-xane A2 (TxA2) — 12.0 ± 0.9 ng/ml, prostacyclin (PgI2) — 44.0 ± 4.2 ng/ml, surface viscosity (SV) — 14.00 ± 0.23 mN/m, elasticity — 43.0 ± 0.6 mN/m, viscoelastic modulus — 24.0 ± 0.8 mN/m, surfactant index — 48.0 ± 0.8 r.u. In comparison with the control group of apparently healthy people, burns are associated with an increase of VEGF level by 5.2 times, ET1 — by 28 %, TxA2 — by 69 % with the decrease of PgI2 level by 35 % and SV by 12 % that is observed in 98, 54, 27, 32 and 42 % of cases, respectively, and the indices correlate with each other (SV ↔ ET1, SV ↔ PgI2) and with laboratory criteria of the disease, they depend on the severity of the pathological process (the degree of respiratory burn, integral severity of injury and shock), affect the survival of the injured persons, and the level of VEGF has prognostic significance. Conclusions. Violations of the endothelial function of blood vessels and the rheological properties of blood serum are involved in pathogenetic constructions of burn injury.
Введение
Тяжесть ожоговой травмы (ОТ) отражает степень сосудистых повреждений [1, 6, 13]. В патогенетических построениях ангиопатии при термических ожогах (ТО) участвуют дисфункция эндотелиоцитов сосудов [9], эндотелиальных гликопротеинов клеточной адгезии [7] и ингибитора активации профибринолизина в эндотелии [10], при этом ОТ вызывает апоптоз эндотелиоцитов [2].
Нарушения эндотелиальной функции сосудов (ЭФС) являются важным звеном патогенеза ОТ [5, 11, 12], которые в итоге резко нарушают процессы микроциркуляции, но эти вопросы требуют дальнейшего решения [14]. Эндотелиальная дисфункция сосудов при ОТ тесно связана с эритроцитарно-тромбоцитарным звеном реологических свойств крови (РСК), а с плазменными составляющими такие соотношения пока не изучены, хотя имеются корреляции с показателями вязкости сыворотки [4, 8]. Следует подчеркнуть, что ОТ свойственны системные изменения не только вискозных свойств крови, но и вязкоэластичных характеристик ее плазменного звена непосредственно в ране [3].
Цель исследования: изучить клинико-патогенетическую значимость эндотелиальной дисфункции сосудов и реологических свойств сыворотки крови при ожоговой травме.
Материалы и методы
Ретроспективно проанализированы результаты обследования 117 больных (82,9 % составили мужчины и 17,1 % — женщины в возрасте от 14 до 79 лет (в среднем — 44,20 ± 1,53 года). Срок обследования после получения ОТ составил до 7 суток (в среднем — 1,65 ± 0,19 суток), а 41,9 % от числа пострадавших поступили в клинику в первый день ТО. У 90,6 % обследованных непосредственной причиной ТО было открытое пламя, а у остальных 9,4 % — контакт с высокотемпературным фактором. Соотношение частоты таких причин у мужчин и женщин существенно отличалось, составляя соответственно 15 : 1 и 3 : 1 (χ2 = 6,89, р = 0,009). Поражение ТО туловища установлено у 74,4 % больных, рук — у 69,2 %, ног — у 62,4 %, головы — у 43,6 %, дыхательных путей — у 32,5 %, промежности — у 10,3 %.
Показатель площади ТО (BA) составил 23,40 ± 1,84 %, степени его выраженности (BD) — 1,640 ± 0,065 о.е., кровопотери (DB) — 0,400 ± 0,033 мл/см2, интегральной тяжести ОТ (WB) — 1,570 ± 0,057 усл.ед., среднего артериального давления (Ра) — 103,10 ± 0,84 мм рт.ст., сосудистого сопротивления (VR) — 2,40 ± 0,05 дин × с × см–8, минутного объема крови (VB) — 35,7 ± 0,70 дл/мин, вазопенического ожогового индекса (VP) — 168,70 ± 6,53 о.е. BD подсчитывали по формуле:
BD = ln[(b2)2 + (b3)2 + (b4)2],
где b2, b3, b4 — соответственно ТО II, III и IV степени.
WB определяли по формуле:
WB = (2 × BD + DB + DS + BR) : 4,
где DS — наличие шока, а BR — ТО дыхательных путей. VP высчитывали по формуле:
VP = Pa : VR × VB.
Иммуноферментным методом исследовали показатели в сыворотке крови сосудистого эндотелиального фактора роста (VEGF), эндотелина-1 (ET1), тромбо-ксана А2 (TxA2) и простациклина (PgI2), а также соотношения TxA2/PgI2 (ридер PR2100 Sanofi diagnostic pasteur, Франция). Межфазная тензиометрия крови проведена с помощью компьютерного аппарата PAT2-Sinterface (Германия). Определяли уровни поверхностной вязкости (sV), упругости (sE) и модуля вязкоэластичности (VE), а также высчитывали белковый сурфактантный индекс (SI) по формуле:
SI = 10 × (sV + sE + VE) : (GF + 2 × Ab + 10 × FG),
где GF — общий белок крови, Ab — альбумины, FG — фибриноген, которые исследовали с помощью биохимического анализатора Olympus-AU640 (Япония). Контрольную группу составили 30 условно здоровых людей (21 мужчина и 9 женщин в возрасте от 18 до 64 лет).
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (SE) и отклонения (SD), критерии множественной регрессии (R), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), показатели однофакторного дисперсионного анализа (D) и многофакторного Уилкоксона — Рао (WR), тест однородности дисперсии Брауна — Форсайта (BF), критерии различий Стьюдента (t) и Макнемара — Фишера (χ2), а также достоверность статистических показателей (р). Подсчитывали прогностически позитивный результат модели (PPV) и выживаемость больных по методу Каплана — Мейера (St).
Результаты и обсуждение
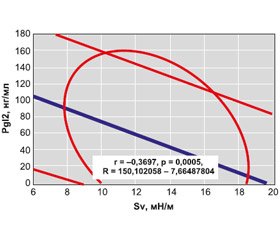
У больных с ОТ показатели VEGF составили 464,50 ± 10,97 пг/мл, ET1 — 5,00 ± 0,19 пг/мл, TxA2 — 12,00 ± 0,85 нг/мл, PgI2 — 43,9 ± 4,2 нг/мл, TxA2/PgI2 — 47,20 ± 5,05 %, sV — 13,60 ± 0,23 мН/м, sE 42,50 ± 0,58 мН/м, VE — 23,60 ± 0,77 мН/м, SI — 48,30 ± 0,77 о.е. По сравнению с контрольной группой условно здоровых людей содержание VEGF достоверно было выше в 5,2 раза (t = 25,39, p < 0,001), ET1 — на 28 % (t = 3,38, p = 0,001), а TxA2 — на 69 % (t = 3,11, p = 0,002) при уменьшении уровня PgI2 на 35 % (t = 2,90, p = 0,004) и sV на 12 % (t = 4,56, p < 0,001), что представлено на рис. 1. Такие отклонения от нормы (< M ± SD >) обнаружены соответственно в 98,3, 53,9, 26,5, 31,6 и 42,3 % случаев (рис. 2). Трехмерные интегральные гистограммы РСК (sV + sE + VE) нашли свое отражение на рис. 3, а тензиограммы сыворотки крови у здоровых и больных — на рис. 4.
/55-1.jpg)
/55-2.jpg)
/55-3.jpg)
Как показал многофакторный дисперсионный анализ Уилкоксона — Рао, на интегральные вазальные признаки ЭФС и РСК оказывают воздействие ТО ног (WR = 2,85, p = 0,025) и дыхательных путей (WR = 4,10, p = 0,001), наличие и тяжесть шока (WR = 1,71, p = 0,029), а также выраженность респираторной ожоговой патологии (WR = 1,62, p = 0,048).
По результатам однофакторного дисперсионного анализа, на показатель VEGF оказывают влияние время обследования пострадавших после ОТ (D = 2,85, p = 0,001) и характер причин ТО (D = 2,03, p = 0,020), на содержание простациклинемии — степень кровопотери (D = 1,65, p = 0,041), на соотношение TxA2/PgI2 — развитие шока (D = 1,69, p = 0,040), на уровень sV — поражение дыхательных путей (D = 3,33, p = 0,001), на параметр SI — ТО головы (D = 1,74, p = 0,030). В свою очередь, показатель sV определяет тяжесть ожога органов дыхания и, по данным анализа Кендалла, обратно коррелирует со степенью респираторной патологии. В связи с этим уровень sV < 11 мН/м сыворотки крови (< M-SD больных) рекомендуется учитывать для оценки тяжелого поражения ТО дыхательных путей (PPV = 78,9 %).
Установлены разнонаправленные корреляционные связи Пирсона (рис. 5 и 6) вазоконстриктора ЕТ1 и вазодилататоров PgI2 с показателем sV (r = +0,568, p < 0,001 и r = –0,370, p < 0,001). По результатам выполненного анализа множественной регрессии выявлены прямые связи интегрального состояния РСК с содержанием VEGF (R = +4,17, p < 0,001) и PgI2 (R = +2,90, p = 0,005), а состояния ЭФС — с уровнями sV (R = +6,36, p < 0,001; R = +7,38, p < 0,001; R = +3,65, p = 0,001 и R = +9,18, p < 0,001). Значения WB влияют на показатели VR (BF = 3,67, p = 0,014), что продемонстрировал анализ Брауна — Форсайта. Как показал корреляционный анализ Пирсона, имеют место прямые связи с WB показателей Pa (r = +0,203, p = 0,030) и FG (r = +0,384, p < 0,001). Параметры VEGF и ТхА2 прямо коррелируют с содержанием фибриногенемии (соответственно r = +0,275, p = 0,024 и r = +0,375, p < 0,001), уровень sV — c VP (r = +0,219, p = 0,033), VE — c VR (r = +0,205, p = 0,046), имеют место обратные соотношения sV — c VB (r = –0,210, p = 0,041).
/56-1.jpg)
11,1 % от числа обследованных больных в сроках до 5 суток умерли (10,3 % от числа мужчин и 15,0 % — женщин; χ2 = 0,37, p = 0,543). Наблюдался половой диморфизм выживаемости по методу Каплана — Мейера, который показан на рис. 7. С возрастом пострадавших от ОТ прямо зависела частота смерти больных (BF = 11,99, p = 0,001; τ = +0,246, p < 0,001), а от времени с момента нанесения травмы установлена обратная связь (BF = 5,12, p = 0,026; τ = –0,167, p = 0,008), что продемонстрировали дисперсионный анализ Брауна — Форсайта и корреляционный непараметрический Кендалла. Неблагоприятный исход ОТ зависел от показателей ВА (BF = 20,91, p < 0,001), BD (BF = 4,39, p = 0,038) и WB (BF = 9,72, p = 0,002), ТО промежности (BF = 28,43, p < 0,001) и дыхательных путей (BF = 6,27, p = 0,014), степени шока (BF = 25,35, p < 0,001).
/56-2.jpg)
На летальный исход при ОТ влияет показатель VEGF (D = 3,84, p = 0,036), с которым существует прямая корреляционная связь (τ = +0,181, р = 0,044). Позитивно также соотносится и параметр тромбоксанемии (τ = +0,136, p = 0,046). У умерших лиц оказались достоверно (на 13 %) выше значения VEGF (t = 2,16, p = 0,035), на 85 % — TxA2 (t = 3,48, p = 0,001) и на 20 % меньше значение SI (t = 3,64, p < 0,001), что представлено на рис. 8. С учетом выполненного вариационного, дисперсионного и непараметрического корреляционного анализа дана следующая практическая рекомендация: показатель VEGF > 590 пг/мл (> M + SD умерших обожженных) является прогнознегативным в отношении выживаемости больных с ОТ (PPV = 76,9 %).
Выводы
По сравнению с контрольной группой условно здоровых людей ОТ сопровождается повышением содержания VEGF в 5,2 раза, ET1 — на 28 %, TxA2 — на 69 % при уменьшении уровня PgI2 на 35 % и sV — на 12 %, что наблюдается соответственно в 98, 54, 27, 32 и 42 % случаев, а показатели коррелируют между собой (sV ↔ ET1, sV ↔ PgI2) и лабораторными критериями болезни, зависят от тяжести течения патологического процесса (параметров BR, BD, WB, степени шока и поражения дыхательных путей), влияют на выживаемость пострадавших, а уровень VEGF обладает прогностической значимостью. Нарушения ЭФС и РСК участвуют в патогенетических построениях ОТ.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Etulain J. Platelets in wound healing and regenerative medicine // Platelets. — 2018. — 14(2). — Р. 1-13. doi: 10.1080/09537104.2018.1430357.
2. Foresta C., Schipilliti M., De Toni L., Magagna S., Lancerotto L., Azzena B. et al. Blood levels, apoptosis, and homing of the endothelial progenitor cells after skin burns and escharectomy // J. Trauma. — 2011. — 70(1). — Р. 459-65. doi: 10.1097/TA.0b013e3181fcf83c.
3. Guan Y., Lu M., Shen Z., Wan M. Optical tracking of local surface wave for skin viscoelasticity // Med. Eng. Phys. — 2014. — 36(6). — Р. 708-14. doi: 10.1016/j.medengphy.2014.02.022.
4. Huang Y.S. Thromboxane and prostacyclin imbalance in the pathogenesis of early damage after severe burns // Zhonghua Yi Xue Za Zhi. — 2013. — 73(10). — Р. 615-7.
5. Kelly-Goss M.R., Ning B., Bruce A.C., Tavakol D.N., Yi D., Hu S. et al. Dynamic, heterogeneous endothelial Tie2 expression and capillary blood flow during microvascular remodeling // Sci. Rep. — 2017. — 7(1). — Р. 9049. doi: 10.1038/s41598-017-08982-z.
6. Korkmaz H.I., Ulrich M.M.W., Vogels S., de Wit T., van Zuijlen P.P.M., Krijnen P.A.J. et al. Neutrophil extracellular traps coincide with a pro-coagulant status of microcirculatory endothelium in burn wounds // Wound Repair. Regen. — 2017. — 25(4). — Р. 609-17. doi: 10.1111/wrr.12560.
7. Lagus H., Kankuri E., Nuutila K., Juteau S., Sarlomo-Rikala M., Vuola J. Induced granulation tissue but not artificial dermis enhances early host-graft interactions in full-thickness burn wounds // World J. Surg. — 2018. — 42(4). — Р. 981-91. doi: 10.1007/s00268-017-4270-6.
8. Mirdell R., Iredahl F., Sjöberg F., Farnebo S., Tesselaar E. Microvascular blood flow in scalds in children and its relation to duration of wound healing: A study using laser speckle contrast imaging // Burns. — 2016. — 42(3). — Р. 648-54. doi: 10.1016/j.burns.2015.12.005.
9. Op’t Veld R.C., van den Boomen O.I., Lundvig D.M.S., Bronkhorst E.M., Kouwer P.H.J., Jansen J.A. et al. Thermosensitive biomimetic polyisocyanopeptide hydrogels may facilitate wound repair // Biomaterials. — 2018. — 30(181). — Р. 392-401. doi: 10.1016/j.biomaterials.2018.07.038.
10. Osuka A., Kusuki H., Yoneda K., Matsuura H., Matsumoto H., Ogura H. et al. Glycocalyx shedding is enhanced by age and correlates with increased fluid requirement in patients with major burns // Shock. — 2018. — 50(1). — Р. 60-5. doi: 10.1097/SHK.0000000000001028.
11. Shibuya M. Vascular endothelial growth factor and its receptor system: physiological functions in angiogenesis and pathological roles in various diseases // J. Biochem. — 2018. — 153. — Р. 13-9. doi: 10.1093/jb/mvs136.
12. Tetsuaki H., Koichi N. Endothelial dysfunction as a cellular mechanism for vascular failure // Am. J. Physiol. Heart Circulat Physiol. — 2012. — 302(3). — Р. 499-505. doi: 10.1152/ajpheart.00325.2011.
13. Udy A.A., Roberts J.A., Lipman J., Blot S. The effects of major burn related pathophysiological changes on the pharmacokinetics and pharmacodynamics of drug use: An appraisal utilizing antibiotics // Adv. Drug. Deliv. Rev. — 2018. — 123(1). — Р. 65-74. doi: 10.1016/j.addr.2017.09.019.
14. Zhang Q.F., Wei W., Shang T., Zhou H.M., Li Z.N., Wang C.J. et al. Influence of high-voltage electrical burn on the rheological property of platelet and leukocyte in rats and the interventional effect of pentoxifylline // Zhonghua Shao Shang Za Zhi. — 2012. — 28(6). — Р. 428-34.

/55-1.jpg)
/55-2.jpg)
/55-3.jpg)
/56-1.jpg)
/56-2.jpg)
/56-3.jpg)