Журнал «Боль. Суставы. Позвоночник» Том 8, №2, 2018
Вернуться к номеру
Особливості впливу препарату келтикан та поляризуючого світла на ознаки невропатичного болю в комбінованій терапії діабетичної полінейропатії
Авторы: Макарчук Н.Р., Мартинюк Л.П.
ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України», м. Тернопіль, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Актуальність. Діагностика та лікування діабетичної полінейропатії мають особливе значення для хворих на цукровий діабет, оскільки вона може призводити до тяжких наслідків. Метою дослідження було підвищення ефективності лікування невропатичного болю шляхом включення препарату келтикан та поляризуючого світла в комплексну терапію діабетичної полінейропатії. Матеріали та методи. Обстежено 99 хворих на цукровий діабет 2-го типу, ускладнений діабетичною полінейропатією. Пацієнти були розподілені на 3 групи: до контрольної групи увійшли 32 пацієнти, які отримували стандартне лікування, 32 хворі 2-ї групи додатково отримували келтикан по 1 капсулі тричі на добу впродовж місяця, а 35 хворим 3-ї групи додатково було призначено 12 лікувальних процедур поляризуючим світлом. Оцінку інтенсивності невропатичного болю проводили за допомогою модифікованого опитувальника DN4. Результати. Установлено позитивний клінічний ефект лікування в усіх групах після 12-денного курсу лікування, який зберігався впродовж 3 місяців у 2-й та 3-й групах, а через 6 місяців — лише в групі з додатковим призначенням келтикану. Висновки. Використання опитувальника DN4 із модифікованою шкалою оцінки показників невропатичного болю дозволяє оптимізувати діагностику даного ускладнення у хворих на цукровий діабет. Включення препарату келтикан та поляризуючого світла в стандартну комплексну терапію діабетичної полінейропатії підвищує клінічну ефективність лікування невропатичного болю.
Актуальность. Диагностика и лечение диабетической полинейропатии имеют особое значение для больных сахарным диабетом, так как она может приводить к тяжелым последствиям. Целью исследования было повышение эффективности лечения невропатической боли путем включения препарата келтикан и поляризующего света в комплексную терапию диабетической полинейропатии. Материалы и методы. Обследовано 99 больных с сахарным диабетом 2-го типа, осложненным диабетической полинейропатией. Пациенты были распределены на 3 группы: в контрольную группу вошли 32 пациента, которые получали стандартное лечение, 32 больных 2-й группы дополнительно получали келтикан по 1 капсуле три раза в сутки в течение месяца, а 35 больным 3-й группы дополнительно были назначены 12 лечебных процедур поляризующим светом. Оценку интенсивности нейропатической боли проводили с помощью модифицированного опросника DN4. Результаты. Установлен положительный клинический эффект терапии у всех больных после 12-дневного курса лечения, который сохранялся в течение 3 месяцев во 2-й и 3-й группах, а через 6 месяцев — только в группе с дополнительным назначением келтикана. Выводы. Использование опросника DN4 с модифицированной шкалой оценки показателей невропатической боли позволяет оптимизировать диагностику данного осложнения у больных сахарным диабетом. Включение препарата келтикан и поляризующего света в стандартную комплексную терапию диабетической полинейропатии повышает клиническую эффективность лечения невропатической боли.
Background. Diagnosis and treatment of diabetic polyneuropathy is of particular importance for patients with diabetes mellitus and can lead to severe consequences. The purpose of the study was to increase the effectiveness of treatment for neuropathic pain by inclusion of keltican and polarizing light into the comprehensive therapy of diabetic polyneuropathy. Materials and methods. We examined 99 patients with type 2 diabetes mellitus complicated by diabetic polyneuropathy. Patients were divided into 3 groups: the control group included 32 patients who received standard treatment, 32 persons in the second group additionally received 1 capsule of keltican three times a day for a month, and 35 diabetic patients of the third group were assigned additional 12 procedures of polarizing light. The assessment of neuropathic pain severity was performed using a DN4 modified questionnaire. Results. The positive clinical effect of treatment was observed in all groups after 12 days of treatment, and maintained for 3 months in groups 2 and 3, and it lasted for 6 months in the group with additional prescription of keltican. Conclusions. The inclusion of keltican and polarizing light in the standard comprehensive therapy of diabetic polyneuropathy increases the clinical efficacy of neuropathic pain treatment. Using a DN4 questionnaire with a modified evaluation scale to assess neuropathic pain severity helps to optimize diagnosis of such complications in diabetic patients.
діабетична полінейропатія; невропатичний біль; келтикан; поляризуюче світло
диабетическая полинейропатия; нейропатическая боль; келтикан; поляризующий свет
diabetic polyneuropathy; neuropathic pain; keltican; polarizing light
Вступ
Матеріали та методи
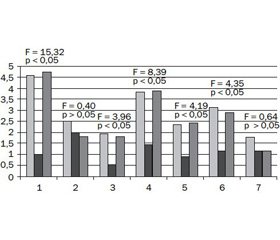
Результати та обговорення
Висновки
- Martianez T, Carrascal M, Lamarca A, et al. UTP affects the Schwannoma cell line proteome through P2Y receptors leading to cytoskeletal reorganisation. Proteomics. 2012 Jan;12(1):145-56. doi: 10.1002/pmic.201100187.
- Martianez T, Lamarca A, Casals N, Gella A. N-cadherin expression is regulated by UTP in schwannoma cells. Purinergic Signal. 2013 Jun;9(2):259-70. doi: 10.1007/s11302-012-9348-x.
- Lamarca A, Gella A, Martianez, et al. Uridine 5’-triphosphate promotes in vitro Schwannoma cell migration through matrix metalloproteinase-2 activation. PLoS One. 2014 Jun 6;9(6):e98998. doi: 10.1371/journal.pone.0098998.
- Bennett MI, Attal N, Backonja MM, et al. Using screening tools to identify neuropathic pain. Pain. 2007 Feb;127(3):199-203. doi: 10.1016/j.pain.2006.10.034.
- Borenstein DG. Epidemiology, etiology, diagnostic evaluation and treatment of lumbar pain. Curr Opin Rheumatol. 2000 Mar;12(2):143-9.
- Bouhassira D, Attal N, Alchaar H, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain. 2005 Mar;114(1-2):29-36. doi: 10.1016/j.pain.2004.12.010.
- Bouhassira D, Attal N, Fermanian J, et al. Deve–lopment and validation of the Neuropathic Pain Symtom Inventory. Pain. 2004 Apr;108(3):248-57. doi: 10.1016/j.pain.2003.12.024.
- Bregovskiy VB. Painful diabetic polyneuropathy of the lower extremities: current knowledge and treatment options (review). Bol`. 2008;(18):29-34.(In Russian).
- Danilov AB, Davydov OS. Diagnostic scales for the assessment of neuropathic pain. Bol`. 2007;(16):11-14. (In Russian).
- Danilov AB. Pharmacotherapy of pain syndrome in diabetic polyneuropathy. Consilium medicum. 2006;8(9):85-89. ( In Ukrainian).
- Buglak NP, Vdovychenko JuP, Guljar SO, Kosakovs'kyj AL, Lymans'kyj JuP. Zastosuvannja Bioptron-Pajler - svitla v medycyni: terapija nyz'kointensyvnymy poljaryzovanymy elektromagnitnymy hvyljamy optychno-infrachervonogo diapazonu : navchal'no-metodychnyj posibnyk [The use of Bioptron-payler light in medicine: therapy with low-intensity polarized electromagnetic waves of the optical infrared range: educational and methodical manual. Kiev: Bogomoletz Institute of Physiology of NAS of Ukraine; 2006. 151 p. (In Ukrainian).
- Mibielli MA, Nunes CP, Cohen JC, et al. Treatment of acute, non-traumatic pain using a combination of diclofenac-cholestyramine, uridine triphosphate, cytidine monophosphate, and hydroxycobalamin. Proc West Pharmacol Soc. 2010;53:5-12.
- Müller D. Treatment of neuropathic pain syndromes. Results of an open study of the drug based on pyrimidine nucleotides. Fortschr Med Orig. 2002 Dec 5;120(4):131-3. (in German).
- Povoroznyuk VV, Shinkarenko TYe, Pryimych UI. Neuropathic Pain Component in Musculoskeletal System Diseases: Review of the Literature and the Results of Own Researches, Part I. 2014;(16):5-13. ( In Ukrainian).
- Rachyn AP, Sharov MN, Vyhovskaia SN, Nuvakhova MB, Voropaev AA, Tarasova LIu. Experience in the use of a complex drug uridinmonfosfata with –exacerbation of chronic nonspecific pain in the lower back. RMJ. 2017;25(24):1812-1817.(In Russian).
- Rudenko AA, Muravskaia LV, Diachenko PA, Parkhomets BA, Andrieieva YeH, Sydorov ZhP, Kruhlikov PV. Infusion therapy for herpeviral damage of the peripheral nervous system. Ukrai'ns'kyj himioterapevtychnyj zhurnal. 2012;(26):209-212. (In Ukrainian).
- Singh R, Kishore L, Kaur N. Diabetic peri–pheral neuropathy: current perspective and future directions. Pharmacol Res. 2014 Feb;80:21-35. doi: 10.1016/j.phrs.2013.12.005.
- Sokrut VN, Kazakov VN. Meditsinskaia reabilita–tsiia v terapii: Rukovodstvo dlia studentov i vrachei [Medical rehabilitation in Therapy: A Guide for Students and Doctors]. Donetsk: DMU im. M. Gor'kogo; 2003.1076 р. (In Russian).
- Tesfaye S, Selvarajah D. Advances in the epidemio–logy, pathogenesis and management of diabetic peripheral neuropathy. Diabetes Metab Res Rev. 2012 Feb;28(Suppl 1):8-14. doi: 10.1002/dmrr.2239.
- Ministry of Health of Ukraine. Order No 574 dated Aug 5, 2009. On approval of medical treatment protocols for patients with endocrine diseases. Available from: http://old.moz.gov.ua/ua/portal/dn_20090805_574.html. (In Ukrainian).
- Vlasenko MV. Quality of life in patients with diabetes mellitus type 2 with metabolic neuropathy against pathogenic therapy. Mìžnarodnij endokrinologìčnij žurnal. 2013; 1(49): 51-55. (In Ukrainian).
- Zilliox L, Russell JW. Treatment of diabetic sensory polyneuropathy. Curr Treat Options Neurol. 2011 Apr;13(2):143-59. doi: 10.1007/s11940-011-0113-1.

/54-1.jpg)
/53-1.jpg)