Введение
Вопросы диагностики и лечения заболеваний пищеварительной системы у детей являются в настоящее время актуальной темой. Согласно данным статистики, заболевания органов пищеварения выходят на второе место в структуре детских заболеваний. За 2014–2015 гг. в Украине зарегистрирован рост показателей распространенности и заболеваемости хроническими воспалительными заболеваниями кишечника (ХВЗК) среди трудоспособного населения [1]. Среди детей и подростков распространенность и заболеваемость ХВЗК имеет некоторую тенденцию к уменьшению. Несмотря на то, что впервые выявленные случаи язвенного колита и болезни Крона среди детского населения за последние годы снизились на 8,7 и 25 % соответственно [1], общая тенденция к росту ХВЗК во всем мире не позволяет оставлять без внимания вопросы ранней неинвазивной диагностики данных заболеваний.
Согласно действующим в Украине протоколам медицинской помощи детям с заболеваниями органов пищеварения (приказ МЗ Украины № 59 от 29.01.2013), в группу воспалительных заболеваний кишечника входят неспецифический язвенный колит (НЯК), болезнь Крона, хронический неспецифический неязвенный колит (ХННК).
Неспецифический язвенный колит — хроническое воспалительное заболевание толстого кишечника неизвестной этиологии, с проксимальным распространением процесса от прямой кишки, характеризующееся непрерывным воспалением слизистой оболочки (реже — проникающее в подслизистый слой), с рецидивирующим течением и возможностью развития местных и системных осложнений [2–4]. Клиническое течение заболевания характеризуется сменой фаз обострения и ремиссии. К симптомам заболевания относятся: частый, жидкий стул (иногда — запор), примесь крови в кале, тенезмы, часто больные жалуются на абдоминальные боли. При среднетяжелом и тяжелом течении присоединяются симптомы интоксикации, потеря массы тела, а также системные проявления (полиартрит, узловатая эритема, реактивный гепатит, поражение слизистых оболочек, кожи). Тяжесть и агрессивное течение НЯК у детей обусловливают трудности его диагностики и лечения [3–5].
Хронический неспецифический неязвенный колит — это хроническое полиэтиологическое заболевание, которое характеризуется воспалительно-дистрофическими, атрофическими изменениями слизистой оболочки толстого кишечника, морфологическими признаками дистрофии эпителия, уменьшением глубины крипт и развитием лимфоплазматической инфильтрации разной степени выраженности и функциональными нарушениями. Это заболевание составляет около 10 % всей хронической патологии органов пищеварительной системы. Клиническая картина характеризуется неустойчивостью стула с преобладанием запоров, ложными позывами к дефекации, чувством неполного опорожнения кишечника. Боль чаще ноющего характера, ослабевает после акта дефекации и отхождения газов. Для обострения хронического колита характерно появление или усиление симптомов хронической интоксикации: повышенной утомляемости, сниженного аппетита, головной боли, субфебрилитета [6].
К не менее распространенным заболеваниям можно отнести и функциональное заболевание — синдром раздраженного кишечника (СРК), которое характеризуется сочетанием абдоминальной боли с нарушением частоты и характера стула. В основе функциональных гастроинтестинальных заболеваний наряду с нарушениями моторики, висцеральной чувствительности органов пищеварения, их секреторной функции, иммунного ответа лежат изменения состава микрофлоры [7]. Дисбаланс кишечной флоры сопровождается симптомами кишечной диспепсии (запоры, поносы, метеоризм, боль, дискомфорт, ощущение переполнения или тяжести в животе). При СРК могут наблюдаться проявления синдрома нарушения пищеварения (стеаторея, амилорея, креаторея), возможно формирование астеновегетативного синдрома.
Диагностика воспалительных заболеваний кишечника у детей и проведение дифференциальной диагностики с функциональными заболеваниями, построенные на клинических, лабораторных, рентгенологических, эндоскопических и гистологических признаках, на практике является сложной задачей [4, 5]. Эндоскопический метод с морфологическим исследованием биоптата представляется наиболее информативным, однако он является, с одной стороны, инвазивным методом, с другой — требует дополнительной тщательной подготовки пациента к обследованию. Не менее важна высокая квалификация врача-эндоскописта и врача-морфолога [4]. Поэтому в последнее время все чаще используются такие неинвазивные методы диагностики ХВЗК, как определение фекальных маркеров воспаления [9–12]. К их числу относится фекальный кальпротектин (ФК).
Фекальный кальпротектин — кальцийсвязывающий белок SS100, который был обнаружен в 1980 году Fagerhol et al. [11]. ФК составляет 60 % от внутриклеточной жидкости нейтрофилов, обладает противомикробными и антипролиферативными свойствами. Кальпротектин высвобождается из клеток при их повреждении и попадает в каловые массы. Содержание ФК пропорционально лейкоцитарной миграции, поэтому при ХВЗК показатели повышаются, а при функциональных заболеваниях кишечника остаются в пределах нормы [7–9]. Показано, что концентрация кальпротектина в кале коррелирует с гистологической и эндоскопической активностью ХВЗК [12, 13]. В норме концентрация ФК менее 50 мкг/г кала, повышение ее свыше 100 мкг/г кала отмечается при воспалительных заболеваниях кишечника. Определение ФК дает возможность не только провести дифференциальную диагностику между воспалительными заболеваниями кишечника и СРК, но и оценить степень воспалительных заболеваний кишечника [14, 15], а также эффективность проводимой терапии [16].
Цель работы: изучение диагностической ценности исследования кальпротектина при хронических заболеваниях кишечника у детей.
Материалы и методы
Исследование проводилось в условиях гастроэнтерологического отделения детской городской клинической больницы № 2 г. Днепра — клинической базы кафедры пропедевтики детских болезней ГУ «Днепропетровская медицинская академия МЗ Украины». Был обследован 31 пациент от 3 до 17 лет, 19 мальчиков и 12 девочек. Пациенты были разделены на группы в зависимости от выявленной патологии — органической или функциональной. Среди детей с органическими заболеваниями первую группу составили 4 пациента с НЯК, вторую — 15 детей с неспецифическим неязвенным колитом, третью группу (сравнения) составили 12 больных с функциональным заболеванием — синдромом раздраженного кишечника.
Все дети поступали в гастроэнтерологическое отделение в период обострения заболевания. Обследование проводили в соответствии с унифицированными клиническими протоколами медицинской помощи детям с заболеваниями органов пищеварения, принятыми в Украине (2013). Диагноз базировался на сочетании нескольких параметров: анамнеза, тщательного осмотра пациента, результатах илеоколоноскопии с биопсией и гистологического исследования биоптатов. Активность ХВЗК определяли с учетом общего состояния ребенка, интенсивности болевого синдрома, лихорадки, частоты стула, наличия гемоколита, изменений гемограммы в виде лейкоцитоза и повышения скорости оседания эритроцитов, С-реактивного белка, изменений протеинограммы. Эндоскопически оценку активности проводили с учетом протяженности поражения, наличия язвенных дефектов, эрозий, контактной кровоточивости, изменения сосудистого рисунка, а также наложений слизи на поверхности слизистой оболочки кишки. У всех больных исследовали уровень кальпротектина в образцах кала.
Концентрация уровня ФК определялась методом иммуноферментного анализа ELISA с использованием моноклональных антител. Концентрация кальпротектина более 50 мкг/г оценивалась как положительный результат теста. Диагностическая ценность метода определялась на основе сравнения показателей кальпротектина в трех группах пациентов. Статистическая обработка результатов проводилась с использованием пакета прикладных программ Statistica 6.0. Вычисляли среднее арифметическое, стандартную ошибку среднего, стандартное отклонение, критерий Стьюдента.
Результаты и обсуждение
Клинико-лабораторные и эндоскопические проявления заболевания у 19 детей позволили диагностировать хронические воспалительные заболевания кишечника — НЯК (4 пациента) и ХННК (15 человек). Клинические характеристики пациентов представлены в табл. 1. Симптомы НЯК проявлялись у всех детей абдоминальным болевым синдромом (боли до, во время и после дефекации, с локализацией в левой подвздошной области или нижних отделах живота), диареей, явлениями гемоколита, субфебрильной лихорадкой, воспалительными изменениями гемограммы, повышением С-реактивного белка, повышением α2-глобулина.
Клинические симптомы при ХННК характеризовались абдоминальным болевым синдромом, преобладанием запоров, снижение массы тела было нехарактерно. При ХННК повышение температуры отмечалось у одного пациента, явлений гемоколита у детей не было, лабораторные показатели в большинстве случаев (80 %) оставались в пределах нормы.
Кишечные симптомы СРК проявлялись нарушением дефекации и приступообразной тупой, давящей или распирающей болью в животе, метеоризмом. Боль и метеоризм чаще возникали при стрессовой ситуации, усиливались после еды, перед дефекацией и проходили после дефекации. Как правило, у наших пациентов имел место вариант СРК с запором — дефекация 2–3 раза в неделю, с напряжением, чувство неполного опорожнения кишечника, изменение формы и характера каловых масс (твердые, сухие, «овечий» кал, иногда кашицеобразный или жидкий стул с первой плотной порцией). У детей присутствовали жалобы общего характера: головная боль, утомляемость, покалывание или небольшая боль в области сердца, чувство кома в горле. Общий анализ крови и биохимические гематологические тесты у детей были в пределах возрастной нормы.
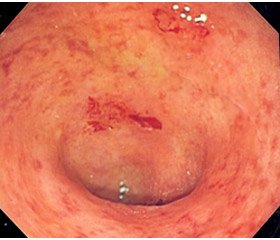
При эндоскопическом исследовании у пациентов с НЯК имели место отечность, гиперемия, изменение сосудистого рисунка слизистой, контактная кровоточивость, наличие эрозий и язвенных дефектов слизистой кишечника, при морфологическом исследовании — уменьшение числа бокаловидных клеток, деформация крипт, лимфоцитарная инфильтрация. При проведении колоноскопии у детей с ХННК определялись гиперемия слизистой оболочки, изменения сосудистого рисунка без выявления дефектов. Морфологически обычно отмечались лимфоцитарная инфильтрация, дистрофические изменения слизистой и сглаженность крипт.
У всех 31 обследованного пациента были изучены уровни кальпротектина в образцах кала. Средние концентрации ФК у пациентов представлены в табл. 2.
Наиболее высокими средние показатели кальпротектина были в группе детей с НЯК. Поскольку пациенты обследовались в период обострения заболевания, нормальных значений фекального кальпротектина в этой группе не было ни у кого. При ХННК также содержание кальпротектина оказывалось повышенным, и средние значения превышали норму более чем в 2 раза. В то же время у всех пациентов с СРК показатели ФК не выходили за пределы нормальных значений. В целом же среди всех пациентов с ХВЗК уровень ФК составил 149,68 ± 15,62 мкг/г, то есть в 3 раза выше пороговых значений. Различия в группах детей с воспалительными и функциональными заболеваниями кишечника высокодостоверны (p < 0,001).
В заключение следует отметить, что проведение исследования содержания кальпротектина в кале является простой и неинвазивной методикой, которая может дополнить клинико-лабораторные данные при ХВЗК, облегчить их дифференциальную диагностику с функциональными заболеваниями. Такие клинические проявления, как абдоминальный болевой синдром, симптомы кишечной диспепсии, астенический синдром, являются общими для ХВЗК и СРК. Неспецифические лабораторные признаки воспаления могут присутствовать вследствие сопутствующей патологии. Решающими в диагностике обоснованно считаются данные инструментального (эндоскопического и морфологического) исследования. При этом даже визуальная и морфологическая оценка не гарантирует правильный диагноз. Вероятно, что исследование кальпротектина в кале без учета всех клинико-лабораторных и инструментальных данных также не решает проблемы диагностики ХВЗК. Однако при более чем двукратном превышении показателя выше нормы результаты теста в диагностике ХВЗК являются информативными, что было продемонстрировано в ходе исследования у детей с НЯК и ХННК в активной фазе заболевания.
Выводы
1. Исследование ФК при ХВЗК представляет высокую диагностическую ценность в качестве скрининга для подтверждения органической природы заболевания кишечника и определения показаний к проведению инвазивных инструментальных методов диагностики.
2. В активном периоде ХВЗК происходит повышение ФК в соответствии со степенью активности заболевания, что позволяет мониторировать течение заболевания и оценивать эффективность проводимой терапии. При использовании фекального кальпротектинового теста двукратное превышение нормального показателя можно считать диагностически значимым.
3. Внедрение неинвазивной методики определения кальпротектина в образцах кала у детей с патологией кишечника позволит ограничить частоту проводимых инвазивных методов исследования, однако не исключает проведения колоноскопии с биопсией для первичной диагностики заболевания и в динамике, в соответствии с протоколами оказания медицинской помощи детям с ХВЗК.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов при подготовке данной статьи.
Список литературы
1. Степанов Ю.М. Хронические воспалительные заболевания кишечника: особенности эпидемиологии в Украине / Ю.М. Степанов, О.П. Скирда, И.Ю. Петишко // Гастроентерологія. — 2017. — № 2(51). — С. 97-105. — doi: 10.22141/2308-2097.51.2.2017.101703.
2. Белоусова Е.А. Язвенный колит и болезнь Крона / Е.А. Белоусова. — Тверь: Триада, 2002. — 128 с.
3. Халиф И.Л. Воспалительные заболевания кишечника (неспецифический язвенный колит и болезнь Крона). Клиника, диагностика и лечение / И.Л. Халиф, И.Д. Лоранская. — М.: Миклош, 2004. — 88 с.
4. Денисова М.Ф. Современные подходы в диагностике язвенного колита у детей / М.Ф. Денисова // Современная педиатрия. — 2014. — № 3(59). — С. 113-115.
5. Nikolaus S. Diagnostic of inflammatory bowel disease / S. Nikolaus, S. Schreiber // Gastroenterology. — 2007. — Vol. 133(5). — P. 1670-1689. — doi: 10.1053/j. gastro.2007.09.001.
6. Белоусова О.Ю. Хронический неспецифический неязвенный колит у детей / О.Ю. Белоусова // Перинатология и педиатрия. — 2013. — № 1. — С. 87-91.
7. Маев И.В. Эволюция представлений о синдроме раздраженного кишечника / И.В. Маев, Ю.А. Кучерявый, С.В. Черемушкин. — М., 2013. — 80 с.
8. Павленко Н.В. Визначення маркерів кишечного запалення у діагностичному пошуку у дітей із патологією кишечника / Н.В. Павленко, К.В. Волошин, О.Б. Ганзій, О.Л. Слободянюк // Здоровье ребенка. — 2016. — № 5(73). — С. 47-50. — doi: 10.22141/2224-0551.5.1.73.1.2016.78940.
9. Степанов Ю.М. Роль біомаркерів у діагностиці хронічних запальних захворювань кишечника / Ю.М. Степанов, І.В. Псарьова // Гастроэнтерология. — 2017. — № 1(51). — С. 56-63. — doi: 10.22141/2308-2097.51.1.2017.97872.
10. Sherwood R.A. Faecal Markers of Gastrointestinal Inflammation / R.A. Sherwood // Journal of Clinical Pathology. — 2012. — Vol. 65(11). — P. 981-985. — doi: 10.1136/jclinpath-2012-200901. Epub 2012 Jul 19.
11. Fagerhol M.K. Release and Quantitation of a Leucocyte Derived Protein (L1) / Magne K. Fagerhol, Inge Dale, Terje Anderson // Scand. J. Haematol. — 1980. — Vol. 24, Issue 5. — P. 390-398. — doi: 10.1111 / j.1600-0609.1980.tb02754.x.
12. Iskandar H.N. Biomarkers in Inflammatory Bowel Disease: Current Practices and Recent Advances / H.N. Iskandar, M.A. Ciorba // Transl. Res. — 2012. — Vol. 159(4). — P. 313-325. — doi: 10.1016/j.trsl.2012.01.001. Epub 2012 Feb 1.
13. Otten C.M. Diagnostic performance of rapid tests for detection of fecal calprotectin and lactoferrin and their ability to discriminate inflammatory from irritable bower syndrome / C.M. Otten, L. Kok, B.J. Witteman // Clin. Chem. Lab. Med. — 2008. — Vol. 46(9). — P. 1275-1280. — doi: 10.1515/CCLM.2008.246.
14. Pang T. Fecal biomarkers of intestinal health and disease in children // T. Pang, S.T. Leach, T. Katz, A.S. Day, C.Y. Ooi // Front. Pediatr. — 2014 Jan. — Vol. 28(2). — P. 6. — doi: 10.3389/fped.2014.00006.
15. Peterson C.G. Fecal levels of leukocyte markers reflect disease activity in patients with ulcerative colitis / C.G. Peterson, P. Sangfelt, M. Wagner, T. Hansson, H. Lettesjö, M. Carlson // Scand. J. Clin. Lab. Invest. — 2007. — Vol. 67. — P. 810-820. — doi: 10.1080/00365510701452838.
16. Wagner M. Fecal markers of inflammation used as surrogate markers for treatment outcome in relapsing inflammatory bowel di–sease / M. Wagner, C.G. Peterson, P. Ridefelt, P. Sangfelt, M. Carlson // World J. Gastroenterol. — 2008. — Vol. 14. — P. 5584-5589. — PMID: 18810778.

/54-1.jpg)