Резюме
Актуальність. Пошук підходів до корекції ключових ланок патогенезу при симптомах харчової гіперчутливості (ХГ) у дітей залишається перспективним напрямком досліджень. Мета: дослідити клінічну ефективність патогенетично обґрунтованої схеми терапії шкірних проявів ХГ у дітей. Матеріали та методи. За період з 2011 до 2016 року після аналізу 1780 амбулаторних карт і загальноклінічного обстеження відібраних дітей віком від 1 місяця до 18 років у подальшому дослідженні взяли участь 148 пацієнтів. Випадковим методом вони були розподілені на 2 групи лікування: перша (основна) група (n = 88) отримувала патогенетично обґрунтовану терапію, націлену на корекцію шкірного й кишкового бар’єрів упродовж 10 днів; друга, група порівняння (n = 60), отримувала традиційне базове лікування. Результати. На 10-ту добу від початку терапії медіана й розмах коливань балів за шкалою SCORAD в основній групі дослідження були статистично меншими (p < 0,05). Рідше спостерігались рецидиви (U[79; 53] = 1492,5; p = 0,001), а тривалість персистенції шкірних симптомів також була статистично меншою (U[79; 53] = 1516,5; p = 0,001) порівняно з 2-ю групою. Стійкіші довготривалі ефекти проведеного лікування порівняно зі стандартною схемою (p < 0,05) мали діти з маніфестацією симптомів у віці до одного року. Оцінка відносної вологості шкіри в дітей із симптомами ХГ на шкірі дозволяє однаково контролювати й прогнозувати як частоту, так і тривалість загострень. Висновки. Запропонована схема лікування має як швидкі, так і довготривалі профілактичні ефекти незалежно від клінічного фенотипу висипу.
Актуальность. Поиск подходов к коррекции ключевых звеньев патогенеза при симптомах пищевой гиперчувствительности (ПГ) у детей остается перспективным направлением исследований. Цель: исследовать клиническую эффективность патогенетически обоснованной схемы терапии кожных проявлений ПГ у детей. Материалы и методы. С 2011 по 2016 г. после анализа 1780 амбулаторных карт и общеклинического обследования отобранных детей в возрасте от 1 месяца до 18 лет дальнейшее участие в исследовании приняли 148 пациентов. Случайным образом дети были распределены на 2 группы лечения: первая (основная) группа (n = 88) получала патогенетически обоснованную терапию, направленную на коррекцию кожного и мукозального барьеров в течение 10 дней; вторая, группа сравнения (n = 60), получала традиционное базисное лечение. Результаты. На 10-е сутки от начала терапии медиана и размах колебаний баллов по шкале SCORAD в основной группе были статистически меньшими (p < 0,05). Реже наблюдались рецидивы (U[79; 53] = 1492,5; p = 0,001), а длительность персистенции кожных симптомов также была меньшей (U[79; 53] = 1516,5; p = 0,001) в сравнении со 2-й группой. Более стойкие длительные эффекты от проведенного лечения имели дети с манифестацией симптомов в возрасте до одного года (p < 0,05). Оценка относительной влажности кожи у детей с симптомами ПГ на коже позволяет одинаково контролировать и прогнозировать как частоту, так и длительность обострений. Выводы. Предложенная схема лечения имеет как быстрые, так и длительные эффекты независимо от клинического фенотипа высыпаний.
Background. Further search for the ways to correct the key links of food hypersensitivity (FH) skin symptoms remains perspective. Aim of the study was to evaluate pathogenetically grounded therapy of the skin FH symptoms in children. Materials and methods. From 2011 to 2016, after analyzing source medical records of the 1780 children aged 1 month to 18 years, 148 eligible patients were randomly divided into 2 groups of treatment. Group 1 (n = 88) was administered pathogenetically grounded therapy for 10 days, which was aimed at the correction of epidermal and mucosal barrier dysfunction; group 2 (comparison) received standard treatment. Results. Median and interquartile variation of the SCORing Atopic Dermatitis results in group 1 were statistically lower (p < 0.05). Exacerbations (U[79; 53] = 1492.5; p = 0.001) and duration of the skin symptoms persistence (U[79; 53] = 1516.5; p = 0.001) were rare as compared to the group 2. Children with onset of the symptoms before 12 months of age had better prolonged effect (p < 0.05). Assessment of the relative humidity of the skin enables to control and to predict the incidence and duration of the FH skin symptoms equally. Conclusions. Pathogenetically grounded therapy of the skin FH symptoms in children had both short- and long-term effects regardless of clinical phenotype of the rash.
Вступ
Визнаним фактом є твердження про те, що збільшення проявів алергії викликане змінами адаптації, навіть у дітей, які не мають генів атопії [2]. Термін «харчова гіперчутливість» (ХГ) є збірним, і за ним стоїть спектр різної патології: істина харчова алергія (ХА), анафілактичний шок на харчові продукти, неімунна ХГ, харчова непереносимість, токсичні реакції на їжу, фармакологічні реакції на їжу. Така кількість можливих різних патофізіологічних процесів за наявності однієї картини захворювання створює ряд проблем при визначенні тактики ведення хворих із гіперчутливістю до харчових продуктів [3, 7]. Усе більше публікацій вказують на роль дефекту бар’єрної функції шкіри, експресії рецепторів і цитокінів у прогресуванні алергічних захворювань [5]. До важливих чинників формування сенсибілізації до харчових алергенів належать також порушення проникності бар’єра кишечника й імунної толерантності до їжі [1, 2]. Дослідження змін у системі регуляції імунної відповіді, присутність біологічних маркерів запалення на слизовій шлунково-кишкового тракту та в шкірі можуть бути використані для оптимізації й контролю терапії [4].
З огляду на це метою роботи стало дослідити значимість маркерів дисфункції мукозального бар’єра для оцінки ефективності нової стратегії лікування шкірних проявів ХГ у дітей.
Матеріали та методи
За період з 2011 до 2016 року після ретельного аналізу 1780 амбулаторних карт та загальноклінічного обстеження в дослідження були відібрані діти віком від 1 місяця до 18 років, які звернулися по медичну допомогу до КУ «Запорізька міська дитяча багатопрофільна лікарня № 5» та Університетської клініки Запорізького державного медичного університету з приводу клінічних симптомів алергії на шкірі, пов’язаних із вживанням харчових продуктів. Вибірка дітей була випадковою, поточною. Подальше обстеження пройшли 760 пацієнтів, з яких після ретельного аналізу критеріїв включення й виключення подальшу участь у дослідженні продовжили 148 пацієнтів. Випадковим методом вони були розділені на 2 групи залежно від проведеного лікування. Перша (основна) група (n = 88) отримувала терапію згідно із запропонованою нами схемою лікування. Друга, група порівняння (n = 60), отримувала базову терапію згідно з наказом МОЗ України № 507 від 28.12.2002 (рис. 1).
/34-1.jpg)
Ефекти лікування оцінювали за допомогою вимірювання вологості шкіри, за шкалою SCORAD упродовж 1 року спостереження. Сенситизацію до харчових продуктів підтверджували за допомогою шкірного прик-тесту, визначення рівнів загального та специфічних IgE, оральної провокаційної проби (ОПП).
Стан епідермального бар’єра визначали за рівнем відносної вологості шкіри за допомогою портативного пристрою для визначення вологості шкіри (Queentone, Франція). Нормальним рівень вологості вважали при показниках від 34 до 56. Позитивний ефект терапії оцінювали за підвищенням вологості шкіри не менше ніж на 50 % від вихідного рівня або після досягнення нормального рівня (34 % і вище), що більше. При проведенні тесту на мукозальну проникність наявність лактулози в сечі виявляли за методикою Behrens et al. (1984). Рівень кальпротектину визначали якісним методом у копрофільтраті за допомогою тест-систем Calprotectin RAPID TEST (Італія) за методикою виробника.
Упродовж проспективного спостереження враховувалася зміна характеру перебігу захворювання, зокрема частота загострень, їх тяжкість. Кожен показник переводився в бальну оцінку: 0 — без змін; 1 — незначне зменшення тяжкості та кількості загострень; 2 — значне полегшення перебігу (легкі загострення, що спостерігаються рідко й не потребують лікування); 3 — повна ремісія.
Забір зразків крові проводили натще. Визначення сироваткових концентрацій IL-2, IL-4 методом імуноферментного аналізу (ІФА) проводилося згідно з інструкцією до наборів Human IL-2 Platinum ELISA й Human IL-4 Platinum ELISA, виробник Affymetrix eBioscience, Австрія. TLR-2 у сироватці крові виявляли за допомогою набору ELISA Kit for TLR-2 для ІФА, виробник Cloud-Clone Corp.
Статистична обробка результатів проводилась за допомогою пакета програми Statistica 6.0 (StatSoft Inc., США, № AXXR712D833214FAN5). Нормальність розподілу параметрів визначали за тестом Шапіро — Уїлка. При ненормальному розподілі ознаки описову статистику подавали у вигляді медіани й міжквартильного розмаху — Ме (Q25-Q75). Якісні показники надано у вигляді абсолютної й відносної кількості. Порівняння проводили за тестом Манна — Уїтні. Для з’ясування характеру й сили зв’язку використовували рангову кореляцію за Спірменом, для груп із категоріальними даними — коефіцієнт гамма. Гіпотеза щодо зв’язку між ознаками ефективності методів лікування оцінена за допомогою кластерного аналізу. Значущим вважали рівень р < 0,05.
Робота виконана в рамках науково-дослідної роботи кафедри факультетської педіатрії ЗДМУ МОЗ України і є фрагментом планової наукової теми: «Розробка методів ранньої діагностики найбільш поширених алергічних захворювань у дітей різних вікових груп, профілактики та лікування основних функціональних порушень та супутньої патології у цієї групи хворих», номер держреєстрації 0112U005648.
Результати та обговорення
Встановлено, що відібрані групи дітей були рівномірними, не мали вірогідної різниці ні за віковим та статевим складом, ні за показниками, що характеризують особливості перебігу симптомів ХГ на шкірі (р > 0,05). Переважна кількість дітей у обох групах дослідження була віком до 3 років (33 (50 %) та 37 (61 %) відповідно). Аналіз груп дослідження за даними результатів стандартного алергологічного обстеження за допомогою прик-тестування, провокаційної проби й визначення рівнів специфічних антитіл також показав відсутність статистично значимої різниці (р > 0,05) (табл. 1).
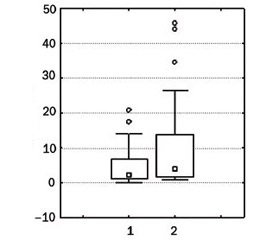
Також групи були порівнянними за даними визначення рівнів цитокінів. Після виключення із аналізу «викидів», що перевищували медіану в декілька десятків раз, вірогідна різниця між групами була відсутня (рис. 2).
Отже, відібрані групи дітей були рівномірними, не мали вірогідних відмінностей ні за віковим і статевим складом, ні за показниками, що характеризують особливості перебігу симптомів ХГ на шкірі, стан мукозального бар’єра (р > 0,05).
Відповідно до розробленого дизайну дослідження ефективність запропонованої стратегії лікування оцінювали одночасно як за динамікою клінічної симптоматики, лабораторних даних, так і за катамнестичними показниками. Виявлено, що на момент включення в дослідження діти з обох груп статистично не відрізнялися за ступенем тяжкості шкірних проявів за шкалою SCORAD (р > 0,05). При приблизно однакових вихідних даних за тяжкістю симптомів на шкірі в обох групах на 10-ту добу від початку терапії медіана й розмах коливань балів за шкалою SCORAD в основній групі дослідження були статистично меншими (p < 0,05).
Маркери дисфункції мукозального бар’єра, такі як тест сечі з лактулозою й кальпротектин у копрофільтраті, мали різні зв’язки й значення для короткотривалих і довготривалих ефектів терапії симптомів ХГ на шкірі в дітей. За результатами вимірювання вологості шкіри вірогідної різниці між групами дослідження виявлено не було (p = 0,12). Проте при подальшій математичній обробці результатів терапії пацієнтів за двома схемами нами було виявлено, що в основній групі дітей залежно від наявності лактулози в сечі, що свідчило про підвищену проникність кишкового бар’єра, змінювалась відносна вологість у непошкоджених ділянках і вираженість свербежу, оцінена суб’єктивно (U[41; 26] = 411,5; р = 0,04 і –U[52; 29] = 556,5; р = 0,03 відповідно). Дані факти свідчили про роль проникності слизової тонкої кишки в появі важливого діагностичного симптому ХА — свербежу, підтверджували зв’язок неспроможності зовнішніх і внутрішніх бар’єрів, а також засвідчували необхідність їх конкордантного лікування [9]. Однак наявність лактулози в сечі була важливою лише для прогнозування короткострокових результатів оптимізованого лікування. На противагу цьому тривалий ефект від запропонованої терапії, а саме зменшення частоти загострень у періоді спостереження, відрізнявся залежно від наявності підвищених рівнів IL-4 (U[15; 7] = 28,0; р = 0,01), позитивних результатів прик-тесту (U[57; 13] = 250,5; р = 0,04) та ОПП (U[15; 7] = 503,0; р = 0,01). Але довготривалий ефект не був пов’язаний із рівнями IL-2 та TLR-4. Дані результати підтверджують важливість оптимізованого лікування для запобігання стимуляції й закріплення Th2-опосередкованої імунної відповіді в дітей із пошкодженими бар’єрами й можливість запобігання реалізації атопії в дітей із симптомами ХГ.
У той же час традиційна схема терапії впливала лише на тривалість загострень, особливо в дітей із наявністю асимптомного запалення слизової кишки — кальпротектином у копрофільтраті (U[21; 16] = 105,5; р = 0,02), і не зменшувала частоти загострень, що свідчить про її симптоматичну, а не патогенетичну дію. Виявлено, що наявність кальпротектину не має значення для прогнозування ефекту при використанні нової стратегії ведення пацієнтів із ХГ. Огляд літератури також показав, що в дітей наявність цього маркера в копрофільтраті може залежати й від характеру харчування та здатності мікробіоти до імуномодулюючого ефекту. За результатами досліджень інших авторів, діти на грудному вигодовуванні мали вищі значення кальпротектину [6]. Цей факт дозволяє припустити, що повна елімінація алергенів із дієти важлива лише під час наявності симптомів.
Висновки
Отже, отримані результати показали, що маркери дисфункції мукозального бар’єра, такі як тест сечі з лактулозою й кальпротектин у копрофільтраті, мали різні зв’язки та значення для короткотривалих та довготривалих ефектів терапії симптомів ХГ на шкірі в дітей. Контроль мукозальної проникності за допомогою тесту сечі з лактулозою — проспективний маркер короткострокових результатів нової стратегії лікування ХГ (p < 0,05). Кальпротектин у копрофільтраті має значення щодо тривалості загострень лише при традиційних підходах до лікування (p < 0,05). Тривалі ефекти від запропонованої терапії прямо не залежали від стану мукозальної проникності, що свідчить про однакову ефективність цього підходу до лікування епідермальної й мукозальної дисфункції у всій когорті пацієнтів із проявами ХГ на шкірі. Але було виявлено різницю залежно від наявності маркерів системних імунних змін, а саме підвищених рівнів IL-4 (U[15; 7] = 28,0; р = 0,01), позитивних результатів прик-тесту (U[57; 13] = 250,5; р = 0,04) та ОПП (U[15; 7] = 503,0; р = 0,01). Це свідчить про важливість доповнення запропонованої схеми методами алергенспецифічної терапії в пацієнтів із позитивними результатами ОПП.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Абатуров А.Е., Никулина А.А., Петренко Л.Л. Лактазная недостаточность у детей // Междунар. журн. педиатрии, акушерства и гинекологии. — 2015. — Т. 7, № 2. — С. 53-63.
2. Вплив факторів навколишнього середовища на стан здоров’я дітей раннього віку / Ю.Г. Антипкін, Ю.Г. Резніченко, М.О. Ярцева // Перинатология и педиатрия. — 2012. — № 1(49). — С. 48-51.
3. Современные подходы к ведению пациентов с пищевой аллергией / О.Г. Шадрин, В.А. Клименко, Ю.В. Карпушенко, Л.М. Адарюкова, Е.С. Ивахненко // Современная педиатрия. — 2012. — № 5(45). — С. 101-104.
4. Deciphering the black box of food allergy mechanisms / V. Sampath, D. Tupa, M.T. Graham, T.A. Chatila, J.M. Spergel, K.C. Nadeau // Ann. Allergy Asthma Immunol. — 2017. — Vol. 118(1). — P. 21-27.
5. Hong X., Wang X. Epigenetics and development offood allergy (FA) in early childhood // Curr. Allergy Asthma Rep. — 2014. — Vol. 14(9). — P. 460-466.
6. Li F., Ma J., Geng S., Wang J., Ren F., Sheng X. Comparison of the different kinds of feeding on the level of fecal calprotectin // Early Hum. Dev. — 2014. — 90(9). — Р. 471-5.
7. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy / A. Muraro, T. Werfel, K. Hoffmann-Sommergruberet, G. Roberts, K. Beyer, C. Bindslev-Jensen, V. Cardona et al. // Allergy. — 2014. — Vol. 69(8). — P. 1008-1025.

/34-1.jpg)
/35-1.jpg)