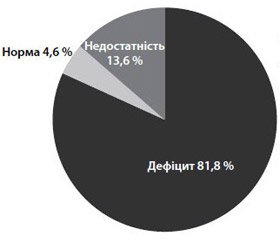
Дефіцит вітаміну D є загальною та достатньо поширеною проблемою, що має виражені клінічні наслідки (рис. 1). За даними популяційних досліджень (Поворознюк В.В., 2012), у 95,4 % населення Украї–ни істотно підвищені ризики втрати кісткової маси і ускладнень, пов’язаних із дефіцитом вітаміну D, у 81,8 % спостерігається дефіцит вітаміну D, у 13,6 % — його недостатність, у 4,6 % — нормальні показники.
Загальновизнаний класичний ефект вітаміну D3 в організмі — це підтримка рівня кальцію (Са) та фосфору (Р) у сироватці крові у вузьких фізіологічних межах, що забезпечує нормальне функціонування усіх органів та тканин.
Традиційна характеристика вітаміну D3 як гормона — регулятора мінерального обміну останнім часом доповнилась новими даними [1], що дозволили суттєво змінити погляд на фізіологічну роль цього вітаміну (рис. 2).
Відкриття рецепторів до гормонально-активних форм вітаміну D3 та їх синтезу у нетрадиційних для цього вітаміну клітинах різних органів та тканин передбачає більш широкий спектр його фізіологічного ефекту [2].
Розглядаються два механізми впливу вітаміну D3 на фізіологічні процеси: рівні геному та негеномні ефекти. На рівні геному метаболіти вітаміну D3 проявляють фізіологічний ефект шляхом, близьким до дії стероїдних гормонів [3]. Другий механізм дії вітаміну D3 виявляється через вплив на мембрану клітини.
Було продемонстровано, що холекальциферол прямо або опосередковано регулює синтез ліпідів, білків, гормонів, рецепторних білків. Установлено, що вітамін D3 бере участь у проліферації й диференціації клітин багатьох органів і тканин, у процесах модуляції імунної відповіді, функціональної активності серцево-судинної системи, шлунково-кишкового тракту, клітин м’язової тканини [4]. Враховуючи, що вітамін D3 бере участь у регуляції багатьох фізіологічних процесів в організмі, його препарати широко застосовують для профілактики та лікування не тільки порушень мінерального –обміну. Так, отримані позитивні ефекти від лікування холекальциферолом та його активними метаболітами імунодефіцитних станів, анемії, цукрового діабету (ЦД), різних патологічних станів печінки, шлунково-кишкового тракту, серцево-судинної системи, туберкульозу, злоякісних пухлин молочних залоз та кишечника тощо.
Розширення уявлення про роль вітаміну D3 стало результатом відкриття рецепторних білків у клітинах органів та тканин, не залучених до мінерального обміну та обміну вітаміну, а також можливості синтезу активних метаболітів вітаміну D3 цими клітинами. Наявність таких рецепторів була показано, зокрема, у β-клітинах підшлункової залози, що дозволяє розглядати їх як клітини-мішені для вітаміну D3 [5].
На роль вітаміну D3 у здійсненні функцій підшлункової залози вказують індуковані 1,25-дигідрохолекальциферолом (1,25(ОН)2D3) морфологічні зміни β-клітин з одночасним підвищенням їх активності, а також наявність високоафінного рецептора, що локалізується в ядрах β-клітин підшлункової залози. При внутрішньочеревному введенні щурам [3Н]-1,25(ОН)2D3 чи інкубації острівців підшлункової залози з дигідроксиметаболітом вітаміну D3 у дослідах in vitro мітка концентрується в ядрах β-клітин у кількості 400 нмоль/мг ДНК. При цьому здатність накопичувати 1,25(ОН)2D3 мають тільки клітини, що містять інсулін, тобто β-клітини, але не клітини, які містять глюкагон чи соматостатин [6]. Характерним є те, що 1,25(ОН)2D3 зв’язується як із клітинами, що розвиваються, так і зі зрілими β-клітинами острівцевої тканини підшлункової залози, що узгоджується з участю гормона в проліферації та диференціюванні цих клітин, а також регуляції їх функціональної активності. Тому порушення забезпечення організму активними метаболітами вітаміну D3 може бути однією з основних причин зміни рівноваги між процесами деструкції β-клітин та здатністю їх регенерувати, що призведе до кількісного зменшення β-клітин підшлункової залози, а це, як відомо, лежить в основі розвитку діабету типу 1.
Крім даних про вплив гормонально-активних форм вітаміну D3 на процеси проліферації та диференціювання, велике значення мають відомості про зміну різних функціональних властивостей цих клітин під впливом зазначених метаболітів. Першим етапом такої дії є зв’язування 1,25(ОН)2D3 із рецепторними білками β-клітин. Утворений гормон-рецепторний комплекс переноситься в ядро клітини та вступає у взаємодію з певними ділянками молекули ДНК. Результатом цієї взаємодії є біосинтез нових молекул мРНК та трансляції відповідних білків, що беруть участь у гормональній відповіді [6].
В експерименті доведено, що 1,25(ОН)2D3 регулює рівень глюкози в крові. Одноразове введення його щурам, позбавленим вітаміну D, підвищує їх толерантність до глюкози та збільшує секрецію інсуліну. Подальші дослідження в цьому напрямку показали, що нормалізація толерантності до глюкози відбувається достатньо швидко та в дозозалежній манері. Ефект 1,25(ОН)2D3 досягає максимуму через 3 години після його введення та знижується при збільшені його дози.
Дещо по-іншому проявляють свою дію інші метаболіти вітаміну D3: 25-гідроксихолекальциферол (25(ОН)D3) та 24,25-дигідроксихолекальциферол (24,25(ОН)2D3). При введенні хворим із дефіцитом вітаміну D ці метаболіти, не змінюючи толерантності до глюкози, призводили до нормалізації секреції інсуліну та часткового пригнічення секреції глюкагону [1].
З урахуванням суттєвого впливу вітаміну D3 на вуглеводний обмін, ризики виникнення ЦД 1-го та 2-го типу та метаболічного синдрому в осіб із дефіцитом вітаміну D3 нам було цікаво з’ясувати можливості пріоритетного впливу вітаміну D3 або рівня кальціємії на стан вуглеводного обміну з метою визначення подальшої тактики запобігання ризикам порушення вуглеводного обміну різного ступеня. Дослідження проводили на щурах із масою 70 ± 5 г, яких протягом двох місяців утримували на D-гіповітамінозному раціоні зі збалансованим вмістом кальцію (1,2 %) та фосфору (0,7 %) згідно з ГОСТом 11222-65. Контрольній групі тварин протягом усього часу дослідження вводили фізіологічну дозу вітаміну D3 (40 МО).
Результати досліджень свідчать (рис. 3), що в групі щурів, які утримувались на D-гіповітаміноз–ному раціоні, діагностувались гіпокальціємія та гіпофосфатемія внаслідок зниження вмісту 25(ОН)D3. При цьому введення лікувальної дози вітаміну D3 нормалізувало забезпеченість організму мінеральними компонентами та 25(ОН)D3.
/28-1.jpg)
У цих групах тварин визначали рівень глюкози та інсуліну в сироватці крові (рис. 4). Як видно з наведених даних, у тварин, що утримувались на D-гіповітамінозній дієті, більше ніж у два рази підвищувався рівень глюкози в сироватці крові й на 30 % знижувався рівень інсуліну. У групі, що отримувала лікувальну дозу вітаміну D3, дослідні показники значно покращувались. Тобто отримані результати свідчать, що синтез інсуліну залежить від забезпеченості організму вітаміном D3. З метою підтримання даного висновку в цих групах тварин проводили тест толерантності до глюкози (рис. 4). У результаті у тварин із D-гіповітамінозом у точці максимуму рівень глюкози підвищувався на 80 % і навіть через 60 хвилин не досягав первинного рівня. У конт–рольній групі й групі, що отримувала лікувальні дози вітаміну D3, характер глікемічної кривої був однаковим. У зазначених групах щурів у наведені терміни визначали рівень інсуліну в сироватці крові (рис. 4). Як видно з наведених даних, у тварин із D-гіповітамінозом пік інсулінової секреції в точці максимуму пригнічувався на 46 % порівняно з його рівнем у тварин, що одержували вітамін D3. Низький вміст інсуліну в сироватці крові корелював із високим рівнем глюкози в тварин даної групи в цей період. Таким чином, отримані нами результати яскраво свідчать про те, що в тварин із D-гіповітамінозом порушується обмін вуглеводів.
/29-1.jpg)
Регулятором секреції інсуліну може бути змінення вмісту кальцію та неорганічного фосфору в організмі. Відомо, що гіпофосфатемія інгібує функціональну активність підшлункової залози. Однак дані літератури свідчать про те, що введення 1,25(ОН)2D3 у кількості 0,26 пмоль відновлює секрецію інсуліну без змін рівня неорганічного фосфору [1].
З метою визначення можливості впливу кальцію на вуглеводний обмін і секрецію інсуліну щурів із D-гіповітамінозом утримували протягом 10 днів на збагаченій кальцієм та фосфором дієті. Як вид–но з наведених даних, утримання тварин на дієті з додатковим введенням мінеральних компонентів (1,4 % кальцію та 0,8 % фосфору) нормалізує рівень кальцію в сироватці крові, але це не сприяє вірогідному зниженню глюкози та підвищенню вмісту інсуліну. Отримані результати дають можливість припустити, що тільки рівень кальцію в сироватці крові не регулює секрецію інсуліну та толерантність до глюкози (рис. 5). Отримані нами дані свідчать про те, що недостатність забезпечення організму вітаміном D3 супроводжується порушенням вуглеводного обміну, а саме підвищенням рівня глюкози, зниженням інсуліну, що корелює зі зниженням рівня 25(ОН)D3.
Наступні наші дослідження зі щурами на тлі експериментального ЦД продемонстрували, що дане захворювання супроводжується вірогідним знач–ним (в 3 рази) зниженням рівня 25(ОН)D3, збільшенням у 7,5 раза глюкози та зниженням у 4,5 раза рівня інсуліну (рис. 6), а застосування замісної терапії вітаміном D3 веде до зниження глюкози у 2,6 раза та збільшення інсуліну в 3,6 раза.
Таким чином, при експериментальному цукровому діабеті вітамін D3 стимулює β-клітини острівців підшлункової залози, що проявляється в його гіпоглікемічній дії. Розширення наших знань про роль вітаміну D3 в організмі в нормі та при патології розкриває перспективи клінічного застосування цього вітаміну при профілактиці та лікуванні ЦД.
Результати досліджень, які наведені на рис. 7, свідчать про те, що серед обстежених пацієнтів із ЦД як 1-го, так і 2-го типу низьке забезпечення організму вітаміном D3 відповідало декомпенсованому ЦД. При цьому чим нижчим був рівень 25(ОН)D3, тим вищими реєструвались показники глікемії. Зростаючий дефіцит вітаміну D3 призводив до стійкого порушення вуглеводного обміну.
Тривалий дефіцит вітаміну D3 в організмі спричинює патологічні зміни в багатьох органах. Забезпеченість вітаміном D3 залежить від статі, тяжкості, тривалості захворювання та має сезонні коливання. Тому ми вважали доцільним дослідити характер змін рівня 25(ОН)D3 щодо вищенаведених параметрів і залежно від первинного рівня 25(ОН)D3 у хворих на цукровий діабет (рис. 8).
Одержані дані свідчать про те, що забезпеченість організму вітаміном D3 у хворих на ЦД 1-го та 2-го типу мала сезонний характер, рівень 25(ОН)D3 у жінок був вищим, ніж у чоловіків, за ЦД як 1-го, так і 2-го типу (44,5 % жінок та 62,5 % чоловіків мали дефіцит), та мав прямий зв’язок зі ступенем тяжкості захворювання і обернений — з індексом маси тіла.
На підставі аналізу отриманих результатів розроблено алгоритм діагностики та лікування станів, що супроводжуються браком забезпеченості організму вітаміном D3 (рис. 9).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/27-1.jpg)
/28-1.jpg)
/29-1.jpg)
/30-1.jpg)
/31-1.jpg)
/32-1.jpg)