Газета «Новости медицины и фармации» Гастроэнтерология. Проктология (644) 2018 (тематический номер)
Вернуться к номеру
Сравнительное исследование фитопрепарата Гепаклин и силимарина у больных с метаболическим синдромом и неалкогольной жировой болезнью печени
Авторы: Дорофеев А.Э.(1), Руденко Н.Н.(2), Навка О.Е.(3), Силаков А.И.(4)
(1) — Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев, Украина
(2) — ННациональный медицинский университет им. А.А. Богомольца, г. Киев, Украина
(3) — НАвиационный медицинский центр Национального авиационного университета, г. Киев, Украина
(4) — НКНП «Консультативно-диагностический центр» Святошинского района г. Киева, г. Киев, Украина
Разделы: Клинические исследования
Версия для печати
Конец прошлого и начало нынешнего века характеризуются лавинообразным нарастанием количества людей с избыточной массой тела и ожирением. Так, за последние 35 лет в мире количество больных с ожирением удвоилось и достигло 11 % среди мужчин и 15 % среди женщин. Причем ожирение стало проблемой не только в развитых, но и в развивающихся странах (Arroyo-Johnson C., Mincey K.D., 2016). В 2014 году в мире насчитывалось около 1,9 миллиарда людей с избыточной массой тела, а у 650 миллионов находили ожирение. Наша страна не является исключением. Так, по данным ВОЗ, в 2016 году у 61,5 % взрослых жителей Украины индекс массы тела (ИМТ) превышал 25. В настоящее время ВОЗ характеризует ожирение как наиболее важную причину развития хронических заболеваний, опередившую проблему недоедания (WHO, 2016). Это объясняется тем, что избыточная масса тела и ожирение приводят к росту сердечно-сосудистой, эндокринной и онкологической патологии (Yumuk V. еt al., 2015).
Известно, что наиболее метаболически активным является висцеральный жир. Поэтому абдоминальное ожирение закономерно сопровождается целым рядом изменений липидного, углеводного и других видов обмена веществ, повышая риск развития многих заболеваний. Хорошо известны диагностические критерии метаболического синдрома (МС), включающие увеличение окружности талии (> 80 см у женщин и > 84 см у мужчин европеоидной расы), а также не менее 2 дополнительных критериев: повышение АД > 130/85 мм рт.ст.; повышение уровня триглицеридов (ТГ) > 1,7 ммоль/л; повышение глюкозы плазмы крови натощак > 5,6 ммоль/л; и снижение липопротеидов высокой плотности (ЛПВП) < 1 ммоль/л у мужчин и < 1,3 ммоль/л у женщин или прием гипотензивных, сахароснижающих, гиполипидемических препаратов (Alberti K.G. еt al., 2009; Goldenberg R. et al., 2013). Помимо уже перечисленных заболеваний, МС часто сопровождается развитием остеоартроза, псориаза, мочекаменной болезни и такой гастроэнтерологической патологии, как неалкогольная жировая болезнь печени (НАЖБП) и дискинезия желчевыводящих путей (Halmos T., Suba I., 2017).
В настоящее время НАЖБП вышла на первое место среди причин поражения печени в развитых странах и, по прогнозам, в ближайшее десятилетие станет самой частой причиной смерти от заболеваний печени (Younossi Z. еt al., 2018). Известно, что у большинства пациентов с НАЖБП выявляется стеатоз печени — накопление жира более чем в 5 % гепатоцитов без признаков воспаления, однако у части больных присоединяется воспаление — развивается стеатогепатит. Исходом такого процесса будет фиброз, цирроз печени, а у некоторых больных — развитие гепатоцеллюлярной карциномы. Золотым стандартом диагностики НАЖБП является биопсия печени с морфологическим исследованием. Однако усовершенствование ультразвуковой диагностики позволяет достаточно информативно и, главное, неинвазивно подтвердить наличие стеатоза печени (Pappachan J.M. еt al., 2017).
Среди функциональных заболеваний желудочно-кишечного тракта, пожалуй, самой малоизвестной для практических врачей является функциональная патология желчного пузыря (ФПЖП). В нашей стране это заболевание лучше известно под названием «дискинезия желчевыводящих путей» (ДЖВП). В настоящее время ФПЖП имеет четкие диагностические критерии, подтвержденные в очередном IV Римском консенсусе по функциональной патологии желудочно-кишечного тракта (ЖКТ). Однако там же указывается достаточно слабая доказательная база методов диагностики и лечения этой патологии (Cotton P.B. еt al., 2016). К диагностическим критериям ФПЖП относится наличие билиарных болей у пациентов с сохраненным желчным пузырем (ЖП) при исключении желчнокаменной болезни. У большинства этих пациентов обнаруживается снижение сократимости ЖП. В то же время у части больных с ФПЖП сократительная функция желчного пузыря оказалась повышенной или нормальной (Pihl K.D. еt al., 2018). Истинная распространенность ДЖВП неизвестна, хотя предполагается, что у взрослых около 20 % всех холецистэктомий проводится в связи именно с этой патологией (Bielefeldt K. еt al., 2014).
Следует отметить, что вопросы лечения НАЖБП и ФПЖП в настоящее время недостаточно разработаны (Cotton P.B. еt al., 2016; Pappachan J.M. еt al., 2017). В Северной Америке больным с ФПЖП принято проводить холецистэктомию, хотя ее эффективность оказалась намного ниже, чем при желчнокаменной болезни (Goussous N. еt al., 2014). При НАЖБП в первую очередь лечится основная патология (диабет, ожирение). В то же время только модификация образа жизни (диета и физнагрузки), а также токоферол и пиоглитазон доказали эффективность и включены в рекомендации по лечению этой патологии. Во всем мире идет активный поиск новых препаратов для терапии НАЖБП (Younossi Z.M. еt al., 2017).
В настоящее время пристальное внимание уделяется изучению как отдельных фитопрепаратов, так и их комплексов в лечении больных с метаболическим синдромом и НАЖБП. При этом отмечается воздействие отдельных растительных компонентов на аппетит, толерантность к глюкозе, уровень липопротеидов и сократимость ЖП (Yao H. еt al., 2016; Valvi A.R. et al., 2016).
Одним из таких препаратов является Гепаклин (Ananta Medicare Ltd.) — аюрведический препарат, состоящий из 7 растительных компонентов. Каждый из компонентов этого препарата имеет не только тысячелетний опыт применения в традиционной индийской медицине, но и подтверждение эффективности современными методами исследования. Первый компонент — экстракт корневищ пикрорхизы курроа (Picrorhiza kurroa) — обладает противовоспалительным (ингибирует синтез IL-1β, IL-6, TNF-R1, VEGF, MMP-3 и ММР-9) и антиоксидантным эффектами, а также уменьшает содержание липидов в печени при НАЖБП (Kumar R. et al., 2016; Shetty S.N. et al., 2010). Второй компонент — андрографис метельчатый (Andrographis paniculata) — оказывает противовоспалительное действие (подавление СОХ-2, LPS, снижение синтеза IFN-γ, TNF-α, IL-1β, IL-17A и IL-6), гипогликемический, гиполипидемический, иммуномодулирующий, желчегонный и гепатопротективный эффекты (Hos-sain M.S. et al., 2014; Chua L.S., 2014). Следующий компонент — филантус (Phyllanthus niruri) — имеет доказанный противовоспалительный, антибактериальный и гепатопротективный эффект, также обсуждается его эффективность в лечении вирусного гепатита (Sarin B. еt al., 2014; Xia Y. et al., 2013). Еще одним компонентом является тефрозия пурпурная (Tephrosia purpurea), которая обладает противовоспалительным, антиоксидантным, гипогликемическим и гепатопротективным эффектами (Palbag S. et al., 2014). Стебли тиноспоры сердцелистной (Tinospora cordifolia) обладают противовоспалительным, гипогликемическим, спазмолитическим и желчегонным действием (Hussain L. et al., 2015). Бурхавия диффузная (Boerhaavia diffusa) оказывает гипогликемическое, противовоспалительное, желчегонное и гепатопротективное действие (Tacchini M. et al., 2015). Наиболее изученным компонентом препарата Гепаклин является хорошо нам известный в качестве специи перец длинный (Piper longum). Множество исследований показало антибактериальный, противовоспалительный, антиоксидантный, иммуномодулирующий, гиполипидемический и гепатопротективный эффекты длинного перца (Kumar S. et al., 2011; Gutierrez R.M. еt al., 2013).
Цель исследования. Учитывая вышеизложенное, мы поставили перед собой задачу изучить влияние комплексного фитопрепарата Гепаклин на состояние липидного, углеводного обмена, функцию печени и сократимость желчного пузыря у больных с метаболическим синдромом и НАЖБП и сравнить с хорошо изученным растительным гепатопротектором силимарином.
Материалы и методы
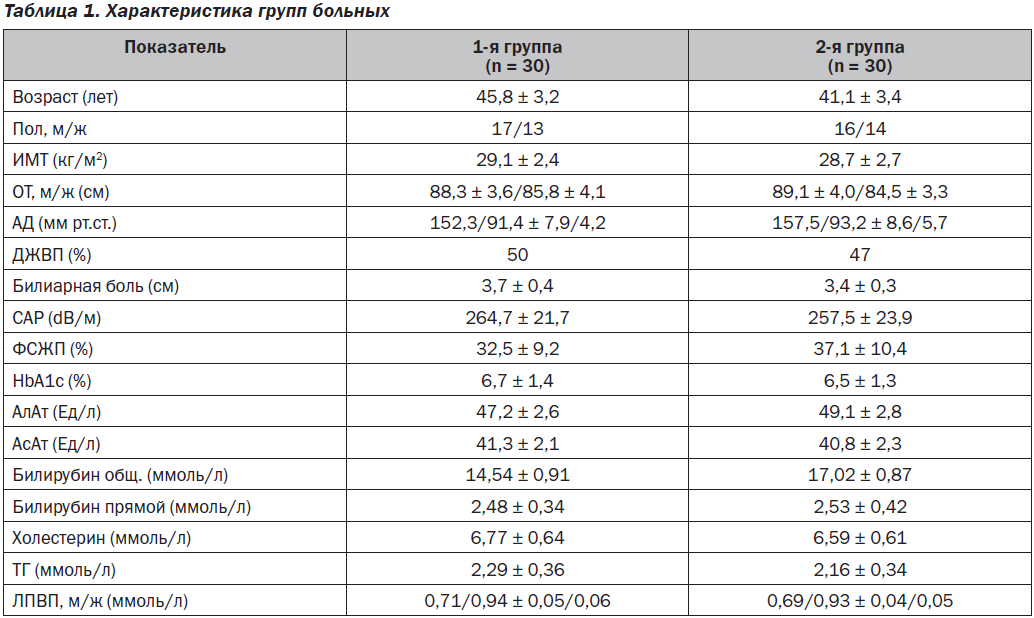
Исследование носило характер открытого, многоцентрового, сравнительного. Под нашим наблюдением находилось 60 амбулаторных больных с МС. Мужчин было 33 (55 %), женщин 27, средний возраст составлял 43,2 ± 1,5 года. Диагноз МС выставлялся на основании общепринятых диагностических критериев (Alberti K.G. et al., 2009). Кроме антропометрических показателей (рост, окружность талии — ОТ, масса тела и индекс массы тела — ИМТ), у всех больных определяли АД, гликозилированный гемоглобин (HbA1c), общий холестерин, фракции липопротеидов, аминотрансферазы (АсАт и АлАт), билирубин и его фракции. При проведении сонографии органов брюшной полости определяли размеры долей печени, коэффициент ослабления ультразвуковой волны (Controlled Attenuation Parameter — CAP). Также оценивали фракцию сокращения желчного пузыря (ФСЖП) при помощи динамической холецистографии на фоне стандартного желчегонного завтрака (норма от 35 до 75 %). Выраженность билиарной боли оценивалась по визуальной аналоговой шкале (ВАШ). Критериями невключения были иные причины поражения печени — вирусные гепатиты, употребление алкоголя > 2 алкогольных единиц в сутки, употребление гепатотоксичных медикаментов, а также желчнокаменная болезнь, сахарный диабет, требующий медикаментозного лечения, клинически значимая печеночная, почечная или сердечная недостаточность, прием гиполипидемических препаратов.
Выбор САР для оценки выраженности степени стеатоза печени у больных НАЖБП основывался на его высокой информативности. Показано, что при значении САР от 206,5 до 232,5 dB/м у 83 % пациентов диагностируется стеатоз ≥ S1; при 232,5–282,5 dB/m у 96 % ≥ S2, при показателе более 282,5 dB/m у 98 % ≥ S3 (Andrade P. et al., 2017).
У всех включенных в исследование больных соно-графически выявлялся стеатоз печени. У 22 на основании повышения уровня аминотрансфераз выставлялся диагноз стеатогепатита. При проведении динамической холецистографии у 29 человек найдена ДЖВП, причем у 26 — со сниженной ФСЖП, а еще у 3 — с повышенной.
Больные были рандомизированы на две группы по 30 человек. В обеих группах было по 11 больных со стеатогепатитом. Среди пациентов с ДЖВП в первой группе было 14 со сниженной и 1 с повышенной функцией ЖП, а во второй, соответственно, 12 и 2. Характеристика больных в обеих группах представлена в табл. 1. Как видно из приведенных данных, исходно отсутствовали достоверные различия изучаемых показателей между пациентами двух групп (р > 0,05). Пациенты первой группы получали Гепаклин по 1 табл. три раза в сутки за 30 мин до еды. Во второй группе сравнения — силимарин по 45 мг 3 раза в сутки. Продолжительность лечения в обеих группах составляла 12 недель.
Результаты
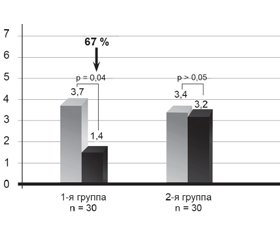
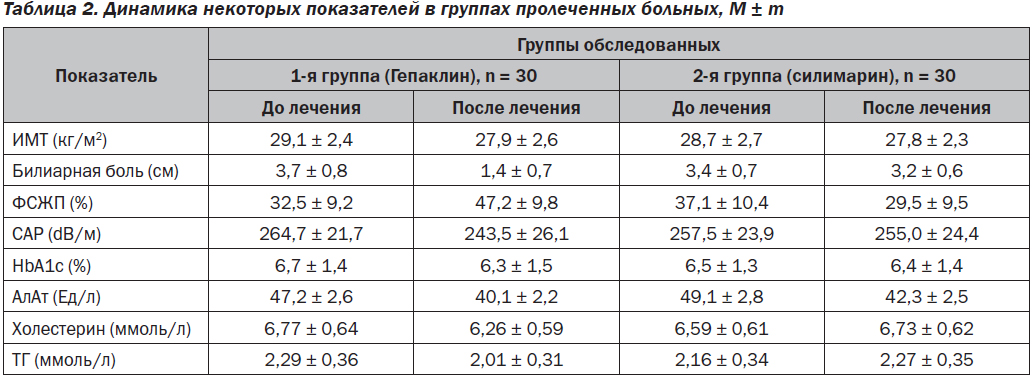
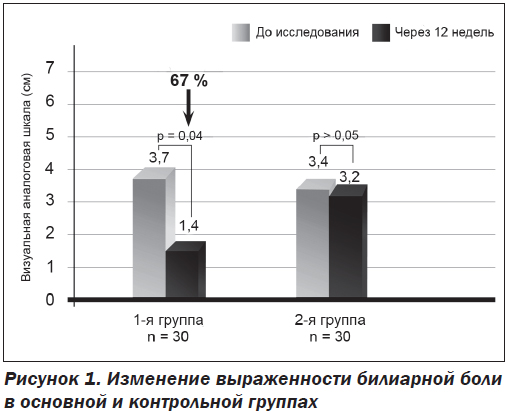
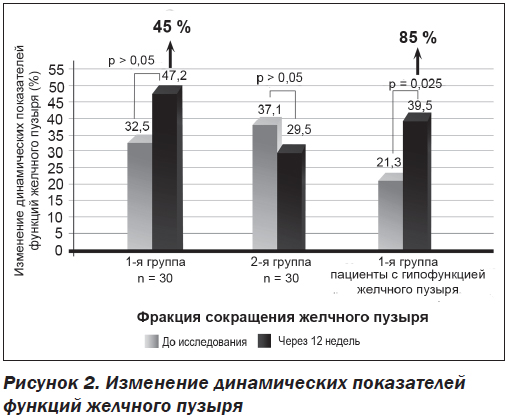
После 12 недель применения Гепаклина в первой группе больных нами найдено достоверное уменьшение выраженности билиарной боли на 67 % от исходного уровня (р = 0,04) (рис. 1) и количества билиарного сладжа. Также отмечена тенденция к снижению массы тела (ИМТ снизился на 4 %), уменьшению окружности талии на 0,8 см, снижению HbA1c на 0,4 %, АлАт на 15 %, общего холестерина на 7,5 %, ТГ на 12 % САР на 8 % и повышению ФСЖП на 45 % от исходного (рис. 2), однако все эти изменения не достигали достоверного значения (р > 0,05). Нами не найдена динамика в показателях АД, АсАт, щелочной фосфатазы, билирубина и его фракций, липопротеидов низкой плотности, С-реактивного протеина, клинического анализа крови. Однако при анализе сократимости желчного пузыря у больных с его сниженной моторикой найдено достоверное улучшение ФСЖП на 85 % (с 21,3 ± 5,1 до 39,5 ± 5,7; p = 0,025) (рис. 2).
Во второй группе отмечалось недостоверное снижение уровня АлАт на 16 % от исходного. Масса тела, окружность талии, уровень HbA1c, АсАт, щелочной фосфатазы, билирубина и его фракций, липопротеидов низкой плотности, С-реактивного протеина, клинического анализа крови остались практически на том же уровне, а содержание холестерина и ТГ даже незначительно повысилось. В этой группе пациентов также не наблюдалось изменения АД, выраженности билиарной боли, сократимости ЖП и степени стеатоза.
В обеих группах отмечалась высокая безопасность препаратов и отсутствие клинически значимых побочных эффектов. В первой и второй группах у 3 и 4 больных отмечались головные боли, у 4 и 2 пациентов — боли в суставах нижних конечностей, у 3 и 1 больного — изжога, у 2 больных каждой группы — тошнота. Нами не найдено неблагоприятных изменений в общем анализе крови, маркерах холестаза и цитолиза.
Обсуждение
У обследованных нами больных с метаболическим синдромом более чем в трети случаев найден неалкогольный стеатогепатит, а у остальных — стеатоз печени, что соответствует данным, полученным в западной и восточной популяциях (Gaharwar R. et al., 2015; Targher G., Byrne C.D., 2015). В то же время распространенность ДЖВП в группе больных с МС и НАЖБП недостаточно изучена, хотя известно, что эта патология чаще встречается у пациентов с ожирением и сахарным диабетом. По нашим данным, у 48 % таких больных встречалась ДЖВП, причем почти в 90 % случаев выявлялся ее гипомоторный вариант.
Как показало наше исследование, основное лечебное воздействие Гепаклин оказывает на желчный пузырь. В результате 12-недельного применения этого средства найдено достоверное уменьшение выраженности билиарной боли на 67 % по ВАШ, повышение фракции сокращения желчного пузыря, особенно у больных с гипомоторным вариантом ДЖВП, на 85 %. Также у больных, принимавших Гепаклин, отмечено уменьшение количества билиарного сладжа в желчном пузыре. Следует отметить, что у больных первой группы наблюдалось улучшение липидного (снижение общего холестерина и триглицеридов) и углеводного обменов (снижение HbA1c), а также выраженности стеатоза по данным сонографии, однако эти изменения не достигли достоверного уровня.
Необходимо подчеркнуть высокую безопасность исследуемого фитопрепарата. За три месяца приема Гепаклина в единичных случаях отмечались незначительные побочные эффекты, не потребовавшие изменения лечения.
Выводы
Таким образом, натуральный мультикомпонентный фитопрепарат Гепаклин оказывает нормализующее воздействие на сократимость желчного пузыря и уменьшает выраженность билиарной боли у больных с метаболическим синдромом и неалкогольной жировой болезнью печени. Гепаклин обладает хорошей переносимостью и высокой безопасностью.
Список литературы
1. Alberti K.G., Eckel R.H., Grundy S.M. et al. Harmonizing the metabolic syndrome: ajoint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Fede-ration; International Atherosclerosis Society and International Association for the Study of Obesity // Circulation. — 2009 Oct 20. — 120(16). — 1640-5.
2. Andrade P., Rodrigues S., Rodrigues-Pinto E. et al. Diagnostic Accuracy of Controlled Attenuation Parameter for Detecting Hepatic Steatosis in Patients with Chronic Liver Disease // GE Port. J. Gastroenterol. — 2017 Jul. — 24(4). — 161-168.
3. Arroyo-Johnson C., Mincey K.D. Obesity Epidemio-logy Worldwide // Gastroenterol. Clin. North Am. — 2016 Dec. — 45(4). — 571-579.
4. Bielefeldt K., Saligram S., Zickmund S.L. et al. Cholecystectomy for biliary dyskinesia. — how did we get there? // Dig Dis Sci. — 2014 Dec. — 59(12). — 2850-63.
5. Chua L.S. Review on liver inflammation and antiinflammatory activity of Andrographis paniculatafor hepatoprotection // Phytother. Res. — 2014 Nov. — 28(11). — 1589-98.
6. Cotton P.B., Elta G.H., Carter C.R. et al. Gallbladder and Sphincter of Oddi Disorders // Gastroenterology. — 2016 Feb. — 150. — 1420-9.
7. Gaharwar R., Trikha S., Margekar S.L. et al. Study of Clinical Profile of Patients of Non Alcoholic Fatty Liver Disease and its Association with Metabolic Syndrome // J. Assoc. Physicians India. — 2015 Jan. — 63(1). — 12-6.
8. Goldenberg R., Punthakee Z. Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. Definition, classification and diagnosis of diabetes, prediabetes and metabolic syndrome // Can. J. Diabetes. — 2013 Apr. — 37 Suppl 1. — S8-11.
9. Goussous N., Kowdley G.C., Sardana N. et al. Gallbladder dysfunction: how much longer will it be controversial? // Digestion. — 2014. — 90(3). — 147-54.
10. Gutierrez R.M., Gonzalez A.M., Hoyo-Vadillo C. Alkaloids from piper: a review of its phytochemistry and pharmacology // Mini Rev. Med. Chem. — 2013 Feb. — 13(2). — 163-93.
11. Halmos T., Suba I. Non-alcoholic fatty liver disease, as a component of the metabolic syndrome, and its causal correlations with other extrahepatic diseases // Orv. Hetil. — 2017 Dec. — 158(52). — 2051-61.
12. Hossain M.S., Urbi Z., Sule A. et al. Andrographis paniculata (Burm. f.) Wall. ex Nees: a review of ethnobo-tany, phytochemistry, and pharmacology // Scientific World Journal. — 2014. — 2014. — 274-905.
13. Hussain L., Akash M.S., Ain N.U. et al. The Analgesic, Anti-Inflammatory and Anti-Pyretic Activities of Tinospora cordifolia // Adv. Clin. Exp. Med. — 2015 Nov-Dec. — 24(6). — 957-64.
14. Kumar R., Gupta Y.K., Singh S., Arunraja S. Picrorhiza kurroa Inhibits Experimental Arthritis Through Inhibition of Pro-inflammatory Cytokines, Angiogenesis and MMPs // Phytother. Res. — 2016 Jan. — 30(1). — 112-9.
15. Kumar S., Kamboj J., Suman, Sharma S. Overview for various aspects of the health benefits of Piper longum linn. Fruit // J. Acupunct. Meridian. Stud. — 2011 Jun. — 4(2). — 134-40.
16. Palbag S., Dey B.K., Singh N.K. Ethnopharmaco–logy, phytochemistry and pharmacology of Tephrosia purpurea // Chin. J. Nat. Med. — 2014 Jan. — 12(1). — 1-7.
17. Pappachan J.M., Babu S., Krishnan B., Ravindran N.C. Non-alcoholic Fatty Liver Disease; A Clinical Update // J. Clin. Transl. Hepatol. — 2017 Dec 28. — 5(4). — 384-393.
18. Pihl K.D., Jones M.W., Deppen J.G. et al. Effects of laparoscopic cholecystectomy in normokinetic biliary dyskinesia // Am. J. Surg. — 2018 Jan. — 215(1). — 116-119.
19. Sarin B., Verma N., Martín J.P., Mohanty A. An overview of important ethnomedicinal herbs of Phyllanthus species: present status and future prospects // Scientific World Journal. — 2014 Feb 3. — 2014. — 839-172.
20. Shetty S.N., Mengi S., Vaidya R., Vaidya A.D.
A study of standardized extracts of Picrorhiza kurroa Royle ex Benth in experimental nonalcoholic fatty liver di-sease // J. Ayurveda Integr. Med. — 2010 Jul. — 1(3). — 203-10.
21. Tacchini M., Spagnoletti A., Marieschi M. et al. Phytochemical profile and bioactivity of traditional ayurvedic decoctions and hydro-alcoholic macerations of Boerhaavia diffusa L. and Curculigo orchioides Gaertn // Nat. Prod. Res. — 2015. — 29(22). — 2071-9.
22. Targher G., Byrne C.D. A Perspective on Metabolic Syndrome and Nonalcoholic Fatty Liver Disease // Metab. Syndr. Relat. Disord. — 2015 Aug. — 13(6). — 235-8.
23. Valvi A.R., Mouriya N., Athawale R.B., Bhatt N.S. Hepatoprotective Ayurvedic plants: a review // J. Complement. Integr. Med. — 2016 Sep 1. — 13(3). — 207-215.
24. WHO. Global Health Observatory data. http: //apps.who.int/gho/data/view.main.BMI25Cv
25. Xia Y., Luo H., Liu J.P., Gluud C. Phyllanthus species versus antiviral drugs for chronic hepatitis B virus infection // Cochrane Database Syst. Rev. — 2013 Apr 30. — (4). — CD009004.
26. Yao H., Qiao Y.J., Zhao Y.L. et al. Herbal medicines and nonalcoholic fatty liver disease // World J. Gastroenterol. — 2016 Aug 14. — 22(30). — 6890-905.
27. Younossi Z., Anstee Q.M., Marietti M. et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention // Nat. Rev. Gastroenterol. Hepatol. — 2018 Jan. — 15(1). — 11-20.
28. Younossi Z.M., Loomba R., Rinella M.E. et al. Current and Future Therapeutic Regimens for Non-alcoholic Fatty Liver Disease(NAFLD) and Non-alcoholic Steatohepatitis (NASH) // Hepatology. — 2017 Dec 9. [Epub ahead of print].
29. Yumuk V., Tsigos C., Fried M. et al. European Guidelines for Obesity Management in Adults // Obes. Facts. — 2015. — 8(6). — 402-24.