Введение
В настоящее время изучаются связи комбинации различных генов цитокинов с патогенетически значимыми количественными и качественными признаками заболевания. Однако данные о влиянии генотипа по полиморфным вариантам генов цитокинов на изменчивость показателей, значимых для прогрессирования хронического вирусного гепатита, немногочисленны. При этом в исследуемую группу нередко включаются больные как хроническим гепатитом С (ХГС), так и хроническим гепатитом В (ХГВ).
Вирусный гепатит С характеризуется увеличением удельного веса хронических форм, приростом показателей смертности населения от цирроза печени и гепатоцеллюлярной карциномы [1, 2].
Вирусный гепатит С является основной причиной формирования хронических заболеваний печени. Это связано с тем, что вирус гепатита С является уникальным адаптогеном, он способен ускользать от иммунного контроля, создавая новые антигенные варианты, что способствует переходу острого гепатита С в хроническую форму в 70–80 % случаев [3–5].
В формировании различных вариантов течения и исходов гепатита С и В важнейшую роль играет состояние иммунной системы больного [6–8].
Среди многочисленных факторов, которые определяют характер взаимодействия возбудителя и макроорганизма, влияют на хронизацию HCV-инфекции, а также модифицируют скорость фиброгенеза в печени, особая роль принадлежит генетическим факторам; считается, что полиморфизм генов цитокинов оказывает значительное влияние на характер течения хронического гепатита [9–11].
В исследованиях ряда авторов показано, что генетический статус человека по полиморфным вариантам ряда генов цитокинов является важнейшим фактором, определяющим такие патогенетические признаки течения хронических вирусных гепатитов, как количественное содержание цитокинов, а также уровень биохимических показателей крови [12–14].
Биохимические показатели крови, такие как уровень АлАт, АсАт, билирубина и его фракций, щелочная фосфатаза, служат для определения функционального состояния печени как в норме, так и при различной патологии. Синдром цитолиза оценивается путем –определения активности в сыворотке крови печеночных ферментов АлАт и АсАт. Состояние пигментного обмена — по уровню билирубина и его фракций. Синтетическая функция характеризуется уровнем белка, альбу–мино-глобулиновым и протромбиновым индексом.
Функциональное состояние печени, как общеизвестно, определяется на основании оценки показателей синдрома цитолиза, пигментного обмена, синдрома холестаза, мезенхимально-воспалительного синдрома, синтетической функции печени, которую характеризует протромбиновый индекс.
В связи с вышеизложенным представляется актуальным изучение индивидуального ответа организма больного на воздействие вируса гепатита С и В путем выявления возможной ассоциации полиморфных вариантов генов IL-4, IL-10 и TNFα с уровнем биохимических показателей.
Учитывая, что анализ данных об ассоциации полиморфизма генов цитокинов с биохимическими показателями у больных ХГС нередко противоречив и зависит от этнической группы, представляется целесообразным провести анализ ассоциации комбинации генов цитокинов IL-4 (C589T), IL-10 (G1082A) и TNFα (G308A) среди лиц, проживающих в Одесском регионе, с клинической симптоматикой заболевания и основными биохимическими показателями.
Целью исследования является корреляционный анализ полиморфизма генов IL-4 (C589T), IL-10 (G1082A) и TNFα (G308A) у больных ХГС с биохимическими и иммунологическими показателями, а также степенью фиброза у больных ХГС.
Материалы и методы
Обследовано 100 пациентов с ХГС, возраст которых варьировал от 18 до 62 лет. Средний возраст пациентов составил 42,00 ± 3,08 года. Пациенты, включенные в данное исследование, находятся на диспансерном учете в гепатоцентре КП «Одесская городская клиническая инфекционная больница». Все пациенты, включенные в исследование, проживают в Одесском регионе, в группах исследования лиц мужского пола было 44 %, а лиц женского пола — 56 %. Длительность болезни не превышает 10 лет.
Группа контроля представлена 30 практически здоровыми людьми, их средний возраст составляет 32,00 ± 1,05 года. Количество женщин и мужчин было одинаковым (15 человек).
При постановке диагноза хронического гепатита С учитывали данные анамнеза и клинические показатели (слабость, повышенная утомляемость, снижение работоспособности, недомогание, потливость, кожный зуд, снижение или отсутствие аппетита, тошнота, чувство тяжести в правом подреберье, неустойчивый стул, желтуха, проявления геморрагического синдрома, гепатомегалия, спленомегалия). У всех больных исследовали общий анализ крови, общий анализ мочи, концентрацию общего билирубина в сыворотке крови и его фракций, активность АЛТ, концентрацию общего белка и его фракций, протромбиновый индекс, щелочную фосфатазу (ЩФ).
Для подтверждения диагноза хронического гепатита С были использованы основные серологические маркеры (анти-HCV-IgM, качественное и количественное определение РНК HCV с помощью полимеразной цепной реакции (ПЦР), а также генотипа вируса).
Оценку морфологических изменений в печени (степень активности и выраженность фибротических изменений) проводили по шкале METAVIR с использованием неинвазивного метода Fibrotest.
Молекулярно-генетические исследования включали определение полиморфных вариантов генов IL-4 (C589T), IL-10 (G1082A), TNFα (G308A). Полиморфизм изучался при помощи амплификации соответствующих участков генома методом ПЦР. Исследования проводились на базе Немецкого диагностического центра им. св. Павла (г. Одесса).
Определение субпопуляций Т- и В-лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+) проводилось иммунофлюоресцентным методом с помощью набора моноклональных и поликлональных антител для установления дифференциальных антигенов лимфоцитов человека с использованием иммунофлюоресцентного микроскопа «Евростар».
Результаты иммунологических исследований приведены в виде среднего арифметического (М) и ошибки среднего арифметического (± m). С целью выявления корреляционных зависимостей между отдельными показателями был применен коэффициент корреляции Спирмена.
Распределение генотипов по исследованным полиморфным локусам проверяли с помощью критерия χ2 Пирсона. Частоты аллелей и генотипов в группах сравнивали с применением критерия χ2 Пирсона с поправкой Йетса на непрерывность при числе степеней свободы, равном 1.
Результаты и обсуждение
Клиническое течение ХГС в группе обследованных больных характеризовалось отсутствием цикличности заболевания. Астеновегетативный синдром наблюдался у всех больных (100 %), диспептический — у 86 пациентов (86 %), артралгический — у 41 (41 %). Желтуха наблюдалась редко (11 %), была слабовыраженной и непродолжительной. У большинства больных была обнаружена гепатомегалия (92 %), реже — спленомегалия (45 %).
Анализ биохимических показателей у больных ХГС с разной степенью активности процесса свидетельствует о том, что у большинства обследованных (92 %) уровень общего билирубина оставался в пределах нормы. У больных с умеренной активностью средний уровень общего билирубина составил 21,2 ± 1,4 мкмоль/л.
В большинстве случаев отмечалось повышение активности трансаминаз, среднее значение составило: АлАт — 1,39 ± 0,7 ммоль/л/час, АсАт — 1,25 ± 0,8 ммоль/л/час. Тимоловая проба повышалась в среднем до 5,8 ± 0,9 единицы. Индекс де Ритиса (соотношение АсАт и АлАт) в среднем составил 0,87 ± 0,64. Содержание общего белка у больных ХГС составило 74,12 ± 0,72 г/л, альбуминов — в среднем 43,74 ± 0,66 г/л, а глобулинов — 30,38 ± 0,18 г/л, альбумино-глобулиновый индекс составил 1,44 ± 0,02. Содержание щелочной фосфатазы оставалось в пределах нормы (91,20 ± 6,72 ед/л). Протромбиновый индекс равнялся в среднем 97,05 ± 0,48 %.
При анализе динамики основных клинических синдромов установлено, что у больных ХГС со степенью фиброза F0-F1 наблюдалось менее выраженное изменение общего состояния, чем у больных со степенью фиброза F2-F3. Изучение субпопуляционного состава лимфоцитов периферической крови у больных ХГС до начала лечения установило достоверно низкую экс–прессию CD3+, CD4+, CD16+ и увеличение количества клеток, экспрессирующих антигены CD8+ и CD19+, по сравнению с показателями здоровых лиц (р < 0,05). При этом значительное снижение количества CD4+ наблюдалось у 65 % больных; снижение CD16+ — у 46,97 % обследованных больных ХГС (табл. 2).
При исследовании аллельного полиморфизма IL-10 (G1082A), IL-4 (C589T) и TNFα (G308A) выявлены существенные различия в контрольной и исследуемой группах больных.
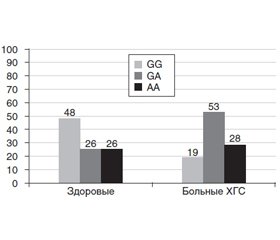
У здоровых лиц значительно преобладал гомозиготный генотип СС IL-4 (С589Т) (рис. 1). У больных ХГС также отмечалось его преобладание, но в значительно меньшей степени (р < 0,05, χ2 = 4,77). Кроме того, у больных ХГС значительно чаще встречался гетерозиготный генотип СТ IL-4 (С589Т) (р < 0,05, χ2 = 6,78). У здоровых лиц частота аллели С составила 0,9; аллели Т — 0,1. У больных — соответственно 0,81 и 0,19.
У здоровых лиц преобладал гомозиготный генотип СС IL-10 (1082G/A) (р < 0,05, χ2 = 9,33). При исследовании полиморфизма IL-10 (1082G/A) у больных ХГС установлено преобладание гетерозиготной аллели (комбинация GА у 53 % больных) (р < 0,05, χ2 = 6,44). У здоровых лиц частота аллели G составила 0,6; аллели A — 0,4. У больных — соответственно 0,46 и 0,54 (рис. 2)
При изучении аллельного полиморфизма TNFα (G308A) в контрольной группе выявлено преобладание гомозиготного типа генотипа GG TNFα (G308A) у 91 % (р < 0,05, χ2 = 50,88). У больных ХГС отмечалось преобладание гетерозиготной аллели GA (77 %) (р < 0,05, χ2 = 47,88). У здоровых лиц частота аллели G составила 0,93; аллели A — 0,07. У больных — соответственно 0,58 и 0,42 (рис. 3).
Для оценки ассоциации активности воспалительного процесса, степени изменений печеночной ткани, показателей клеточного иммунитета и аллельного полиморфизма генов все больные были разделены на три группы: с отсутствующим или минимальным фиброзом (F0-F1) — 46 %, умеренным фиброзом (F2) — 31 % и с выраженным фиброзом (F3) — 23 %.
Взаимосвязь фиброза печеночной ткани, показателей клеточного иммунитета и аллельного полиморфизма исследуемых генотипов оценивали при помощи коэффициента ранговой корреляции Спирмена.
Установлено наличие следующих корреляционных связей:
— прямая корреляционная связь между генотипами IL-4 и содержанием CD3+, р < 0,05 (большее содержание CD3+ отмечается у носителей генотипа СС, меньшее — у носителей генотипа ТТ);
— прямая корреляционная связь между генотипами IL-4 и активностью АлАт и АсАт, р < 0,01 (меньшая активность АлАт и АсАт отмечается у носителей генотипа СС, большая активность — у носителей генотипа ТТ);
— обратная корреляционная связь между генотипами TNFα и активностью АлАт и АсАт, р < 0,01 (меньшая активность АлАт и АсАт отмечается у носителей генотипа GG, большая — у носителей генотипа АА);
— обратная корреляционная связь между содержанием CD3+ и активностью АлАт и АсАт (низкое содержание CD3+-клеток соответствует более высокой активности трансаминаз), р < 0,05.
Выраженность некровоспалительного процесса в печеночной ткани была более значительной при быстром прогрессировании фиброза. Можно предположить, что комбинации генотипов СС IL-4 и GG TNFα обладают противовоспалительной активностью, так как они доминируют у больных со степенью фиброза F0-F1 и менее выраженным дисбалансом иммунного статуса. Возможно, комбинации генотипов ТТ IL-4 и АА TNFα ассоциируются с профиброгенным эффектом, так как они обнаружены у пациентов с фиброзом F2-F3.
Таким образом, при ХГС носители генотипов ТТ IL-4 и АА TNFα характеризуются более высоким уровнем повреждения гепатоцитов и степенью выраженности мезенхимального воспаления.
Наличие взаимосвязи активности трансаминаз, иммунологических показателей и определенных генотипов IL-4 и TNFα позволяет использовать полученную информацию как один из критериев активности воспалительного процесса в печени. Выраженность изменений показателей клеточного иммунитета является дополнительным критерием степени морфологических нарушений в печеночной ткани.
Выводы
Полученные данные могут помочь практическому врачу-клиницисту в прогнозировании течения ХГС, что непосредственно взаимосвязано с индивидуальным планом ведения пациента с хроническим гепатитом С.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Ivashkin VT, Iushchuk ND, Kozhevnikova GM, Maevskaia MV, Maev IV. Recommendations for diagnostics and treatment of adults patients with hepatitis C. Rossiiskii zhurnal gastroenterologii, gepatologii, koloproktologii. 2013;23(2):41-70. (in Russian).
2. Kozko VN, Antsyferova NV, Solomennyk AO, Kopiychenko YaI. Clinical and epidemiological characteristics of chronic form of HCV-infection. Hepatology. 2012;4(18):77-83. (in Ukrainian).
3. Ivashkin VT. Immune homeostasis and immune liver disea–ses. Rossiiskii zhurnal gastroenterologii, gepatologii, koloproktologii. 2009;19(3):4-12. (in Russian).
4. Kanda T, Yokosuka O, Omata M. Hepatitis C virus and hepatocellular carcinoma. Biology (Basel). 2013 Mar; 2(1):304-316. doi: 10.3390/biology2010304.
5. Kucheryavy YuA, Stukova NYu, Ahtayeva ML. Chronic hepatitis, liver cirrhosis and hepatocellular carcinoma — links in one and the same chain. Klinicheskie perspektivy gastroenterologii, gepatologii. 2012;5:3-11. (in Russian).
6. Lobzln YuV, Nikitin VYu, Sukhina LA, Tsigan VN, Mitin YuA. Immunopathogenesis of viral hepatitis С Immunological mar–kers of the disease progression. Journal of microbiology, epidemiology and immunobiology. 2007;6:75-84. (in Russian).
7. Goncharova IA, Gamal Abd El-Aziz Nasr H, Beloborodova EV, Ozhegova DS, Puzyrev VP. Polymorphism of gene modifiers of immune response in liver diseases of different etiologies. Medical genetics. 2010;9(12):20-24. (in Russian).
8. Moroz LV, Jacyk IV. Immunogenetic profile in patients with chronic hepatitis C. Hepatology. 2011;12(2):28-33. (in Ukrai–nian).
9. Nikolaeva LI, Kolotvin AV, Samokhodskaya LM, et al. Analysis of the influence of genetic factors of hepatitis c virus and gene polymorphism in infected patients on the development of liver fibrosis. Epidemiologiya i Infektsionnye Bolezni. 2012;5:7-13. (in Russian).
10. Samokhodskaya LM, Ignatova TM, Abdullayev SM, et al. Prognostic value of combination of allelic variants of cytokine and hemochromatosis genes in patients with chronic hepatitis С. Rossiiskii zhurnal gastroenterologii, gepatologii, koloproktologii. 2007;17(2):50-56. (in Russian).
11. Avdoshina VV, Konenkov VI, Beloborodova EI, Novitsky VV, Ryazantseva NV, Zima AP. Alleles distribution of polymorphic promoter region c-590t in inter-leukin-4 genes and q-576r and ile-50val regions in il-4 receptor gene il-4ra in patients with HCV-infection. Journal of microbiology, epidemiology and immunobiology. 2007;1:43-46. (in Russian).
12. Goncharova IA, Beloborodova EV, Friedin MB, Beloborodova EI, Chernogoruk GE, Puzyrev VP. Genetic factors determining predisposition to chronic course of virus hepatitis and fibrosis in liver. Molecular Biology. 2008;42(2):238-241. (in Russian).
13. Afzal MS, Tahir S, Salman A, et al. Analysis of interleukin-10 gene polymorphisms and hepatitis C susceptibility in Pakistan. J Infect Dev Ctries. 2011 Jul 4;5(6):473-9. PMID: 21727647.
14. Semyonova NA, Ryazantseva NV, Novitsky VV, Bychkov VA, Chechina OYe. Role of IL6 -174C/G gene polymorphism in development of chronic HCV infection. Bulletin of Siberian Medicine. 2010;9(5):93-97. (in Russian).

/37-1.jpg)
/38-1.jpg)
/38-2.jpg)