Вступ
Проблема антибіотикорезистентності мікроорганізмів до антибіотиків стала настільки важливою, що восени 2016 р. окремим питанням виносилась на розгляд Генеральної Асамблеї ООН на рівні голів держав-учасниць. Антибіотики, з якими ще недавно пов’язували сподівання на повну перемогу над інфекціями, швидко втрачають свою ефективність через поширення полірезистентних бактерій. Стійкість збудників гнійно-запальних захворювань до сучасних протимікробних засобів потребує значно більших витрат медичних ресурсів, важким економічним тягарем лягає на родини хворих та суспільство й обумовлює зростання смертності.
У лютому 2017 р. Всесвітня організація охорони здоров’я вперше опублікувала список стійких до дії антибіотиків «пріоритетних патогенів», що становлять найбільшу загрозу для здоров’я людини, до якого включено 12 видів бактерій. Із їх числа до групи з критично високим рівнем пріоритетності віднесено Acinetobacter baumannii, Pseudomonas aeruginosa та Enterobacteriaceae, стійкі до карбапенемів. До ІІ категорії пріоритетності віднесено метицилін-резистентні стафілококи та ентерококи. Ці мікроорганізми найчастіше викликають тяжкі ранові інфекції, смертельні вентилятор-асоційовані пневмонії, катетер-асоційовані септичні стани. При цьому майже всі штами цих видів бактерій, що виділяють у клініках, характеризуються стійкістю до цефалоспоринів третього та четвертого покоління і антибіотиків-карбапенемів, здатністю формувати нові механізми резистентності [1].
Низка додаткових питань щодо ефективності антибіотикотерапії пов’язана зі здатністю мікроорганізмів існувати на колонізованих поверхнях у вигляді біоплівок. По-перше, бактеріальні клітини, вкарбовані в полімерний плівковий матрикс, мають потужний захист від зовнішніх впливів, у тому числі й від впливу антибіотиків. По-друге, обмеження поживних речовин і простору в біоплівці обумовлює формування в її складі субпопуляції метаболічно неактивних клітин-персистерів. Відсутність в останніх будь-яких процесів біосинтезу робить їх невразливими до антибіотиків із будь-яким механізмом дії. Стійкість до протимікробних засобів у біоплівкової форми бактерій у десятки, а іноді й у сотні разів перевищує таку планктонних форм. Концентрації антибіотиків, здатні знищити бактерії в біоплівках, часто значно вищі, ніж ті, що створюються в тканинах організму при введенні максимально допустимих доз препарату. Усвідомлення факту існування бактерій у вигляді біоплівок у біотопах макроорганізму надає додаткове пояснення невдачам антибактеріальної терапії, підібраної за результатами визначення чутливості планктонних форм бактерій до протимікробних засобів. Доречно зауважити, що мікроорганізми, які увійшли до списку ВООЗ бактерій І категорії пріоритетності, характеризуються високим рівнем плівкоутворюючої активності [2].
Створення списку проблемних мікроорганізмів ВООЗ має на меті стимулювати розвиток науково-дослідницьких робіт зі створення нових високо–ефективних антибіотиків. Однак подібні дослідження не лише дуже вартісні, але й довготривалі. Тому не менш важливими за практичною значимістю можуть бути результати пошуку ефективних способів корекції патологічних процесів, обумовлених полірезистентними бактеріями, з використанням уже існуючого арсеналу протимікробних засобів.
Мікроорганізми, віднесені ВООЗ за пріоритетністю до І категорії, характеризуються відносно високим ступенем стійкості й до антисептичних препаратів. Однак, як правило, ця властивість не має критичного характеру, антисептики в робочих концентраціях чинять нищівний вплив на полірезистентні до антибіотиків штами бактерій. Крім того, відома здатність антисептичних препаратів із числа четвертинних амонієвих сполук підвищувати чутливість мікроорганізмів до антибіотиків [3]. Правомірно припустити, що антисептики цієї групи можуть позитивно вплинути на ефективність антибіотиків у випадку комбінованого застосування. Результати перевірки ефективності комбінованого впливу антисептиків із числа четвертинних амонієвих сполук і антибіотиків на полірезистентні до антибіотиків штами мікроорганізмів становлять значний практичний інтерес.
Метою дослідження стало вивчення потенціюючої дії суббактеріостатичних концентрацій декаметоксину на ефективність бактерицидного впливу антибіотиків та визначення ефективності поєднаного впливу декаметоксину й сучасних антибіотиків у концентраціях, що створюються при клінічному застосуванні, на полірезистентні мікроорганізми біоплівкової форми існування.
Матеріали та методи
У дослідженнях використані клінічні штами бактерій, виділені з матеріалу від тяжкохворих, які перебували на стаціонарному лікуванні у відділеннях інтенсивної терапії лікувальних закладів м. Вінниці. Визначали протимікробний вплив на досліджувані штами серійних зразків антибіотиків вітчизняного виробництва: меропенему, амікацину (ПАТ «Київмедпрепарат»), цефтріаксону (ФФ «Дарниця»), цефепіму (ПАТ НВЦ «Борщагівський ХФЗ»). Взаємне потенціювання антимікробної активності вивчали з використанням серійних зразків препарату Декасан (ТОВ «Юрія-Фарм»), основною діючою речовиною якого є четвертинна амонієва сполука декаметоксин.
Антимікробну активність антисептичних препаратів визначали за допомогою методу послідовних серійних розведень у рідкому живильному середовищі [4].
Дослідження потенціюючої дії Декасану на активність антибіотиків проводили методом послідовних розведень антибіотика в рідкому живильному середовищі, у кожну пробірку з яким додавали розведений ізотонічним розчином хлориду натрію до досягнення суббактеріостатичної концентрації –Декасан.
Ефективність впливу антибіотиків/антисептиків на біоплівкові форми бактерій вивчали з використанням полімерних тест-об’єктів. Тест-об’єкти, на яких попередньо формували біоплівку одного з досліджуваних штамів мікроорганізмів, занурювали в живильне середовище з антибактеріальним препаратом. Тривалість експозиції перебування тест-об’єктів у розчині антибактеріального препарату становила 24, 48 годин при 37 °С. Після завершення експозиції дії тест-об’єкти відмивали стерильним ізотонічним розчином хлориду натрію від залишків протимікробного засобу й переносили у пробірки зі звичайним м’ясопептонним бульйоном (МПБ). Пробірки з тест-об’єктами інкубували при 37 °С протягом 24 годин. Про повну ерадикацію життє–здатних мікроорганізмів із біоплівки на тест-об’єкті робили висновок за відсутністю росту в МПБ через 48 годин.
Дослідження взаємного потенціювання дії антибіотиків та антисептиків на сформовані біоплівки визначали в пробірках з Декасаном, до якого додавали досліджуваний антибіотик у максимальної концентрації, що створюється в сироватці крові при введенні терапевтичних доз. У кожну пробірку вносили тест-об’єкти зі сформованою біоплівкою й проводили дослідження наведеним вище способом.
Значення максимальної концентрації антибіотиків, що створюється в сироватці крові при введенні терапевтичних доз антибіотиків (Сmax), отримані з літературних джерел [5].
Статистичну обробку результатів досліджень проводили за допомогою пакета програм Statisticа 10.0 та Microsoft Office Excel. Відсоткові співвідношення знищених штамів та тих, що вижили, у біоплівковій формі при ізольованому застосуванні антибіотиків та при їх комбінуванні з декаметоксином порівнювали за допомогою критерію χ-квадрат.
Результати та обговорення
У дослідженні впливу декаметоксину на чутливість мікроорганізмів до антибіотиків було використано клінічні штами бактерій, які за результатами визначення чутливості диско-дифузійним методом були віднесені до категорії стійких. Становило інтерес, чи зміниться рівень чутливості таких варіантів бактерій до антибіотика в присутності декаметоксину в концентрації, що ізольовано не впливає на розмноження бактерій.
У табл. 1 узагальнено показники мінімальних бактерицидних концентрацій (МБцК) цефтріаксону й аналогічні показники того ж препарату в присутності суббактеріостатичної концентрації декаметоксину для мікроорганізмів різних видів, включених у згаданий вище список ВООЗ.
Аналіз наведених у табл. 1 даних дозволяє зробити висновок, що досліджені клінічні штами мікроорганізмів дійсно характеризувались високим рівнем стійкості до цефалоспоринів ІІІ покоління. Адже МБцК цефтріаксону для переважної кількості видів вимірювалась тисячами мікрограмів у мілілітрі, тоді як у сироватці крові концентрація препарату на піку після введення середньотерапевтичної дози близька до 80 мкг/мл. Навіть у відносно чутливих клебсієл середній показник МБцК був вищим (> 90 мкг/мл), ніж концентрація в сироватці в процесі лікування.
Наявність у середовищі суббактеріостатичної концентрації декаметоксину суттєво посилювала дію антибіотика. МБцК цефтріаксону для акінетобактерій в цих умовах статистично вірогідно зменшувалась у 6,1 раза, для псевдомонад — у 7,4 раза. Найпотужніше декаметоксин підвищував чутливість до цефтріаксону в грампозитивних бактерій. Так, у присутності декаметоксину для знищення клінічних штамів стафілококів необхідна була у 13,3 раза менша концентрація цефтріаксону, ніж у звичайних умовах, а для ентерококів — у 20,1 раза.
Аналогічний ефект спостерігали в процесі дослідження чутливості мікроорганізмів до інших антибіотиків бета-лактамного ряду. В акінетобактерій у присутності декаметоксину МБцК цефалоспорину ІV покоління цефепіму статистично вірогідно зменшувалась у 4–16 разів, той же показник меропенему зменшувався у 8–16 разів. МБцК цефепіму для клебсієл знижувалась у 4 рази.
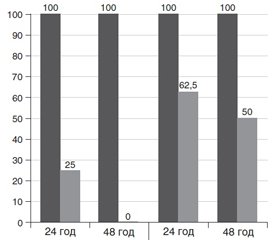
Зменшення показника МБцК антибіотиків у присутності суббактеріостатичної концентрації декаметоксину для планктонних форм мікроорганізмів, безумовно, свідчить про наявність в декаметоксину й бета-лактамних антибіотиків ефекту взаємного потенціювання протимікробної активності. Становить значний інтерес питання: чи достатньо потужності цього ефекту для знищення високозахищених мікробних клітин у складі біоплівок? Тим більше що саме в плівковій формі мікроорганізми існують на рановій поверхні. Нами проведено дослідження ефективності бактерицидної дії декаметоксину й меропенему та їх комбінації на плівкові форми акінетобактерій та паличок синьо-зеленого гною. При цьому встановлено, що в процесі перебування тест-об’єктів, вкритих біоплівками цих видів мікроорганізмів, у Декасані, який містить 200 мкг/мл декаметоксину, протягом 48 годин повного знищення життєздатних бактеріальних клітин не досягається. Меропенем було взято в дослід, оскільки ВООЗ, публікуючи список пріоритетних мікроорганізмів, особливу увагу акцентувала на стійкості бактерії до антибіотиків карбапенемового ряду. Досліджували вплив антибіотика в концентрації, що досягається в сироватці крові на піку після введення препарату в організм людини (100 мкг/мл). Результати дослідження ілюструє рис. 1.
/41-2.jpg)
Зображення на діаграмі свідчить, що акінетобактерії й псевдомонади в плівковій формі виживають у досліджуваному розчині меропенему 24 год, збільшення експозиції впливу антибіотика до 48 год не впливає на рівень виживання плівкових форм бактерій. У Декасані, у який додано меропенем у тій же концентрації, через 24 год життєздатні клітини псевдомонад виявлено на 62,5 % використаних у досліді тест-об’єктів. При експозиції дії в 48 год живі клітини паличок синьо-зеленого гною залишились лише на половині тест-об’єктів. При добовій експозиції дії комбінованого розчину акінетобактерії виживали у 25 % випадків, збільшення експозиції дії вдвічі дозволяло досягти повного знезаражування тест-об’єктів із плівковою формою цього виду мікроорганізмів. Отже, очевидно, що декаметоксин і меропенем взаємно посилюють згубний вплив на полірезистентні бактерії зі списку пріоритетних мікроорганізмів ВООЗ.
Схожі результати одержано при дослідженні впливу меропенему й Декасану на плівкові форми карбапенем-резистентних бактерій роду Enterobacter. Ефект посилення декаметоксином дії на плівкові форми мікроорганізмів спостерігали щодо антибіотиків інших груп. Так, статистично вірогідно в присутності декаметоксину посилювалась дія на плівкові форми акінетобактерій амікацину, ципрофлоксацину та колістину. Слід підкреслити, що потенціюючий ефект був встановлений для клінічно досяжних концентрацій цих препаратів.
Отже, результати експериментальних досліджень свідчать про істотне посилення бактерицидного ефекту щодо найбільш витривалих до протимікробних препаратів варіантів бактерій при поєднаному впливі антибіотиків і антисептика декаметоксин. У процесі проведення протимікробної терапії ранової інфекції локальне застосування Декасану може позитивно впливати на ефективність системного застосування антибіотиків.
Висновки
Антисептик із числа четвертинних амонієвих сполук декаметоксин і антибіотики бета-лактамного, аміноглікозидного, фторхінолонового рядів у процесі поєднаного впливу на мікробні клітини взаємно посилюють бактерицидну дію, що обґрунтовує доцільність їх комбінованого застосування у схемах комплексного лікування ранової інфекції.
Конфлікт інтересів. Не заявлений.

/41-1.jpg)
/41-2.jpg)