Два известных отечественных исследователя, Л.В. Новицкая-Усенко и С.Г. Демин, продемонстрировали целесообразность применения L-аргинина у хирургических больных абдоминального профиля для борьбы с послеоперационной атонией кишечника. Соответствующие результаты были представлены в работе «Влияние метоклопрамида и L-аргинина на показатели моторно-эвакуаторной функции ЖКТ и гемодинамику после неотложных абдоминальных операций».
Авторы сообщают, что моторно-эвакуаторная дисфункция желудочно-кишечного тракта очень распространена в послеоперационном периоде и возникает не только после больших операций на брюшной полости, в забрюшинном пространстве, гинекологических, урологических операций, но и после небольших по объему оперативных вмешательств, в том числе выполненных лапароскопически. Последствия развития послеоперационных нарушений моторики желудочно-кишечного тракта существенно увеличивают продолжительность пребывания в стационаре, осложняют послеоперационный период и повышают стоимость лечения.
В литературе последних лет появились сведения об универсальном регуляторе клеточного и тканевого метаболизма — монооксиде азота (NO). Научный интерес к нему обусловлен прежде всего тем, что он участвует в регуляции многих функций, таких как сосудистый тонус, сердечная сократимость, агрегация тромбоцитов, нейротрансмиссия, синтез аденозинтрифосфорной кислоты и белка, модулирует иммунный ответ.
При перитоните происходит снижение уровня кровотока в микроциркуляторном русле в поврежденном отделе желудочно-кишечного тракта. При этом изменения регуляции микроциркуляции присутствуют как на органном уровне, так и на периферии в целом. Изменения модуляции кровотока кишечника развиваются после нарушения процессов транскапиллярного обмена на периферии, что приводит к усилению вазомоторного компонента регуляции, изменению пре- и посткапиллярного сопротивления, вызывая нарушение микроциркуляции и перфузии стенки кишки. L-аргинин, выступая в роли донатора NO, может модулировать иммунный ответ организма, уменьшая экспрессию провоспалительного IL-8 и клеточных молекул адгезии у хирургических больных, а обогащенное L-аргинином парентеральное питание поддерживает защиту брюшины и улучшает результаты лечения у больных с перитонитом.
Положительное влияние L-аргинина на восстановление функции эндотелия при ишемическом/реперфузионном поражении кишечника и слизистой оболочки желудка, возможность улучшать адаптацию организма после резекции тонкой кишки, а также участие L-аргинина в поддержании тонуса желудка и модуляции транзита нутриентов по разным отделам кишечника стали основанием для его применения в цитируемой работе.
Цель исследования Л.В. Новицкой-Усенко и С.Г. Демина заключалась в том, чтобы оценить влияние послеоперационно назначенного метоклопрамида и L-аргинина (Тивортин®, «Юрия Фарм», Украина) на показатели моторно-эвакуаторной функции желудочно-кишечного тракта, гемодинамику и маркеры воспаления после неотложных абдоминальных операций.
Материалы и методы
В исследование был включен 51 пациент, которым проводили неотложные оперативные вмешательства по поводу ущемленных грыж, острой кишечной непроходимости, перфорации язв двенадцатиперстной кишки с распространенным перитонитом. В зависимости от медикаментозной профилактики послеоперационных нарушений желудочно-кишечного тракта пациенты были разделены на две группы: группа 1 (n = 27) получала стандартную терапию метоклопрамидом и неостигмином (прозерином), группа 2 (n = 24) — тестируемую схему лечения метоклопрамидом и L-аргинином.
Для оценки моторно-эвакуаторной функции желудочно-кишечного тракта использовали значение внутрибрюшного давления, измерение которого производили непрямым методом путем регистрации давления в мочевом пузыре. Данный показатель оценивали до операции и через 1, 2 и 3 суток после нее. В ходе исследования оценивали частоту вздутия живота, тошноты, рвоты, задержки отхождения газов, время начала отхождения газов и первой самостоятельной дефекации. Параметры гемодинамики регистрировали до операции и через 1, 3 и 7 суток после нее. Критериями оценки результатов лечения были: длительность пребывания в отделении анестезиологии и интенсивной терапии, длительность пребывания в стационаре, летальность в отделении анестезиологии и интенсивной терапии, сроки восстановления самостоятельного отхождения газов и самостоятельной дефекации. Конечной точкой исследования были 28-е сутки после оперативного вмешательства, когда была оценена общая летальность и количество лиц, достигших VIII уровня качества жизни по шкале RLAS (Rancho Los Amigos Scale).
Исследование было выполнено в г. Днепре (Украина). Показатели 15 здоровых добровольцев из данного региона были приняты за норму.
Результаты и обсуждение
Внутрибрюшное давление
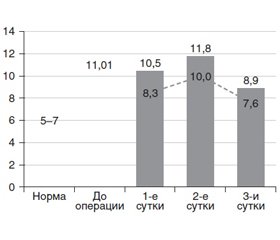
Развитие воспалительных процессов в брюшной полости сопровождалось ростом внутрибрюшного давления: в среднем у всех больных до 11,01 мм рт.ст. при норме 5–7 мм рт.ст.
Спустя 1, 2 и 3 суток после операции внутрибрюшное давление в группе метоклопрамида и неостигмина достоверно превышало верхнюю границу нормы. В то же время в группе метоклопрамида и L-аргинина спустя 1 и 3 суток такие различия отсутствовали: внутрибрюшное давление достоверно не отличалось от верхней границы нормы. Лишь на 2-е сутки у пациентов с L-аргинином верхняя граница нормы была достоверно превышена на 45,7 % (р = 0,002) подобно пациентам с неостигмином — превышение на 48,5 % (p < 0,001) (рис. 1).
Перфузионное давление (ПерД) в брюшной полости, рассчитанное как разница между средним артериальным давлением и внутрибрюшным давлением (ПерД = СрАД – ВБД), было нормальным как до операции, так и спустя 1, 2 и 3 суток после нее.
Другие показатели моторно-эвакуаторной функции желудочно-кишечного тракта
В дополнение к внутрибрюшному давлению в ходе исследования оценивали ряд других показателей, характеризующих моторно-эвакуаторную функцию желудочно-кишечного тракта.
При госпитализации у 53,4 % из 51 пациента наблюдалась задержка отхождения газов, у 68,9 % отмечалась тошнота, у 31 % — рвота.
Спустя 1 сутки после операции задержка отхождения газов, вздутие живота и ощущение переполнения в животе имели место у абсолютного большинства пациентов обеих групп, что указывало на развитие послеоперационных нарушений моторики желудочно-кишечного тракта. При этом тошнота была отмечена у 53,9 % пациентов группы метоклопрамида и неостигмина и только у трети пациентов группы метоклопрамида и L-аргинина.
Спустя 3 суток после операции наблюдалось уменьшение частоты моторно-эвакуаторных нарушений в обеих группах. В группе метоклопрамида и неостигмина задержка отхождения газов наблюдалась у 7,4 % пациентов, в группе метоклопрамида и L-аргинина у всех пациентов газы отходили самостоятельно. В группе метоклопрамида и неостигмина вздутие живота наблюдалось у 77,8 % пациентов, в группе метоклопрамида и L-аргинина — у 47,8 % пациентов. Аналогичные цифры для ощущения переполнения в животе составили 88,9 и 47,8 % соответственно. Тошнота и рвота отсутствовали у большинства пациентов обеих групп.
Спустя 7 суток после операции у 100 % обследованных пациентов наблюдалось самостоятельное отхождение газов. В группе метоклопрамида и нео–стигмина вздутие живота было отмечено у 3,8 % пациентов, ощущение переполнения в животе — у 11,5 % пациентов, тошнота — у 7,6 % пациентов. В группе метоклопрамида и L-аргинина вздутие живота, сопровождавшееся ощущением переполнения в животе, было отмечено у 8,4 % пациентов, тошнота и рвота не были зафиксированы ни у одного из пациентов.
Авторы не приводят достоверность различий (р-уровень) для вышеперечисленных показателей.
Общее периферическое сопротивление сосудов
До операции было отмечено увеличение общего периферического сопротивления сосудов (ОПСС): в среднем у всех больных до 1493 дин/с/см2 при норме 1029 дин/с/см2.
Спустя 1 сутки после операции в группе метоклопрамида и неостигмина происходило снижение общего периферического сопротивления сосудов (ОПСС) почти до нормы, в то время как в группе метоклопрамида и L-аргинина данный показатель оставался на дооперационном уровне.
В последующие контрольные точки отчетливо видно (рис. 2), что в группе метоклопрамида и неостигмина ОПСС непрерывно повышалось, достигая к 7-м суткам дооперационного уровня. Напротив, в группе метоклопрамида и L-аргинина ОПСС непрерывно снижалось и к 7-м суткам было на 16,9 % (р = 0,049) ниже дооперационного уровня, но все еще на 24 % (p < 0,001) выше нормы.
В ходе исследования было изучено также удельное периферическое сопротивление сосудов (УПСС), динамика которого была сходна с таковой у ОПСС.
Изменение других гемодинамических показателей
Изменения других гемодинамических показателей были в целом физиологически сбалансированы с изменениями ОПСС. Например, рост ОПСС сопровождался уменьшением ударного объема (УО) сердца, что приводило к компенсаторной тахикардии, и т.д.
Особый интерес представляет динамика минутного объема кровотока (МОК), работы левого желудочка (РЛЖ) и мощности левого желудочка (табл. 1). Видно, что в группе метоклопрамида и L-аргинина МОК быстрее достигал нормы (начиная с 3-х суток) по сравнению с группой метоклопрамида и неостигмина. В группе метоклопрамида и L-аргинина РЛЖ все время оставалась нормальной, в то время как в группе метоклопрамида и нео–стигмина этот показатель достигал нормы лишь к 7-м суткам после операции. В группе метоклопрамида и L-аргинина мощность левого желудочка даже увеличивалась по сравнению с нормой начиная с 3-х суток, в то время как во второй группе лечения показатель имел тенденцию оставаться нормальным.
Конечные результаты лечения и конечная точка исследования
В группе метоклопрамида и L-аргинина (Тивортин) наблюдалось более быстрое восстановление перистальтики после операции. Так, самостоятельное отхождение газов наблюдалось через 2,22 ± 0,30 суток после операции, что было на 21,8 % (р = 0,001) быстрее по сравнению с группой метоклопрамида и неостигмина. Более быстрое восстановление перистальтики способствовало сокращению длительности пребывания пациентов в отделении анестезиологии и интенсивной терапии: в группе метоклопрамида и L-аргинина (Тивортин) она составила 2,25 ± 0,30 суток, в группе метоклопрамида и неостигмина — 2,81 ± 0,30 суток.
Летальных случаев в обеих группах к 28-м суткам после операции зарегистрировано не было. 100 % пациентов обеих групп к 28-м суткам после операции достигли VIII уровня качества жизни по шкале RLAS, что свидетельствовало об их возвращении к привычной жизни.
Выводы
1. У большинства больных в раннем после–операционном периоде после неотложных абдоминальных операций развиваются послеоперационные нарушения моторики желудочно-кишечного тракта. Однако на фоне применения метоклопрамида и L-аргинина через 3 суток у большинства обследованных проявления моторно-эвакуаторных нарушений были слабо выражены. Активная моторно-эвакуаторная деятельность желудочно-кишечного тракта восстанавливалась через 2–3 суток после операции.
2. Применение метоклопрамида и L-аргинина (Тивортин) сопровождалось уменьшением явлений периферического вазоспазма при стабильной работе левого желудочка и увеличении его мощности.
Подготовила Наталия Куприненко
Список литературы
1. Новицька-Усенко Л.В., Дьомін С.Г. Вплив метоклопраміду та L-аргініну на показники моторно-евакуаторної функції ШКТ та гемодинаміку після невідкладних абдомінальних операцій // Медицина неотложных состояний. — 2015. — № 2. — С. 98-103.
2. Беляев А.В. Парентеральное и энтеральное питание в интенсивной терапии — К.: КИМ, 2009. — 344 с.
3. Губергриц Н.Б. Современный прокинетик итоприд в лечении диспепсии / Н.Б. Губергриц, П.Г. Фоменко // Внутрішня медицина. — 2009. — № 3 (15). — С. 27-35.
4. Климочкина Е.М. Влияние состояния К+-АТФ-зави–симых каналов на содержание стабильных метаболитов оксида азота в культуре мононуклеарных клеток здоровых добровольцев / Е.М. Климочкина // Український журнал експериментальної медицини ім. Г.О. Можаєва. — 2008. — Т. 9, № 1. — С. 93-96.
5. Колосовских А.А. Функциональное состояние микроциркуляции кишечника при разлитом перитоните / А.А. Колосовских, С.Л. Кан, Ю.А. Чурляев, О.С. Золоева // Общая реаниматология. — 2012. — № 8. — С. 33-37.
6. Camli A., Barlas М., Yagmurlu A. Does L-arginin einduce intestinal adaptation by epithelial growth factor? // ANZ J. Surg. — 2005. — Vol. 75. — P. 73-75.
7. De Giorgio R., Knowles C.H. Acutecolonic pseudo-obstruction // Br. J. Of Surg. — 2009. — Vol. 96. — P. 229-239.
8. Delgago-Aros S., Camilleri M. Pseudo-obstruction in the critically ill // Best. Pract. Res. Clin. Gastroenterol. — 2003. — Vol. 17. — P. 427-444.
9. De Meirelles L.R., Santoro M.M., Mendes M. Inhibitore effects of endogenous L-arginine analogues on nitric oxide synthesis in platelets: role in platelet hyperaggrebilityin hypertension // Clin. аnd Experiment. Pharmacol. аnd Phisiol. — 2007. — Vol. 34. — P. 1267-1271.
10. Fraser R., Vozzo R., Di Matteo A.C. Endogenous nitric oxide modulates small intestinal nutrient transit and activity in healthy adult humans // Scand. J. Gastroenterol. — 2005. — Vol. 40. — P. 1290-1295.
11. Herbert M.K., Holzer P. Standartized concept for the treatment of gastrointestinal dysmotility in critically ill // Clin. Nutr. — 2008. — Vol. 27. — P. 25-41.
12. Johnson M., Walsh R. Current therapies to shorten postoperative ileus // Clevel. and Clinic. Journal of Medicine. — 2009. — Vol. 76. — P. 641-648.
13. Kabaroglu C., Akisu M., Habif S. Effects of L-arginine and L-carnitine in hypoxia/reoxygenation-induced intestinal injury // Pediatrics International. — 2005. — Vol. 47. — P. 10-14.
14. Procacciante F., DeLuca M., Abilaliaj V. Post-operative ileus in hemicolectomy for cancer: open versus laparoscopic approach // Ann. Ital. Chir. — 2013. — Vol. 84. — P. 557-562.
15. Ueno C., Fukatsu K., Maeshima Y. Arginine-enriched total parenteral nutrition improvessur vival in peritonit is by normalizing Nf kappa B activation in peritoneal resident and exudative leukocytes // Ann. Surg. — 2010. — Vol. 251 (5). — P. 959-965.
16. Wolff B.G., Weese J.L., Ludwig K.A. Postoperative ileus-related morbidity profile in patients treated with alvimopan after bowel resection // J. Am. Coll. Surg. — 2007. — Vol. 204. — P. 609-616.
17. Yeh C.L., Hsu C.S., Chen S.C. Effect of arginine on cellular adhesion molecule expression and leukocyte transmigration in endo the lial cells stimulated by biological fluid from surgical patients // Shok. — 2007. — Vol. 28(1). — P. 39-44.

/41-1.jpg)
/42-1.jpg)
/42-2.jpg)