Журнал «Медицина неотложных состояний» 4 (83) 2017
Дикарбонильный стресс: гипотеза клеточного повреждения в условиях гипоксии. Пусковой механизм развития мультиорганной дисфункции
Резюме
Актуальність. Різноманітні критичні стани організму часто асоційовані з розвитком гіпоксії, у результаті чого активуються механізми гліколізу, під впливом звільнення стресових гормонів розвивається гіперглікемія. Показано, що в умовах анаеробного гліколізу на тлі гіперглікемії в клітинах продукуються токсичні речовини, що викликають гліколізування протеїнів та нуклеїнових кислот. Разом із порушенням функції клітинних білків виникає мітохондріальна дисфункція, що призводить до енергетичного дефіциту та порушення функціонування органів. Мета дослідження: виявити провідні механізми дикарбонільного стресу, їх значення для формування критичних станів організму та визначити найбільш перспективні способи корекції для фахівців у галузі інтенсивної терапії. Матеріали та методи. Детальне вивчення результатів сучасних наукових досліджень процесів вуглеводного обміну при патологічних станах на підставі інформації, поданої в Інтернеті. Результати. Провідна роль у пошкодженні клітинних структур організму при дикарбонільному стресі належить гліоксалю та метилгліоксалю. Ці хімічні сполуки утворюються як побічні продукти анаеробного гліколізу. Збільшенню їх синтезу сприяють активація анаеробного гліколізу та гіперглікемія. Дикарбонільні сполуки вступають у хімічні реакції з амінними групами протеїнів, нуклеїнових кислот та інших біологічно активних сполук, порушуючи їх функціонування. Природна детоксикація здійснюється гліоксалазною системою за участю відновленого глутатіону, що є основним компонентом антиоксидантної системи. Прогресування окислювального стресу та поява антиоксидантного дефіциту зумовлюють збільшення тяжкості пошкоджень, що викликає підвищене утворення гліоксалю та метилгліоксалю. Профілактика дикарбонільного стресу здійснюється за допомогою збільшення потужності антиоксидантної системи, насамперед за рахунок зростання утворення відновленого глутатіону. Для нейтралізації токсичних дикарбонільних метаболітів можуть бути використані препарати, що виконують функцію «пасток». Перспективне застосування терапії, що спрямована на усунення мітохондріальної дисфункції. Висновки. Нова проблема пошкодження організму в умовах дикарбонільного стресу диктує необхідність аналізу та переоцінки численної кількості заходів інтенсивної терапії. Докладне вивчення особливостей вуглеводного обміну при різних критичних станах, включаючи визначення концентрації гліоксалю та метилгліоксалю, моніторинг рівня глікемії та кліренсу лактату в поєднанні з поверненням до оцінювання стану компенсації функції прооксидантної/антиоксидантної системи організму, є одним із перспективних напрямів наукових досліджень у клініці, що має розпочатися. Фахівці з інтенсивної терапії щоденно стикаються із ситуаціями, коли дикарбонільний стрес може виступати як один із дійсних механізмів формування органної та мультиорганної дисфункції й визначає розвиток декомпенсації життєво важливих функцій. Навчитися протистояти йому є актуальною найближчою задачею.
Актуальность. Различные критические состояния организма часто ассоциированы с развитием гипоксии, в результате чего активируются механизмы гликолиза, под влиянием выброса стрессовых гормонов развивается гипергликемия. Показано, что в условиях анаэробного гликолиза на фоне гипергликемии в клетках продуцируются токсичные соединения, вызывающие гликолизирование протеинов и нуклеиновых кислот. Вместе с нарушением функции клеточных белков развивается митохондриальная дисфункция, которая приводит к энергетическому дефициту и нарушению функционирования органов. Цель исследования: выявить основные механизмы дикарбонильного стресса, их значение для формирования критических состояний организма и определить наиболее перспективные способы коррекции для специалистов в области интенсивной терапии. Материалы и методы. Детальное изучение результатов современных научных исследований процессов углеводного обмена при патологических состояниях на основании информации, представленной в Интернете. Результаты. Ведущая роль в повреждении клеточных структур организма при дикарбонильном стрессе принадлежит глиоксалю и метилглиоксалю. Эти вещества образуются в качестве побочных продуктов анаэробного гликолиза. Увеличению их синтеза способствуют активация анаэробного гликолиза и гипергликемия. Дикарбонильные соединения вступают в химические реакции с аминогруппами протеинов, нуклеиновых кислот и других биологически активных соединений, нарушая их функционирование. Естественная детоксикация осуществляется глиоксалазной системой с участием восстановленного глутатиона, который является основным компонентом антиоксидантной системы. Усиление окислительного стресса и появление антиоксидантного дефицита обусловливают увеличение тяжести повреждений, связанных с повышенной продукцией глиоксаля и метилглиоксаля. Профилактика дикарбонильного стресса осуществляется с помощью увеличения мощности антиоксидантной системы, прежде всего за счет увеличения продукции восстановленного глутатиона. Для нейтрализации токсичных дикарбонильных метаболитов могут быть использованы препараты, выполняющие функцию «ловушек». Перспективно применение терапии, направленной на устранение митохондриальной дисфункции. Выводы. Новая проблема повреждения организма в условиях дикарбонильного стресса диктует необходимость анализа и переоценки множества мероприятий интенсивной терапии. Детальное изучение особенностей углеводного обмена при различных критических состояниях, включая определение концентрации глиоксаля и метилглиоксаля, мониторинг уровня гликемии и клиренса лактата в сочетании с возвращением к оцениванию состояния компенсации функции прооксидантной/антиоксидантной системы организма, является одним из перспективных направлений предстоящих научных исследований в клинике. Специалисты по интенсивной терапии ежедневно сталкиваются с ситуациями, когда дикарбонильный стресс может выступать в качестве одного из действительных механизмов формирования органной и мультиорганной дисфункции и определяет развитие декомпенсации жизненно важных функций. Научиться противостоять ему является актуальной ближайшей задачей.
Background. Various critical states of the body are often associated with the development of hypoxia, as a result of which the mechanisms of glycolysis are activated, under the influence of stress hormone release, hyperglycemia develops. It is shown that under the conditions of anaerobic glycolysis against a background of hyperglycemia, toxic compounds are produced in the cells, which cause the glycosylation of proteins and nucleic acids. Together with the violation of the cellular protein function, mitochondrial dysfunction develops, which leads to an energy deficiency and organ dysfunction. The aim of investigation was to identify the main mechanisms of dicarbonyl stress, their importance for the formation of critical states of the organism and determine the most promising methods of correction for specialists in the field of intensive care. Materials and methods. Detailed study of the results of modern scientific researches on the processes of carbohydrate metabolism in pathological conditions based on information provided on the Internet. Results. The leading role in the damage to the cellular structures of the body under dicarbonyl stress belongs to glyoxal and methylglyoxal. These substances are formed as by-products of anaerobic glycolysis. Increase in their synthesis is promoted by activation of anaerobic glycolysis and hyperglycemia. Dicarbonyl compounds enter into chemical reactions with amino groups of proteins, nucleic acids and other biologically active compounds, disrupting their functioning. Natural detoxification is carried out by the glyoxalase system with the participation of reduced glutathione, which is the main component of the antioxidant system. The increase in oxidative stress and the appearance of antioxidant deficiency cause an increase in the severity of lesions associated with increased production of glyoxal and methylglyoxal. Prevention of dicarbonyl stress is achieved by increasing the power of the antioxidant system, primarily by increasing the production of reduced glutathione. To neutralize toxic dicarbonyl metabolites, drugs that perform the function of “traps” can be used. The use of therapy aimed at eliminating mitochondrial dysfunction is promising. Conclusions. The emerging problem of damage to the body in conditions of dicarbonyl stress dictates the need for the analysis and reassessment of a variety of intensive care interventions. A detailed study of the characteristics of carbohydrate metabolism in various critical states, including determination of glyoxal and methylglyoxal concentration, monitoring the level of glycemia and clearance of lactate, together with a return to assessing the state of compensation of the prooxidant/antioxidant system of the body, is one of the promising directions for upcoming scientific research in the clinic. Specialists in intensive care face daily situations where dicarbonyl stress can act as one of the real mechanisms for the formation of organ, multi-organ dysfunction and predetermine the development of decompensation of vital functions. Learning to resist him is the actual immediate task.
Ключевые слова
дикарбонільний стрес; анаеробний гліколіз; гліоксаль; метилгліоксаль; глутатіон; антиоксидантна система; мітохондріальна дисфункція
дикарбонильный стресс; анаэробный гликолиз; глиоксаль; метилглиоксаль; глутатион; антиоксидантная система; митохондриальная дисфункция
dicarbonyl stress; anaerobic glycolysis; glyoxal; methylglyoxal; glutathione; antioxidant system; mitochondrial dysfunction
Введение
Термин «гипоксия» подразумевает снижение напряжения кислорода и его объемного содержания в тканях. Дефицит кислорода любого происхождения ассоциирован с уменьшением энергопродукции через угнетение реакция аэробного гликолиза. Реакции цикла трикарбоновых кислот весьма чувствительны к недостатку кислорода и подавляются уже при гипоксии средней степени тяжести. В таких условиях главными путями энергопродукции становятся анаэробный гликолиз и сукцинатный шунт. В то время как особенности реакций сукцинатного типа дыхания до конца не изучены, механизмы анаэробного гликолиза хорошо известны. Конечным его продуктом является молочная кислота. Определение концентрации лактата в крови в состоянии покоя как обособленно, так и в динамике (клиренс лактата) является оценкой тяжести гипоксии и имеет серьезное прогностическое значение в интенсивной терапии [1–3]. Между тем лактат является веществом совершенно не токсичным и успешно метаболизируется, не нанося ущерба организму. У высококлассных ватерполистов концентрация лактата в крови в процессе интенсивной нагрузки возрастает от начальной 1,34 ± 0,35 мМоль/л до 14–16 мМоль/л. У юных велосипедистов и бегунов-аматоров уровень лактата достигает 9–10 мМоль/л. Тем не менее организм подавляющего большинства спортсменов справляется с задачей быстрой утилизации этого продукта обмена весьма успешно, без неблагоприятных последствий.
В клинической практике избыток лактата представляет не более чем маркер наличия и тяжести кислородной задолженности. Повреждения организму наносят совсем другие химические соединения [4–6].
В процессе активации анаэробного гликолиза в организме могут накапливаться вещества, отличные от лактата, несущие в своей химической структуре две карбонильные группы (> С = O), в связи с чем и названы дикарбонильными. Эти вещества обладают значительной цитотоксичностью, повреждая протеины и нарушая процессы тканевого дыхания, инициируют воспаление. Неблагоприятное интегративное действие на организм химических соединений, несущих в себе пару карбонильных групп, в ситуациях, характеризующихся их усиленной продукцией и нарушением инактивации, получило название «дикарбонильный стресс» [7–9].
Цель исследования: выявить основные механизмы дикарбонильного стресса, их значение для формирования критических состояний организма и определить наиболее перспективные способы коррекции для специалистов в области интенсивной терапии.
Материалы и методы
Детальное изучение результатов современных научных исследований процессов углеводного обмена при патологических состояниях. Анализ проведен на основании последней информации, представленной в Интернете на специализированных сайтах для профессионалов биологии и медицины — Frontiersin Neuroscience, Hindawi Publishing Corporation, PLoSOne, Realize Health, Scientific Reports, в журналах «Archives of Physiology and Biochemistry», «Biochemical and Biophysical Research Communications», «Critical Care Medicine», «Free Radical Biology and Medicine», «International Journal of Biochemistry & Cell Biology», «International Journal of Molecular Sciences», «Journal of Neuroscience», «Nature Cell Biology», «Toxicology Research» и других источниках.
Результаты
Из известных дикарбонильных соединений, образующихся в организме в условиях активации анаэробного гликолиза, особое внимание уделяется глиоксалю и метилглиоксалю. Реактивные дикарбонильные соединения, в том числе указанные, образуются в организме в процессе анаэробного гликолиза, глюконеогенеза и перекисного окисления липидов. Основным механизмом действия этих веществ считают гликолизирование протеинов, вследствие чего меняются их свойства и нарушаются функции. Структура белков нарушается при взаимодействии дикарбонильных соединений с аминогруппами. В процесс вовлекаются как белки внутриклеточного протоплазматического матрикса, так и внеклеточные протеины. В свою очередь, измененные протеины активируют клетки сосудистого эндотелия, мезангиальные клетки и макрофаги, продуцирующие активные формы кислорода. Таким образом, дикарбонильные соединения принимают участие в формировании механизмов окислительного стресса [7, 8, 10].
Глиоксаль
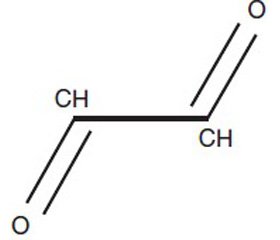
Глиоксаль является простейшим диальдегидом. Он принимает активное участие в гликолизировании протеинов. В качестве маркера наличия и тяжести белковой модификации вследствие гликолизирования используется определение концентрации N-(карбоксиметил)-лизина. Концентрация этого химического соединения бывает высокой при сепсисе и различных критических состояниях. Высокое содержание в крови N-(карбоксиметил)-лизина ассоциировано с увеличением внутрибольничной летальности. Увеличение продукции как N-(карбоксиметил)-лизина, так и близкого к нему по химической структуре N-(карбоксиэтил)-лизина, который накапливается вследствие наличия метилированного производного глиоксаля — метилглиоксаля, ассоциировано с увеличением оценки тяжести пациентов по шкале SOFA и встречается при множестве заболеваний [10–12]. Показано, что кумуляция N-(карбоксиметил)-лизина в астроцитах спинного мозга у страдающих боковым амиотрофическим склерозом была сопряжена с угнетением активности транспортера глутамата, в связи с чем последний накапливался и создавал эффект эксайтотоксичности. Инкубация культур нервных клеток с глиоксалем приводит к угнетению обратного захвата глутамата, вследствие чего его концентрация в межклеточной жидкости также возрастает. Токсичный эффект глиоксаля определяет гибель двигательных нейронов при боковом амиотрофическом склерозе [13]. Примечательно, что глиоксаль представляет не что иное, как один из продуктов превращения (или летального синтеза) в организме этиленгликоля — вещества, обладающего высокой токсичностью и повреждающего центральную нервную систему, а также почки.
/79-1.jpg)
При окислении глиоксаля образуются глиоксиловая кислота СНО—СООН и щавелевая кислота НООС—СООН. Оба соединения относятся к дикарбонильным. Георге Могош утверждает, что из метаболитов этиленгликоля для центральной нервной системы наиболее токсична глиоксиловая кислота [14].
Основная масса глиоксаля подвергается превращению в гликолевую кислоту. Это происходит в основном под действием глиоксалазы-1, наибольшая активность которой отмечена в цитоплазме клеток поджелудочной железы, легких, почек и головного мозга. Активность глиоксалазы-1 фетальных тканей в 3 раза выше, чем в тканях взрослого организма. Конверсия глиоксаля в гликолевую кислоту происходит при участии восстановленного глутатиона. В условиях окислительного стресса, когда отмечается дефицит восстановленного глутатиона, в превращении глиоксаля принимают участие альдегидредуктаза, карбонилредуктаза, альдегиддегидрогенза и 2-оксоальдегиддегидрогеназа. Избыток глиоксаля приводит к активации процессов свободнорадикального окисления и образованию формальдегида. Все это способствует повреждению клеточных мембран. Повреждающее действие глиоксаля может быть уменьшено при использовании для его нейтрализации специальных «ловушек», к которым относят D-пеницилламин, аминогуанидин, аргинин, цистеин и пиридоксимин. Подверженность гепатоцитов к токсическому действию глиоксаля снижается при наличии тиамина. Пока методы защиты с помощью перечисленных веществ не нашли применения в клинической практике. Разработка методов фармакологической детоксикации развивается в других направлениях [8, 10, 15].
/80-1.jpg)
Метилглиоксаль
Метилглиоксаль всегда продуцируется как побочный продукт анаэробного гликолиза. Образование его возрастает вместе с увеличением скорости гликолиза и количеством превращающейся глюкозы. Метилглиоксаль образуется в процессе неферментной деградации глицеральдегида-3-фосфата и дегидрооксиацетона фосфата. Гликолиз поддерживает продукцию метилглиоксаля на уровне 125 мкмоль/кг клеточной массы в сутки при условии нормогликемического состояния. Гипергликемия и активация анаэробного гликолиза при гипоксии определяют значительное увеличение образования метилглиоксаля. В меньшей степени метилглиоксаль образуется в процессе окисления ацетона и других кетоновых тел. Другими путями продукции метилглиоксаля являются окисление аминоацетона при превращении треонина, липидная пероксидация и метаболизм гликолизированных протеинов и моносахаридов. Концентрация метилглиоксаля у здоровых добровольцев в плазме крови составляет 50–150 мкмоль/л, а внутриклеточная — 1–4 ммоль/л. Превышение этих концентраций ассоциируют с развитием дикарбонильного стресса. В физиологическом состоянии более 99 % метилглиоксаля обезвреживаются ферментом глиоксалазой. Соответственно, значительно меньшее количество этого токсичного вещества подвергается превращению под действием альдокеторедуктазы и альдегиддегидрогеназы, в результате чего образуются гидроксиацетон и пировиноградная кислота. Глиоксалазная система включает действие глиоксалазы-1 и -2, которое катализируется восстановленным глутатионом. Конечным продуктом этого процесса является D-лактат. В процессе окислительного стресса концентрация восстановленного глутатиона снижается, темп инактивации метилглиоксаля уменьшается, вследствие чего происходит накопление указанного токсического продукта. Таким образом, окислительный стресс тесно связан с дикарбонильным стрессом [8–10].
Глиоксалазная система защиты нейронов более уязвима, чем защита астроцитов. Внесенный в культуру нейронов в концентрациях 250–750 мкмоль/л метилглиоксаль наносит серьезный ущерб их жизнедеятельности, в то время как концентрация метилглиоксаля, достигающая 1 ммоль/л, не влияет на целостность астроцитов и других глиальных клеток [9, 16]. Токсичность метилглиоксаля обу–словлена активной продукцией и накоплением конечных продуктов гликолизирования, а также участием в механизмах окислительного стресса. Глутатионзависимые антиоксидантные процессы серьезно снижаютcя при культивации нейронных клеток с метилглиоксалем. Внесение антиоксиданта и предшественника образования глутатиона N-ацетилцистеина предотвращает гибель нейронов при наличии метилглиоксаля [9, 17]. Увеличение скорости гликолиза снижает емкость глиоксалазной системы и способствует накоплению метилглиоксаля. Компенсация достигается посредством увеличения окисления глюкозы по пентозофосфатному пути, который участвует в регенерации восстановленного глутатиона посредством образования восстановительного эквивалента в форме восстановленного никотинамидадениндинуклеотидфосфата (НАДФ) [9, 18, 19]. Активация пентозофосфатного пути окисления углеводов стимулируется метионином, вследствие чего увеличивается синтез НАДФ, что способствует превращению окисленного глутатиона в восстановленный. В печени происходит синтез восстановленного глутатиона с участием метионина. В настоящее время препараты, содержащие метионин, рассматриваются в качестве средства защиты от токсического действия метилглиоксаля при дикарбонильном стрессе [20–22].
Патофизиологические последствия дикарбонильного стресса
Агрессивные «медиаторы» дикарбонильного стресса, включая прежде всего глиоксаль и метилглиоксаль, образуются как побочный продукт гликолиза. Таким образом, высокий уровень глюкозы в крови и все ситуации, способствующие развитию гипергликемии (тяжелый стресс, гиперпродукция глюкокортикостероидов и катехоламинов, экзогенное их введение, повышение концентрации моносахаридов в крови в результате их поступления извне в составе растворов глюкозы и фруктозы, дефицит инсулина, гипоксия и др.), предопределяют усиленное накопление глиоксаля и метилглиоксаля. Основной механизм повреждения заключается в гликолизировании протеинов и биологически активных субстанций полипептидного происхождения, в результате чего нарушаются их основные функции по обеспечению нормальной клеточной жизнедеятельности. Снижение функции глиоксалазной системы на фоне окислительного стресса ограничивает возможность естественной детоксикации. Вследствие этого формируются тяжелые нарушения обменных процессов, которые принимают участие в механизмах формирования болезни Альц–геймера и Паркинсона, сахарного диабета, эндотелиальной дисфункции, сосудистой дисфункции, нейродегенерации, хронической почечной недостаточности и старения [8, 10].
Для специалистов в области медицины критических состояний наиболее актуальным механизмом реализации карбонильного стресса является гипоксия. Гипоксия ассоциирована с усиленным высвобождением гормонов стресса, гипергликемией и активацией анаэробного гликолиза. Гипоксия не только способствует угнетению функции глиоксалазной системы, но и через накопление продуктов карбонильного стресса инициирует в организме системную воспалительную реакцию. В условиях дикарбонильного стресса происходят усиление продукции и высвобождение медиаторов воспаления, что предопределяет формирование эндотелиальной и мультиорганной дисфункции [23–25]. Существуют данные о том, что повышение концентрации метилглиоксаля способствует усилению болевой импульсации [26].
Установлено, что метилглиоксаль индуцирует формирование митохондриальной дисфункции. Отмечены увеличение образования супероксидного аниона, радикала оксида азота и истощение запасов восстановленного глутатиона при внесении в культуры клеток метилглиоксаля. При этом возрастает активность ферментов (аминотрансфераз) как один из маркеров мембранного повреждения и цитолиза. При наличии метилглиоксаля патологически возрастает проницаемость митохондриальных мембран, вследствие чего снижается энергопродукция. Выявлено, что метилглиоксаль угнетает активность III митохондриального дыхательного комплекса, переносящего электроны с убихинона на цито–хромы. Вызванный метилглиоксалем клеточный апоптоз блокируется при наличии циклоспорина А, который препятствует увеличению мембранной проницаемости [27–29].
При критических состояниях концентрация дикарбонильных соединений в клетках возрастает вместе с уровнем гипергликемии. Отмечено угнетение активности митохондриальных дыхательных ферментов в условиях экспериментальной ожоговой болезни на 25–62 % при стойком повышении уровня глюкозы в крови [30].
Хроническая инфузия глиоксаля и метилглиоксаля подопытным животным приводит к развитию у них сахарного диабета 2-го типа. В культуре бета-клеток поджелудочной железы были выявлены снижение продукции аденозинтрифосфата, потребления кислорода и активация процессов апоптоза при инкубации с метилглиоксалем [31].
Перспективы коррекции
Направления коррекции очевидны, поскольку определяются необходимостью устранения гипоксии любого происхождения, что подразумевает:
— оптимизацию функции внешнего дыхания и ее протезирование в случаях неэффективности с дополнительным использованием кислорода;
— поддержание эффективного сердечного выброса и перфузионного давления вместе с мероприятиями, направленными на увеличение количества функционирующих капилляров и улучшение реологии крови;
— обеспечение эффективной кислородной емкости крови вместе с профилактикой образования патологических форм гемоглобина;
— применение препаратов, способствующих улучшению функции тканевого дыхания.
Немаловажным аспектом является мониторинг уровня гликемии с проведением ее жесткой коррекции для достижения нормогликемического состояния. Возможны длительные дискуссии при оказании помощи пациентам, нуждающимся в повышенном энергетическом обеспечении, которое ассоциировано с применением большого количества углеводов.
Интенсивная терапия должна включать мероприятия по поддержанию достаточной мощности антиокислительной системы организма, что предполагает применение препаратов, способствующих увеличению пула восстановленного глутатиона, который называют «матерью всех антиоксидантов». Увеличению синтеза глутатиона способствует включение в схемы лечения N-ацетилцистеина, липоевой кислоты. Рециркуляции глутатиона способствуют препараты селена, фолиевая кислота, особенно в активной форме 5-метилтетрагидрофолата, а также активные формы витаминов В6 и В12 — пиридоксальфосфат и метилкобаламин. Альфа-токоферол и витамин С не только «работают» совместно с восстановленным глутатионом, но и значительно снижают его расходование в процессе реализации антиоксидантной защиты. Такими же свойствами обладают некоторые флавоноиды, например силибинин [32, 33]. Применение флавоноидов способствует уменьшению гликолизации и препятствует формированию митохондриальной дисфункции. Отмечено снижение содержания конечных продуктов гликолизирования при использовании в качестве «ловушек» для глиоксаля (50,5 %) и метилглиоксаля (80,1 %) флавоноида кверцетина. Проявления митохондриальной дисфункции и апоптоза уменьшались при наличии катехина [34, 35]. В исследовании М. Xue (2016) у 32 пациентов с ожирением, находящихся на обогащенной углеводами диете, было установлено, что применение фитоалексина ресвератрола и флавоноида гесперидина обеспечивало повышение на 22 % активности глиоксалазы-1, снижало уровень гликемии, концентрацию метилглиоксаля в плазме на 37 % и имело преимущество перед применением метформина [36].
Еще одним путем профилактики развития карбонильного и окислительного стресса, как указывалось выше, является применение метионина. Для защиты важен не только сам метионин, но и его метаболит S-аденозилметионин, который синтезируется из фолата, метионина и витамина В12. S-аденозилметионин предоставляет большое количество метильных групп для фосфатидилэтаноламин-N-метилтрансферазы, поставляющей фосфатидилхолин для построения клеточных мембран. Образовавшийся при этом S-аденозилгомоцистеин через цепь реакций гидролиза и трансметилирования вновь превращается в метионин или с участием пиридоксальфосфата используется для образования глутатиона. Стимуляция метионином пентозофосфатного пути окисления углеводов способствует накоплению восстановленного глутатиона [20, 21, 37].
В работе P.B. LiPun (2014), построенной на –изучении митохондриальных обменных процессов с помощью масс-спектрометрии, было установлено, что на фоне дикарбонильного стресса потенциал митохондриальной мембраны возрастал после внесения в среду сукцината и ожидаемо снижался при использовании разобщающего окислительное фосфорилирование карбонилцианида [38]. Таким образом, определенную перспективу в профилактике дикарбонильного стресса представляет новый кристаллоидный раствор для инфузионной терапии, в состав которого включены сукцинат, метионин и одно из аденозиновых производных — инозин. Наш начальный опыт его клинического применения включает в основном позитивные результаты при оказании помощи пациентам с синдромом мультиорганной дисфункции.
Обсуждение
В практике специалистов по интенсивной терапии потенциально существует значительное количество случаев, когда интенсификация образования токсичных дикарбонильных метаболитов может серьезно повлиять на развитие критических состояний и исход заболевания. Все состояния, характеризующиеся развитием гипоксии, а значит, активацией процессов анаэробного гликолиза, могут быть ассоциированы с усиленной продукцией глиоксаля и метилглиоксаля. Нарушению обменных процессов, безусловно, способствуют развитие стрессовой гипергликемии в ответ на усиленный выброс контринсулярных гормонов и активацию катаболических процессов, множество мероприятий интенсивной терапии, таких как терапия глюкокортикостероидами, продолжительные непрерывные инфузии симпатомиметиков, парентеральное и энтеральное питание с включением большого количества глюкозы, применение несбалансированных аминокислотных растворов, препаратов со свойствами прооксидантов, разобщителей окислительного фосфорилирования. Пока последствия накопления токсических метаболитов дикарбонильного стресса в клинической практике недостаточно изучены. Поэтому в каждом конкретном случае трудно будет дать адекватную прогностическую оценку. Для прояснения вопроса об определении тяжести дикарбонильного стресса и ее связи с последующими клиническими вариантами течения заболеваний необходимы дальнейшие исследования.
Выводы
Открывающаяся проблема повреждения организма в условиях дикарбонильного стресса диктует необходимость анализа и переоценки множества мероприятий интенсивной терапии. Детальное –изучение особенностей углеводного обмена при различных критических состояниях, включая определение концентрации глиоксаля и метилглиоксаля, мониторинг уровня гликемии и клиренса лактата в сочетании с возвращением к оцениванию состояния компенсации функции прооксидантной/антиоксидантной системы организма, представляет одно из перспективных направлений предстоящих научных исследований в клинике. Специалисты по интенсивной терапии ежедневно сталкиваются с ситуациями, когда дикарбонильный стресс может выступать в качестве одного из действительных механизмов формирования органной, мультиорганной дисфункции и предопределять развитие декомпенсации жизненно важных функций. Научиться противостоять ему — актуальная ближайшая задача.
Конфликт интересов. Авторы статьи заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Lukyanova L.D., Kirova Y.I. Mitochondria-Controlled Signaling Mechanismsof Brain Protectionin Hypoxia [Electronic resource] / L.D. Lukyanova, Y.I. Kirova // Frontiersin Neuroscience. — 2015. — Vol. 9. — Article 320. — Access mode: https://pdfs.semanticscholar.org/afa0/4188911b94b9561da7f741a0c2c36d24e98c.pdf (last access: 24.03.17).
2. Wheaton W.W., Chandel N.S. Hypoxia 2: Hypoxia Regu–lates Cellular Metabolism / W.W. Weaton, N.S. Chandel // American Journal of Physiology: Cell Physiology. — 2011. — Vol. 300, № 3. — C. 385-393.
3. Solaina G., Baracca A., Lenaz G. et al. Hypoxia and Mitochondrial Oxidative Metabolism / G. Solaina, A. Baracca, G. Lenaz et al. // Biochimica et Biophysica Acta Bioenergetics. — 2010. — Vol. 1797, № 6–7. — P. 1171-1177.
4. Takagi H., Murase Y., Minami T. et al. Lactate Production and Clearance during High Intensity Swimming Test in Elite Water-Polo Players / H. Takagi, Y. Murase, T. Minami et al. // Bulletin of Faculty of Health and Sport Sciences. — 2013. — Vol. 36, № 1. — P. 77-84.
5. Melchiorri G.,Castagna C.,Sorge R. et al. Game Activity and Blood Lactate in Men's Elite Water-Polo Players / G. Melchiorri, C. Castanga, R. Sorge et al. // The Journal of Strength & Conditioning Research. — 2010. — Vol. 24, № 10. — P. 2647-2651.
6. Rapoport B.I. Metabolic Factors Limiting Performance in Marathon Runners [Electronic resource] / B.I. Rapoport // PLoS One; Computational Biology. — 2010. — Vol. 6, № 10. — e1000960. — Access mode: http://journals.plos.org/ploscompbiol/article?id=10.1371/journal.pcbi.1000960 (last access: 24.03.17).
7. Van Bussel B.C.T., van der Poll M.C.G., Schalkwijk C.G. et al. Increased Dicarbonyl Stress as a Novel Mechanism of Multi-Organ Failure in Critical Illness / B.C.T. van Bussel, M.C.G. van der Poll, C.G. Schalkwijk et al. // International Journal of Molecular Sciences. — 2017. — Vol. 18. — P. 346.
8. Nigro C., Leone A., Raciti G.A. et al. Methylglyoxal-Glyoxalase 1 Balance: The Root of Vascular Damage / C. Nigro, A. Leone, G.A. Raciti et al. // International Journal of Molecular Sciences. — 2017. — Vol. 18. — P. 188.
9. Allaman I., Belanger M., Magistretti P.J. Methylglyoxal, the Dark Side of Glycolysis [Electronic resource] / I. Allaman, M. Belanger, P.J. Magistretti // Frontiers in Neuroscience. — 2015. — Vol. 9. — P. 23. — Access mode:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4321437/ (last access: 24.03.17).
10. Rabbani N., Thornalley P.J. Dicarbonyl Stress in Cell and Tissue Dysfunction Contributing to Ageing and Disease / N. Rabbani, P.J. Thornalley // Biochemical and Biophysical Research Communications. — 2015. — Vol. 458, № 2. — P. 221-226.
11. Meertens J.H., Nienhuis H.L., Lefrandt J.D. et al. The Course of Skin and Serum Biomarkers of Advanced GlycationEndproducts and Its Association with Oxidative Stress, Inflammation, Disease Severity, and Mortality during ICU Admission in Critically Ill Patients: Results from a Prospective Pilot Study [Electronic resource] / J.H. Meertens, H.L. Nienhuis, J.D. Lefrandt et al. // PLoS One. — 2016. — Vol. 11, № 8. — e0160893. — Access mode: https://www.ncbi.nlm.nih.gov/pubmed/27529340 (last access: 31.03.17).
12. Vincent J.L., de Mendonca A., Cantraine F. et al. Use of the SOFA Score to Assess the Incidence of Organ Dysfunction/Failure in Intensive Care Units: Results of a Multicenter, Prospective Study. Working Group on «Sepsis-Related Problems» of the EuropeanSociety of Intensive Care Medicine / J.L. Vincent, A. de Mendonca, F. Cantraine et al. // Critical Care Medicine. — 1998. — Vol. 26. — P. 1793-1800.
13. Kawaguchi M., Shibata N., Horiuchi S. et al. Glyoxal Inactivates Glutamate Transporter-1 in Cultured Rat Astrocytes / M. Kawaguchi, N. Shibata, S. Shibata et al. // Neuropatho–logy. — 2005. — Vol. 25, № 1. — P. 27-36.
14. Могош Г. Острые отравления. Диагноз. Лечение: Пер. с рум. / Г. Могош — Бухарест: Медицинское издательство, 1984. — С. 452-453.
15. Lange J.N., Wood K.D., Knight J. et al. Glyo–xal Formation and Its Role in Endogenous Oxalate Synthesis [Electronic resource] / J.N. Lange, K.D. Wood, J. Knight et al. // Hindawi Publishing Corporation; Advances in Uro–logy. — 2012. — Vol. 2012. — ID 819202. — Access mode: doi:10.1155/2012/819202 (last access: 28.03.17).
16. Hansen F., de Souza D.F., SilveiraSda L. at al. Methylglyoxal Alters Glucose Metabolism and Increases AGEs Content in C6 Glioma Cells / F. Hansen, D.F. de Souza, L. SilveiraSda et al. // Metabolic Brain Disease. — 2012. — Vol. 27, № 4. — P. 531-539.
17. Di Loreto S., Zimmitti V., Sebastiani P. et al. Methylglyoxal Causes Strong Weakening of Detoxifying Capacity and Apoptotic Cell Death in Rat Hippocampal Neurons / S. Di Loreto, V. Zimmitti, P. Sebastiani et al. // The International Journal of Biochemistry & Cell Biology. — 2008. — Vol. 40, № 2. — P. 245-257.
18. Bélanger M., Yang J., Petit J.M. et al. System in Astrocyte-Mediated Neuroprotection / M. Belanger, J. Yang, J.M. Petit et al. // Journal of Neuroscience. — 2011. — Vol. 31, № 50. — P. 18338-18352.
19. Herrero-Mendez A., Almeida A., Fernández E. et al. The Bioenergetic and Antioxidant Status of Neurons Is Controlled by Continuous Degradation of a Key Glycolytic Enzyme by APC/C-Cdh1 / A. Herrero-Mendez, A. Almeida, E. Fernandez et al. // Nature Cell Biology. — 2009. — Vol. 11, № 6. — P. 747-752.
20. Campbell K., Vowinckel J., Keller M.A. et al. Methionine Metabolism Alters Oxidative Stress Resistance via the Pentose Phosphate Pathway / K. Campbell, J. Vowinckel, M.A. Keller et al. // Antioxidants & Redox Signaling. — 2016. — Vol. 24, № 10. — P. 543-547.
21. Luo S., Levine R.L. Methionine in Proteins Defends against Oxidative Stress / S. Luo, R.L. Levine // The FASEB Journal. — 2009. — Vol. 23, № 2. — P. 464-472.
22. Bianchi G., Brizi M., Rossi B. et al. Synthesis of Glutathione in Response to Methionine Load in Control Subjects and in Patients with Cirrhosis / G. Bianchi, M. Brizi, B. Rossi et al. // Metabolism. — 2000. — Vol. 49, № 11. — P. 1434-1439.
23. Rabbani N., Xue M., Thornalley P.J. Methylglyoxal-Induced Dicarbonyl Stress in Aging and Disease: First steps towards Glyoxalase 1-Based Treatments / N. Rabbani, M. Xue, P.J. Thornalley // Clinical Science. — 2016. — Vol. 130, № 19. — P. 1677-1696.
24. Celec P., Jurkovičová I., Buchta R. et al. Antioxidant Vitamins Prevent Oxidative and Carbonyl Stress in an Animal Model of Obstructive Sleep Apnea / P. Celec, I. Jurkovicova, R. Buchta et al. // Sleep and Breathing. — 2013. — Vol. 17, № 2. — P. 867-871.
25. Xiao H., Gu Z., Wang G. et al. The Possible Mechanisms Underlying the Impairment of HIF-1α Pathway Signaling in Hyperglycemia and the Beneficial Effects of Certain Therapies / H. Xiao, Z. Gu, G. Wang et al. // International Journal of Medical Sciences. — 2013. — Vol. 10, № 10. — P. 1412-1421.
26. Andersson D.A., Gentry C., Light E. et al. Methylglyo–xal Evokes Pain by Stimulating TRPA1 [Electronic resource] / D.A. Andersson, C. Gentry, E. Light et al. // PLoS One. — 2013. — Vol. 8, № 10. — e77986. — Access mode: doi: 10.1371/journal.pone.0077986 (last access: 31.03.17).
27. Seo K., Ki S.H., Shin S.M. Methylglyoxal Induces Mitochondrial Dysfunction and Cell Death in Liver / K. Seo, S.H. Ki, S.M. Shin // Toxicology Research. — 2014. — Vol. 30, № 3. — P. 193-198.
28. Suh K.S., Choi E.M., Rhee S.Y. et al. Methylglyoxal Induces Oxidative Stress and Mitochondrial Dysfunction in Osteoblastic MC3T3-E1 Cells [Electronic resource] / K.S. Suh, E.M. Choi, S.Y. Rhee et al. // Free Radical Research. — 2014. — Vol. 48, № 2. — P. 206-217. — Access mode: http://dx.doi.org/–10.3109/10715762.2013.859387 (last access: 31.03.17).
29. Wang H., Liu J., Wu L. Methylglyoxal-Induced Mitochondrial Dysfunction in Vascular Smooth Muscle Cells / H. Wang, J. Liu, L. Wu // Biochemical Pharmacology. — 2009. — Vol. 77, № 11. — P. 1709-1716.
30. Vanhorebeek I., Ellger B., De Vos R. et al. Tissue-Specific Glucose Toxicity Induces Mitochondrial Damage in a Burn Injury Model of Critical Illness / I. Vanhorebeek, B. Ellger, R. de Vos et al. // Critical Care Medicine. — 2009. — Vol. 37, № 4. — P. 1355-1364.
31. Chang T.J., Tseng H.C., Liu M.W. et al. Glucagon-Like Peptide-1 Prevents Methylglyoxal-Induced Apoptosis of Beta Cells through Improving Mitochondrial Function and Suppressing Prolonged AMPK Activation [Electronic resource] / T.J. Chang, H.C. Tseng, M.W. Liu et al. // Scientific Reports. — 2016. — Vol. 6. — Article 23403. — Access mode:http://www.nature.com/articles/srep23403 (last access: 31.03.17).
32. Hyman M. Glutathione: The Mother of All Antioxidants [Electronic resource] / M. Hyman // The Huffington Post. — Access mode: http://www.huffingtonpost.com/dr-mark-hyman/glutathione-the-mother-of_b_530494.html (last access: 31.03.17).
33. Ezhilarasan D., Karthikeyan S. Silibinin Alleviates N-nitrosodimethylamine-Induced Glutathione Dysregulation and Hepatotoxicity in Rats / D. Ezhilarasan, S. Karthikeyan // Chinese Journal of Natural Medicine. — 2016. — Vol. 14, № 1. — P. 40-47.
34. Li X., Zheng T., Sang S. et al. Quercetin Inhibits Advanced Glycation End Product Formation by Trapping Methyl–glyoxal and Glyoxal / X. Li, T. Zheng, S. Sang [et al.] // Journal of Agricultural and Food Chemistry. — 2014. — Vol. 62, № 50. — P. 12152-12158.
35. Zhang T., Mu Y., Yang M. et al. Catechin Prevents Methy–lglyoxal-Induced Mitochondrial Dysfunction and Apoptosis in EA.hy926 Cells / T. Zhang, Y. Mu, M. Yang et al. // Archives of Physiology and Biochemistry. — 2016. — Vol. 123, № 2. — P. 121-127.
36. Xue M., Weickert M.O., Qureshi S.A. et al. Improved Glycemic Control and Vascular Function in Overweight and Obese Subjects by Glyoxalase 1 Inducer Formulation [Electronic resource] / M.Xue, M.O.Weickert, S.A.Qureshi [et al.] // Diabetes; The University of Warwick. — Access mode: http://wrap.warwick.ac.uk/79041/3/WRAP_Thornalley_0670584-mv-120516-db16-0153.full.pdf (last access: 31.03.17).
37. Lambert E. Glucose Metabolism: Glycation and Methy–lation [Electronic resource] / E. Lambert // Realize Health. — Access mode: https://www.realizehealth.com.au/2015/08/18/glucose-metabolism-glycation-and-methylation/ (last access: 31.03.17).
38. Li Pun P.B., Logan A., Darley-Usmar V. et al. A Mitochondria-Targeted Mass Spectrometry Probe to Detect Glyoxals: Implications for Diabetes / P.B. Li Pun, A. Logan, V. Darley-Usmar et al. // Free Radical Biology and Medicine. — 2014. — Vol. 67, № 100. — P. 437-450.

/79-1.jpg)
/80-1.jpg)