Резюме
Актуальність. Серед механізмів, що призводять до розвитку і погіршення перебігу цукрового діабету (ЦД) 1-го типу і його ускладнень, значна роль належить інтенсифікації окисного стресу. В розвитку багатьох пізніх ускладнень ЦД, зокрема мікро- і макроангіопатій, нефропатії та інших, одним із основних патогенетичних механізмів є окислювальний стрес. Мета: оцінити вплив фітопрепарату BNO 1030 на про-/антиоксидантний статус крові при експериментальному ЦД 1-го типу. Матеріали і методи. Дослідження були проведені на інтактних щурах-самцях лінії Wistar, у яких моделювали експериментальний ЦД 1-го типу. Продукцію активних форм кисню (АФК) в лейкоцитах крові вимірювали, використовуючи 2’,7’-дихлорфлуоресцеїн діацетат. Вміст живих, апоптотичних і некротичних лейкоцитів визначали, використовуючи анексин V, кон’югований з GFP (green fluorescent protein) і РІ (Propidium iodidi). Результати. На тлі зниження маси тіла і підвищення концентрації глюкози в крові діабетичних тварин встановлено посилене утворення активних форм кисню порівняно з контрольною групою тварин, що свідчить про інтенсифікацію окисного стресу. У цих умовах знижувалася активність супероксиддисмутази (СОД), що свідчить про порушення регуляції між про- і антиоксидантними процесами. Висновки. Введення препарату BNO 1030 тваринам при експериментальному ЦД 1-го типу призводило до незначної інтенсифікації вироблення АФК як в контрольній, так і в діабетичній групі, проте його прийом підвищував життєздатність імунних клітин, запобігаючи їх загибелі. Застосування препарату BNO 1030 сприяло підвищенню активності СОД на 10 % порівняно з групою діабетичних тварин.
Актуальность. Среди механизмов, которые приводят к развитию и ухудшению течения сахарного диабета (СД) 1-го типа и его осложнений, значительная роль принадлежит интенсификации окислительного стресса. В развитии многих поздних осложнений СД 1-го типа, в частности микро- и макроангиопатий, нефропатии и других, одним из основных патогенетических механизмов является окислительный стресс. Цель: оценить влияние фитопрепарата BNO 1030 на про-/антиоксидантный статус крови при экспериментальном СД 1-го типа. Материалы и методы. Исследования проведены на интактных крысах-самцах линии Wistar, у которых моделировали экспериментальный СД 1-го типа. Продукцию активных форм кислорода (АФК) в лейкоцитах крови измеряли, используя 2’,7’-дихлорфлуоресцеин диацетат. Содержание живых, апоптотических и некротических лейкоцитов определяли, используя аннексин V, конъюгированный с GFP (green fluorescent protein) и РI (Propidium iodide). Результаты. На фоне снижения массы тела и повышения концентрации глюкозы в крови диабетических животных установлено усиленное образование активных форм кислорода по сравнению с контрольной группой животных, что свидетельствует об интенсификации окислительного стресса. В этих условиях снижалась активность супероксиддисмутазы (СОД), что свидетельствует о нарушении регуляции между про- и антиоксидантными процессами. Выводы. Введение препарата BNO 1030 животным при экспериментальном СД 1-го типа приводило к незначительной интенсификации выработки АФК как в контрольной, так и в диабетической группе, однако его влияние повышало жизнеспособность иммунных клеток, предотвращая их гибель. Применение препарата BNO 1030 способствовало повышению активности СОД на 10 % по сравнению с группой диабетических животных.
Background. Among the mechanisms that lead to the development and deterioration of the diabetes mellitus type 1 (DM1) and its complications, an important role belongs to the intensification of oxidative stress. In the development of many late complications of DM1, in particular, micro- and macroangiopathies, nephropathy and others, oxidative stress is one of the main pathogenetic mechanisms. Objective. To evaluate the effect of phytopreparation BNO 1030 on pro/antioxidant status of the blood in experimental type 1 diabetes mellitus. Materials and methods. The studies were performed on intact male Wistar rats, in which experimental DM1 was modeled. The production of reactive oxygen species in the blood was measured using 2’,7’-dichlorofluorescein diacetate. The content of living, apoptotic and necrotic leukocytes was determined using annexin V conjugated with GFP (green fluorescent protein) and PI (propidium iodide). Results. Against the background of a decrease in body weight and an increase in the concentration of glucose in the blood of diabetic animals, an enhanced formation of reactive oxygen species was established in comparison with the control group of animals that indicates an intensification of the oxidative stress. Under these conditions, the activity of superoxide dismutase decreased, which indicates a violation of regulation between pro- and antioxidant processes. Conclusions. Administration of BNO 1030 to animals with experimental DM1 resulted in the slight intensification of the production of reactive oxygen species both in the control and in the diabetic group, but its effect increased the viability of immune cells, preventing their death. The use of BNO 1030 resulted in an increase of the activity of superoxide dismutase by 10 % compared to the group of diabetic animals.
Введение
На сегодняшний день определение механизмов, лежащих в основе развития сахарного диабета 1-го типа (СД1), — чрезвычайно актуальная медико-социальная проблема, поскольку данное заболевание приводит к ранней инвалидизации и высокой летальности, которые в первую очередь обусловлены осложнениями сердечно-сосудистой системы. Основным фактором, инициирующим развитие сосудистых осложнений при СД1, является хроническая гипергликемия. Известно, что среди механизмов, приводящих к развитию и усилению течения СД1 и его осложнений, значительная роль принадлежит интенсификации окислительного стресса. В этих условиях происходит чрезмерное образование активных форм кислорода (АФК) и усиление процессов аутоокисления глюкозы. При этом в организме возникает нарушение баланса между прооксидант–ными процессами и системой антиоксидантной
защиты [2]. АФК, образующиеся в физиологических условиях, принимают участие в регуляторных процессах, являются сигнальными молекулами, влияют на активность некоторых протеиназ и фосфатазы, а также на экспрессию генов [11]. Однако вследствие их чрезвычайно высокой активности, еще и в чрезмерных концентрациях, АФК способны вызвать нарушения метаболизма клеток в результате развития окислительного стресса, что приводит к нарушению процессов мембранного транспорта, изменению активности ферментов, генных мутаций, повреждению структуры белков, липидов и т.д. [1]. Более того, окислительный стресс, индуцированный гипергликемией, запускает механизмы повреждения β-клеток и тем самым ускоряет развитие и прогрессирование СД1. Доказано, что
в развитии многих поздних осложнений СД1, в частности микро- и макроангиопатий, нефропатии и других, одним из основных патогенетических механизмов является окислительный стресс [8, 12]. Поэтому необходима постоянная регуляция количества выработки АФК с целью поддержания их уровня в физиологических пределах, необходимых для функционирования клеток в организме человека и животных. Такую регуляцию от пагубного воздействия сверхпроизводства АФК, обеспечивая торможение окислительно-свободнорадикальных реакций и предотвращая окисление биологически активных соединений в организме, выполняет антиоксидантная система защиты (АОС). Основные звенья этой системы — ферментативная и неферментативная. Одним из основных компонентов ферментативной системы АОС является ее ключевой фермент — супероксиддисмутаза (СОД). СОД катализирует превращение супероксидного анионрадикала с образованием пероксида водорода с последующим образованием кислорода и воды. Высокая активность СОД обнаружена в печени, сердце, а также в эритроцитах крови [6, 10].
Известно, что нарушения основных путей метаболизма в организме, возникающие при развитии СД, тесно связаны с ослаблением функционирования иммунной системы [3]. Повышенную восприимчивость к инфекциям у пациентов с СД1 связывают с нарушениями защитных функций организма в результате подавленного иммунитета, усиленной клеточной адгезии микроорганизмов, склонности к катаболическим процессам. Особенно сложным является лечение СД1 при его коморбидности с другими хроническими заболеваниями, например такими, как хронический тонзиллит (ХТ). В таких условиях ХТ усиливает метаболические нарушения, индуцированные СД1, что приводит к декомпенсации углеводного обмена и кетоацидоза, что, в свою очередь, ухудшает течение патологического процесса в небных миндалинах [5]. Поэтому большое значение в клинике лечения СД1 при наличии ХТ имеет комплексная терапия с применением современных иммунореабилитационных препаратов.
Среди средств неспецифической иммунофармакотерапии особый интерес с точки зрения клинической эффективности представляет комбинированный растительный препарат BNO 1030, в состав которого входят активные компоненты корня алтея, цветков ромашки, травы хвоща полевого, листьев ореха, травы тысячелистника, коры дуба, травы одуванчика лекарственного. Благодаря этим компонентам препарат обладает выразительным иммуномодулирующим действием, направленным на активацию звена неспецифической иммунной защиты (увеличение количества и активности фагоцитов, киллерной защиты), а также восстановление антителообразования в условиях иммуносупрессии [7].
Цель исследования — оценить влияние препарата BNO 1030 на про-/антиоксидантный статус крови при экспериментальном сахарном диабете 1-го типа.
Материалы и методы
Исследования проведены на интактных крысах-самцах линии Wistar массой тела 140–150 г, у которых моделировали экспериментальный СД1. Содержание животных и проведение экспериментов осуществляли в соответствии с общепринятыми международными требованиями Европейской конвенции по защите животных, используемых в экспериментальных исследованиях и других научных целях (Страсбург, 1986), и согласно соответствующим национальным положениям о проведении экспериментальных работ. Животных, которые были разделены на 4 группы, удерживали на стандартном рационе вивария со свободным доступом к пище и воде. Экспериментальный СД1 у крыс индуцировали путем однократного внутрибрюшинного введения стрептозотоцина (Sigma-Aldrich Co LLC, США) в дозе 55 мг/кг массы тела, который растворяли в 0,1 M цитратном буфере, рН 4,5, непосредственно перед его введением животным. Крысам контрольной группы такого же возраста внутрибрюшинно вводили 0,5 мл 0,1 М цитратного буфера, рН 4,5. После четырех недель развития диабета крысам в течение 14 дней три раза в сутки per os вводили препарат BNO 1030 в дозе 0,05 мл/животное, которая была рассчитана согласно рекомендациям к применению суточной дозы для детей старше 12 лет и взрослых и с учетом коэффициентов видовой устойчивости человека и крыс (0,45 и 1,89 соответственно).
Лейкоциты получали в день эксперимента из периферической крови подопытных животных путем осмотического шока мембран эритроцитов. Для этого гепаринизированную кровь смешивали с холодным лизирующим раствором (0,15 моль/л NH4Cl, 1 ммоль/л KHCO3, 0,1 ммоль/л ЭДTA, pH 7,2–7,4) в соотношении 1 : 20 и после тщательного встряхивания инкубировали в течение 10 мин при 37 °С. По истечении времени лизиса эритроцитов образцы центрифугировали (400 g, 5 мин) для осаждения лейкоцитов. Супернатант удаляли, а осадок дважды промывали физиологическим раствором путем центрифугирования (400 g, 5 мин). Промытый осадок ресуспендировали в концентрации 2 × 106 кл/мл в фосфатно-солевом буфере PBS (Phosphate buffered saline, pH 7,2). Сыворотку крови получали центрифугированием цельной крови на центрифуге Еppendorf 5810R (США) при 1300 g в течение 7 мин при 22 °С. До использования сыворотку крови хранили при –72 °С.
Продукцию АФК в лейкоцитах крови измеряли, используя 2’,7’-дихлорфлуоресцеин диацетат (2′,7′-Dichlorofluorescin diacetate, Sigma-Aldrich) в конечной концентрации 25 мкмоль/л (рис. 1) [9].
Содержание живых, апоптотических и некротических лейкоцитов детектировали, используя аннексин V, конъюгированный с GFP (green fluorescent protein) и РI (Propidium iodide, Sigma-Aldrich, США). Для этого клетки ресуспендировали в 1 мл аннексин-связывающего буфера (10 моль/л Hepes, 140 моль/л NaCl, 2,5 моль/л CaCl2) и осаждали при 400 g в течение 7 мин. Удаляли надосадочную фракцию, а клетки ресуспендировали в 500 мкл аннексин-связующего буфера с добавлением аннексин-GFP в конечной концентрации 0,6 мкг/мл и РI в конечной концентрации 5,0 мкг/мл. Образцы перемешивали на вортексе и инкубировали при комнатной температуре в течение 15 мин. После этого образцы были проанализированы с помощью цитофлуориметра COULTER EPICS XL. Флуоресцентные сигналы исследуемых образцов регистрировали с каналом FL1 (515–535 нм) для GFP и FL3 (620–630 нм) — для РI (рис. 2). Было проанализировано более 20 000 событий с каждого образца. Обработку результатов проводили с помощью программы FCS Express V3.
Активность супероксиддисмутазы (СОД) определяли микропланшетным методом, общий объем пробы составлял 0,25 мл. К 200 мкл свежеприготовленной смеси (0,1 ммоль/л ЭДТА, 62 ммоль/л НСТ (нитросиним тетразола), 294 ммоль/л NADH в 50 ммоль/л фосфатном буфере, рН 7,4) добавляли 25 мкл образца. Реакцию запускали добавлением 25 мкл свежеприготовленного 33 ммоль/л PMS (phenazine methosulfate) в 50 ммоль/л фосфатном буфере, рН 7,4, содержащего 0,1 ммоль/л ЭДTA. Экстинкцию измеряли при длине волны 560 нм. Сравнение активности СОД при СД1 и при действии препарата осуществляли по отношению к контролю, который принимали за 100 %.
Результаты
При применении указанного выше способа моделирования СД1 удалось воссоздать полную клиническую картину этого заболевания в исследуемой группе диабетических животных. Так, если в начале проведения экспериментов масса тела животных и концентрация глюкозы в крови были практически одинаковы во всех исследуемых группах, то через шесть недель развития СД1 масса тела диабетических крыс снизилась на 19 %, а уровень глюкозы в крови повысился в 2,3 раза по сравнению с конт–рольными животными, что является подтверждением развития у животных некомпенсированной гипергликемии.
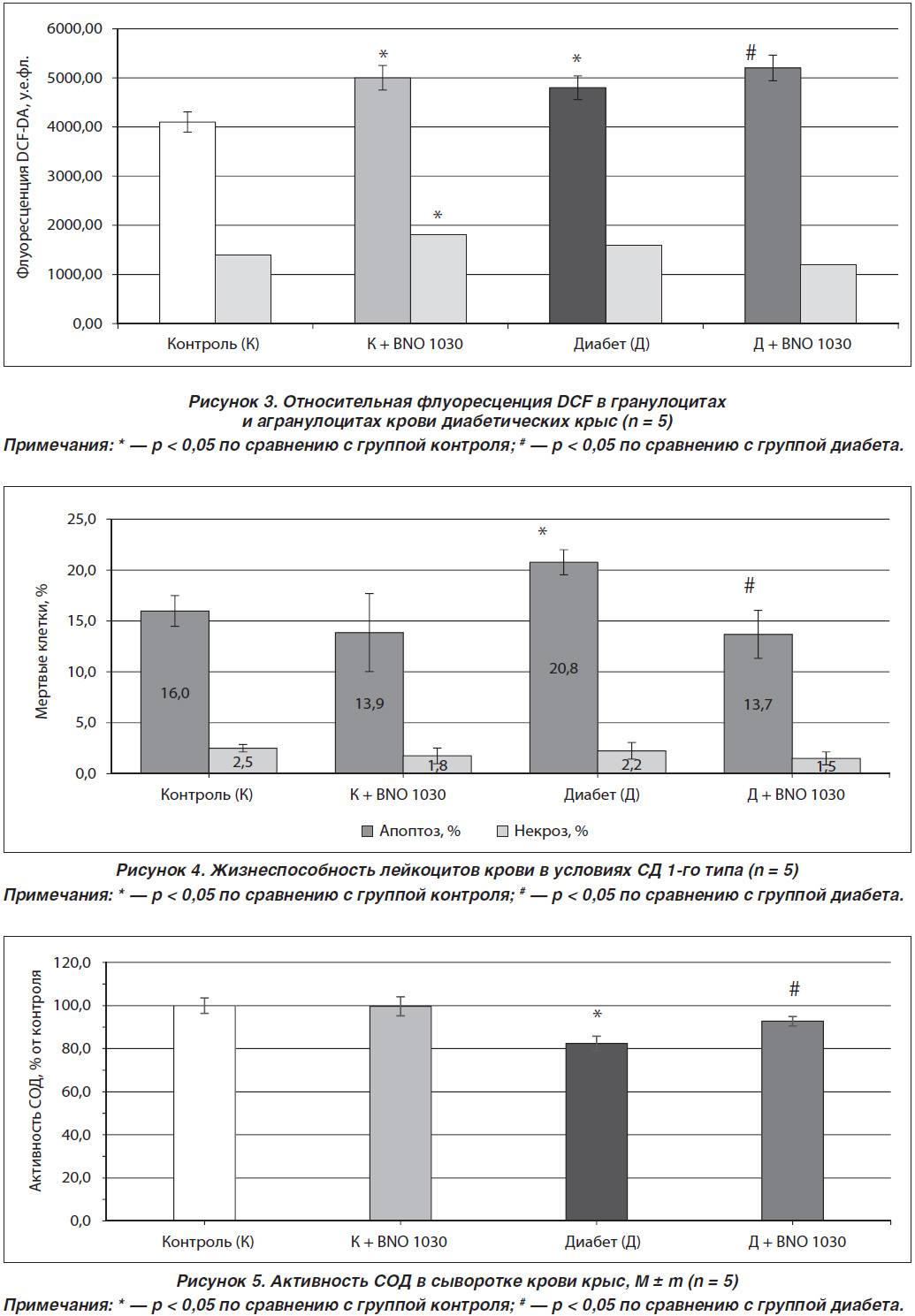
При анализе уровня АФК в лейкоцитах крови было обнаружено, что у диабетических крыс их уровень в гранулоцитах увеличивается на 17 % по сравнению с группой контрольных животных. Однако уровень АФК в агранулоцитах крови диабетических крыс не менялся и был таким, как и в контрольной группе. Полученные данные свидетельствуют о том, что на фоне гипергликемии, индуцированной СД1, происходит усиленное образование АФК, которые запускают развитие окислительного стресса и повышают скорость окисления глюкозы. Эти данные согласуются с результатами других исследователей, которые показали, что существует связь между развитием окислительного стресса в лейкоцитах, уровнем глюкозы в крови, артериальным давлением и С-реактивным белком [10]. Уровень АФК в гранулоцитах крови диабетических крыс, которым был введен препарат BNO 1030, увеличивался на 8 %, в то время как в агранулоцитах снижался на 5 % по сравнению с группой диабетических животных без введения данного препарата (рис. 3).
Обсуждение
На фоне интенсификации окислительного стресса целесообразным было выяснить состояние системы антиоксидантной защиты. При определении активности ключевого фермента АОС, СОД, было установлено, что ее активность в сыворотке крови диабетических крыс снижалась на 17,6 %, что свидетельствует о том, что продукция супер–оксидных радикалов (O2) значительно превышает функциональную способность фермента (рис. 5). Введение препарата BNO 1030 в течение двух недель диабетическим крысам приводило к частичному повышению активности СОД, что свидетельствует о его протекторном действии на состояние АОС.
Выводы
1. Полученные результаты исследований имеют важное клиническое значение, поскольку свидетельствуют о том, что комбинированный растительный препарат BNO 1030 способствует обеспечению эффективной поддержки иммунной системы в условиях СД1.
2. Введение препарата BNO 1030 животным при экспериментальном СД1 приводило к незначительной интенсификации выработки АФК как в конт–рольной, так и в диабетической группе, однако его влияние повышало жизнеспособность иммунных клеток, предотвращая их гибель.
3. Применение препарата BNO 1030 способствовало повышению активности СОД на 10 % по сравнению с группой диабетических животных, что дает основание считать, что среди составляющих этого препарата имеются соединения, которые обладают антиоксидантным действием и подавляют усиленное образование супероксидных радикалов, индуцированных СД1.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждения.
Список литературы
1. Chattopadhyay S., Ramanathan M., Das J., Bhattacharya S.K. Animal models in experimental diabetes mellitus // Indian Journal of Experimental Biology. — 1997. — Vol. 35(11). — P. 1141-1145.
2. Ewing J.F., Janero D.R. Microplate superoxide dismutase assay employing a nonenzymatic superoxide generator // Anal. Biochem. — 1995. — Vol. 232(2). — P. 243-248.
3. Kashiwagi A., Asahina T., Nishio Y. et al. Glycation, oxidative stress, and scavenger activity. Glucose metabolism and radical scavenger dysfunction in endothelial cells // Diabetes. — 1996. — Vol. 45. — P. 84-86.
4. Muller J., Hoepelman A.I.M., Rutten G.E.H.M. Increased Risk of Common Infections in Patients with Type 1 and Type 2 Diabetes Mellitus // Clinical Infectious Diseases. — 2005. — Vol. 41(3). — P. 281-288.
5. Prentki M., Nolan C.J. Islet β cell failure in type 2 diabetes // J. Inv. — 2006. — Vol. 116(7). — P. 1802-1812.
6. Poitout V., Robertson R.P. Minireview: secondary β-cell fai–lure in type 2 diabetes — a convergence of glucotoxicity and lipotoxicity // Endocrinology. — 2002. — Vol. 143(2). — P. 339-342.
7. Valko M., Leibfritz D., Moncol J. et al. Free radicals and antioxidants in normal physiological functions and human disease // Int. J. Biochem. Cell. Biol. — 2007. — Vol. 39(1). — P. 44-84.
8. Yang H., Jin X., Lam C.W.K., Yan S.K. Oxidative stress and diabetes mellitus // Clin. Chem. Lab. Med. — 2011. — Vol. 49(11). — P. 1773-1782.
9. Zheng W., Huang L.Z., Zhao L. et al. Superoxide dismutase activity and malondialdehyde level in plasma and morphological evaluation of acute severe hemorrhagic shock in rats // Am. J. Emerg. Med. — 2008. — Vol. 26(1). — P. 54-58.
10. Yasunari K., Maeda K., Nakamura M., Yoshikawa J. Oxidative stress in leukocytes is a possible link between Blood pressure, Blood Glucose, and C-Reacting Protein // Hypertension. — 2002. — Vol. 39. — P. 777-780. doi: org/10.1161/hy0302.104670.
11. Berger T. Tolerability and efficacy of a herbal combination preparation in children and adolescents with recurrent infections of the upper respiratory tract // MMW Fortschr Med. — 2008. — Vol. 150(2). — P. 85-90.
12. Stavniichuk R., Drel V.R., Shevalye H. et al. Baicalein alleviates diabetic peripheral neuropathy through inhibition of oxidative-nitrosative stress and p38 MAPK activation // Exp. Neurol. — 2011. — Vol. 230(1). — P. 106-113.