Введение
Сахарный диабет (СД), являясь одним из наиболее распространенных неинфекционных заболеваний, представляет интерес для исследователей с позиций выявления факторов, оказывающих влияние на его течение. В настоящее время накапливается информация о новых факторах риска диабета, к которым можно отнести нарушения сна, в котором человек проводит около трети своей жизни. Сон — генетически детерминированная составляющая развития и существования живого организма, которая характеризуется закономерной последовательной сменой определенных полиграфических картин в виде циклов, фаз и стадий [1]. Сон играет значимую роль в регуляции различных функций организма, включая терморегуляцию, секрецию различных гормонов, метаболические процессы, в том числе связанные с регуляцией гомеостаза глюкозы, психоэмоциональное состояние пациента. Именно эти факторы определяют интерес к изучению влияния сна на течение СД и взаимосвязь с состоянием углеводного обмена. Подавляющее большинство исследований оценки дыхательных нарушений во сне и СД посвящены проблеме СД 2-го типа и ожирения [2–4]. При этих состояниях нарушения сна ассоциируются с избыточным отложением жировой ткани в области глотки, что является одной из причин развития апноэ во сне. В последние годы накапливаются знания о нарушениях сна у пациентов с СД 1-го типа [5–8].
Компенсация СД 1-го типа позволяет предот–вратить развитие осложнений и оказывает бесспорно положительное влияние на общесоматическое и психоэмоциональное состояние пациента. Целевые уровни компенсации традиционно оцениваются по результатам самоконтроля гликемии и уровню гликированного гемоглобина (НbА1с). В то же время известно, что определение гликемии по данным самоконтроля и значению уровня НbА1с не всегда совпадает со значениями суточного мониторинга гликемии (СМГ) и может свидетельствовать о «ложнонормальной» компенсации при значимых колебаниях гликемии в течение суток. Нами была выдвинута гипотеза о негативном влиянии на показатели сна декомпенсации СД 1-го типа и наличия гипогликемических эпизодов. Для уточнения механизмов взаимосвязи компенсации СД 1-го типа и расстройств проведено исследование по оценке изменений сомнологических показателей в зависимости от уровня гликемии и наличия гипогликемических эпизодов по данным СМГ, что определило направление данного исследования.
Цель исследования: оценить сомнологические показатели и респираторные события сна (РС) в зависимости от уровня гликемии (УГ) во время сна по СМГ у пациентов с СД 1-го типа.
Материалы и методы
Проведено одномоментное индивидуально-–кон–тролируемое исследование 57 пациентов с СД 1-го типа, обследованных с выполнением общепринятых исследований для таких пациентов, сопоставимых по возрасту, индексу массы тела (ИМТ), стажу СД. Всем участникам исследования выполнили:
— определение НbА1с в венозной крови (анализатор Architect c800, Abbott, США);
— СМГ с использованием СGMS Gold (Conti–nuous Glucose Monitoring System Gold производства Medtronic MiniMed, США) и оценкой среднего значения гликемии (СГ) перед сном, СГ после сна, доли нормогликемии, гипергликемии, гипогликемии перед сном и после сна, уровня гликемии во время сна;
— полисомнографический мониторинг ночного сна с помощью системы SOMNOlab 2, Weinmann R & K (Германия) в лаборатории сна в течение одной диагностической ночи.
Структура сна записывалась и определялась в соответствии со стандартом А. Rechtschffen и А. Kales [9] и регистрацией следующих показателей: N1, N2, N3, N4 стадии медленного сна (NREM-сон), REM-сон, общее время сна (ОВС), рассчитывался коэффициент эффективности сна (ЭС); WASO (wake after sleep onset) — продолжительность бодрствования после засыпания, смена фаз сна (СФС). Расчет коэффициента ЭС проводился по формуле:
Коэффициент ЭС = ОВС/время, проведенное в постели × 100 %.
Для оценки РС проводилась регистрация частоты дыхания (ЧД), гипопноэ общего времени сна (ОВС), средней продолжительности гипопноэ, максимальной длительности апноэ, обструктивного апноэ (ОА) ОВС, средней длительности ОА, максимальной длительности ОА, центрального апноэ (ЦА) ОВС, средней длительности ЦА, максимальной длительности ЦА, среднего насыщения крови кислородом (SpO2) и оценкой индексов апноэ-гипопноэ (AHI) ОВС и NREM.
В соответствии с целью исследования пациенты были разделены на 3 группы в зависимости от УГ во время сна. В группу 1 вошли пациенты, УГ во время сна у которых не превышал значение 3,9 ммоль/л, что свидетельствует о наличии у них гипогликемических эпизодов. Группу 2 составили пациенты с УГ во время сна 3,9–6,9 ммоль/л, что соответствует целевым значениям для компенсации СД 1-го типа. Группа 3 была представлена пациентами с УГ 7,0–10,0 ммоль/л, что превышает целевые значения и соответствует декомпенсации или гипергликемии. В табл. 1 представлена характеристика групп сравнения.
Статистический анализ выполнялся с помощью компьютерных программ Statistica 10.0 (StatSoft Inc., США), Excel for Windows (1997–2003).
Результаты
На первом этапе исследования проведена оценка показателей сна в группах сравнения, представленная в табл. 2.
В данном исследовании не проводилось сравнения с группой здоровых лиц, что обусловлено инвазивностью используемых методов исследования, но для понимания выраженности изменений в архитектуре сна использованы доли нормальных значений показателей по отношению к ОВС: REM-сон — 20–25 %; NREM-сон — 80–75 %, где N1 — 2–5 %; N2 — 45–55 %; N3 — 3–8 %; N4 — 10–15 %; WASO — 5 %, коэффициент ЭС — более 85 % [10].
В результате оценки приведенных данных установлено, что ОВС у пациентов с СД 1-го типа всех групп сравнения не имеет достаточной продолжительности. Максимальная продолжительность ОВС выявлена у пациентов первой группы — 6,15 [5,40; 6,43] ч. Коэффициент ЭС ни в одной из групп сравнения не достигал нормальных значений и составил в группе 1 84,00 [80,00; 85,00] %, в группе 2 — 79,80 [77,00; 81,00] % и в группе 3 — 70,00 [69,00; 74,00] % — минимальное значение.
При оценке стадий REM-сна выявлены различия, которые свидетельствуют о максимальной доле N1 стадии в группе 1 у пациентов с гипо–гликемическими эпизодами — 14,10 [10,60; 23,00] против 11,05 [5,00; 18,30] % в группе 2 и 7,00 [4,70;14,00] % в группе 3 (р = 0,0110 и р = 0,0479 соответственно) от ОВС. Продолжительность N3 и N4 стадий глубокого сна у пациентов с нормогликемией (группа 2) оказалась самой длительной среди групп сравнения. При сравнении значений REM-сна отмечено, что в группе 2 доля данного вида сна составила 29,40 [22,50; 43,00] % от ОВС, что на 10,1 % меньше, чем в группе 1 (39,50 [26,00; 48,00] %, р = 0,0479), и на 13,5 % меньше, чем в группе 3 (39,90 [24,70; 41,40] %, р = 0,0421).
Полученные результаты подтверждаются в исследовании S.F. Feupe еt al., в котором отмечено снижение продолжительности глубоких стадий медленного сна (N3, N4) при гипогликемии у взрослых пациентов, а в исследовании, проведенном среди детей с ночными гипогликемиями, установлено, что только при условии спонтанной гипогликемии возникает пролонгирование дельта-сна (стадии N3, N4) [7, 11]. Различия в результатах могут быть объяснены тем, что пациенты настоящего исследования провели все ОВС при УГ не более 3,9 ммоль/л, поэтому этот временной промежуток невозможно назвать спонтанным. Выявленный факт позволяет предположить, что возникающий дефицит глубоких стадий медленного сна является своего рода защитной реакцией организма, позволяющей быстрее перейти к пробуждению из поверхностного сна или из стадий N1, N2 в состояние бодрствования при ночной гипогликемии [7]. Уменьшение продолжительности глубокого медленноволнового сна (N3, N4) у пациентов группы 3 при декомпенсации СД можно объяснить особенностями метаболизма глюкозы во время сна. Известно, что в глубоких стадиях медленного сна на периферии увеличивается концентрация глюкозы, а утилизация ее мозгом уменьшается. Описанные результаты находят подтверждение в литературе об обратной зависимости между значением НbА1с и продолжительностью медленноволнового сна [12–14]. Приведенные результаты свидетельствуют о том, что декомпенсация препятствует углублению стадий сна, поэтому в структуре сна преобладают REM-сон, а также поверхностные стадии медленного сна.
Продолжительность REM-сна в группе 1 при гипогликемии была на 10,1 % больше, а в группе 3 при декомпенсации на 13,4 % больше, чем у пациентов группы 2 с нормогликемией. С учетом знаний о том, что поглощение глюкозы головным мозгом и периферическими тканями во время REM-сна аналогично периоду бодрствования, пролонгирование данного вида сна может быть следствием готовности к пробуждению как при гипогликемии, так и на фоне декомпенсации — гипергликемии. Литературные данные о значениях гликемии, способствующих пробуждению во время ночного сна, противоречивы. При регистрации УГ ниже 2,2 ммоль/л при пробуждении [15] имеются противоречащие исследования, которые указывают, что к пробуждению от сна приводит не столько УГ, сколько скорость снижения УГ, отмечая, что снижение гликемии на 1,38 ммоль/л/ч является фактором, инициирущим пробуждение и независимым от стартового уровня гликемии [15].
Анализ периода бодрствования во время ночного сна или продолжительность бодрствования после засыпания (WASO — wake after sleep onset) свидетельствует о наибольшей продолжительности WASO у пациентов группы 3 с декомпенсацией СД 1-го типа. Длительные промежутки бодрствования во время сна могут быть следствием клинических проявлений декомпенсации (учащенное мочеиспускание, сухость во рту и другие проявления декомпенсации СД) и, возможно, скорости снижения гликемии. Доля WASO во всех группах исследования превышала нормативные значения (5 % от ОВС) и составила при гипогликемии 16,2 %, при нормогликемии — 17,8 %, при декомпенсации — 25,1 %.
Также продемонстрировал различия и показатель СФС, который отражает переход из состояния бодрствования к медленноволновому сну (стадиям N1, N2, N3, N4), затем к REM-сну и обратно. Учащение этого показателя может свидетельствовать о готовности организма к пробуждению у пациентов с гипогликемиями. СФС чаще регистрировалась в группе 1 (у пациентов с гипогликемией) — 151,13 [118,00; 219,00] раза против 144,45 [97,00; 197,00] раза в группе 3 у пациентов с декомпенсацией СД 1-го типа.
Проведенный анализ позволяет сделать заключение о том, что у всех пациентов с СД 1-го типа независимо от компенсации и наличия гипогликемий наблюдается недостаточная продолжительность ОВС с низким коэффициентом ЭС менее 85 %; отмечается дефицит глубоких стадий медленноволнового сна с большей выраженностью нарушений при наличии гипогликемий или декомпенсации, а длительность REM превышает допустимые нормативные значения.
Отсутствие компенсации СД 1-го типа оказывает негативное влияние на сон и приводит к увеличению продолжительности промежутков бодрствования, учащению СФС, которые отмечаются у пациентов с гипогликемиями и при декомпенсации.
Увеличение ОВС у пациентов с гипогликемиями характеризуется недостаточной полноценностью сна, так как это сон с продолжительным промежутком бодрствования во время сна и, соответственно, частой СФС и быстрым наступлением REM-сна. Также сон у пациентов с гипогликемиями не имеет достаточной глубины и имеет минимальную представленность дельта-волновой активности.
Далее для установления наличия РС в зависимости от уровня гликемии был проведен анализ, результаты которого представлены в табл. 3.
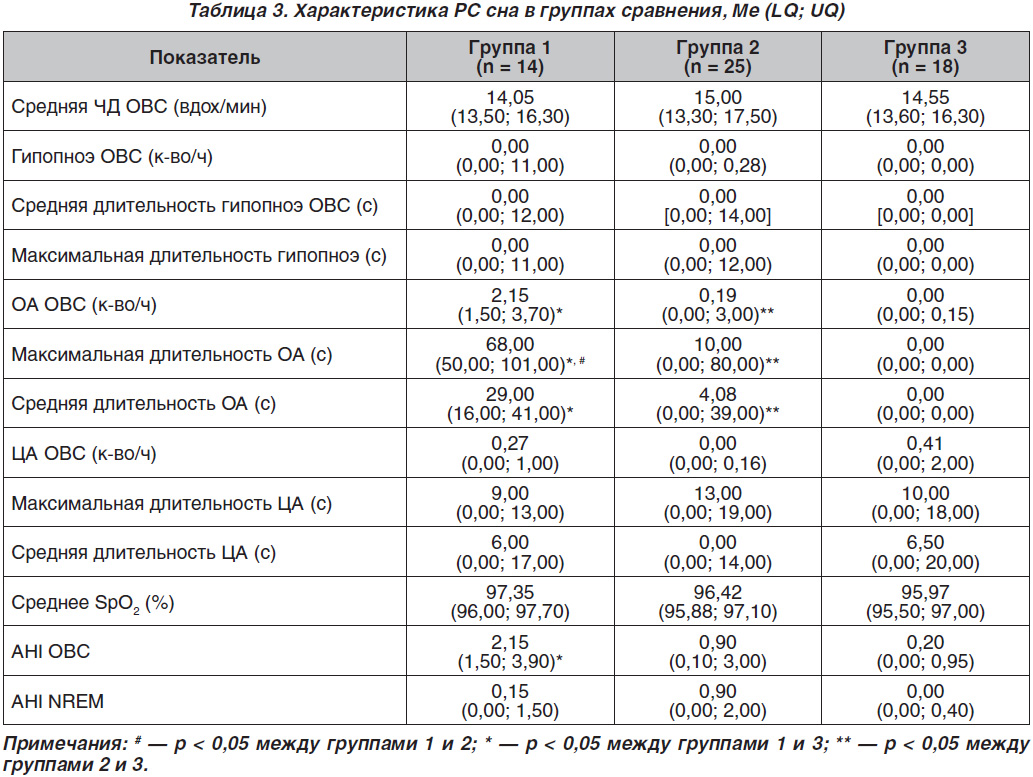
Анализ РС сна выявил значимые различия в группах пациентов с СД 1-го типа в зависимости от уровня гликемии. В группе 1 при гипогликемии количество ОА ОВС составило 2,15 (1,50; 3,70) против 0,00 (0,00; 0,15) к-во/ч в группе 3 гипергликемий (р = 0,0009) и 0,19 (0,00; 3,00) в группе 2 (р = 0,0199). Максимальная длительность ОА в группе 1 с гипогликемиями cоставила 68,00 (50,00; 101,00) против 10,00 (0,00; 80,00) в группе 2 (р = 0,0479) и 0,00 (0,00; 0,00) в группе 3 (р = 0,0016). При сравнении показателя максимальной длительности ОА между группами 2 и 3 наибольшее значение отмечено у пациентов группы 2 с нормогликемией (р = 0,0498). Показатель индекса апноэ AHI ОВС составил 2,15 (1,50; 3,90) в группе 1 с ночными гипогликемиями против 0,20 (0,00; 0,95) в группе 3. Наиболее высокие значения AHI NREM отмечены в группе 2 — при нормогликемии — 0,90 (0,00; 2,00) против 0,00 (0,00; 0,40) в группе 3.
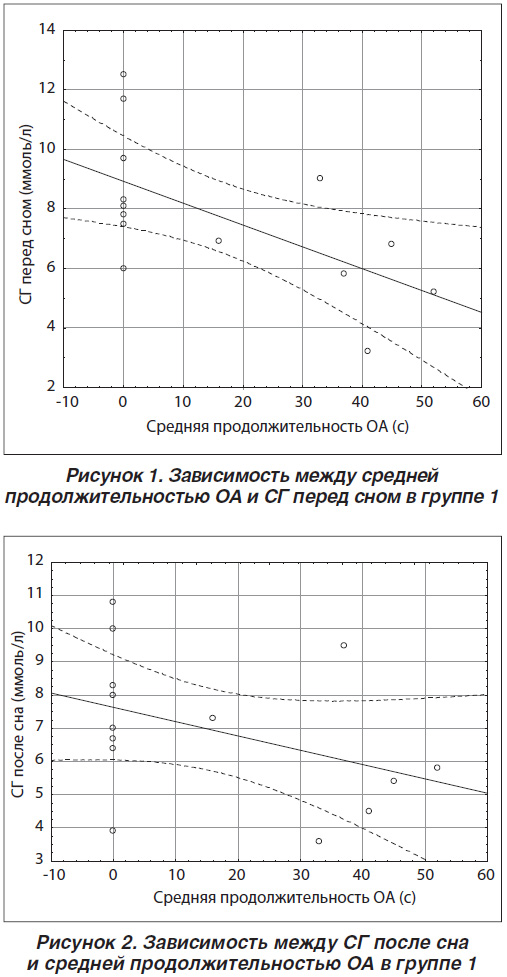
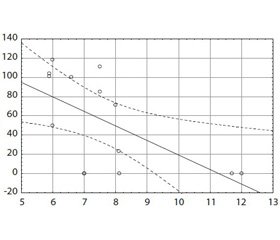
Для оценки связи исследуемых показателей выполнен корреляционный анализ методом Спирмена. В группе 1, включающей пациентов с ночными гипогликемиями, установлено, что средняя продолжительность ОА находится в обратной зависимости от СГ перед сном (r = –0,6895) (рис. 1), доли гипергликемий перед сном (r = –0,5829), СГ после сна (r = –0,5790) (рис. 2). Обратная корреляционная зависимость выявлена между уровнем НbА1с и максимальной длительностью ОА (r = –0,6363) (рис. 3), что свидетельствует о сокращении максимальной длительности ОА с повышением значения НbА1с.
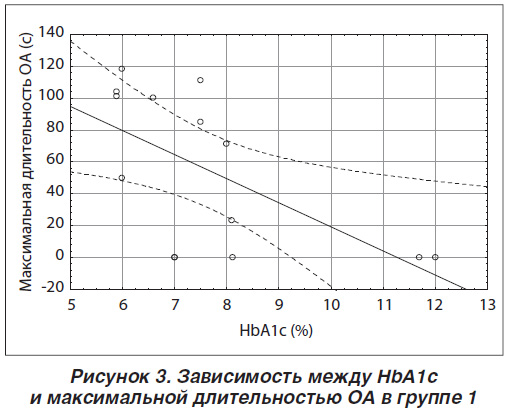
Также выявлена обратная корреляция между средней длительностью ЦА и УГ во время сна (r = –0,6723), показателем СГ перед сном (r = –0,8459), долей гипергликемии (r = –0,6610) и обратная корреляция с долей гипогликемии перед сном (r = 0,8007). Таким образом, можно заключить, что увеличение СГ, доля гипергликемии перед сном и УГ во время сна сокращают среднюю продолжительность ЦА, а доля гипогликемии перед сном ее увеличивает. Снижение уровня СГ перед сном и увеличение доли гипогликемии перед сном у пациентов группы 1 с ночными гипогликемиями приводят к увеличению АНI ОВС (r = –0,6210; r = 0,6501).
Во второй группе у пациентов со значением НbА1с 7,0 % и гликемией во время сна 4,5 ммоль/л установлено:
— уменьшение УГ во время сна сопровождается увеличением средней продолжительности ОА (r = –0,5009) и максимальной длительностью ЦА (r = –0,4801);
— снижение показателей СГ, доли гипергликемии перед сном приводит к повышению индекса AHI ОВС и AHI NREM (r = –0,4122; r = –0,4917 и r = –0,4519; r = –0,5544);
— положительная корреляция между AHI ОВС и AHI NREM и долей нормогликемии перед сном (r = 0,4903; r = 0,6071);
— снижение НbА1с сопровождается пролонгированием максимальной длительности ОА (r = –0,4328).
У пациентов с декомпенсацией в группе 3 максимальная длительность ЦА увеличивалась при снижении значений СГ перед сном (r = –0,4697) и доли гипергликемии перед сном (r = –0,4815). Также отмечена зависимость, при которой увеличение максимальной длительности ОА ОВС приводит к увеличению доли гипогликемии после сна (r = 0,8851).
Обсуждение
Результаты, приведенные выше, позволяют утверждать, что ОА ОВС встречается чаще у пациентов с ночной гипогликемией — 85,71 % случаев (у 12 из 14 человек) и имеет наиболее продолжительный (68 с) показатель максимальной длительности ОА. Эти данные согласуются с результатами исследования L. Meyer et al., которые указывают на увеличение частоты ОА ОВС при УГ менее 3,31 ммоль/л [16].
По данным литературы, на частоту встречаемости и продолжительность ОА сна оказывают влияние различные факторы — длительность СД, избыточная масса тела или ожирение, возраст, наличие микрососудистых осложнений СД, развитие диабетической автономной невропатии [3–5, 17, 19]. В нашем исследовании пациенты всех групп имели практически одинаковый стаж заболевания, ИМТ, возраст, что позволяет исключить влияние этих факторов на возникновение апноэ. Обсуждаемая причина — микрососудистые осложнения, возможно, сыграла свою роль в развитии ОА, так как наличие микрососудистых нарушений приводит к респираторной дисфункции [17].
В нашем исследовании у пациентов с выявленными апноэ сна ретинопатия была установлена у всех пациентов (100 %), а нефропатия — в 51 % случаев. Аналогичная взаимосвязь между ОА и микро–ангиопатиями была установлена в исследовании
G. Manin et al., в котором ОА определено у 46,2 % обследованных пациентов с СД 1-го типа без учета компенсации и наличия подтвержденных гипогликемических эпизодов, из них у 35,5 % была выявлена микроальбуминурия, свидетельствующая о наличии нефропатии, и у 84 % — ретинопатия [18].
Роль невропатии в развитии ОА связывается с развитием вегетативной невропатии, что объяс–няется нарушениями контроля дыхательной системы во время сна вегетативной нервной системой [19]. У включенных в данное исследование пациентов не проводилось специальное обследование, направленное на выявление диабетической автономной невропатии, но частота выявления ОА и сочетание с другими хроническими осложнениями СД 1-го типа позволяет высказать гипотезу о том, что ОА может быть проявлением респираторной формы автономной невропатии, проявляющейся эпизодическими апноэ сна вследствие нарушений контроля центральной нервной системы за дыханием и потенциально драматическим развитием, вплоть до внезапной смерти во сне.
Выводы
1. У пациентов с СД 1-го типа независимо от компенсации и наличия гипогликемий наблюдается недостаточная продолжительность ОВС с низким коэффициентом ЭС менее 85 %; отмечается дефицит глубоких стадий медленноволнового сна с большей выраженностью нарушений при наличии гипогликемий или декомпенсации, а длительность REM превышает допустимые нормативные значения.
2. Отсутствие компенсации СД 1-го типа оказывает негативное влияние на сон и приводит к увеличению продолжительности промежутков бодрствования, учащению СФС, которые отмечаются у пациентов с гипогликемиями и при декомпенсации.
3. Наиболее значимые и выраженные отклонения в РС сна выявлены у пациентов с ночными гипогликемиями:
— ОА зарегистрировано у 85,71 % обследованных и имеет наибольшую продолжительность по сравнению с пациентами без гипогликемических эпизодов в течение ночи наблюдения;
— выявлена максимальная частота регистрации ОА ОВС и его наибольшая продолжительность;
— низкие значения СГ перед сном ассоциированы с увеличением продолжительности ОА ОВС.
У пациентов с нормогликемией группы 2 отмечено, что наличие ОА во время сна сопровождается снижением СГ после сна за счет увеличения доли гипогликемии после сна.
При декомпенсации СД 1-го типа зарегистрированы: минимальные значения всех исследуемых РС сна; ассоциация снижения СГ перед сном и доли гипергликемии перед сном с увеличением максимальной длительности ЦА сна; продолжительные периоды ОА с долей гипогликемии после сна.
В заключение следует подчеркнуть, что выдвинутая гипотеза о влиянии нарушений компенсации СД 1-го типа и особенно гипогликемических эпизодов на качество и продолжительность сна, что может быть одной из причин снижения качества жизни и нарушений работоспособноcти при СД 1-го типа. Более того, полученные результаты свидетельствуют о потенциальной возможности использования выявленных фактов при планировании дальнейших научных исследований, в том числе и по потенциальному использованию коррекционных лечебных технологий, например, дельта-сон индуцирующего пептида.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Ковальзон В.М. Основы сомнологии: физиология и нейрохимия цикла «бодрствование — сон» / Ковальзон В.М. — М.: БИНОМ. Лаборатория знаний, 2014. — 240 с.
2. Do differences in sleep architecture exist between persons with Type 2 diabetes and nondiabetic controls? / М. Pallayova, V. Donic, S. Gresova [et al.] // Diabetes Sci. Technology. — 2010. — Vol. 4. — Р. 344-52.
3. Quantity and quality of sleep and incidence of type 2 / F.P. Сappuccio, L. D’Elia, P. Strazzullo [et al.] // Diabetes Сare. — 2010. — Vol. 33(2). — Р. 414-420.
4. Effects of poor and short sleep on glucose mеtabolism and obesity risk / K. Spiegel, E. Tasali, R. Leproult [et al.] //Nature Reviews Endocrinology. — 2009. — Vol. 5. — P. 253-261.
5. Sleep apnoea in children with diabetes mellitus: effect of glycaemic control / M.P. Villa, G. Miltari, M. Montesano [еt al.] // Diabetologia. — 2000. — Vol. 43(6). — Р. 696-702.
6. Sleep, glucose, and daytime functioning in youth with type 1 diabetes / M.M. Perfect, P.G. Patel, R.E. Seott [et al.] // Sleep. — 2012. — Vol. 35(1). — Р. 81-88.
7. Interactions between hypoglycaemia and sleep architecture in children with type 1diabetes mellitus / G. Pillar, G. Schuscheim, R. Weiss [et al.] // Pediatr. — 2003. — Vol. 142. — Р. 163-168.
8. Дорошкевич И.П. Оценка влияния гликемии на показатели сна при сахарном диабете 1-го типа: результаты одномоментного когортного исследования / И.П. Дорошкевич, Т.В. Мохорт // Международный эндокринологический журнал. — 2014. — № 7(63). — С. 23-27.
9. Rechtschaffen A. A manual of standardized terminology, techniques and scoring system for sleep stages of human subjects / Rechtschaffen A., Kales А. — Government printing office. — Washington, 1968. — 59 p.
10. Bassetti C. ESRS European sleep medicine textbook / Bassetti C., Dogas Z., Peigneux P. — Bonn: VG Bild — Kunst, 2014. — 300 p.
11. Nocturnal continuous glucose and sleep stage data in adults with type 1 diabetes in real-world conditions / S.F. Feupe, P.F. Frias, S.C. Mednick [et al.] // Diabetes Sci Technol. — 2013. — Vol. 7(5). — Р. 1337-1345.
12. Sleep loss: a novel risk factor for insulin resistance and type 2 diabetes / K. Spiegel, К. Knutson, R. Leproult [et al.] // Appl. Physiol. — 2005. — Vol. 99(5). — Р. 2008-2019.
13. Sleep architecture and glucose and insulin homeostasis in obese adolescents / D. Koren, L.E. Levitt Katz, P.C. Brar [et al.] // Diabetes Care. — 2011. — Vol. 34(11). — Р. 2442-2447.
14. Slow-wave sleep and the risk of type 2 diabetes in humans /E. Tasali, R. Leproult, D.A. Ehrmann [et al.] // Proc. Natl. Acad. Sci. USA. — 2008. — Vol. 105(3). — Р. 1044-1049.
15. Defective awakening response to nocturnal hypoglycemia in patients with type 1 diabetes mellitus / В. Schultes, K. Jauch-Chara, S. Gais [et al.] // PlosMed. — 2007. — Vol. 4(2). — Р. 164-180.
16. Meyer L. Prevalence of obstructive sleep apnea (OSA) in patients with type 1 diabetes and impact on glucose profile [Electronic resource] / L. Meyer, C. Canel, J.P. Le Floch // Model of accesse: http://www.abstractsonline.com/pp8/#!/3699/presentation/8579.
17. Сакович О.М. Клинико-функциональная характеристика респираторной и кардиоваскулярной систем у больных сахарным диабетом 1 типа: Автореф. дис... на соискание степени канд. мед. наук: 14.01.04 «внутренние болезни» /О.М. Сакович. — Красноярск, 2010. — 26 с.
18. Obstructive sleep apnoea in people with type 1 diabetes: prevalence and association with micro- and macrovascular complications / Manin G., Pons A., Baltzinger P. [et al.] // Diabet. Med. — 2015. — Vol. 32(1). — P. 90-96.
19. Cardiovascular autonomic neuropathy contributes to sleep apnea in young and learn type 1 diabetes mellitus patients [Electronic resource] / C.C.P.S. Janovsky, L.C.S.P. Rolim, J.R. Sa [et al.] // Front. Endocrinol. — 2014. — Vol. 5(119). — Mode of accesse: http://journal.frontiersin.org/article/10.3389/fendo.2014.00119/full.