Введение
Диагностика и лечение больных с метастазами анонимного рака (МАР) или так называемой карциномы с неопределенным первичным очагом, на долю которых приходятся 0,5–15 % больных с впервые зарегистрированным диагнозом злокачественного новообразования, являются нерешенной проблемой на сегодняшний день [1, 6, 9].
МАР — особое клинико-патологическое состояние, которое определяется наличием метастатических очагов, и нет возможности выявить первичный очаг с помощью современных диагностических методов. Это состояние определяется только гистологическим исследованием опухоли, гистологический тип которой не совпадает с известными типами опухолей органа, из которого был взят материал для исследования [8, 9]. Сложности диагностики у пациентов с МАР, а также неудовлетворительные результаты лечения вызывают у большинства онкологов пессимизм в отношении данной группы больных [8]. Пациенты с МАР имеют плохой прогноз, средняя продолжительность их жизни обычно составляет 5–6 месяцев, а уровень общей 5-летней выживаемости не превышает 10 % [1, 8, 9].
Клинические проявления у больных с МАР зависят от того, какие органы поражаются метастатическим процессом, но у большинства больных могут отмечаться симптомы астенизации, слабости, повышенной утомляемости, потеря веса и другие общие симптомы [6, 8, 9, 11]. Большую роль в обследовании таких больных играет тщательно собранный анамнез, особенно при проведении в прошлом каких-либо оперативных вмешательств, последние требуют морфологической верификации. Проведение компьютерной или магнитно-резонансной томографии достаточно часто позволяет определиться с диагнозом и внести соответствующие коррективы в тактику лечения [2, 9]. Лабораторные исследования должны начинаться с клинического анализа крови, определения уровня электролитов, проведения печеночных и почечных проб, а также обязательным является определение концентрации кальция, альбумина и фосфатов [2, 9]. При наличии жалоб на боль в костях или изменениях уровня кальция и/или щелочной фосфатазы в сыворотке крови необходимо проведение остеосцинтиграфии [2, 9, 11]. При наличии поражения костей, особенно при обнаружении аденокарциномы, необходимы проведение маммографии у женщин и исследование предстательной железы у мужчин [2, 8, 9].
Безусловно, большую роль в обследовании этих больных играет морфологическое исследование, при наличии возможностей предпочтение следует отдавать инцизионной биопсии или трепан-биопсии. Применение иммуногистохимических, цитогенетических исследований и др. иногда позволяет точно определить гистологический тип опухоли, например выявить лимфому, меланому или герминогенные опухоли [9].
По мнению J.D. Hainsworth, определение локализации первичного очага положительно влияет на продолжительность и качество жизни пациента только в случаях, когда опухоль чувствительна к соответствующей терапии [11].
Рекомендации по лечению больных с МАР достаточно противоречивы. При наличии висцеральных очагов или поражении лимфатических узлов рекомендуется применение полихимиотерапии (ПХТ), преимущественно на основе препаратов платины. Например, при наличии высоко- или умеренно дифференцированной аденокарциномы комбинация карбоплатина, паклитаксела и этопозида позволяет достичь регрессии у 40 % больных [3, 14]. При наличии недифференцированных опухолей предпочтение следует отдавать схемам на базе цисплатина [5, 10, 11]. В последние годы стали чаще применять схемы с таксанами и гемцитабином, что привело к повышению показателей выживаемости больных [7, 8, 12, 13].
В литературе имеются сообщения, что при наличии метастатических костных очагов анонимного рака рекомендуется проведение хирургического вмешательства при угрозе/наличии перелома или лучевой терапии (ЛТ) на очаги поражения [9]. В данной статье мы хотим сообщить о нашем опыте обследования и лечения пациентов с метастатическим поражением костей при МАР.
Материалы и методы
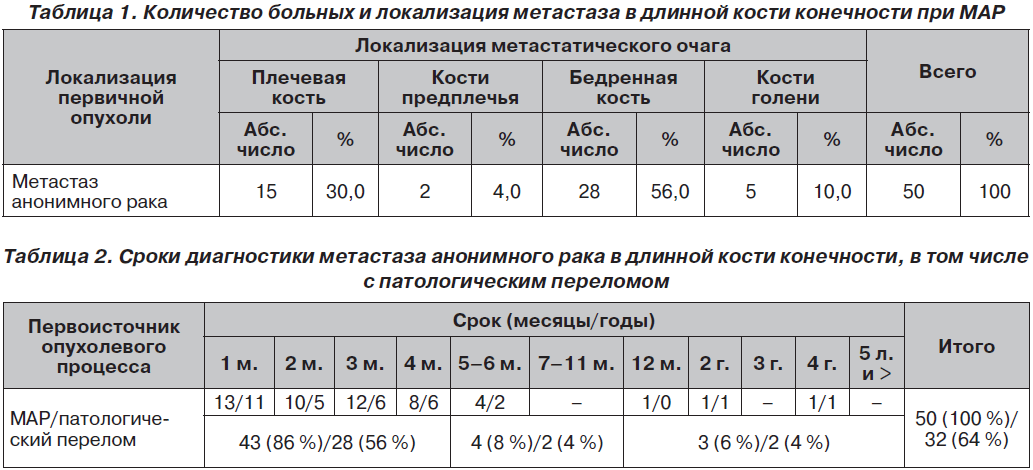
В клинических отделах НИИТО ДонНМУ проведено обследование и лечение 50 больных с метастатическим поражением длинных костей конечностей при метастазах анонимного рака. В табл. 1 представлены количество больных и локализация метастаза в длинной кости конечности при МАР.
Несмотря на всестороннее обследование 50 больных, установить локализацию первичного злокачественного очага не удалось, из них 32 (64 %) пациента обратились за медицинской помощью только после наступившего патологического перелома. В табл. 2 представлены сроки диагностики метастаза анонимного рака в длинной кости конечности, в том числе с патологическим переломом.
Больным проводилось комплексное обследование: рентгенография очага поражения в кости; рентгенография и компьютерная томография органов грудной клетки; ультразвуковое исследование, компьютерная или магнитно-резонансная томография органов брюшной полости, забрюшинного пространства и малого таза; остеосцинтиграфия; компьютерная или магнитно-резонансная томография головного мозга; позитронно-эмиссионная томография.
Всем 50 пациентам с целью верификации процесса выполнена открытая или трепанобиопсия метастатического очага в кости. Установлен гистогенез опухоли: у 29 (58 %) пациентов — железистый рак, у 15 (30 %) — плоскоклеточный, у 6 (12 %) — низкодифференцированный.
Лечебная тактика определялась нами в первую очередь с учетом общего состояния больного, локализации метастазов, распространенности опухолевого процесса, морфологического строения метастатической опухоли, предполагаемой локализации первичного очага.
При обследовании пациентов с МАР множественные метастазы в кости и висцеральные органы отмечены у 41 (82 %) больного. У пациентов с множественными метастазами при тяжелом общем состоянии и их отказе от оперативного вмешательства осуществляли иммобилизацию пораженной метастазом конечности гипсовой повязкой.
У 6 (12 %) больных с относительно удовлетворительным общим состоянием выполнены органосохраняющие операции: у 4 (8 %) — сегментарная резекция метастатического очага длинной кости с замещением образовавшегося дефекта металлополимерной вставкой, у 1 (2 %) — однополюсное эндопротезирование дефекта проксимального отдела плечевой кости металлополимерным эндопротезом, у 1 (2 %) — металлоостеосинтез патологического перелома бедренной кости блокирующим интрамедуллярным стержнем.
У 1 (2 %) больного вынуждены были выполнить ампутацию конечности на уровне средней трети бедра, у 1 (2 %) — экзартикуляцию верхней конечности, у 1 (2 %) — нижней конечности. Причинами удаления конечности в двух наблюдениях были выраженный болевой синдром и настойчивое требование больных, в одном — распадающаяся опухоль с поражением мягких тканей и угрозой профузного кровотечения.
После проведенных диагностических, консервативных и хирургических мероприятий все больные продолжили комплексное (полихимиотерапия, лучевая терапия, бисфосфонаты) или симптоматическое лечение.
Выбор схемы полихимиотерапии производился нами с учетом гистологического типа опухоли.
15 пациентам при метастазе анонимного плоскоклеточного рака ПХТ проводилась по схемам: CF (цисплатин 100 мг/м2 внутривенно (в/в) в 1-й день, фторурацил 1000 мг/м2 (24-часовая инфузия в 1–4-й дни), схему повторяли каждые 3 недели), или МBP (метотрексат 40 мг/м2 внутримышечно (в/м) в 1-й и 15-й дни, блеомицин 10 мг/м2 в/м в 1, 8 и 15-й дни, цисплатин 50 мг/м2 в/в в 4-й день, схему повторяли каждые 3 недели), или GP (гемцитабин 1000 мг/м2 в/в в 1, 8 и 15-й дни, цисплатин 50 мг/м2 в/в в 1-й день, схему повторяли каждые 3 недели).
29 пациентам при метастазе анонимного железистого рака и 6 пациентам при метастазе анонимного низкодифференцированного рака ПХТ проводилась по схемам: BEP (блеомицин 30 мг внутривенно или в/м 1 раз в неделю на протяжении 12 недель, этопозид 100 мг/м2 в/в на протяжении 5 суток, цисплатин
20 мг/м2 в/в на протяжении 5 суток, схему повторяли каждые 3 недели), или EP (этопозид 120 мг/м2 в/в в 1, 3, 5-й дни, цисплатин 80 мг/м2 в/в в 1-й день, схему повторяли каждые 3 недели), или PCE (паклитаксел 175 мг/м2 в/в в 1-й день, карбоплатин AUC 6 мг/м2 в/в в 1-й день, этопозид 50–100 мг перорально на протяжении 10 суток, схему повторяли каждые 3 недели), или DM (доксорубицин 50 мг/м2 в/в в 1-й и 22-й дни, митомицин 10 мг/м2 в/в в 1-й день, схему повторяли каждые 42 дня).
Всем пациентам проводилось лечение бисфосфонатами. Пациентам вводили в/в золендроновую кислоту в дозе 4 мг в сутки, или памифос 90 мг в сутки, или памиредин 90 мг в сутки с интервалом в 28 дней, проводили от 6 до 10 курсов.
ЛТ назначалась на очаг поражения в кости при наличии выраженного болевого синдрома и угрозе возникновения или наличии патологического перелома. ЛТ проводилась на метастатический очаг поражения в кости разовой очаговой дозой 2–2,5 Грея до суммарной очаговой дозы 40–60 Грей.
В дальнейшем пациенты с метастазами анонимного рака в кости скелета продолжали обследование с целью выявления первичной злокачественной опухоли.
Продолжительность жизни определялась методом Каплана — Мейера.
Результаты
В результате проведенного лечения 50 пациентов с МАР получены следующие данные: у 20 пациентов с множественными метастазами в кости и висцеральные органы, которые получали симптоматическую терапию, средняя продолжительность жизни составила 3,6 ± 1,9 месяца (95% ДИ 1,5–6,0 месяца). Средняя продолжительность жизни 10 пациентов с множественными метастазами в кости и висцеральные органы, которые получали химиотерапию и лучевую терапию, составила 11,4 ± 2,5 месяца (95% ДИ 8,2–14,1 месяца). Средняя продолжительность жизни 11 пациентов с множественными метастазами анонимной опухоли в длинные кости конечностей, сочетающимися с поражением позвоночника, получавших химиолучевое лечение, составила 9,5 ± 2,1 месяца (95% ДИ 6,7–11,8 месяца). Средняя продолжительность жизни 9 пациентов с множественными метастазами анонимной опухоли в длинные кости конечностей, у которых выполнены органосохраняющие и калечащие операции с последующим химиолучевым лечением, составила 13,0 ± 3,1 месяца (95% ДИ 6,9–19,1 месяца).
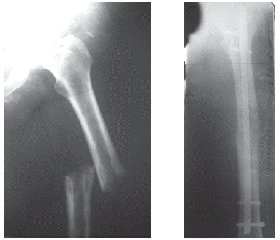
Приводим клиническое наблюдение. Больная В., 55 лет, доставлена в отделение НИИТО в связи с переломом левой бедренной кости (рис. 1а). Из анамнеза заболевания: боль в левом бедре беспокоила в течение года, но появилась вслед за болями в пояснице. Проводилось консервативное лечение распространенного остеохондроза позвоночника в поликлинике по месту жительства. Во время ходьбы оступилась и почувствовала хруст и резкую боль в левом бедре. При осмотре отмечались укорочение левого бедра и угловая деформация, выраженный отек мягких тканей. Пальпаторно определялись болезненность и патологическая по-движность в средней трети бедра. При рентгенографии выявлен перелом левой бедренной кости в средней трети, концы отломков на протяжении 2–4 см «изъедены», снижена плотность костной ткани — патологический перелом.
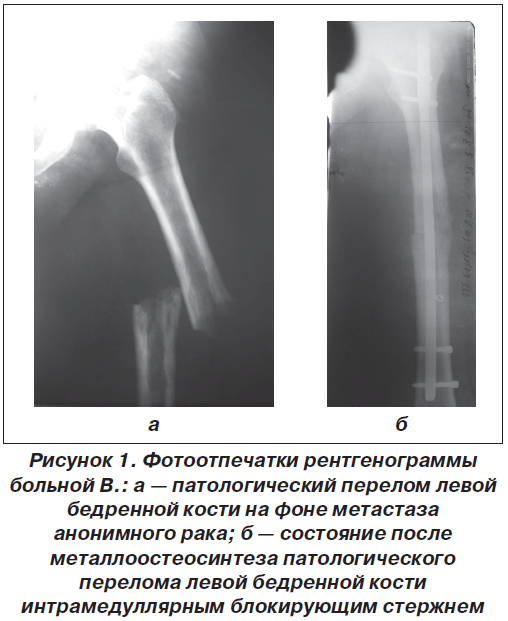
С целью уточнения диагноза больной выполнена трепанобиопсия кости в месте перелома, гистологически — железистый рак. При обследовании больной обнаружены метастазы в печень и легкие. Для стабилизации перелома бедренной кости произведен интрамедуллярный остеосинтез блокирующим стержнем (рис. 1б). Осуществлено дообследование больной на предмет поиска первоисточника опухоли, но, к сожалению, его обнаружить не удалось. Больной проведен курс ПХТ по схеме EP (этопозид, цисплатин), после снятия швов больная направлена для проведения курса ЛТ в онкодиспансер по месту жительства.
Следует отметить хорошую переносимость больными облучения, 12 пациентов отмечали жалобы на незначительную тошноту, несмотря на применение ондасетрона, что, возможно, связано с большим объемом облучения. Через 1–2 месяца после облучения у 15 (50 %) пациентов отмечалось уменьшение болей, у 10 (33,3 %) больных боли в месте поражения кости исчезли полностью, поэтому они отказались от применения обезболивающих средств. При рентгенологическом исследовании после облучения в динамике отмечено восстановление структуры кости, а в месте перелома — образование костной мозоли.
Обсуждение
По нашему мнению, обследование больных с метастазами анонимного рака должно включать такие этапы: предварительная дифференцировка и оценка общего состояния; оценка распространенности опухолевого поражения; получение материала для морфологического исследования, поиск первичного очага.
В перечень обязательных обследований при выявлении метастатических очагов в костях должны быть включены: рентгенография костей, рентгенография и компьютерная томография органов грудной клетки, остеосцинтиграфия, ультразвуковое исследование, компьютерная и магнитно-резонансная томография органов брюшной полости, забрюшинного пространства и малого таза, компьютерная или магнитно-резонансная томография головного мозга, открытая или трепанобиопсия очага поражения в кости, аспирационная биопсия или трепанобиопсия костного мозга с цитологическим, морфологическим, цитогенетическим, иммунофенотипичным исследованием материала.
Лечебная тактика у больных с метастазами анонимного рака в кости определяется индивидуально с учетом общего состояния, локализации и распространенности метастатического поражения, результатов морфологического исследования полученного материала из метастаза в кости, предполагаемой локализации первичного очага. При лечении больных с метастатическим поражением костей при метастазах анонимного рака в кости следует учитывать следующие моменты: лечение больных с метастазами анонимного рака в кости должно быть комплексным, в схемы терапии должны включаться бисфосфонаты.
С учетом полученных нами данных можно говорить о том, что средняя продолжительность жизни пациентов с метастазами анонимного рака, получавших комплексное лечение, выше, чем у лиц, лечение которых ограничилось симптоматической терапией.
Выводы
1. План обследования пациентов с метастазами анонимного рака в кости должен включать лишь те исследования, которые позволяют выявить первичный очаг на основании локализации метастазов и их предполагаемой морфологической принадлежности.
2. При метастазах анонимного рака в кости лечение заключается в сочетании полихимиотерапии, бисфосфонатов и лучевого воздействия на очаг поражения в кости, а в случаях, когда это возможно, — в удалении метастатического очага.
3. У пациентов с диссеминированным процессом выявление первичного очага, за редким исключением, не позволяет надеяться на существенное улучшение результатов специального лечения.
4. Пациенты с метастазами анонимного рака в кости подлежат динамическому наблюдению, в процессе которого возможно выявление первичной опухоли.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Комаров И.Г., Комов Д.В. Метастазы злокачественных опухолей без выявленного первичного очага. — М.: Триада-Х, 2002. — 136 с.
2. Analysis of a diagnostic strategy for patients with suspected tumors of unknown origin / J.L. Abbruzzese, M.C. Abbruzzese, R. Lenzi et al. // J. Clin. Oncol. — 1995. — Vol. 13. — P. 2094-2103.
3. Carcinoma of unknown primary site: treatment with 1-hour paclitaxel, carboplatin, and extended-schedule etoposide / J.D. Hainsworth, J.B. Erland, L.A. Kalman et al. // J. Clin. Oncol. — 1997. — Vol. 15. — Р. 2385-2393.
4. Cervical lymph node metastases from unknown primary tumors / C. Grau, L.V. Johansen, J. Jakobsen et al. // Radiother. Oncol. — 2000. — Vol. 55. — P. 121-129.
5. Combined modality therapy with chemoradiation for squamous cell carcinoma of the head and neck from an occult primary / S.M. Smith, A. Argiris, K. Stenson et al. // Proc. Am. Soc. Clin. Oncol. — 2002. — Vol. 21. — Р. 235.
6. Diagnostic and therapeutic management of cancer of unknown primary / N. Pavlidis, E. Briasoulis, J. Hainsworth et al. // Eur. J. Cancer. — 2003. — Vol. 39. — Р. 1990-2005.
7. Gemcitabine, carboplatin, and paclitaxel for patients with carcinoma of unknown primary site: A Minnie Pearl Cancer Research Network study / F.A. Greco, H.A. Burris, S. Lit-chy et al. // J. Clin. Oncol. — 2002. — Vol. 20. — Р. 1651-1656.
8. Gemcitabine and docetaxel as front-line chemotherapy in patients with carcinoma of an unknown primary site / D. Pouessel, S. Culine, C. Becht et al. // Cancer. — 2004. — Vol. 100. — Р. 1257-1261.
9. Hainsworth J.D. Carcinoma of unknown primary site / J.D. Hainsworth // Cancer Management: A Multidisciplinary Approach. Medical, Surgical & Radiation Onco-logy. Pazdur R., Coia L.R., Hoskins W.J., Wagman L.D. (eds.). — New York: Masson, 2002. — P. 947-978.
10. Hainsworth J.D. Cisplatin-based combination chemotherapy in the treatment of poorly differentiated carcinoma and poorly differentiated adenocarcinoma of unknown primary site: results of a 12-year experience / J.D. Hainsworth, D.H. Johnson, F.A. Greco // J. Clin. Oncol. — 1992. — Vol. 10. — Р. 912-922.
11. Hainsworth J.D. Treatment of patients with cancer of an unknown primary site / J.D. Hainsworth, F.A. Greco // N. Engl. J. Med. — 1993. — Vol. 329. — Р. 257-263.
12. Schapira D.V. The need to consider survival, outcome, and expense when evaluating and treating patients with unknown primary carcinoma / D.V. Schapira, A.R. Jarrett // Arch. Intern. Med. — 1995. — Vol. 155. — Р. 2050-2054.
13. Taxane-based chemotherapy for patients with carcinoma of unknown primary site / F.A. Greco, J. Gray, H.A. Burris et al. // Cancer J. — 2001. — Vol. 7. — Р. 203-212.
14. Treatment of metastatic poorly differentiated neuroendocrine carcinoma with paclitaxel/carboplatin/etoposide: A Minnie Pearl Cancer Research Network phase II trial / C.E. McKay, J.D. Hainsworth, H.A. Burris et al. // Proc. Am. Soc. Clin. Oncol. — 2002. — Vol. 21. — Р. 158.