Статья опубликована на с. 63-84
Список сокращений
АВ — атриовентрикулярная (блокада, проводимость)
АД — артериальное давление
АДГ — антидиуретический гормон
АИК — аппарат искусственного кровообращения
АКШ — аортокоронарное шунтирование
АНЦА — антинейтрофильные цитоплазматические аутоантитела (аутоантитела к цитоплазме нейтрофилов)
АТ II — ангиотензин II
АФС — антифосфолипидный синдром
АЦЦ — N-ацетилцистеин
АЧТВ — активированное частичное тромбопластиновое время
БКК — блокаторы кальциевых каналов
БПНС — быстропрогрессирующий нефритический синдром
БРА — блокаторы рецепторов ангиотензина II
БЭН — белково-энергетическая недостаточность
ВПВ — верхняя полая вена
ГБМ — гломерулярная базальная мембрана
ГД — гемодиализ
ГДФ — гемодиафильтрация
ГЛПС — геморрагическая лихорадка с почечным синдромом
ГМК — гладкомышечные клетки
ГН — гломерулонефрит
ГРС — гепаторенальный синдром
ГУС — гемолитико-уремический синдром
ГЭК — гидроксиэтилкрахмалы
ДЗЛА — давление заклинивания легочной артерии
ДЗЛК — давление заклинивания в легочных капиллярах
ДИ — доверительный интервал
ДК — дендритные клетки
ДПП — давление в правом предсердии
ЗПТ — заместительная почечная терапия
иАПФ — ингибиторы ангиотензинпревращающего фермента
ИВЛ — искусственная вентиляция легких
ИРП — ишемическое реперфузионное повреждение
ИТН — ишемический тубулярный некроз
ИФА — иммуноферментный анализ
ИХА — иммунохроматографический анализ
КИ-ОПП — контраст-индуцированное острое повреждение почек
КИУП — контраст-интенсифицированная ультрасонография почек
ККОС — клубочково-канальцевая обратная связь
КОС — кислотно-основное состояние
КРС — кардиоренальный синдром
КТ — компьютерная томография
КФ — клубочковая фильтрация
КФО — комплексное функциональное обследование почек
ЛДГ — лактатдегидрогеназа
ЛПС — липополисахариды
ММ — молекулярная масса
МО — мочевая обструкция
МОД — минутный объем дыхания
МПГН — мембрано-пролиферативный гломерулонефрит
МРТ — магнитно-резонансная томография
МТ — масса тела
ННА — ненаркотические анальгетики
НПВ — нижняя полая вена
НПВП — нестероидные противовоспалительные препараты
НПЗТ — непрерывная почечная заместительная терапия
ОБП — острая болезнь почек
ОГПС — острый гем-пигментный синдром
ОИН — острый интерстициальный нефрит
ОИТН — острый ишемический тубулярный некроз
ОКН — острый кортикальный некроз
ОКРС — острый кардиоренальный синдром
ОМ — объем мочи
ОНС — острый нефритический синдром
ОПН — острая почечная недостаточность
ОПП — острое повреждение почек
ОПСС — общее периферическое сосудистое сопротивление
ОРДС — острый респираторный дистресс-синдром
ОРИТ — отделение реанимации и интенсивной терапии
ОРТПХ — острая реакция трансплантата против хозяина
ОСН — острая сердечная недостаточность
ОТИН — острый тубулоинтерстициальный нефрит
ОТИНС — тубулоинтерстициальный нефритический синдром
ОТН — острый тубулярный некроз
ОТТН — острый токсический тубулярный некроз
ОЦК — объем циркулирующей крови
ОЦП — объем циркулирующей плазмы
П/Ж — подкожно-жировая (клетчатка)
ПД — перитонеальный диализ
ПДКВ — положительное давление в конце выдоха
ПМЯЛ — полиморфноядерные лейкоциты
ПНГ — пароксизмальная ночная гемоглобулинурия
ПОЛ — перекисное окисление липидов
ПОПП — преренальное острое повреждение почек
ПЦР — полимеразная цепная реакция
РААС — ренин-ангиотензин-альдостероновая система
РАС — ренин-ангиотензиновая система
РДСВ — респираторный дистресс-синдром взрослых
РКИ — рандомизированное клиническое исследование
РКС — рентгеноконтрастные средства
РМА — реакция микроагглютинации
РСК — реакция связывания комплемента
РТ — рост
РТПО — реакция трансплантата против опухоли
РТПХ — реакция трансплантата против хозяина
СВ — сердечный выброс
СД — сахарный диабет
СЗП — свежезамороженная плазма
СИАГ — синдром интраабдоминальной гипертензии
СИИ — строгий ионный интервал
СК — система комплемента
СКВ — системная красная волчанка
СКФ — скорость клубочковой фильтрации
СЛОК — синдром лизиса опухолевых клеток
СН — сердечная недостаточность
СНС — симпатическая нервная система
СОС — синдром обструкции синусоидов печени
ССВО — синдром системного воспалительного ответа
ССВР — синдром системной воспалительной реакции
СХАЭ — синдром холестериновой атероэмболии
ТБМ — тубулярная базальная мембрана
ТГCК — трансплантация гемопоэтических стволовых клеток
ТИН — тубулоинтерстициальный нефрит
ТМА — тромботическая микроангиопатия
ТПН — терминальная почечная недостаточность
ТТН — токсический тубулярный некроз
ТТП — тромботическая тромбоцитопеническая пурпура
ТЭЛА — тромбоэмболия легочной артерии
УФ — ультрафильтрация
ФВЛЖ — фракция выброса левого желудочка
ФДЭ — фосфодиэстераза
ФР — фактор риска
ФЭNa— фракционная экскреция натрия
ХБП — хроническая болезнь почек
ХКПС — хантавирусный кардиопульмональный синдром
ХНТВ — хантавирусы
ХНТВИ — хантавирусные инфекции
ХСН — хроническая сердечная недостаточность
ЦВД — центральное венозное давление
ЦАМФ — циклический аденозинмонофосфат
ЦГМФ — циклический гуанозинмонофосфат
ЦМВ — цитомегаловирус
ЦП — цирроз печени
ЭК — эпителиальные клетки
ЭКК — экстракорпоральный контур
ЭН — эпидемическая нефропатия
ЭПР — эндоплазматический ретикулум
ЭЦО — эффективный циркулирующий объем
ЮВД — югулярное венозное давление
ЮГА — юкстагломерулярный аппарат
ACT — активированное время свертывания
BNP — натрийуретический пептид B-типа
Ccr — клиренс креатинина
CIN — ингибиторы кальциневрина
CРБ — C-реактивный белок
HGF — фактор роста гепатоцитов
HHV‑6 — вирус герпеса шестого типа
IGF — инсулиноподобный фактор роста
IL — интерлейкины
KIM — молекула почечного повреждения
NGAL — нейтрофильный желатиназоассоциированный липокалин
PAF — фактор активации тромбоцитов
ROS — реактивные радикалы кислорода
Scr — концентрация креатинина в сыворотке крови
TGF — трансформирующий фактор роста
TLR — Toll-подобные рецепторы
TNF — фактор некроза опухолей
TNFR — рецептор фактора некроза опухоли
VEGF — сосудистый эндотелиальный фактор роста
Методика оценки силы рекомендаций и уровня их предсказательности, использованная при составлении данных клинических рекомендаций (в соответствии с клиническими рекомендациями KDIGO).
По силе рекомендации подразделяются на три категории в убывающем порядке: уровень 1 (эксперты рекомендуют); уровень 2 (эксперты предлагают); недифференцированный уровень (табл. 1). Сила предсказательности рекомендаций подразделена на 4 уровня (табл. 2).
Введение
Острое повреждение почек (ОПП) — широко распространенное и чрезвычайно опасное состояние, которое, несмотря на совершенствование медицинских технологий, зачастую несвоевременно диагностируется и является причиной неблагоприятных исходов, в том числе летального.
ОПП — понятие, вошедшее в медицинский лексикон сравнительно недавно и повсеместно заменившее известный термин «острая почечная недостаточность» (ОПН).
Данная замена обусловлена несколькими обстоятельствами, в том числе необходимостью унифицировать критерии диагностики и стратификации тяжести острого поражения/дисфункции почек. Например, только в англоязычной литературе фигурировало более 30 определений острой почечной недостаточности. Такая ситуация не позволяла дать даже минимально объективную оценку результатам исследований по эпидемиологии и изучению исходов этого состояния. В частности, заболеваемость ОПН, по данным ряда разработок, варьировала от 1 до 31 %, а летальность составляла от 19 до 83 % [Hoste E.A. и соавт., 2006].
/66.jpg)
Однако главным основанием для создания понятия ОПП послужило накопление сведений о том, что даже незначительное транзиторное нарастание концентрации креатинина в сыворотке крови (Scr) ассоциируется с резким увеличением летальности. Такое повышение смертности наблюдается как в раннем, так и в отдаленном периодах. При этом летальный исход далеко не всегда определяется «почечными» причинами [Chertow G.M. и соавт., 2005]. Все это позволило предположить, что при определенных ситуациях активируется достаточно сложная система патогенетических связей, ведущая к повреждениям не только собственно почечной ткани, но и других органов и систем. Такие представления легли в основу концептуальной модели ОПП, которая при наличии этиологической причины и, возможно, предрасполагающих обстоятельств (факторов риска) предусматривает переход от «нормы» к возможному летальному исходу. Этот переход осуществляется через ряд этапов, многие из которых еще являются потенциально обратимыми. Иными словами, модель отражает этапность формирования данного состояния в тесной связи с развитием различных внепочечных осложнений или проявлений ОПП (рис. 1). В этом смысле концепция ОПП тесно сближается с представлениями о ХБП [Murugan R., Kellum J.A., 2011].
/67_3.jpg)
Становление понятия ОПП и внедрение его в медицинскую практику прошло через ряд этапов. Первоначально группой экспертов Acute Dialysis Quality Initiative (ADQI) была предпринята попытка унифицировать определение и стратификацию тяжести ОПН. Предложения ADQI по данному вопросу (система RIFLE) были представлены в 2002 г. Эта система базировалась на величинах диуреза, Scr и клиренса креатинина (Ccr) и стратифицировала ОПН по тяжести на пять функциональных классов [Bouman C. и соавт., 2002].
Система критериев RIFLE неплохо зарекомендовала себя на практике, хотя бы в отношении предсказания исходов у пациентов с ОПН [Hoste E.A. и соавт., 2006]. Но оказалось, что эта система не лишена ряда недостатков. Например, много вопросов вызывало наличие в классификации классов R (риск) и E (терминальная почечная недостаточность). Очевидно, что риск развития какого-либо заболевания или патологического состояния — не само это состояние или заболевание. Не менее понятно, что ТПН (класс E) — исход ОПН, а никак не само ОПН. Эти и некоторые другие соображения побудили к поиску модификаций классификационных систем острой патологии почек.
Позже участниками группы ADQI, представителями трех нефрологических ассоциаций (ASN, ISN и NKF) и Европейского общества интенсивной терапии (European Society of Intensive Care Medicine) на встрече в Виченце (Италия) в 2004 г. была предложена концепция «острого повреждения почек» (ОПП — acute kidney injury — AKI). При этом ОПП рассматривалось как более широкое понятие, чем собственно ОПН [Mehta R.L. и соавт., 2007]. Там же было создано сообщество экспертов различных специальностей Acute Kidney Injury Network (AKIN), которым надлежало проводить дальнейшую разработку проблемы ОПП.
Первые результаты деятельности группы AKIN были опубликованы в 2007 г., они коснулись вопросов уточнения диагностических критериев и стратификации тяжести ОПП (AKIN-критерии). AKIN-критерии предполагали стратификацию тяжести ОПП на три стадии в зависимости от концентрации креатинина в сыворотке крови и объема мочи (диуреза). Величина СКФ (клиренс креатинина) из критериев диагностики и стратификации тяжести ОПП была исключена [Mehta R.L. и соавт., 2007].
Дальнейшее развитие концепции ОПП связано с деятельностью международной группы экспертов Kidney Disease Improving Global Outcomes (KDIGO), которой были несколько модифицированы определение, критерии диагностики, стратификации тяжести ОПП и подготовлены подробные клинические рекомендации [KDIGO Clinical Practice Guideline… 2012]. Несмотря на имеющиеся недостатки, предложения KDIGO в настоящее время стали общепринятыми и в той или иной степени послужили основой для разработки целого ряда национальных рекомендаций, в том числе и представленных ниже.
Раздел I. Острое повреждение почек как важная медицинская и социальная проблема
Рекомендация 1.1
Внедрение концепции ОПП в практическую работу системы национального здравоохранения следует рассматривать как важный стратегический, междисциплинарный подход к снижению общей смертности, заболеваемости хронической болезнью почек и сердечно-сосудистой патологии, к увеличению продолжительности жизни населения, а также к уменьшению расходов на лечение осложнений острого нарушения функции почек и проведение заместительной почечной терапии (1А).
Комментарий
ОПП является полиэтиологическим состоянием. Оно может вызываться внешними воздействиями, которые накладываются на здоровые или больные почки, или быть связаны с первичным повреждением органа (подробнее см. Рекомендацию 4.1, табл. 4.1).
При этом этиологическая и эпидемиологическая структура ОПП может существенно различаться в зависимости от того, формируется оно на догоспитальном этапе (внебольничное ОПП) или развивается уже в стационаре (внутрибольничное ОПП). Усредненная оценка их частоты в процентном соотношении приведена в табл. 1.1.
Более точные сведения об этиологической структуре внутрибольничного ОПП можно получить из недавно опубликованной работы X. Zeng и соавт. [2014] (табл. 1.2).
В любом случае эти данные свидетельствуют о том, что с ОПП может встретиться врач практически любой специальности, и подчеркивают мультидисциплинарность этой проблемы.
По суммарным данным, заболеваемость ОПП варьирует от 140 до 2880 случаев на миллион населения в год. При этом отмечается нарастание заболеваемости на 400 % с 1988 по 2002 г. [Case J. и соавт., 2013]. По сообщению другой группы авторов, общая частота новых случаев ОПП за период с 1996 по новых случаев ОПП на 100 000 населения, а число больных с ОПП, требующих заместительной почечной терапии (ЗПТ), возросло за тот же период с 19,5 до 29,6 на 100 000 населения [Hsu C.Y. и соавт., 2007].
Интегрированные результаты исследований последних лет свидетельствуют о том, что заболеваемость ОПП в общей популяции достигает 0,25 %, что сравнимо с заболеваемостью инфарктом миокарда [Piccinni P. и соавт., 2011].
Распространенность ОПП также достаточно высока. Если принять во внимание только случаи, потребовавшие проведения гемодиализа, то, по имеющимся оценкам, она составляет от 183 до 295 пациентов на миллион населения в год (табл. 1.3).
Исходы ОПП остаются неудовлетворительными. Несмотря на успехи в развитии медицинских технологий, летальность при данном состоянии высока. В существенной мере она зависит от этиологии ОПП (табл. 1.4).
При этом смертность от ОПП превышает суммарную смертность от рака молочной железы, рака простаты, сердечной недостаточности и диабета [Lewington A.J.P. и соавт., 2013].
Неблагоприятные исходы ОПП не исчерпываются высокой смертностью. ОПП является важной причиной развития ХБП. Данные эпидемиологических, проспективных исследований последних лет свидетельствуют о том, что пациенты, которые изначально имели нормальную функцию почек и перенесли ОПП, после которого функция почек восстановилась до базальных значений, имеют более высокий риск развития ХБП. У 15 % из общего числа данных пациентов через 2,5 года формируется стойкая дисфункция почек на уровне ХБП 3-й ст. [Jones J. и соавт., 2012]. Примерно у 10 % детей, перенесших ОПП, через 1–3 года формируется ХБП [Mammen C. и соавт., 2012]. Риск развития ХБП у пациентов, которые имели нормальную функцию почек до возникновения ОПП и в последующем восстановили ее до базальных значений в течение короткого периода (90 дней), особенно высок в первые 2–3 года [Bucaloiu I.D. и соавт., 2012; Jones J. и соавт., 2012]. Данные метаанализа свидетельствуют, что после перенесенного ОПП относительный риск формирования ХБП или ТПН соответственно составляет 8,82 (95 % ДИ 3,05–25,48) и 3,10 (95 % ДИ 1,91–5,03) [Coca S.G. и соавт., 2012].
Этиологическая роль ОПП в развитии ХБП, очевидно, увеличивает и потребность в ЗПТ (табл. 1.5).
ОПП и кардиоваскулярные риски. Тесная взаимо–связь между состоянием функции почек и поражениями кардиоваскулярной системы в настоящее время считается аксиомой. При этом снижение СКФ является одной из важнейших детерминант сердечно-сосудистого риска. В свою очередь, патология кардиоваскулярной системы способствует развитию почечных повреждений (кардиоренальный континуум, острые и хронические кардиоренальные и ренокардиальные синдромы) [Смирнов А.В. и соавт., 2005; Ronco C. и соавт., 2008].
Хорошо известно, что различные острые сердечно-сосудистые проблемы могут стать причинами ОПП (острый кардиоренальный синдром тип 1) [Ronco C. и соавт., 2008]. С другой стороны, действующая классификация предполагает выделение острого ренокардиального синдрома (кардиоренальный синдром тип 3). В данном случае эпизод ОПП приводит к развитию острого повреждения/дисфункции сердечно-сосудистой системы [Ronco C. и соавт., 2008; Bagshaw S.M. и соавт., 2013]. Однако, как показали результаты недавнего исследования, выполненного на Тайване, перенесение ОПП, потребовавшего ЗПТ с полным восстановлением функции почек, в отдаленном периоде ассоциируется с большей вероятностью появления коронарной патологии и величиной кардиоваскулярной летальности по сравнению с пациентами без ОПП [Wu V.C. и соавт., 2014]. Эти данные дают основания выделять таких больных в группу повышенного кардиоваскулярного риска.
Сам факт перенесения ОПП определяет не только плохой прогноз, но и связан с существенными дополнительными расходами. Так, уже в 2000 г. затраты на одного выжившего с ОПП в течение 6-месячного срока достигли 80 000 долл. [Korkeila M. и соавт., 2000]. К 2005 г. общие расходы на госпитальное лечение ОПП достигли 9 млрд долл. [Chertow G.M. и соавт. 2005].
Приведенные выше данные диктуют необходимость, во‑первых, организации динамического (диспансерного) наблюдения, во‑вторых, осуществления комплекса мероприятий по нефропротекции и, в‑третьих, понимания проблемы организаторами здравоохранения при проспективном планировании потребности в ЗПТ.
Раздел II. Определение и классификация острого повреждения почек
Рекомендация 2.1
Под ОПП следует понимать быстрое развитие дисфункции органа в результате непосредственного воздействия ренальных или экстраренальных повреждающих факторов (NG).
Комментарий
В патогенетическом плане ОПП следует рассматривать как совокупность механизмов, связанных с повреждением различных компартментов почки и приводящих к дисфункции органа, в первую очередь в результате нарушения процессов клубочковой фильтрации и экскреции, с последующими нарушениями системного гомеостаза.
Отдельную проблему представляют сроки появления дисфункции почек после неблагоприятного воздействия или развития острого заболевания (в том числе заболевания почек). Чисто условно было принято, что появление острой дисфункции почек должно происходить в срок до семи суток от момента индукции. Однако в конкретной клинической ситуации данный срок может существенно изменяться. Решение данного вопроса должно приниматься индивидуально в каждом отдельном случае.
Существенно подчеркнуть, что приведенное выше определение ОПП, полностью соответствующее принципам действующих на сегодняшний день международных рекомендаций, является скорее функциональным. При этом и определение, и классификационные системы KDIGO, RIFLE и AKIN, по сути, ориентированы на больных с острыми вторичными повреждениями почек, но не охватывают случаи ОПП на фоне их первичных паренхиматозных заболеваний, что противоречит самой концепции ОПП, которое исходно рассматривалось как более широкое понятие, чем привычное ОПН. Например, S.S. Waikar и соавт. [2008] отметили, что «снижение СКФ не всегда наблюдается даже в случаях тяжелого паренхиматозного повреждения почек, что, например, может иметь место при волчаночном нефрите». В то же время «редукция СКФ может встречаться в ситуациях без явной [почечной] патологии, в частности, при некоторых вариантах «преренальной азотемии». Отсюда следует, что замена привычного термина ОПН на ОПП может не иметь существенного смысла, поскольку диагностические критерии AKIN или KDIGO построены сугубо на функциональных параметрах». С этим трудно не согласиться. Например, при целом ряде паренхиматозных заболеваний почек (острый постстрептококковый гломерулонефрит, острый интерстициальный нефрит) острый процесс может захватить орган, привести к появлению признаков повреждения (например, микроальбуминурии, протеинурии, гематурии), но не сказаться существенно на состоянии функции, особенно если оценивать ее по таким довольно грубым критериям, как диурез или Scr. В дальнейшем этот процесс может более или менее успешно разрешиться. Очевидно, что в данной ситуации нельзя утверждать, что здесь нет острого повреждения почек. В то же время с действующих позиций оно диагностировано не будет. Мимо этой проблемы не прошли и эксперты KDIGO, обратив внимание на то, что встречаются ситуации, которые не соответствуют критериям ни ХБП, ни ОПП. Поэтому эксперты KDIGO предложили определение «острой болезни почек (ОБП) — острого почечного расстройства» [acute kidney diseases and disorders (AKD)] (табл. 2.1). Если принять, что диагноз ОБП, в том числе, может быть обоснован только на наличии маркеров структурного повреждения (без изменений Scr или СКФ), то концепция острой патологии почек обретает необходимую стройность. При этом ОПП является составной частью ОБП. К случаям неизвестной болезни почек (НБП) следует относить ситуации с нарастанием Scr в течение 7 сут. менее чем в 1,5 раза от базального при неопределенности нозологических признаков почечной патологии.
/71.jpg)
ОБП пока не является общепринятым понятием и на сегодняшний день не должно фигурировать в диагнозе.
Рекомендация 2.2
В практической деятельности ОПП следует определять в соответствии с рекомендациями KDIGO как наличие как минимум одного из следующих критериев:
— нарастание Scr ≥ 0,3 мг/дл (≥ 26,5 мкмоль/л) в течение 48 ч, или
— нарастание Scr ≥ 1,5 раза от исходного, которое, как известно или предполагается, произошло в течение 7 суток, или
— объем мочи < 0,5 мл/кг/ч в течение 6 ч.
Рекомендация 2.3
В клинической практике ОПП следует стратифицировать по тяжести согласно следующим критериям KDIGO (NG).
Комментарий
Как следует из приведенного выше, выявление и стратификация тяжести ОПП базируется на использовании двух диагностических тестов — концентрации креатинина в сыворотке крови и объеме мочи. Такой выбор был обусловлен повсеместной распространенностью и доступностью данных параметров. Однако необходимо иметь в виду, что оба эти теста не идеальны.
Предполагается, что концентрация креатинина в сыворотке крови обратно связана с величиной скорости клубочковой фильтрации, и рост Scr должен строго соответствовать снижению СКФ. Тем не менее давно известно, что креатинин экскретируется не только за счет гломерулярной фильтрации, но и путем канальцевой секреции. Предсказать вклад секреции в выведение креатинина у конкретного индивидуума, особенно страдающего тяжелой патологией почек, невозможно. Кроме того, концентрация креатинина в сыворотке крови подвержена влиянию целого ряда факторов, не имеющих прямого отношения к состоянию функции почек (табл. 2.3).
/72.jpg)
Концентрация креатинина в сыворотке крови является малочувствительным индексом. Отчетливое нарастание уровня сывороточного креатинина происходит тогда, когда глобальная функциональная способность почек уменьшается примерно вдвое [Mеrtensson J. и соавт., 2012; Slocum J.L. и соавт., 2012]. Кроме того, особенности кинетики креатинина в организме таковы, что рост его концентрации существенно (более чем на сутки) запаздывает вслед за внезапным снижением СКФ. При этом наиболее медленный рост Scr (во всяком случае, в относительном выражении) происходит у пациентов с исходно сниженной функцией почек (исходно низкой СКФ), что может создать проблемы в диагностике ОПП на ХБП или в дифференциальной диагностике ОПП и ХБП [Смирнов А.В. и соавт., 2009; Waikar S.S., Bonventre J.V., 2009].
Среди отмеченных выше принципов стратификации тяжести ОПП необходимо обратить внимание на базальный (исходный) уровень функции почек. В подавляющем большинстве случаев у пациентов с подозрением на ОПП исходные уровни ни Scr, ни СКФ не известны. В связи с этим составлена таблица, которая позволяет быстро сориентироваться в должных исходных величинах Scr (табл. 2.4). В качестве такого заданного уровня СКФ было принято ее значение 75 мл/мин [Bouman C. и соавт., 2002].
/72_2.jpg)
Второй важнейший критерий диагностики и стратификации тяжести ОПП — диурез. При этом следует иметь в виду, что величина объема мочи (диурез) — интегральная, но малоспецифичная характеристика функционального состояния почек, поскольку зависит от целого ряда экстраренальных и ренальных факторов. При этом сами механизмы формирования окончательной величины объема мочи весьма различны [Murugan R., Kellum J.A., 2011. — http://www.ncbi.nlm.nih.gov/pubmed?term=Kellum%20JA%5bAuthor%5d&cauthor=true&cauthor_uid=21343898]. Однако если у взрослых людей диурез снижается ниже необходимого минимума, у пациента развивается олигурия (выделение за сутки менее 5 мл мочи/кг массы тела) [Bouman C. и соавт., 2002]. Появление олигоурии является несомненным признаком тяжелого повреждения почек [Bouman C. и соавт., 2002]. Кроме того, при ОПП изменения объема мочи могут проявляться задолго до того, как отреагируют другие общепринятые маркеры ренальной дисфункции, например Scr [Bellomo R. и соавт., 2004].
Тем не менее, проводя критический анализ системы KDIGO, эксперты Kidney Disease Outcomes Quality Initiative (KDOQI, США) указали на низкую информативность критериев, основанных на уровне диуреза для диагностики и стратификации тяжести ОПП, по крайней мере для взрослых [Palevsky P.M. и соавт., 2013].
По-видимому, часть ограничений диагностических возможностей концентрации креатинина в сыворотке крови и объема при ОПП могут быть сняты при использовании так называемых «биомаркеров» ОПП (см. Рекомендацию 3.1.1).
Важным моментом является то, что ОПП — динамическое состояние, выраженность его в процессе мониторинга может меняться. Поэтому для правильной стратификации тяжести ОПП во внимание должны приниматься значения критериев, которые приводят к выбору наиболее выраженной стадии повреждения почек у конкретного пациента.
Раздел III. Диагностика и дифференциальная диагностика острого повреждения почек
Рекомендация 3.1
Для максимально ранней диагностики вероятной ОПП у лиц с факторами риска и ассоциированными состояниями необходим мониторинг как минимум следующих параметров: массы тела, темпа диуреза, креатинина, мочевины и электролитов сыворотки крови; результаты мониторирования должны быть зарегистрированы в медицинской документации и подвергаться постоянному анализу (NG).
Комментарий
Помимо уже упомянутых ограничений в оценке концентрации креатинина в сыворотке крови для диагностики и стратификации тяжести ОПП (см. комментарий к Рекомендациям 2.2–2.3), в плане мониторинга конкретного пациента с ОПП заслуживает внимания еще один момент: влияние уровня гидратации на Scr. Показано, что у гипергидратированных пациентов уровень сывороточного креатинина может существенно уменьшаться, что, естественно, занижает и оценку тяжести ОПП. Выходом из этой ситуации может быть использование концентраций креатинина в сыворотке крови, корригированных на баланс жидкости:
Корригированный Scr = Scr × фактор коррекции.
Фактор коррекции = [масса тела при поступлении, кг × 0,6 + Σ (ежедневный кумулятивный баланс жидкости, л)] / масса тела при поступлении, кг × 0,6.
При этом ежедневный кумулятивный баланс жидкости рассчитывается как сумма ежедневного баланса жидкости (поступление жидкости в сутки — минус выведение жидкости, без учета неощутимых потерь воды) [Macedo E. и соавт., 2010].
Возможно также, что проблему невысокой информативности критериев ОПП, основанных на величине объема мочи (см. комментарий к Рекомендациям 2.2–2.3), можно отчасти разрешить при мониторинге почасового (сбор мочи в специальные градуированные мочеприемники) или даже поминутного объема мочи в режиме онлайн. В настоящее время появились мониторы, включающие в себя блок с системой оптической регистрации скорости потока мочи с расчетом минутного объема в режиме онлайн (flow-sensing technology). При этом динамическая регистрация минутного диуреза позволяет оценить состояние почечного кровотока при гиповолемии на ранних стадиях ее развития еще до того момента, когда в организме активируются процессы нейрогуморальной регуляции. Понятно, что подобная регистрация минутного диуреза в первую очередь касается соматически тяжелых пациентов, находящихся в ОРИТ [Shamir M.Y. и соавт., 2011].
Рекомендация 3.1.1
Для прогнозирования развития ОПП у пациентов с наличием факторов риска, которым планируется проведение медицинской процедуры, потенциально способной спровоцировать развитие данного состояния (например, оперативное вмешательство, рентгеноконтрастное исследование и др.), целесообразны исследование базальных уровней биомаркеров повреждения почек и оценка динамики их концентрации после выполнения вмешательств (2C).
Комментарий
Возможно, что применение биомаркеров повреждения почечной ткани в диагностике ОПП, по примеру использования кардиоспецифических белков в неотложной кардиологии, позволит оценивать формирование патологического процесса в почках на более ранних стадиях его развития, а следовательно, существенно улучшить результаты терапии.
Биомаркер, по определению являющийся не обязательно участником, но обязательно свидетелем патологического процесса [Edelstein C.L., 2011], должен отражать течение патогенетических этапов развития ОПП. Один из наиболее распространенных подходов к классификации — соотношение биомаркера с преимущественной локализацией повреждения определенного микроструктурного компартмента почки [Bonventre J.V. и соавт., 2010]. Другой подход основан на патофизиологическом принципе, когда определенные биомаркеры соотносятся с характером патологического процесса (табл. 3.1) [Tesch G.H., 2010]. Способность маркера отражать различные этапы течения ОПП предопределило их дифференциацию по клинической значимости [Noto A. и соавт., 2013]. Доказательная база в отношении предиктивной роли биомаркеров имеется для достаточно ограниченного числа молекул. К их числу могут быть отнесены маркеры почечной дисфункции, белки с повышенным синтезом при ОПП, низкомолекулярные белки мочи и внутриклеточные ферменты клеток тубулярного эпителия, которые составляют так называемую рабочую классификацию биомаркеров (табл. 3.1) [Geus H. и соавт., 2012].
/74.jpg)
NGAL — наиболее изученный биомаркер ОПП. Первые клинические исследования были выполнены у пациентов после кардиохирургических вмешательств в педиатрической практике. Была доказана роль данного маркера как чувствительного предиктора развития ОПП после оперативного вмешательства с применением АИК, а также после коронарографии. Менее очевидные результаты (чувствительность 38,1–50 %) были получены при обследовании взрослых пациентов, у которых, по всей вероятности, экспрессия NGAL изначально выше вследствие предсуществующего поражения почек. По результатам метаанализа, проведенного в 2009 г., куда было включено 2538 пациентов из 19 исследований, выполненных в восьми странах, сделаны выводы о возможности использования уровня NGAL крови и мочи в качестве ранней диагностики ОПП, доказана высокая чувствительность (95 %) и специфичность (95 %), а также возможность с его помощью предсказывать необходимость проведения заместительной почечной терапии и оценивать относительный риск смертности.
В клинической практике следует иметь в виду ряд ограничений по возможности использования NGAL в диагностике ОПП. Доказано, что уровень сывороточного NGAL может повышаться при исходном наличии ХБП, артериальной гипертензии, инфекциях, анемии, гипоксии, злокачественных новообразованиях [Вельков В.В., 2011]. Кроме того, имеются экспериментальные и клинические данные, демонстрирующие зависимость экскреции NGAL с мочой от уровня протеинурии [Пролетов Я.Ю., Саганова Е.С., Галкина О.В. и соавт., 2013]. Последний факт особенно актуален при диагностике ОПП у пациентов с нефротическим синдромом, которые, как известно, изначально предрасположены к преренальному ОПП. При обследовании 79 пациентов с первичной гломерулярной патологией было показано, что протеинурия выше 3,5 г/сут достоверно повышает уровень экскреции NGAL с мочой [Пролетов Я.Ю., Саганова Е.С., Галкина О.В. и соавт., 2013]. В табл. 3.2 представлены статистические показатели диагностической значимости определения NGAL в сыворотке крови и моче с целью диагностики ОПП.
/75.jpg)
KIM‑1 (kidney injury molecule, молекула почечного повреждения) — трансмембранный гликопротеин, имеющий отделяющийся внешний домен с молекулярной массой 90 кДа, концентрацию которого возможно определить в моче. Предполагается, что физиологическая роль этой молекулы — участие в регенераторных процессах при повреждении эпителиальных клеток. Доказано, что в физиологических условиях он практически не определяется в почечной ткани, но при воздействии различных повреждающих факторов на почку в клетках тубулярного эпителия происходит значительное повышение экспрессии KIM‑1. В клинических исследованиях данный маркер показал себя наиболее значимым в диагностике острого канальцевого некроза по сравнению с другими патогенетическими вариантами ОПП, выступая в роли чувствительного предиктора относительного риска летальности, необходимости проведения диализной терапии, в том числе у больных после кардиохирургических вмешательств [Koyner J.L., Vaidya V.S., Bennett M.R. et al., 2010].
L-FABP — печеночный протеин, связывающий жирные кислоты (L-FABP, liver fatty acid binding protein). Это цитоплазматический белок с молекулярной массой 15 кДа, который экспрессируется в тканях с повышенным метаболизмом жирных кислот. Он относится к семейству белков-переносчиков жирных кислот, которые участвуют в транспорте длинноцепочечных жирных кислот между интра- и экстрацеллюлярным пространством, а также регулируют оксидативный стресс, связывая липофильные продукты, ограничивая их повреждающее действие на клеточные мембраны.
В организме человека данная молекула синтезируется в основном в печени, но в небольших количествах обнаруживается в почках и тонком кишечнике. В нормальных условиях L-FABP отсутствует в моче, так как, фильтруясь в клубочках, затем полностью реабсорбируется в проксимальных канальцах, что позволяет диагностировать ОПП при их повреждении. Впервые это было продемонстрировано на модели ишемического канальцевого некроза у животных.
Данный маркер проявил себя в качестве чувствительного предиктора ОПП у детей после кардиохирургических вмешательств с применением АИК. У пациентов с ОПП на фоне септического шока уровень L-FABP повышен и определяет относительный риск смертности. Исследование концентрации этого маркера в моче позволило говорить о нем как о приемлемом биомаркере ОПП у пациентов, поступающих в отделения реанимации (AUC0,95, PPV 100 %, NPV 85 %) [Matsui K., Kamijo-Ikemori A., Hara M. et al., 2011].
Интерлейкин‑18 (IL‑18) — провоспалительный цитокин, продуцируется большим количеством клеток, в том числе макрофагами, остеобластами, клетками почечного и кишечного эпителия. В экспериментальных исследованиях с использованием специфического ингибитора (антитела) данного цитокина была доказана его роль в патогенезе ишемического острого канальцевого некроза, ишемии кишечника, миокарда, головного мозга, артритов [Edelstein C.L., 2011]. Впоследствии была выявлена повышенная экскреция IL‑18 с мочой у мышей с ишемическим острым канальцевым некрозом, сочетающаяся с увеличением экспрессии цитокина в почечной ткани, что предопределило появление клинических исследований, направленных на выяснение возможной роли IL‑18 в ранней диагностике ОПП у человека. Было установлено, что у пациентов после кардиохирургических вмешательств увеличение концентрации IL‑18 в крови может служить надежным признаком раннего развития ОПП. В ряде исследований, выполненных у пациентов в блоке интенсивной терапии, также было доказано значение IL‑18 в ранней диагностике ОПП [Endre Z.H., Pickering J.W., Walker R.J. et al., 2011]. В литературе имеются данные о повышении мочевой экскреции IL‑18 у пациентов с сепсисом [Siew E.D., Ikizler T.A., Gebretsadik T. et al., 2010]. Статистическая оценка диагностической значимости IL‑18 в диагностике ОПП приведена в табл. 3.3.
Функциональные маркеры. Цистатин С представляет собой полипептидную цепочку массой 13 кДа, состоящую из 120 аминокислот. Цистатин С относится к ингибиторам лизосомальных протеиназ и продуцируется всеми ядерными клетками организма, предохраняя организм от неконтролируемой активации протеолиза собственных белков. Цистатин С поступает из клеток в кровоток равномерно, и его сывороточная концентрация поддерживается на постоянном уровне [Каюков И.Г., Смирнов А.В., Эмануэль В.Л., 2012]. Небольшая молекулярная масса и низкое сродство к другим сывороточным белкам определяют способность данной молекулы свободно фильтроваться в почечных клубочках, поступать в канальцы, где она реабсорбируется за счет мегалин-кубулин-опосредованного эндоцитоза и затем полностью метаболизируется в эпителиоцитах проксимальных канальцев, вследствие чего в норме цистатин С экскретируется с мочой в минимальных количествах.
/76.jpg)
Средние параметры, отражающие диагностическую значимость цистатина С у пациентов c ОПП, отражены в табл. 3.4.
Панель биомаркеров. Свойство биомаркеров отражать повреждение различных локусов нефрона, возможность характеризовать течение определенных звеньев патологического процесса, необходимость диагностики ОПП, когда его этиология по клинико-лабораторным данным остается не вполне ясной, предопределило появление исследований, оценивающих диагностическую значимость измерения концентрации в крови и моче не одной, а сразу нескольких молекул. В проспективном исследовании больных после кардиохирургических вмешательств было показано, что метод, основывающийся на одновременном измерении концентраций NGAL, NAG и KIM‑1, обладает большей чувствительностью [Han W.K., Wagener G., Zhu Y. et al., 2009].
В другом исследовании, являющемся многоцентровым, было продемонстрировано, что одновременная оценка мочевых экскреций NGAL и KIM‑1 позволяет предсказывать начало заместительной почечной терапии и относительного риска смертности [Nickolas T.L., Schmidt-Ott K.M., Canetta P. et al., 2012]. В двуцентровом исследовании 529 пациентов, поступающих в отделение реанимации, сравнивалась роль шести мочевых биомаркеров (ГГТП, ЩФ, NGAL, цистатин С, KIM‑1, IL‑18). NGAL, цистатин С и IL‑18 являлись предикторами необходимости проведения диализной терапии, тогда как в отношении риска смертности предикторной ролью обладало большинство маркеров, кроме KIM‑1 [Endre Z.H., Pickering J.W., Walker R.J. et al., 2011]. Нет ответа на вопрос, какая комбинация биомаркеров является оптимальной, но, по мнению некоторых авторов, наиболее оправданным является сочетание маркеров с высокой чувствительностью, с одной стороны, и специфичностью — с другой.
Рекомендация 3.2
Диагностика при развитии ОПП должна быть направлена на выявление основного патогенетического варианта ОПП и жизнеугрожающих осложнений дисфункции органа(NG).
Рекомендация 3.2.1
При наличии критериев ОПП в срочном порядке должна быть выполнена диагностика, направленная на определение основного патогенетического варианта ОПП — преренального, постренального, ренального, что определяет прогноз и тактику ведения больного (NG).
Комментарий
Как уже указывалось выше, в патогенетическом плане ОПП рассматривается как совокупность механизмов, связанных с повреждением различных компартментов почки и приводящих к дисфункции органа. Этим определяется разнообразие причин, приводящих к снижению клубочковой фильтрации при ОПП.
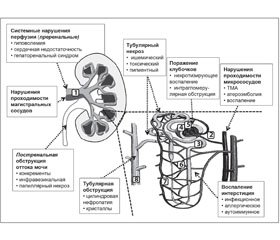
Причины ОПП подразделяются на три основные группы, которые являются основой патогенетической классификации данного состояния (рис. 3.1):
1) преренальные (связанные с гипоперфузией почек);
2) ренальные (связанные с прямым повреждением основных компартментов органа — внутрипочечных сосудов, клубочков, канальцев и интерстиция);
3) обструктивные (связанные с постренальной обструкцией тока мочи).
Механизмы развития ОПП и снижения КФ при повреждении разных компартментов почки — сосудов, клубочков, канальцев и интерстиция могут в значительной степени пересекаться. Поэтому четкую границу между различными патогенетическими вариантами ОПП зачастую провести невозможно. Например, преренальное ОПП, приведшее к развитию ишемического тубулярного некроза (ИТН), переходит в ренальное ОПП.
Основным требованием, предъявляемым к современной диагностике ОПП, является ее своевременность. Это объясняется тем, что ОПП любой стадии ассоциируется с высоким риском летальности. Так, даже незначительный подъем концентрации креатинина сыворотки крови на 0,3–0,4 мг/дл по сравнению с его базальным уровнем сопровождается увеличением относительного риска смерти на 70 % [Chertow G.M. и соавт., 2005].
Современную клиническую диагностику ОПП, соответствующую ее концептуальной модели (см. Введение), можно представить в виде континуума, то есть непрерывной цепи диагностического поиска, который, начинаясь с анализа факторов риска и заболеваний, ассоциирующихся с ОПП, продолжается на этапе формирования повреждения почечной паренхимы, охватывая при этом идентификацию осложнений, обусловленных дисфункцией почек, и заканчивается диагностикой исходов ОПП [Смирнов А.В., 2015].
Континуум клинической диагностики включает в себя два основных этапа. Первый этап — это предиктивная (predictive) диагностика, заключающаяся в клинической оценке эпидемиологических данных у постели пациента, факторов риска и ассоциированных с ОПП состояний, а также применение с диагностической целью ранних биомаркеров повреждения почек. Иными словами, предиктивную диагностику по отношению к самому ОПП можно охарактеризовать как доклиническую, которую проводят в «режиме ожидания».
Второй этап континуума клинической диагностики — это презентационная диагностика. Основные ее принципы — неотложность, соответствующая остроте процесса, и последовательность. Презентационная диагностика — это установление факта состоявшегося ОПП и его осложнений, разграничение основных патогенетических вариантов ОПП (преренальное, ренальное и постренальное), проведение внутрисиндромной, межсиндромной и частной дифференциальной диагностики.
В ходе осуществления презентационной диагностики врачу предстоит ответить на ряд вопросов, которые могут быть сформулированы следующим образом:
1. Имеется ли у пациента ОПП?
2. Не является ли ОПП результатом гиповолемии?
3. Не является ли ОПП результатом обструкции мочевыводящих путей?
4. Какова причина ренального ОПП у данного пациента?
5. Не являются ли симптомы (чаще лабораторные), которые можно было бы принять за признаки ОПП (в силу отсутствия данных анамнеза), результатом латентного (скрытого) течения ХБП?
6. Не произошло ли развитие ОПП у пациента, у которого прежде уже имелась ХБП (ОПП на ХБП)?
Перечисленные вопросы носят обязательный характер, и врачу необходимо аргументированно ответить на каждый из них, однако порядок вопросов может быть пересмотрен в зависимости от конкретной клинической ситуации. Незыблемым остается правило неотложной диагностики, в первую очередь пре- и постренального вариантов ОПП.
Можно выделить два варианта клинической презентации ОПП, которые определяют направление и ход дальнейшей диагностики: олиго-/анурический и неолигурический.
Олиго-/анурический вариант клинической презентации ОПП. При этом варианте ведущим клиническим симптомом в диагностическом процессе является олиго-/анурия.
Неолигурический вариант клинической презентации ОПП. В данном случае отправной точкой в диагностике служит не клинический симптом в виде умеренного ограничения диуреза, оценить который количественно у постели больного не представляется возможным вследствие нечеткости критериев, а клинические симптомы в виде азотемии (повышение концентрации в сыворотке крови креатинина, мочевины), дизэлектролитемии (гиперкалиемия) и др.
Общий ход диагностики с учетом вопросов, сформулированных выше, и анализом вариантов клинической презентации ОПП представлен в алгоритме (рис. 3.2).
Отдельного комментария заслуживает уже упомянутый вопрос о том, не являются ли симптомы (чаще лабораторные), которые можно было бы принять за признаки ОПП (в силу отсутствия данных анамнеза), результатом латентного (скрытого) течения ХБП?
Решение этого вопроса подразумевает проведение дифференциальной диагностики между ХБП и ОПП (межсиндромная дифференциальная диагностика) с привлечением целого ряда как клинических, так и лабораторных и инструментальных критериев (табл. 3.5).
Как видно из приведенных в табл. 3.5 данных, ни один из критериев не имеет абсолютного дифференциально-диагностического значения. Даже исследование биомаркеров может дать ложноположительный результат, особенно в случаях ХБП с высокой протеинурией. Очень важно определить сочетание различных симптомов. Например, достоверность (чувствительность) такого признака ХБП, как уменьшение в размерах почек и/или уменьшение толщины паренхимы (за счет коркового слоя), резко возрастает при одновременном выявлении анемии или низкого темпа прироста креатинина крови и т.д.
Рекомендация 3.2.2
Для раннего выявления основных жизнеугрожающих осложнений ОПП (гиперволемия, тяжелая уремическая интоксикация, дизэлектролитемия и метаболический ацидоз) рекомендуется мониторинг волемического статуса, ионограммы, кислотно-основного состояния крови (NG).
Рекомендация 3.3
Дифференциальную диагностику ОПП следует проводить с участием нефролога и начинать с исключения/подтверждения преренального и/или постренального вариантов; ренальное ОПП является диагнозом исключения (NG).
Рекомендация 3.3.1.
Следует основывать диагностику преренального ОПП на выявлении клинико-патогенетических факторов гипоперфузии почек (NG).
Комментарий
Наряду с диагностикой одного из трех основных патогенетических вариантов ОПП в каждом конкретном случае врачу следует распознать и ведущий патофизиологический фактор.
Например, при истинной гиповолемии в результате кровотечения и при сепсисе почки будут подвергаться гипоперфузии и ишемическому повреждению, то есть в обоих случаях будет формироваться преренальное ОПП. Однако в первом примере гипоперфузия будет обусловлена уменьшением ОЦК и СВ, тогда как во втором — снижением ЭЦО крови за счет вазодилатации. При кровотечении потребуется восстановление ОЦК и увеличение СВ за счет внутривенной инфузии жидкостей, а при сепсисе, помимо этого, необходимо будет введение вазоконстрикторов. С другой стороны, гипоперфузия может быть причиной развития не только преренального ОПП, но и ренального, как это можно наблюдать при билатеральном тромбозе почечных артерий.
Наиболее частой причиной гипоперфузии почек в клинике является гиповолемия (истинная или перераспределительная) (табл. 3.7). Далее следуют причины, обусловливающие снижение эффективного циркулирующего объема крови (ЭЦО) и перфузионного почечного давления (табл. 3.6).
В рамках общей схемы патогенеза гипоперфузии могут быть выделены следующие клинические синдромы:
— Гиповолемический синдром.
— Острый кардиоренальный синдром I типа.
— Синдром интраабдоминальной гипертензии.
— Гепаторенальный синдром I типа.
— Острый макроваскулярный синдром.
— Острый кортикальный некроз.
— Острый ишемический тубулярный некроз.
Выявление конкретного варианта (синдрома) гипоперфузии почек должно проводиться на основе сведений, представленных в соответствующих рекомендациях и руководствах [Смирнов А.В., Добронравов В.А., Румянцев А.Ш., Каюков И.Г. Острое повреждение почек. — М.: МИА, 2015; с разрешения издательства].
Рекомендация 3.3.2
Для диагностики постренального ОПП в кратчайшие сроки следует выполнить исследования, подтверждающие наличие инфраренальной обструкции с последующим уточнением ее конкретной причины с участием уролога (NG).
Комментарий
Оценка дилатации чашечек и лоханки при выполнении УЗИ почек в B-режиме — самый важный этап в семиологической дифференциальной диагностике симптома олиго-/анурии (особенно анурии) с целью исключения или подтверждения наличия обструктивного ОПП. Необходимо подчеркнуть, что при обструктивном ОПП расширение шеек чашечек и почечной лоханки регистрируется всегда на фоне неизмененной почечной паренхимы (в случае отсутствия предшествующей почечной патологии), тогда как при хронической обструкции, ведущей к развитию гидронефроза, всегда отмечается истончение окружающей паренхимы.
Расширение чашечно-лоханочной системы при УЗИ почек является достаточно чувствительным (95 %) и специфичным (70 %) диагностическим тестом для выявления обструкции мочевыводящих путей. Однако указанные статистические параметры следует всегда соотносить с клиническими данными. Если обструкция мочевыводящих путей развивается постепенно, как это наблюдается в случаях сдавления мочеточников извне (ретроперитонеальный фиброз, опухоли органов малого таза, колоректальный рак с метастазами и др.), и параллельно уменьшению диуреза снижается СКФ (а следовательно, скорость образования мочи), то расширение чашечно-лоханочной системы при первичном исследовании пациента может не выявляться.
Такая же ситуация отмечается в тех случаях, когда пациент самостоятельно ограничивает прием жидкости из-за пониженного чувства жажды (внеклеточная гипергидратация и гипоосмоляльность плазмы крови) или при других причинах, ведущих к дегидратации. Дилатация чашечно-лоханочной системы может также отсутствовать, когда периферические ткани, окружающие лоханку и мочеточники, вследствие уменьшения их комплайенса препятствуют развитию дилатации.
/81.jpg)
Во всех перечисленных случаях рекомендуется повторять УЗИ почек через несколько часов после введения пациенту жидкости, а в ряде ситуаций — после введения однократной дозы мочегонных. Ложноотрицательные данные при УЗИ почек в отношении обструкции мочевыводящих путей могут быть получены, если лоханка заполнена плотными массами: конкрементами, сгустками крови или гноя. Даже при самом тщательном УЗИ почек данные в отношении обструкции мочевыводящих путей в виде расширения чашечно-лоханочной системы могут быть отрицательными. В ряде случаев в дифференциальной диагностике помогает проведение допплеросонографии, при которой выявляется повышение индекса резистивности интраренальных артерий, что в сочетании даже с минимальным расширением чашечно-лоханочной системы позволяет высказаться в пользу обструктивного генеза ОПП. В затруднительных случаях всегда следует ориентироваться на клинические проявления: наличие остро развившейся анурии (которая редко когда отмечается в других случаях ОПП), отсутствие изменений в осадке мочи, даже при отрицательных данных УЗИ почек, дает врачу основание провести перкутанную нефростомию, с одной стороны, и, в случае получения диуреза, выполнить подобное оперативное пособие на контр–латеральной почке [Смирнов А.В., 2015].
Рекомендация 3.3.3
В случае ренального ОПП необходимо направить нефрологический диагностический поиск на определение локализации повреждения — сосудов, клубочков, канальцев, интерстиция или их сочетаний, что будет определять тактику ведения и прогноз больного (NG).
Комментарий
При дифференциальной диагностике ренального ОПП следует ориентироваться на определение клинических синдромов.
Гломерулярные (табл. 3.8):
— Острый нефритический синдром.
— Быстропрогрессирующий нефритический синдром.
— Острый микроваскулярный синдром.
Тубулоинтерстициальные (табл. 3.9, 3.10):
— Острый токсический тубулярный некроз.
— Острый гем-пигментный синдром.
— Синдром интраренальной тубулярной обструкции.
— Острый тубулоинтерстициальный нефритический синдром.
Нефритический синдром — клиническое отображение воспалительно-экссудативного процесса, локализующегося в клубочках почки и проявляющегося такими симптомами, как гематурия (макро- и микро-), протеинурия, цилиндрурия, снижение СКФ, периферические отеки, артериальная гипертензия, олигурия.
Под острым нефритическим синдромом (ОНС) понимают острое (1–5 дней) появление указанных симптомов у прежде здорового человека. Отеки, гипертензия и олигурия связаны со снижением СКФ и задержкой натрия в организме вследствие увеличения его реабсорбции в проксимальных канальцах (ФЭ Na < 1 %). В основе снижения СКФ лежит процесс ограничения фильтрационной поверхности капилляров вследствие гиперклеточности клубочка и гиперсократимости мезангиоцитов.
Под быстропрогрессирующим нефритическим синдромом (БПНС) понимают острое начало патологического процесса (1–2 нед.) с появления всех основных почечных симптомов, характеризующегося прогрессирующим снижением СКФ (приблизительно 2–3 мл/мин/сут или более), что обусловливает олигурию и нарастание азотемии. В течение 1–2 мес. (без лечения) формируется терминальная почечная недостаточность, требующая начала ЗПТ. В основе БПНС лежат агрессивные формы гломерулярного воспаления, характеризующиеся высокой концентрацией провоспалительных цитокинов, наличием протеолитических ферментов, продуцируемых пришлыми (из крови) нейтрофилами.
Артериальная гипертензия (объемзависимая), как правило, присутствует, однако она не достигает критических значений, так как активации ЮГА в этих условиях не происходит. Вследствие прогрессирующего снижения СКФ протеинурия чаще всего не достигает значений нефротической.
Острый микроваскулярный синдром — это гломерулярное ОПП, обусловленное остро возникшей окклюзией артериол мелкого калибра (приносящие артериолы) и капилляров почки. В основе окклюзии микрососудов лежат такие патологические процессы, как тромботические микроангиопатии, синдром ДВС, синдром холестериновой атероэмболии.
Тромботические микроангиопатии — это клинико-патологический синдром, объединяющий группу заболеваний с различной этиологией и патогенезом, на завершающих этапах действия которых наступает повреждение эндотелия с потерей им тромборезистентности и последующим формированием множества тромбоцитарных тромбов, окклюзирующих микроциркуляторное русло внутренних органов и тканей с развитием их ишемии и некроза. Вышеперечисленные патологические изменения лежат в основе формирования классической пентады клинических симптомов ТМА: тромбоцитопения, анемия, неврологические нарушения, ренальная дисфункция, лихорадка.
Детальная клиническая диагностика вышеперечисленных синдромов изложена в соответствующих руководствах и рекомендациях [Смирнов А.В., Добронравов В.А., Румянцев А.Ш., Каюков И.Г. Острое повреждение почек. — М.: МИА, 2015; с разрешения издательства].
Рекомендация 3.3.4
Если проведенная клиническая диагностика не позволяет определить характер ренального варианта ОПП, следует рассмотреть возможность выполнения диагностической биопсии в условиях специализированного нефрологического отделения в соответствии с действующими рекомендациями. Морфологический анализ биоптатов необходим для уточнения особенностей поражений сосудов микроциркуляции, клубочков и интерстиция, являющихся причиной ОПП (NG).
Комментарий
Нефробиопсия показана во всех случаях ренального ОПП неясной этиологии, поэтому необходимым условием для ее выполнения является надежное и достоверное исключение пре- и постренальных вариантов острой дисфункции почек на предварительном этапе клинико-лабораторно-инструментального обследования. При ренальном ОПП неясной этиологии 20 % нефрологов предпочитают выполнить биопсию почки на самых ранних этапах наблюдения больного, 26 % специалистов прибегают к ней через неделю от начала острой дисфункции почек, а 40 % врачей придерживаются выжидательной тактики и назначают нефробиопсию через 4 недели от начала ОПП в случаях отсутствия признаков восстановления функции почек [Fuiano G. и соавт., 2000]. В общем массиве всех нефробиопсий, выполненных с диагностической целью, на долю ОПП приходится от 12 до 16 % [Rivera F. и соавт., 2004; Lopez-Gomez J.M. и соавт., 2008].
Пожилой возраст пациентов (> 65 лет) и беременность не являются абсолютными противопоказаниями к проведению биопсии почки, однако в последнем случае к ней обычно прибегают после родоразрешения. В современных условиях, когда частота острого лекарственного интерстициального нефрита в результате полипрагмазии резко возросла, нефробиопсия у пожилых больных зачастую становится единственной процедурой в установлении нозологии ОПП.
Показания к проведению нефробиопсии у пациентов с ренальным ОПП неясной этиологии могут быть суммированы следующим образом:
— наличие анурии или продолжительной олигурии (более 2–3 недель);
— клинические данные (анамнез, физикальное и лабораторное исследование), свидетельствующие о системном процессе (СКВ, васкулиты);
— быстропрогрессирующий нефритический синдром;
— легочно-почечный синдром;
— наличие выраженной артериальной гипертензии в отсутствие признаков гиперволемии (после коррекции артериального давления);
— наличие ОПП у тяжелых соматических больных в отсутствие данных о пре- и постренальной дисфункции почек.
Противопоказания к проведению биопсии почки при ОПП редко носят абсолютный характер (например, системные нарушения коагуляции) и чаще являются относительными, к которым можно отнести:
— наличие единственной функционирующей почки (врожденная или приобретенная патология);
— анатомические аномалии развития мочевыводящей системы;
— гидронефроз (с одной или двух сторон);
— симметрично уменьшенные в размерах почки (длина < 9 см по данным УЗИ);
— наличие локальных инфекций (периренальной, на коже в месте предполагаемой пункции);
— неконтролируемая артериальная гипертензия;
— множественные кисты обеих почек или подозрение на опухоль почки;
— некомплайенсный больной.
В случаях крайней необходимости проведения нефробиопсии, но при наличии относительных противопоказаний к ней, в ряде случаев прибегают к открытой (операционной) биопсии почек.
Рабочая группа членов Ассоциации нефрологов России
Руководители группы
Смирнов А.В., директор Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Добронравов В.А., заместитель директора Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Члены группы
Румянцев А.Ш., профессор кафедры факультетской терапии медицинского факультета Санкт-Петербургского государственного университета, д.м.н.
Шилов E.М., заведующий кафедрой нефрологии и гемодиализа Института профессионального образования Первого Московского государственного медицинского университета им. И.М. Сеченова, главный внештатный специалист, нефролог Министерства здравоохранения России, д.м.н., профессор
Ватазин А.В., руководитель отдела оперативной нефрологии и хирургической гемокоррекции Московского областного научно-исследовательского института им. М.Ф. Владимирского, д.м.н., профессор
Каюков И.Г., заведующий лабораторией клинической физиологии почек Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Кучер А.Г., профессор кафедры пропедевтики внутренних болезней Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н.
Есаян А.М., заведующий кафедрой нефрологии и диализа Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Продолжение в следующем номере
Материал публикуется с разрешения авторов
и редакции журнала «Нефрология»
Впервые опубликовано в журнале «Нефрология». —
2016. — № 20(1). — С. 79-104

/65.jpg)
/66.jpg)
/67_3.jpg)
/67_2.jpg)
/68.jpg)
/69.jpg)
/71.jpg)
/71_2.jpg)
/72.jpg)
/72_2.jpg)
/74.jpg)
/75.jpg)
/76.jpg)
/77.jpg)
/78.jpg)
/79.jpg)
/80.jpg)
/81.jpg)
/82.jpg)
/83.jpg)