Статтю опубліковано на с. 106-110
Вступ
Зумовлюючи високий рівень смертності та частоти госпіталізації пацієнтів, хронічна серцева недостатність (ХСН) залишається актуальною проблемою сучасної медицини (Воронков Л.Г., 2012).
Провідним етіологічним чинником ХСН є ішемічна хвороба серця (ІХС), яка за рахунок поєднання з ожирінням сприяє прогресуванню ХСН і погіршенню прогнозу в даної когорти хворих.
З позиції сучасних поглядів на патогенез ХСН на окрему увагу заслуговує ендотелійзалежна вазодилататорна відповідь, що у таких хворих є значно зниженою (Carolyn S.P. et al., 2012).
Продемонстровано, що в реалізації ендотелійзалежної вазодилататорної відповіді відіграє роль генетичний поліморфізм, зокрема поліморфізм гена ендотеліальної синтази оксиду азоту (eNOS) (Glu298Asp) (Salimi S. et al., 2010; Sharma D. et al., 2014; Yaghmaei M. et al., 2011).
Мета — визначити наявність зв’язків між поліморфізмом гена ендотеліальної синтази оксиду азоту (Glu298Asp) і розвитком та прогресуванням хронічної серцевої недостатності у хворих на ішемічну хворобу серця й ожиріння.
Матеріали та методи
З метою дослідження проведено комплексне обстеження 222 хворих з ІХС та ожирінням, які перебували на лікуванні в кардіологічному відділенні КЗОЗ «Харківська міська клінічна лікарня № 27», що є базовим лікувальним закладом кафедри внутрішньої медицини № 2 і клінічної імунології та алергології Харківського національного медичного університету МОЗ України. Групу порівняння становили 115 хворих на ІХС з нормальною масою тіла. До контрольної групи увійшло 35 практично здорових осіб. Групи були порівнянні за віком і статтю. У дослідження не включали хворих з тяжкою супутньою патологією органів дихання, травлення, нирок та осіб з онкологічними захворюваннями.
Діагноз встановлювався відповідно до діючих наказів МОЗ України.
Усім хворим проводили загальноклінічні та інструментальні обстеження.
Дослідження алельного поліморфізму Glu298Asp гена eNOS проводили методом полімеразної ланцюгової реакції з електрофоретичною детекцією результатів з використанням наборів реактивів «SNP-Експрес» виробництва ТОВ НВФ «Літех» (РФ). Виділення ДНК з цільної крові виконували за допомогою реагенту «ДНК-експрес-кров» виробництва ТОВ НВФ «Літех» (РФ) відповідно до інструкції. Правильність розподілу частот генотипів визначалася відповідністю рівноваги Харді — Вайнберга (pi2 + 2 pipj + pj2 = 1). Згідно з Гельсінкською декларацією всі пацієнти були поінформовані про проведення клінічного дослідження й дали згоду на визначення поліморфізму досліджуваного гена.
Отримані результати подані у вигляді середнього значення ± стандартне відхилення від середнього значення (М ± m). Статистичну обробку даних здійснювали за допомогою пакета Statistica 6.0. Оцінку відмінностей між групами при розподілі, близькому до нормального, проводили за допомогою критерію Пірсона. Статистично вірогідними вважали відмінності при р < 0,05.
Результати та їх обговорення
Тест на дотримання рівноваги Харді — Вайнберга частот генотипів поліморфного локусу Glu298Asp гена eNOS показав, що в групі хворих на ІХС у цілому та в контрольній групі є статистично значущі (р = 0,002 і р = 0,0015 відповідно) відмінності щодо виявлення частот генотипів та очікуваних, розрахованих відповідно до закону Харді — Вайнберга. У групі хворих з ІХС й ожирінням таких відмінностей не виявлено. Результати дослідження частоти виявлення алелей і генотипів поліморфного локусу Glu298Asp гена eNOS у цілому в групі контролю та в групах хворих на ХСН подані в табл. 1.
У контрольній групі мав місце такий розподіл частоти алелей і генотипів поліморфізму гена eNOS (Glu298Asp): носіями алелі А були 13 осіб, що становило 37,14 %, алелі G — 22 особи (62,86 %); генотипи G/А, А/А і G/G мали 17 (48,57 %), 6 (17,14 %) і 12 (34,29 %) осіб відповідно.
Носіями алелі А були 31 хворий на ІХС, що дорівнювало 26,96 %, алелі G — 84 пацієнти (73,04 %). Генотипи G/А, А/А і G/G мали 46 (40,00 %), 12 (10,43 %) і 57 (49,57 %) хворих на ІХС відповідно.
У групі хворих із поєднаним перебігом ІХС та ожиріння носіями алелі А були 64 пацієнти (28,80 %), алелі G — 158 осіб (71,29 %); генотипів G/А, А/А і G/G — 91 (40,99 %), 22 (9,91 %) і 109 (49,10 %) відповідно.
Порівняння частоти виявлення алелей і генотипів поліморфізму гена eNOS (Glu298Asp) між групами показало наявність вірогідних відмінностей щодо алелей А, G і генотипу G/G. У хворих на ІХС частіше зустрічалися алель G (на 10,18 %) і генотип G/G (на 15,28 %), ніж у контрольній групі. Алель А на 10,18 % частіше зустрічалася в контрольній групі, ніж у хворих на ІХС. Так само й в групі хворих з ІХС й ожирінням: алель G і генотип G/G зустрічались на 8,34 і 14,81 % частіше, а алель А — на 8,34 % рідше, ніж у контрольній групі.
У даному дослідженні при проведенні порівняльного аналізу розподілу частот алелей і генотипів поліморфізму гена eNOS (Glu298Asp) між групами обстежених хворих статистично вірогідних відмінностей не встановлено, що, можливо, пов’язано з особливостями вибірки або підпорядкованістю дії цього поліморфного маркера іншим генетичним чинникам.
Отже, за результатами нашого дослідження, алель G і генотип G/G поліморфізму гена eNOS (Glu298Asp) були асоційовані з розвитком ІХС.
Частота розподілу генотипів поліморфізму гена eNOS (Glu298Asp), за даними літератури, істотно відрізняється в досліджуваних популяціях, більше того, одна група дослідників пов’язує ризик виникнення ІХС (Тепляков А.Т. и соавт., 2010) та негативні впливи на її перебіг із наявністю алелі G (Кузнецова Т.Ю. и соавт., 2007), інша — з алеллю А (Dell’Omo G. et al., 2007; Joshi M. et al., 2007).
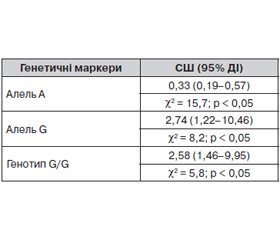
Наявність алелі G та генотипу G/G поліморфізму гена eNOS (Glu298Asp) у хворих на ІХС із супутнім ожирінням була пов’язана з розвитком ХСН (співвідношення шансів (СШ) = 2,74, 95% довірчий інтервал (ДІ) [1,22–10,46], χ2 = 8,2; р < 0,05, і СШ = 2,58, 95% ДІ = [1,46–9,95], χ2 = 5,8; р < 0,05 відповідно), тоді як алель А була пов’язана зі зниженням ризику розвитку ХСН (СШ = 0,33, 95% ДІ = [0,19–0,57], χ2 = 15,7; р < 0,05) (табл. 2).
Нами було проведено дослідження впливу поліморфізму гена eNOS (Glu298Asp) на прогресування ХСН у хворих на ІХС й ожиріння, результати якого подані в табл. 3.
У хворих на ІХС й ожиріння з ХСН І функціонального класу (ФК) алель А поліморфізму гена eNOS (Glu298Asp) зустрічалася в 15 хворих, що становило 30 %, алель G — у 35 хворих (70 %), а генотипи G/A, А/А і G/G — у 21 (42 %), 6 (12 %) і 23 (46 %) пацієнтів відповідно. У другій підгрупі носіями алелі А були 26 осіб, що дорівнювало 22,03 %, алелі G — 92 хворі (77,97 %), а генотипів G/A, А/А і G/G — 44 (37,28 %), 9 (7,63 %) і 65 (55,09 %) пацієнтів відповідно. У третій підгрупі частота виявлення алелей і генотипів була така: для алелі А — 11 (20,37 %), алелі G — 43 (79,63 %), генотипів G/A, А/А і G/G — 21 (38,89 %), 5 (9,26 %) і 28 (51,85 %) відповідно.
/108_2.jpg)
Проведення порівняльного аналізу виявило вірогідне збільшення частоти виявлення алелі G і зменшення алелі А поліморфізму гена eNOS (Glu298Asp) від І до ІІІ–IV ФК ХСН у хворих на ІХС й ожиріння. Так, алель А зустрічалася частіше на 7,97 і 9,63 % у хворих першої підгрупи, ніж у пацієнтів другої та третьої підгруп, а алель G, навпаки, рідше (р < 0,05).
Отже, прогресування ХСН у хворих на ІХС й ожиріння асоціювалось з алеллю G поліморфізму гена eNOS (Glu298Asp), а алель А мала захисні властивості.
У дослідженні M.W. Velloso і співавт. (2010) уперше було проведено оцінку зв’язку поліморфізму гена eNOS (Glu298Asp) із ХСН у населення Бразилії та отримано результати, що не суперечать нашим: частота виявлення алелі G у групі хворих була 72 %, а генотипу G/G — 49 %, що дозволило зробити науковцям висновок про взаємозв’язок алелі G і генотипу G/G із розвитком та прогресуванням ХСН. З іншого боку, канадське дослідження, у якому оцінювались кілька поліморфізмів, у тому числі Т‑786C і Glu298Asp, не продемонструвало ніяких зв’язків між цими поліморфізмами та ХСН (Zakrzewski-Jakubiak M. et al., 2008). Отже, клінічні докази свідчать про те, що поліморфізми гена eNOS (зокрема, Glu298Asp) можуть мати різні ефекти залежно від раси (McNamara D.M. et al., 2009; Tanus-Santos J.E., 2001).
Крім того, ми проаналізували частоту виявлення алелей і генотипів поліморфізму гена eNOS (Glu298Asp) залежно від фракції викиду (ФВ) лівого шлуночка (ЛШ) у хворих на ІХС й ожиріння (табл. 4).
У хворих із систолічною дисфункцією ЛШ алель А зустрічалася у 27 пацієнтів, що становило 22,31 %, алель G — у 94 (77,69 %), генотипи G/A, А/А і G/G — у 48 (39,67 %), 10 (8,26 %) і 63 (52,07 %) відповідно. Розподіл частоти виявлення алелей і генотипів у хворих із ФВ > 45 % відбувався таким чином: носіями алелі А були 35 (34,65 %) хворих, алелі G — 66 (65,35 %), а генотипів G/A, А/А і G/G — 45 (44,55 %), 12 (11,88 %) і 44 (43,57 %) особи відповідно. Вірогідно частіше у хворих із систолічною дисфункцією ЛШ зустрічалися алель G і генотип G/G (на 12,34 і 8,5 % відповідно), ніж у пацієнтів першої підгрупи, що підтверджує попередні результати.
Деякі дослідники пов’язують поліморфізм Glu298Asp (rs1799983) гена еNOS із дозозалежним зниженням ферментативної активності еNOS і зниженням продукції NO (Casas J.P. et al., 2006). Зниження синтезу NO ендотеліальними клітинами судин є одним з патофізіологічних базисів розвитку та прогресування ХСН (Cooke J.P., 2000). Тобто, згідно з наведеними вище результатами, зв’язок алелі G і генотипу G/G поліморфізму гена eNOS (Glu298Asp) із систолічною дисфункцією ЛШ і прогресуванням ХСН у хворих на ІХС й ожиріння призводить до розвитку ендотеліальної дисфункції за рахунок зменшення продукції NO клітинами ендотелію.
Висновки
1. Алель G і генотип G/G поліморфізму гена eNOS (Glu298Asp) було асоційовано з розвитком ІХС. Наявність алелі G та генотипу G/G поліморфізму гена eNOS (Glu298Asp) у хворих на ІХС із супутнім ожирінням була пов’язана з розвитком ХСН (СШ = 2,74, 95% ДІ = [1,22–10,46], χ2 = 8,2; р < 0,05, і СШ = 2,58, 95% ДІ = [1,46–9,95], χ2 = 5,8; р < 0,05 відповідно), тоді як алель А була пов’язана зі зниженням ризику розвитку ХСН (СШ = 0,33, 95% ДІ = [0,19–0,57], χ2 = 15,7; р < 0,05).
2. Прогресування ХСН у хворих на ІХС й ожиріння асоціювалось з алеллю G поліморфізму гена eNOS (Glu298Asp), а алель А мала захисні властивості.
Список литературы
1. Endothelial nitric oxide synthase gene polymorphisms and cardiovascular disease: a HuGE review / [J.P. Casas, G.L. Cavalleri, L.E. Bautista et al.] // Amer. J. Hum. Gen. Epidemiol. — 2006. — Vol. 17. — P. 1-15.
2. Cooke J.P. The endotelium: a new target for therapy / J.P. Cooke // Vase. Med. — 2000. — Vol. 5. — Р. 49-53.
3. Lack of association between endothelial nitric oxide synthase gene polymorphisms, microalbuminuria and endothelial dysfunction in hypertensive men / [G. Dell’Omo, G. Penno, L. Pucci et al.] // J. Hypertens. — 2007. — Vol. 25 (7). — Р. 1389-1395.
4. Biochemical consequences of the NOS3 Glu298Asp variation in human endothelium: altered caveolar localizacion and impaired response to shear / [M. Joshi, C. Mineo, P. Shaul et al.] // FASEB J. — 2007. — Vol. 21 (11). — Р. 2655-2663.
5. Lam C.S. Brutsaert endothelial dysfunction a pathophysiologic factor in heart failure with preserved ejection fraction / C.S. Lam, D.L. Brutsaert // J. Am. Coll Cardiol. — 2012. — Vol. 60(18). — Р. 1787-1789.
6. Endothelial nitric oxide synthase (NOS3) polymorphisms in African Americans with heart failure: results from the A-HeFT trial / [D.M. McNamara, S.W. Tam, M.L. Sabolinski et al.] // J. Card. Fail. — 2009. — Vol. 15. — P. 191-198.
7. Endothelial nitric oxide synthase gene Glu298Asp polymorphism in patients with coronary artery disease / [S. Salimi, A.B. Mohsen Firoozrai, Z.C. Hamid et al.] // Ann. Saudi Med. — 2010. — Vol. 30 (1). — P. 33-37.
8. Endothelial nitric oxide synthase (eNOS) gene Glu298Asp polymorphism and expression in North Indian preeclamptic women / [D. Sharma, S.A. Hussainemail, N. Akhteremail et al.] // Pregnancy Hypertension. — 2014. — Vol. 4(1). — Р. 65-69.
9. Tanus-Santos J.E. Effects of ethnicity on the distribution of clinically relevant endothelial nitric oxide variants / Tanus-Santos J.E., Desai M., Flockhart D.A. // Pharmacogenetics. — 2001. — Vol. 11. — Р. 719-725.
10. Endothelial nitric oxide synthase Glu298Asp gene polymorphism in a multi-ethnical population with heart failure and controls / [M.W. Velloso, S.B. Pereira, L. Gouveia et al.] // Nitric Oxide. — 2010. — Vol. 22(3). — Р. 220-225.
11. September Endothelial nitric oxide synthase gene Glu298Asp polymorphism and risk of preeclampsia in South East of Iran / [M. Yaghmaei, S. Salimi, M. Mokhtari et al.] // Afr. J. of Biotechnol. — 2011. — Vol. 10 (52). — Р. 10712-10717.
12. Ten renin-angiotensin system-related gene polymorphisms in maximally treated Canadian Caucasian patients with heart failure / [M. Zakrzewski-Jakubiak, S. de Denus, M.P. Dube et al.] // Br. J. Clin. Pharmacol. — 2008. — Vol. 65. — P. 742-751.
13. Воронков Л.Г. Пацієнт із ХСН в Україні: аналіз усієї популяції пацієнтів, обстежених у рамках першого національного зрізового дослідження UNIVERS / Л.Г. Воронков // Серцева недостатність. — 2012. — № 1. — С. 8-13.
14. Хроническая сердечная недостаточность у пациентов с артериальной гипертензией и полиморфизмы Glu298Asp NO-синтазы и С24Тр22phox гена NADPH-оксидазы / [Т.Ю. Кузнецова, И.П. Дуданов, Д.В. Гаврилов и др.] // Сердечная недостаточность. — 2007. — № 6 (44). — C. 274-277.
15. Полиморфизм генов eNOS и iNOS при хронической сердечной недостаточности у больных ишемической болезнью сердца / [А.Т. Тепляков, С.Н. Шилов, Е.Н. Березикова и др.] // Кардиол. — 2010. — № 4. — С. 34-38.
1. Casas J.P., Cavalleri G.L., Bautista L.E. et al. Endothelial nitric oxide synthase gene polymorphisms and cardiovascular disease: a HuGE review. Amer. J. Hum. Gen. Epidemiol. 2006; 17: 1–15.
2. Cooke J.P. The endotelium: a new target for therapy. Vase. Med. 2000; 5: 49–53.
3. Dell’Omo G., Penno G., Pucci L. et al. Lack of association between endothelial nitric oxide synthase gene polymorphisms, microalbuminuria and endothelial dysfunction in hypertensive men. J. Hypertens. 2007; 25 (7): 1389–1395.
4. Joshi M., Mineo C., Shaul P. et al. Biochemical consequences of the NOS3 Glu298Asp variation in human endothelium:altered caveolar localizacion and impaired response to shear. FASEB J. 2007; 21 (11): 2655–2663.
5. Lam C.S., Brutsaert D.L. Brutsaert endothelial dysfunction a pathophysiologic factor in heart failure with preserved ejection fraction. J Am Coll Cardiol. 2012; 60(18):1787–1789.
6. McNamara D.M., Tam S.W., Sabolinski M.L. et al. Endothelial nitric oxide synthase (NOS3) polymorphisms in African Americans with heart failure: results from the A-HeFT trial. J. Card Fail. 2009; 15: 191–198.
7. Salimi S., Mohsen Firoozrai A.B., Hamid Z. C. et al. Endothelial nitric oxide synthase gene Glu298Asp polymorphism in patients with coronary artery disease. Ann Saudi Med. 2010; 30(1): 33–37.
8. Sharma D., Hussainemail S.A., Akhteremail N. et al. Endothelial nitric oxide synthase (eNOS) gene Glu298Asp polymorphism and expression in North Indian preeclamptic women. Pregnancy Hypertension. 2014; 4(1): 65–69.
9. Tanus-Santos J.E., Desai M., Flockhart D.A. Effects of ethnicity on the distribution of clinically relevant endothelial nitric oxide variants. Pharmacogenetics. 2001; 11: 719–725.
10. Velloso M.W., Pereira S.B., Gouveia L. et al. Endothelial nitric oxide synthase Glu298Asp gene polymorphism in a multi-ethnical population with heart failure and controls. Nitric Oxide. 2010; 22(3): 220–225.
11. Yaghmaei M., Salimi S., Mokhtari M. et al. September Endothelial nitric oxide synthase gene Glu298Asp polymorphism and risk of preeclampsia in South East of Iran. Afr. J. of Biotechnol. 2011; 10(52): 10712–10717.
12. Zakrzewski-Jakubiak M., de Denus S., Dube M.P. et al. Ten renin-angiotensin system-related gene polymorphisms in maximally treated Canadian Caucasian patients with heart failure. Br. J. Clin. Pharmacol. 2008; 65: 742–751.
13. Voronkov L.H. Patsiyent iz KhSN v Ukrayini: analiz usiyeyi populyatsiyi patsiyentiv, obstezhenykh u ramkakh pershoho natsional’noho zrizovoho doslidzhennya UNIVERS. Sertseva nedostatnist’. 2012; 1: 8–13. Ukrainian.
14. Kuznetsova T.Yu., Dudanov Y.P., Havrylov D.V. y dr. Khronycheskaya serdechnaya nedostatochnost’ u patsyentov s arteryal’noy hypertenzyey y polymorfyzmы Glu298Asp NO-syntazы y S24Tr22phox hena NADPH-oksydazы. Serdechnaya nedostatochnost’. 2007; 6 (44): 274–277. Russian.
15. Teplyakov A.T., Shylov S.N., Berezykova E.N. y dr. Polymorfyzm henov eNOS y iNOS pry khronycheskoy serdechnoy nedostatochnosty u bol’nыkh yshemycheskoy bolezn’yu serdtsa. Kardyol. 2010; 4: 34–38. Russian.
/108.jpg)

/107.jpg)
/108_2.jpg)
/109.jpg)