Резюме
Метою роботи була оцінка антиоксидатної та протизапальної активності інгібітору 5-ліпоксигенази кверцетину, а також вливу препарату на функцію ендотелію у пацієнтів із гострим коронарним синдромом (ГКС) з елевацією сегмента ST на електрокардіограмі на фоні сучасного лікування. Обстежені 94 пацієнти, які надійшли у перші 12 годин від розвитку симптоматики захворювання та отримали реперфузійну терапію методом первинної ангіопластики. Пацієнти були розподілені на дві групи у співвідношенні 2 : 1. Додатково до базисної терапії ГКС 60 хворих отримували інгібітор 5-ліпоксигенази кверцетин, 34 пацієнти становили контрольну групу. Пацієнти обох груп не відрізнялися за основними клініко-анамнестичними показниками, характеристиками інфаркту міокарда та проведеним базисним лікуванням. Результати проби з потікзалежною вазодилатацією (ППЗВ) на 1-шу добу в обох групах не відрізнялися (р = 0,654). У динаміці госпітального періоду відзначено суттєве збільшення приросту діаметра плечової артерії при ППЗВ у групі кверцетину (6,45 ± 1,02 % на 1-шу добу проти 9,96 ± 0,94 % на 7-му добу відповідно, р = 0,004) за відсутності змін у контрольній групі (р = 0,324). Терапія кверцетином суттєво не впливала на динаміку рівнів фактора Віллебранда, розчинного E-селектину, розчинного CD40 ліганду та С-реактивного білка. Відзначено суттєве підвищення вмісту VEGF на 7-му добу у групі кверцетину (149,3 ± 47,2 пкг/мл на 1-шу добу проти 396,0 ± 64,7 пкг/мл на 7-му добу відповідно, р = 0,002) на відміну від контрольної групи (p = 0,373). Рівень мієлопероксидази (МПО) у плазмі крові хворих із гострим інфарктом міокарда (ГІМ) на 1-шу добу в обох виділених групах суттєво не відрізнявся (p = 0,603). Виявлені тісний обернений кореляційний зв’язок (r = –0,46; p = 0,006) між умістом МПО в плазмі крові та результатами ППЗВ на 1-шу добу, а також обернена кореляція між змінами рівня МПО та змінами результатів ППЗВ у динаміці госпітального періоду (r = –0,40; p = 0,01). Терапія кверцетином сприяла значному зниженню рівня МПО в плазмі крові хворих із ГІМ (611,7 ± 83,3 нг/мл на 1-шу добу проти 382,4 ± 65,4 нг/мл на 7-му добу, р = 0,013), чого не спостерігалося в контрольній групі (525,9 ± 122,3 нг/мл на 1-шу добу проти 437,6 ± 104,8 нг/мл на 7-му добу, р = 0,210). За результатами клінічного спостереження, хворі, яким додатково до базисної терапії призначався кверцетин, характеризувалися зменшенням проявів гострої лівошлуночкової недостатності протягом госпітального періоду спостереження. Отже, інгібітор 5-ліпоксигенази кверцетин у хворих на ГІМ з елевацією сегмента ST не справляє додаткового протизапального ефекту, але позитивно впливає на функцію ендотелію та має антиоксидатні властивості (зниження рівня МПО), що обумовлює тенденцію до зменшення внутрішньогоспітальних ускладнень на фоні кверцетину навіть в умовах сучасної терапії ГКС.
Целью работы была оценка антиоксидатной и противовоспалительной активности ингибитора 5-липоксигеназы кверцетина, а также воздействия препарата на функцию эндотелия у пациентов с острым коронарным синдромом (ОКС) с элевацией сегмента ST на электрокардиограмме на фоне современного лечения. Обследованы 94 пациента, поступившие в первые 12 часов с момента развития симптоматики заболевания, которые получили реперфузионную терапию методом первичной ангиопластики. Пациенты были распределены на две группы в соотношении 2 : 1. Дополнительно к базисной терапии ГКС 60 больных получали ингибитор 5-липоксигеназы кверцетин, 34 пациента составили контрольную группу. Пациенты обеих групп не отличались по основным клинико-анамнестическим показателям, характеристикам инфаркта миокарда и проведенному базисному лечению. Результаты пробы с поток-зависимой вазодилатацией (ППЗВ) на 1-е сутки в обеих группах не отличались (р = 0,654). В динамике госпитального периода отмечено существенное увеличение прироста диаметра плечевой артерии при ППЗВ в группе кверцетина (6,45 ± 1,02 % на 1-е сутки против 9,96 ± 0,94 % на 7-е сутки соответственно, р = 0,004) при отсутствии изменений в контрольной группе (р = 0,324). Терапия кверцетином существенно не влияла на динамику уровней фактора Виллебранда, растворимого E-селектина, растворимого CD40 лиганда и С-реактивного белка. Отмечено существенное повышение содержания VEGF на 7-е сутки в группе кверцетина (149,3 ± 47,2 пкг/мл в 1-е сутки против 396,0 ± 64,7 пкг/мл на 7-е сутки соответственно, р = 0,002) в отличие от контрольной группы (p = 0,373). Уровень миелопероксидазы (МПО) в плазме крови больных с острым инфарктом миокарда (ОИМ) на 1-е сутки в обеих выделенных группах существенно не отличался (p = 0,603). Выявлена тесная обратная корреляционная связь (r = –0,46; p = 0,006) между содержанием МПО в плазме крови и результатами ППЗВ на 1-е сутки, а также обратная корреляция между изменениями уровня МПО и изменениями результатов ППЗВ в динамике госпитального периода (r = –0,40; p = 0,01). Терапия кверцетином приводила к значительному снижению уровня МПО в плазме крови больных с ОИМ (611,7 ± 83,3 нг/мл на 1-е сутки против 382,4 ± 65,4 нг/мл
на 7-е сутки, р = 0,013), что не наблюдалось в контрольной группе (525,9 ± 122,3 нг/мл на 1-е сутки против 437,6 ± 104,8 нг/мл на 7-е сутки, р = 0,210). По результатам клинического наблюдения, больные, которым дополнительно к базисной терапии назначался кверцетин, характеризовались уменьшением проявлений острой левожелудочковой недостаточности в течение госпитального периода наблюдения. Следовательно, ингибитор 5-липоксигеназы кверцетина больным ОИМ с элевацией сегмента ST не оказывает дополнительного противовоспалительного эффекта, но положительно влияет на функцию эндотелия и имеет антиоксидатные свойства (снижение уровня МПО), что обусловливает тенденцию к уменьшению внутригоспитальных осложнений на фоне приема кверцетина даже в условиях современной терапии ГКС.
The objective was to evaluate the antioxidant and anti-inflammatory activity of 5-lipoxygenase inhibitor quercetin, as well as the impact of the drug on endothelial function in patients with acute coronary syndrome (ACS) with ST-segment elevation on the electrocardiogram on the background of modern treatment. The study involved 94 patients who were hospitalized within the first 12 hours of developing symptoms of the disease and received reperfusion therapy by primary angioplasty method. Patients were divided into two groups in a ratio of 2 : 1. In addition to the basic treatment for ACS, 60 patients received 5-lipoxygenase inhibitor quercetin, 34 patients were in the control group. Patients in both groups did not differ in main clinical and anamnestic parameters, characteristics of myocardial infarction and basic treatment. Results of tests with flow-dependent vasodilation (FDV) on the 1st day in both groups did not differ (p = 0.654). During hospital period, we marked a significant increase in brachial artery diameter in FDV in corvitin group (6.45 ± 1.02 % on the 1st day against 9.96 ± 0.94 % on the 7th day, respectively, p = 0.004) in the absence of changes in the control group (p = 0.324). Quercetin therapy had not a significant impact on the dynamics of von Willebrand factor, soluble E-selectin, soluble CD40 ligand and C-reactive protein levels. We have detected a significant increase in the content of vascular endothelial growth factor on the 7th day in quercetin group (149.3 ± 47.2 pcg/ml on the 1st day versus 396.0 ± 64.7 pg/ml on the 7th day, respectively, p = 0.002) as opposed to the control group (p = 0.373). The level of myeloperoxidase (MPO) in the blood plasma of patients with acute myocardial infarction (AMI) on the 1st day in two selected groups did not differ significantly (p = 0.603). We have revealed a strong inverse correlation (r = –0.46; p = 0.006) between MPO content in the blood plasma and results of FDV on the 1st day, as well as an inverse correlation between the changes in MPO level and FDV changes in the dynamics of hospital period (r = –0.40; p = 0.01). Quercetin therapy led to a significant reduction of MPO in the blood plasma of patients with AMI (611.7 ± 83.3 ng/ml on the 1st day versus 382.4 ± 65.4 ng/ml on the 7th day, p = 0.013), which was not observed in the control group (525.9 ± 122.3 ng/ml on the 1st day versus 437.6 ± 104.8 ng/ml on the 7th day, p = 0.210). According to the results of clinical observation, patients who in addition to basic therapy received quercetin were characterized by a decrease in the manifestations of acute left ventricular failure during the hospital period. Thus, the administration of 5-lipoxygenase inhibitor quercetin to AMI patients with ST-segment elevation has not additional anti-inflammatory effect, but has a positive effect on endothelial function and antioxidant properties (reduction of MPO level), which causes downward trend in hospital-acquired complications on the background of quercetin administration, even under modern treatment for ACS.
Статтю опубліковано на с. 111-119
Ефективність інгібітору 5-ліпоксигенази кверцетину у пацієнтів із гострим інфарктом міокарда (ГІМ), яким з метою реперфузії вводили тромболітичні препарати, була доведена на початку 2000-х років. Застосування препарату дозволяло суттєво обмежити зону некротизованого міокарда та зменшити кількість клінічних ускладнень як протягом госпітального періоду, так і за результатами тривалого спостереження у цієї категорії хворих [1, 2]. Це дозволило зареєструвати кверцетин для лікування хворих із ГІМ. Утім остаточні механізми дії препарату до цього часу не відомі та підходи до базисної терапії хворих із ГІМ за останні 10–15 років зазнали істотних змін. Тому метою нашої роботи була оцінка антиоксидантної та протизапальної активності кверцетину, а також влив препарату на функцію ендотелію у пацієнтів із гострим коронарним синдромом (ГКС) з елевацією сегмента ST на електрокардіограмі на фоні сучасного лікування.
Кверцетин проявляє властивості модулятора активності різних ферментів, які беруть участь у деградації фосфоліпідів (фосфоліпаз, фосфогеназ, циклооксигеназ), що впливають на вільнорадикальні процеси і відповідають за біосинтез у клітинах оксиду азоту, протеїназ та ін. Блокуюча дія кверцетину на мембранотропні ферменти і насамперед на 5-ліпоксигеназу позначається на гальмуванні синтезу лейкотрієнів LTC4 і LTB4. Кверцетин має також імуномодулюючу та антиоксиданту активність [2, 3].
У лабораторних умовах кверцетин дозозалежно підвищував рівень оксиду азоту в ендотеліальних клітинах, збільшував експресію ендотеліальної NO-cинтетази [3]. Утім вплив препарату на функцію ендотелію у пацієнтів із ГКС з елевацією ST у клінічних умовах не вивчався.
Матеріали та методи
Обстежені 94 пацієнти, які надійшли у відділення в межах 12 годин від початку розвитку симптоматики ГКС. Усім пацієнтам проведена первинна ангіопластика з метою реперфузії. Випадковим методом пацієнти були розподілені на дві групи у співвідношенні 2 : 1. У 1-шу групу (кверцетин) увійшли 60 хворих, які додатково до базисної терапії ГКС отримували інгібітор 5-ліпоксигенази кверцетин (виробництво Борщагівського ХФЗ, м. Київ, Україна), у 2-гу групу (контроль) — 34 пацієнти, яким проводили базисну терапію згідно зі стандартами лікування. Кверцетин уводився протягом 15–20 хвилин внутрішньовенно у дозі 0,5 г після попереднього розведення у 100 мл 0,9% розчину натрію хлориду. Перше введення препарату здійснювали відразу при госпіталізації пацієнта (до проведення реваскуляризації), друге — через 2 години (після проведення реваскуляризації), третє — через 12 годин після другого введення. Подальші введення робили з інтервалом 12 годин протягом 2-ї та 3-ї доби та з інтервалом 24 години протягом 4-ї та 5-ї доби лікування (всього 9 введень препарату) згідно з інструкцією [4]. Вихідні характеристики хворих наведені в табл. 1.
/112.jpg)
Пацієнти обох груп не відрізнялися за основними клініко-анамнестичними показниками. Основні характеристики ГІМ та проведеного лікування подані в табл. 2.
Більшість хворих в обох групах мали інфаркт міокарда передньої локалізації, що відображає структуру пацієнтів, які госпіталізуються до відділення (реперфузійний центр), але не збігається зі звичайним розподілом хворих на ГІМ. У більше ніж третини хворих відзначали поширення ГІМ на бокову стінку лівого шлуночка (ЛШ). Усім хворим проведена перкутанна коронарна ангіопластика (ПТКА), стентування коронарних артерій здійснено у 92,2 % (n = 59) хворих 1-ї групи та 27 (90,0 %) хворих 2-ї групи. Тромболітична терапія перед ПТКА як компонент фармако-інвазивної терапії проведена одному хворому 1-ї групи та двом хворим 2-ї групи. Суттєвих відмінностей у частоті використання основних засобів базисної терапії ГКС між групами не відзначалося.
/113.jpg)
Проводили вимірювання рівня фактора Віллебранда (ФВБ), розчинного CD40 ліганду (CD40L), фактора росту ендотелію судин, розчинного E-селектину та мієлопероксидази (МПО) в динаміці госпітального періоду захворювання для оцінки впливу лікування на вираженість системного запалення, прооксидантного стресу та стан ендотеліальної функції.
Рівень ФВБ визначали методом фермент-зв’язаного флуоресцентного дослідження (метод ELFA) за допомогою тесту Technozym vWF:Ag ELISA [8]. Кров забирали шляхом венепункції, поміщали в 0,11 моль/л розчин тринатрію цитрату у відношенні об’ємів антикоагулянту та крові 1 : 10. Плазму, отриману шляхом центрифугування, розміщували в пластикову пробірку та зберігали при температурі –20 °С не більше 1 місяця до проведення дослідження. Визначення рівня розчинного CD40L проводили за допомогою тесту ELISA Bender MedSystems (США) імуноферментним методом з використанням aHTH-sCD40L моноклональних антитіл згідно з інструкцією виробника [9]. Рівень фактора росту ендотелію судин (VEGF) визначали методом ELISA реактивом HuVEGF ELISA Kit INVITROGEN (Канада) згідно з інструкцією виробника [10]. Визначення рівня розчинного E-селектину проводили за допомогою тесту ELISA з використанням тест-системи eBioscience (Австрія) відповідно до інструкції виробника [11]. Концентрацію МПО в плазмі крові визначали методом імуноферментного аналізу (ІФА) з використанням тест-системи eBioscience (Австрія) згідно з інструкцією виробника [12]. Облік реакції проводили на імуноферментному аналізаторі iEMS Labsystems (Фінляндія).
Реактивну гіперемію визначали за допомогою проби з потікзалежною вазодилатацією (ППЗВ) [13, 14]. Пробу проводили на ультразвуковому сканері IMAGIC Agile (Kontron Medical, Франція) за допомогою судинного датчика LA523K (4–13 MГц/40 мм) на 1-шу та 7-му — 10-ту добу госпітального періоду ГІМ.
Вимоги до проведення ППЗВ на 7-му — 10-ту добу:
1. Проба проводилася зранку, натщесерце.
2. Вранці перед проведенням ППЗВ пацієнти:
— не їли та не вживали напої, які б містили алкоголь, кофеїн чи поліфеноли (какао, чай, фруктові соки) мінімум 12 годин;
— не палили більше ніж 12 годин;
— не приймали медикаментозних препаратів (відміна пероральних нітропрепаратів мінімум за 24 години);
— не мали фізичного навантаження та не займалися фізичними вправами.
3. Проба проводилася у положенні лежачи мінімум через 10 хвилин відпочинку, при кімнатній температурі.
4. Рука пацієнта під час проведення ППЗВ знаходилася у зручному положенні, лікоть фіксований.
5. Діаметр променевої артерії визначали як середнє значення від чотирьох послідовних вимірів на відстані 1 см один від одного.
Високі вимоги пред’являли до методології проведення ППЗВ. На 1-шу добу проба проводилася мінімум через 4 години після припинення болів ангінозного характеру, за відсутності явних ознак серцевої недостатності (не включали пацієнтів з кардіогенним шоком та набряком легенів) та мінімум через 4 години після припинення внутрішньовенної інфузії нітратів (нітрати тривалої дії протягом 1-ї доби не використовували). Вимоги до проведення проби на 7-му — 10-ту добу подані вище. Спочатку у стані спокою у пацієнта вимірювали початковий діаметр плечової артерії. Вимірювання проводили лiнiйним методом, який полягає у визначенні діаметра артерії з використанням двох точок, встановлених ультразвуковим курсором: одна — на межі «адвентиція — медiа передньої стінки судини», друга — на межі «медіа — адвентицiя задньої стінки». Вираховували середню величину з 4 вимірювань. За діаметр плечової брали розраховану таким чином середню величину, обчислену в трьох серцевих циклах у фазу діастоли. Після вимірювання вихідного діаметра плечової артерії пацієнту на плече на 2 см вище від місця виміру накладали манжету від манометра та створювали тиск на 50 мм рт.ст. вищий, ніж рівень системного систолічного тиску, який утримували протягом 5 хвилин. Через 80 с після декомпресії проводили повторне вимірювання діаметра артерії у тому ж самому місці та розраховували показник ендотелійзалежної вазодилатації як процент приросту діаметра плечової артерії щодо вихідного розміру. Умовно прийнято вважати нормальною реакцією плечової артерії її дилатацію на фоні реактивної гiперемiї більше ніж на 10 % вiд початкового діаметра, менше значення або вазоконстрикцiя вважаються патологiчними [13, 14].
Клінічний перебіг ГІМ оцінювали за кількістю ускладнень у госпітальний період захворювання. Гостру лівошлуночкову недостатність (ГЛШН) реєстрували згідно з класифікацією T. Killip [15]. Порушення серцевого ритму реєстрували шляхом добового моніторування ЕКГ з використанням приліжкових моніторів та центральної моніторної системи InnoCare C/C (компанія Innomed Medical Inc., Угорщина). Статистичний аналіз проводився за допомогою електронних таблиць Microsoft® Excel (2010) та статистичної програми Statistica (компанія StatSoft Inc., версія 7.0.61.0) [16].
Результати
Велике значення у розвитку та прогресуванні атеротромботичних ускладнень після ГКС має порушення функції судинної стінки, і в першу чергу судинного ендотелію. Збільшення приросту діаметра плечової артерії у відповідь на пробу з реактивною гіперемією в динаміці спостереження було відзначено в обох досліджуваних групах.
Приріст діаметра плечової артерії при проведенні ППЗВ на 1-шу добу в обох групах суттєво не відрізнявся (6,45 ± 1,02 % у 1-й групі проти 7,29 ± 1,48 % у 2-й групі відповідно, р = 0,654), також не було виявлено різниці у вихідному та кінцевому діаметрах плечової артерії на перший день ГІМ. Утім у динаміці спостереження відзначалися суттєве збільшення приросту діаметра плечової артерії при ППЗВ у групі кверцетину та відсутність вірогідних змін у контрольній групі (табл. 3).
Ми провели аналіз впливу терапії кверцетином на рівень маркерів системного запалення, ендотеліальної функції та тромбоутворення. Вивчалася динаміка ФВБ, VEGF, С-реактивного білка (СРБ), розчинного СD40 ліганду (sCD40L), E-селектину та МПО.
ФВБ — це глікопротеїн плазми крові, синтез та накопичення якого відбувається в основному в клітинах ендотелію (меншою мірою — у тромбоцитах) [5]. Порушення функції ендотеліальних клітин (але не їх загибель) супроводжується вивільненням вмісту внутрішньоклітинних гранул іпідвищенням вмісту ФВБ у крові [6]. ФВБ також бере активну участь у процесах тромбоутворення, особливо на початкових етапах утворення тромбоцитарного тромбу в артеріях [6], та є неспецифічним маркером системного запалення. VEGF, або фактор проникності судин, — це сигнальний білок, що стимулює васкулогенез та ангіогенез. Роль VEGF у пацієнтів із ГІМ вважається неоднозначною. Раніше було показано, що рівень VEGF на 1-шу добу у хворих із ГКС корелює з рівнем кардіоспецифічних маркерів та є незалежним предиктором розвитку повторної ішемії міокарда та несприятливих серцево-судинних подій [17]. Втім цей фактор є дуже важливим у забезпеченні неореваскуляризації періінфарктної та інфарктної зони та веде до покращення скоротливої функції ЛШ після інфаркту міокарда [18]. У багатьох експериментальних роботах була показана ефективність застосування VEGF в терапії ГІМ [19, 20]. СРБ не тільки є типовим білком гострої фази запалення, але й має самостійне патогенетичне значення в процесах атерогенезу, дестабілізації коронарного атеросклерозу та тромбоутворення. У багатьох дослідженнях було показано, що СРБ є потужним маркером прогнозу у хворих з ішемічною хворобою серця (ІХС) та ГКС, що стало, зокрема, причиною його широкого використання у клінічній практиці. CD40 ліганд є глікопротеїдом із родини факторів некрозу пухлини. Основним джерелом розчинної форми CD40 ліганду у крові є активовані тромбоцити, тому цей маркер є одночасно фактором запалення та тромбоутворення [22, 23], також характеризує рівень ендотеліальної дисфункції у хворих із ГІМ, що було продемонстровано на попередньому етапі нашої роботи. Е-селектин належить до молекул клітинної адгезії і виробляється ендотеліальними клітинами при запальному ушкодженні тканини, наприклад при інфікуванні, що сприяє рекрутуванню нейтрофілів із циркулюючої крові до міста ураження та опосередковує їх прикріплення до ендотелію [24]. У стані спокою він, як правило, знаходиться в незначній кількості на ендотеліальних клітинах судин. При стимуляції ендотелію цитокінами TNF-α, ІЛ-1 або деякими продуктами бактеріального розпаду, що активують фактор транскрипції NF-kB, Е-селектин виробляється у великий кількості й експресується виключно на поверхні судинних клітин [25].
У нашому дослідженні рівень ФВБ вимірювався у 18 хворих 1-ї групи та 23 хворих 2-ї групи. В обох досліджуваних групах відзначали тенденцію до зниження ФВБ у динаміці спостереження (табл. 4). Суттєвої різниці між показниками на 1-шу чи 7-му добу ГІМ між групами не спостерігали (p > 0,05). Рівень VEGF на 1-шу добу суттєво не відрізнявся у виділених групах (149,3 ± 47,2 у 1-й групі проти 134,1 ± 50,6 у 2-й групі, р = 0,832). У динаміці спостереження відзначено суттєве підвищення рівня VEGF на 7-му добу у групі кверцетину за відсутності суттєвих змін цього фактора у контрольній групі. Рівень VEGF на 7-му добу у хворих 1-ї групи був значно вищим, ніж у хворих 2-ї групи (396,0 ± 64,7 пкг/мл у 1-й групі проти 196,4 ± 49,9 пкг/мл у 2-й групі, р = 0,022). Ми вважаємо, що підвищення рівня VEGF на фоні терапії кверцетином може свідчити про покращення процесів неореваскуляризації у пацієнтів із ГІМ на фоні прийому препарату.
В обох досліджуваних групах виявлено підвищення рівня СРБ у динаміці спостереження, що може відображати відповідь на процес формування зони некрозу міокарда. Відмінностей між групами у рівні СРБ як на 1-шу добу, так і через 7 діб спостереження не відзначалось (табл. 4). Терапія кверцетином не впливала на динаміку розчинного СD40L та Е-селектину. Спрямованість змін та рівень цих маркерів суттєво не відрізнялися у хворих обох виділених груп.
/115.jpg)
МПО — це фермент лізосом нейтрофілів, що належить до системи неспецифічного захисту. МПО синтезується тільки в процесі гемопоезу і в диференційованих клітинах не утворюється. МПО рідко визначається в зрілих моноцитах і практично зникає при перетворенні моноцитів на тканинні макрофаги [26]. Фізіологічна функція МПО полягає у формуванні високореактивних прооксидантів (за наявності перекису водню МПО призводить до утворення гіпохлорит-аніону) в межах фагосоми і знищенні мікроорганізмів у клітинах вродженого імунітету [26]. Оксидативний стрес клітин вродженого імунітету у відповідь на інфекційні агенти або пошкодження клітин іншої етіології асоціюється зі змінами ліпідного метаболізму, направленого на нейтралізацію токсичного ефекту ендотоксинів. До певного моменту ці зміни корисні в захисті організму від інфекції. Проте зі збільшенням сили і тривалості патологічного процесу збільшується і ризик розвитку атеросклерозу за рахунок стимуляції окислення ліпопротеїнів. Ці зміни відбуваються в результаті порушення про- та антиоксидантної рівноваги, а також функціональної активності клітин вродженого імунітету [27]. Як висококатіонний білок, МПО здатна зв’язуватися з електронегативними поверхнями, такими як ендотеліальна стінка, ліпопротеїни або протеоглікани [28]. В експериментальних роботах показано, що при гострому запаленні МПО виділяється фагоцитами в кровоносне русло, може визначатися на ендотеліальній поверхні, в середині ендотеліальних клітин і в субендотеліальному просторі. Оксидативні реакції, що каталізує субендотеліально-локалізована МПО, спричинюють ендотеліальну дисфункцію [29, 30]. Отже, МПО може моделювати запалення у судинній стінці також шляхом регуляції біодоступності NO [31]. Крім цього, МПО взаємодіє з тромбоцитами й активує їх набагато сильніше, ніж класичні активатори тромбоцитів [32].
У хворих зі стабільною стенокардією в середньому по групі вміст МПО був значно вищим, ніж у групі контролю (відповідно 218,4 ± 30,9 нг/мл проти 74,5 ± 16,3 нг/мл, р < 0,05). Підвищення даного показника у хворих зі стабільними формами ІХС відзначали й інші автори [29].
У нашому дослідженні рівень МПО на 1-шу добу визначався у 60 хворих, повторне визначення МПО на 7-му добу проведено у 55 хворих (41 хворий з 1-ї групи та 14 хворих з 2-ї групи). Вміст МПО у венозній крові хворих із ГКС на 1-шу добу був значно вищий, ніж у хворих зі стабільною стенокардією та у групі контролю, і становив 606,0 ± 59,3 нг/мл (31,9–1870,0 нг/мл).
Отримані результати збігаються з даними попередніх досліджень. Так, у дослідженні M. Graner та співавт. у пацієнтів із болем у грудній клітці саме початковий рівень МПО був найбільш чутливим маркером для ранньої діагностики ГКС [33]. Крім цього, в іншому дослідженні високий рівень МПО в плазмі крові хворих із ГІМ був незалежним маркером розвитку серцево-судинних подій протягом двох років спостереження. У дослідженні CAPTURE рівень МПО > 350 мкг/л у сукупності з підвищенням рівня тропоніну Т, плацентарного фактора росту та зниженням ІЛ-10 (мультимаркерний підхід) були незалежними предикторами розвитку смерті та нефатального інфаркту міокарда протягом тривалого спостереження.
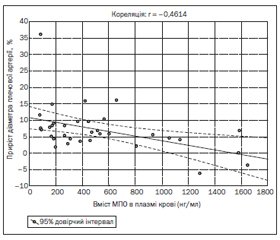
Ми провели оцінку результатів проби з реактивною гіперемією залежно від рівня МПО. Аналіз отриманих даних показав наявність тісного оборотного кореляційного зв’язку (r = –0,46; p = 0,006) між умістом МПО в плазмі крові та ступенем приросту діаметра плечової артерії на 1-шу добу ГІМ з елевацією ST (рис. 1). Втім на 7-му добу від розвитку ГІМ кореляція між рівнем МПО та результатами проби з реактивною гіперемією була відсутня (r = –0,20; p = 0,309).
Аналіз залежності змін результатів проби з реактивною гіперемією протягом госпітального періоду від динаміки рівня МПО в плазмі крові у хворих із ГКС виявив тісний та оборотний зв’язок (r = –0,4; p < 0,05, Spearman test). Спрямованість змін у кожного окремого пацієнта показана на рис. 2.
/116.jpg)
У пацієнтів із ГІМ зі зниженням рівня МПО від 1-ї до 7-ї доби лікування відзначали вірогідне збільшення приросту діаметра плечової артерії у відповідь на проведення проби з реактивною гіперемією (6,15 ± 3,49 % на 1-шу добу проти 9,67 ± 5,86 % на 7-му добу, p < 0,05). У зв’язку з невеликою кількістю хворих зі сталим рівнем чи збільшенням рівня МПО протягом госпітального періоду в динаміці спостереження не було виявлено вірогідних змін у результатах проби з реактивною гіперемією. Втім приріст діаметра плечової артерії на 7-му добу у пацієнтів цієї групи був значно нижчим, ніж у пацієнтів зі зниженням МПО (4,48 ± 5,19 % проти 9,67 ± 5,86 %, р = 0,022) за відсутності суттєвих відмінностей приросту на 1-шу добу (табл. 5). Отже, зниження рівня МПО в плазмі крові з 1-ї до 7-ї доби у нашому дослідженні асоціювалося з покращенням, а відсутність змін чи збільшення вмісту цього ферменту — з погіршенням функції ендотелію в динаміці спостереження.
Раніше було показано, що кверцетин знижує рівень МПО в нейтрофілах периферичної крові хворих із ГКС [34], але динаміка МПО в плазмі хворих на фоні прийому кверцетину не вивчалася. З відомих літературних джерел немає жодної роботи, у якій би проводили аналіз терапії на рівень МПО в плазмі крові.
У нашому дослідженні початковий рівень МПО у плазмі крові хворих із ГІМ в обох виділених групах суттєво не відрізнявся (611,7 ± 83,3 нг/мл
у 1-й групі проти 525,9 ± 122,3 нг/мл у 2-й групі відповідно, p = 0,603). Додавання кверцетину до базисної терапії ГІМ у середньому супроводжувалося значним зниженням рівня МПО в плазмі крові на 7-му добу (611,7 ± 83,3 нг/мл на 1-шу добу проти 382,4 ± 65,4 нг/мл на 7-му добу, р = 0,013) лікування, в той же час у хворих контрольної групи значного зниження рівня МПО не спостерігалося (525,9 ± 122,3 нг/мл на 1-шу добу проти 437,6 ± 104,8нг/мл на 7-му добу, р = 0,210). Детальний аналіз динаміки рівня МПО на фоні прийому кверцетину виявив, що дія препарату щодо рівня МПО була неоднозначною і залежала від початкового рівня ферменту. У пацієнтів ГКС із початково нормальним рівнем МПО в плазмі крові (< 120 нг/мл)
у динаміці лікування спостерігалася тенденція до збільшення даного показника (90,6 ± 6,5 нг/мл на 1-шу добу проти 287,8 ± 82,6 нг/мл на 7-му добу, р = 0,061); у пацієнтів із помірно підвищеним або високим початковим рівнем МПО, навпаки, реєстрували зниження рівня ферменту (738,1 ± 91,4 нг/мл
на 1-шу добу проти 405,3 ± 78,8 нг/мл на 7-му добу, р = 0,002), але тільки приблизно у третини хворих показник знижувався до нормальних величин.
Отримані результати показали підвищення вмісту МПО в плазмі крові хворих із ІХС. Разом із тим, якщо у хворих зі стабільними формами ІХС рівень МПО був помірно підвищений, то у хворих із ГКС з елевацією ST істотно варіював. Більшість пацієнтів із ГКС мали дуже високий рівень МПО у плазмі крові (> 300 нг/мл), але незначна частина хворих (19,5 %) характеризувалася нормальними показниками рівня цього ферменту (< 120 нг/мл). Призначення кверцетину дозволяло істотно зменшити середній рівень МПО у плазмі крові хворих з ГКС.
Аналіз клінічного перебігу ГІМ у виділених групах пацієнтів наведено в табл. 6.
Досить мала вибірка хворих та нетривалий період спостереження (7–10 днів) не дозволили нам визначити суттєві відмінності за частотою ускладнень госпітального періоду захворювання в обох виділених групах. Хворі, яким додатково до базисної терапії призначався кверцетин, характеризувалися зменшенням проявів ГЛШН протягом спостереження.
Таким чином, інгибітор 5-ліпоксигенази кверцетин у хворих на ГІМ з елевацією сегмента ST не справляє додаткового протизапального ефекту, але позитивно впливає на функцію ендотелію та має антиоксидатні властивості (зниження рівня МПО), що обумовлює тенденцію до зменшення внутрішньогоспітальних ускладнень на фоні прийому кверцетину навіть в умовах сучасної терапії ГКС.
Список литературы
1. Parkhomenko A.N., Kozhukhov S.N., Irkin O.I. et al. Cardioprotective effects of 5-lipoxigenase inhibitor quercetine in thrombolysed patients with acute myocardial infarction // XXII Congress of the European Society of Cardiology. Amsterdam (The Netherlands). — 2000. — Europ. Heart J. — 2000. — Vol. 21. (suppl.). — P. 476.
2. Пархоменко А.Н., Иркин О.И., Кожухов С.Н. Возможности фармакологической защиты миокарда при синдроме ишемии-реперфузии в эксперименте и клинической практике // Ліки України. — 2002. — № 7–8. — С. 2-11.
3. Moybenko O., Dosenko V., Parkhomenko O. Endogenous mechanisms of cardioprotection as basis of nosotropic therapy of di–seases of heart. — К.: Naukova dumka, 2008.
4. Нормативно-директивні документи МОЗ України. Інструкція для медичного застосування препарату Кверцетин // http://mozdocs.kiev.ua/likiview.php?id = 8711
5. Verweij C.L. Biosynthesis of human von Willebrand factor // Haemostasis. — 1988. — Vol. 18. — P. 224-245.
6. Mannucci P.M. von Willebrand factor: a marker of endothelial damage? // Arterioscler. Thromb. Vasc. Biol. — 1998. — Vol. 18. — P. 1359-1362.
7. Prentice C.R.M. Platelets and atherosclerosis // Eur. Heart J. — 1999. — Vol. 1, Suppl. A. — P. 3A-7A.
8. Rodeghiero F., Castaman G. The von Willebrand factor // Res. Clin. Lab. — 1990. — Vol. 20. — P. 143-153.
9. Varo N., de Lemos J.A., Libby P. et al. Soluble CD40L: Risk Prediction After Acute Coronary Syndromes // Circulation. — 2003. — Vol. 108. — P. 1049-1052.
10. Tischer E., Mitchell R., Hartman T. et al. The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing // J. Biol. Chem. — 1991. — Vol. 266(18). — P. 11947-54.
11. Tsao K.C., Chang P.Y., Li C.C. et al. Development of a microplate ELISA for circulating E-selectin: assay characterization, comparison with a commercial kit, wand establishment of normal reference values // J. Clin. Lab. Anal. — 2003. — Vol. 17(3). — P. 97-101.
12. Chang P.Y., Wu T.L., Hung C.C. et al. Development of an ELISA for myeloperoxidase on microplate: normal reference values and effect of temperature on specimen preparation // Clin. Chim. Acta. — 2006. — Vol. 373(1–2). — P. 158-63.
13. Thijssen D.H., Black M.A., Pyke K.E. et al. Assessment of flow — mediated dilation in humans: a methodological and physio–logical guideline // American Journal of Physiology. — 2011. — Vol. 300. — P. 2-12.
14. Celermajer D.S., Sorensen K.E., Gooch V.M. et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis // Lancet. — 1992. — Vol. 340. — P. 1111-1115.
15. Killip T., Kimbal J.T. Triatment of miocardial infarction in a coronary care unit a two year experientse with 250 patients // Am. J. Cardiol. — 1967. — Vol. 20. — 457-464.
16. StatSoft, Inc. (2004). Statistica (data analysis software system), version 7. www.statsoft.com.
17. Heeschen C., Dimmeler S., Hamm C.W. et al. Prognostic significance of angiogenic growth factor serum levels in patients with acute coronary syndromes // Circulation. — 2003. — Vol. 107. — P. 524-530.
18. Zhao T., Zhao W., Chen Y. et al. Vascular endothelial growth factor (VEGF)-A: role on cardiac angiogenesis following myocardial infarction // Microvasc. Res. — 2010. — Vol. 80(2). — P. 188-94.
19. Miyagi Y., Chiu L.L., Cimini M. et al. Biodegradable collagen patch with covalently immobilized VEGF for myocardial repair // Biomaterials. — 2011. — № 32. — Р. 1280-1290.
20. Yang Y., Shi C., Hou X. et al. Modified VEGF targets the ischemic myocardium and promotes functional recovery after myocardial infarction // J. Control. Release. — 2015. — Vol. 213. — P. 27-35.
21. Henn V., Slupsky J.R., Gräfe M. et al. CD40 ligand on activated platelets triggers an inflammatory reaction of endothelial cells // Nature. — 1998. — Vol. 5; 391(6667). — P. 591-594.
22. Inwald D.P., McDowall A., Peters M.J. et al. CD40 is constitutively expressed on platelets and provides a novel mechanism for platelet activation // Circ. Res. — 2003. — Vol. 16; 92. — P. 1041-1048.
23. Henn V., Slupsky J.R., Gräfe M. et al. CD40 ligand on activated platelets triggers an inflammatory reaction of endothelial cells // Nature. — 1998. — Vol. 5; 391(6667). — P. 591-594.
24. Талаева, Т.В. Механизмы взаимодействия клеток крови и сосудистой стенки в реализации воспалительного и иммунного ответов / Т.В. Талаева // Український ревматологічний журнал. — 2001. — № 3–4 (5–6). — С. 45-52.
25. Alamanda V. et al. Nicotine-mediated induction of E-selectin in aortic endothelial cells requires Src kinase and E2F1 transcriptional activity // Biochem. Biophys. Res. Commun. — 2012. — Vol. 418, № 1. — Р. 56-61.
26. Klebanoff S. Myeloperoxidase: Friend and foe // J. Leuc. Biol. — 2005. — Vol. 77(5). — P. 598-625.
27. Peluso I., Morabito G., Urban L., Ioannone F., Serafini M. Oxidative stress in atherosclerosis development: the central role of LDL and oxidative burst // Endocr. Metab. Immune Disord. Drug. Targets. — 2012. — Vol. 12(4). — P. 351-60.
28. Ruleva N., Zvyaginceva M., Dugin S. Myeloperoxidase: biological functions and clinical value // Modern scientific technologies. — 2007. — Vol. 8. — P. 11-14. [Russian]
29. Alipour A., Ribalta J., Njo T., Janssen H., Birnie E., van Miltenburg A., Elte J., Castro C. Trans-vessel gradient of myeloperoxidase in coronary artery disease // Eur. J. Clin. Invest. — 2013. — Vol. 43(9). — P. 920-5.
30. Patterson E., Fraser D., Capretta A., Potter R., Cepinskas G. Carbon monoxide-releasing molecule 3 inhibits myeloperoxidase and protects against MPO-induced vascular endothelial cell activation/dysfunction // Free Radic. Biol. Med. — 2014. — Vol. 26 (70C). — P. 167-73.
31. Eiserich J.P.1, Baldus S., Brennan M.L. et al. Myeloperoxidase, a leukocyte-derived vascular NO oxidase // Science. — 2002 Jun 28. — Vol. 296(5577). — P. 2391-4.
32. Kolarova H., Klinke A., Kremserova S., Adam M., Pekarova M., Baldus S., Eiserich J., Kubala L. Myeloperoxidase induces the priming of platelets // Free Radic. Biol. Med. — 2013 Aug. — Vol. 61. — P. 357-69.
33. Graner M., Tikkanen E., Rimpila O., Tikkanen H., Ripatti S., Lokki M., Niemen M., Taskinen M., Sinisalo J. Diagnostic efficacy of myeloperoxidase to identify acute coronary syndrome in subjects with chest pain // Ann. Med. — 2013 Jun. — Vol. 45(4). — P. 322-7.
34. Ryzhkova N., Gavrilenko T., Parkhomenko O., Kozhukhov S. Metabolіc activity of neutrocytes and the ways of it are possible correction at of patients from by the acute coronary syndrom // Fіzіol. J. — 2011. — Vol. 57(2). — P. 35-42. [Ukrainian]

/112.jpg)
/113.jpg)
/114.jpg)
/115.jpg)
/116.jpg)
/117.jpg)