Статтю опубліковано на с. 103-110
Сепсис та його ускладнення є однією з актуальних проблем інтенсивної терапії в дітей. Частота захворюваності на тяжкий сепсис (ТС) у дітей у США становить 0,56 на 1000 населення, а серед дітей першого року життя — 5,2 на 1000. Госпітальна летальність сягає 10,3 %, що при загальній щорічній кількості захворілих понад 42 000 осіб визначає 4400 летальних кінців у дітей від тяжкого сепсису [1]. За сучасними даними, смертність від сепсису в розвинутих країнах становить 5,9 на 100 000 немовлят, а в країнах СНД смертність від сепсису становить 12–15 % [2].
Одним з головних факторів, що визначає градації тяжкості сепсису, є серцево-судинна дисфункція, яка свідчить про наявність у пацієнта ТС або септичного шоку (СШ). Роль дисфункції міокарда та її прогностичне значення у хворих на ТС значно менше вивчені, ніж у хворих на СШ. Варто відзначити, що в доступній літературі містяться результати досліджень переважно систолічної функції лівого шлуночка (ЛШ), у той час як діастолічна функція при септичних станах досліджена значно менше. Між тим існують теоретичні передумови, що дають можливість прогнозувати наявність не лише систолічної, але й діастолічної дисфункції (ДД) ЛШ. Певна кількість зарубіжних досліджень підтверджують наявність ДД міокарда в дорослих, хворих на сепсис [3–5]. У той же час ДД при сепсисі в дітей не вивчалася. Вважається, що ДД розвивається раніше за систолічну, що, імовірно, може бути використано для прогнозування наслідків гемодинамічних розладів та терапевтичної корекції [6]. Серед можливих чинників ДД відзначаються: ішемія міокарда, скорочення часу діастоли через тахікардію, електролітні розлади та синдром «капілярного витоку», розлади споживання міокардом ацильних фрагментів через ушкодження «карнітинового човника» та деякі інші фактори [7–10]. Також наочним є той факт, що тривалість діастоли та кінцево-діастолічний тиск є факторами, які лімітують кровопостачання ЛШ, що, у свою чергу, забезпечує кисневий баланс та ефективність його роботи в умовах підвищеного гемодинамічного попиту.
Отже, метою нашого дослідження було вивчення інтегральних показників гемодинаміки, стану систолічної та діастолічної функції ЛШ, показників структурного ушкодження міокарда, вазоактивних медіаторів і зв’язків між ними та визначення прогностичної значущості діастолічної дисфункції міокарда при С, ТС та СШ у дітей.
Матеріали і методи
Дослідження проведено у 2006–2010 рр. на кафедрі дитячої анестезіології та інтенсивної терапії Харківської медичної академії післядипломної освіти, на базі відділення анестезіології та інтенсивної терапії (ВАІТ) КЗОЗ «Харківська обласна дитяча інфекційна клінічна лікарня». У роботі проаналізовано й узагальнено результати обстеження й лікування 170 хворих, середній вік 32,1 ± 3,7 міс., із сепсисом, ТС та СШ, діагноз яких визначався за критеріями консенсусу SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference, 2002. Хлопчиків було 95 (55,8 %), дівчаток — 75 (44,2 %). Контрольну групу становили 44 практично здорові дитини, середній вік 40,7 ± 8,5 міс. Хлопчиків було 20 (45,0 ± 8,0 %), дівчаток — 24 (55,0 ± 8,0 %).
Моніторниг включав електрокардіографію, визначення частоти серцевих скорочень (ЧСС), пульсоксиметрію (SpO2), вимірювання систолічного (АТс), діастолічного (АТд) та середнього артеріального тиску (САТ) осцилометричним методом, контроль центрального венозного тиску (ЦВТ) (монітори UM-300, Україна).
При надходженні до ВАІТ усім хворим проводили ехокардіоскопію у М-режимі та імпульсно-хвильове допплерівське сканування трансмітрального кровотоку за допомогою ультразвукових сканерів Ultima PA (Україна) та Sono-Sayt Titan (США). Вимірювали кінцево-діастолічний (КДР) та кінцево-систолічний (КСР) розміри ЛШ з наступним розрахунком за L. Teichholz et al. (1976) індексів кінцево-систолічного (ІКСО) та кінцево-діастолічного об’ємів (ІКДО) ЛШ, ударного індексу (УІ), фракції викиду (ФВ). Серцевий індекс розраховували за формулою: СІ = УІ • ЧСС. Також вимірювали параметри трансмітрального кровотоку: максимальні швидкості хвиль раннього діастолічного наповнення (Е) (Vmax E) та передсердної систоли (А) (Vmax A), мінімальні швидкості Е (Vmin E) та А (Vmin A), час уповільнення DT (deceleration time) хвилі Е, час ізоволемічної релаксації IVRT (isovolumic relaxation time), час ізоволемічного скорочення IVCT (isovolumic contraction time) ЛШ та ПШ; Em — пікову швидкість раннього діастолічного зсуву трикуспідального фіброзного кільця на боці латеральної стінки правого шлуночка. На підставі отриманих даних розраховували середні швидкості хвилі Е (Vmean E) та А (Vmean A). Тиск заклинювання легеневих капілярів (ТЗЛК) визначали за формулою: ТЗЛК = 1,24 • Vmax E/Em + 1,9, де Vmax Е — максимальна швидкість транстрикуспідального діастолічного потоку (Nagueh S., 1998). Розраховували відношення максимальної швидкості хвилі раннього діастолічного наповнення до максимальної швидкості хвилі передсердної систоли Е/А ЛШ = Vmax E ЛШ/Vmax А ЛШ. Розраховували показник процентної частки систоли лівого передсердя в наповненні лівого шлуночка (ФП ЛШ) за формулою: ФП ЛШ = Vmax A/(Vmax A + Vmax E) • 100 (Bejamin E. et al., 1992). Кінцево-діастолічний тиск ЛШ (КДТЛШ) розраховували за формулою: КДТЛШ = 1,06 + 15,15 • VTI peak А/VTI Peak Е (Stork T.V., 1989). Податливість ЛШ (ΔP/ΔV) визначали за відношенням КДТЛШ/КДОЛШ (Marino P., 2010). Коронарний перфузійний тиск (КПТ) розраховували за формулою: КПТ = КДТЛШ – АТд. Час систоли (Tsist) визначали за формулою: Tsist = ET A + IVCT MK, час діастоли (Tdiast) за формулою: Tdiаst = ET Peak Ea + ET Peak Aa + IVRT MK. Індекс «напруга — час» (ІНЧ) — за формулою: ІНЧ = АТс • Tsist. Індекс «діастолічний тиск — час» (ІДТЧ) — за формулою: ІДТЧ = КПТ • Tdiast. На підставі цих показників визначали індекс життєздатності міокарда: ІЖМ = ІДТЧ/ІНЧ (Morgan G., Mikhail M., 2010).
Оцінку вірогідності відмінностей величин між групами проводили на підставі критерію t (Стьюдента).
Результати та їх обговорення
За критеріями SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference (2002) усіх хворих було розподілено на три групи: група сепсису (група С) — 71 дитина (41,8 %), група тяжкого сепсису (ТС) — 64 дитини (38,2 %) та група септичного шоку (група СШ) — 34 дитини (20,0 %). За антропометричними показниками та віком хворі, які увійшли до груп С, ТС та СШ, вірогідно не відрізнялися (p > 0,05) (табл. 1).
/104.jpg)
Аналіз показників тяжкості органних розладів свідчить, що в групі С порівняно з групою ТС та СШ була вірогідно меншою кількість хворих, які потребували респіраторної підтримки (р < 0,001). Кількість хворих, які потребували респіраторної підтримки, у групах ТС та СШ вірогідно не відрізнялась (p > 0,05). Загальна кількість хворих, які отримували симпатоміметики, дорівнювала 67 (39,4 ± 3,7 %). У групі С вони використовувалися вірогідно рідше, ніж у групах ТС та СШ (р < 0,001). У свою чергу, застосування симпатоміметиків у групі СШ порівняно із групою ТС також було вірогідно частішим (р < 0,001). Тяжкість органних розладів за SOFA була вірогідно меншою у групі С порівняно із групами ТС та СШ, а у групі ТС, у свою чергу, порівняно з групою СШ (р < 0,001) (табл. 2).
Вивчення показників центральної гемодинаміки свідчить, що одним з найбільш поширених гемодинамічних симптомів С, ТС або СШ є тахікардія, адже ЧСС у всіх досліджуваних групах була вірогідно вищою порівняно з контрольною (p < 0,001). САТ також був вірогідно нижчим порівняно з групою контролю у всіх досліджуваних групах, проте в групі СШ він був вірогідно нижчим, ніж у групі С та ТС (p < 0,001) (табл. 3).
Стан переднавантаження оцінювався за показниками тиску (ЦВТ, ТЗЛК) та об’єму ЛШ (КДР, КДО, ІКДО), а післянавантаження — за показником ІЗПСО. Аналіз отриманих даних свідчить, що ЦВТ у досліджуваних групах хворих не мав відмінностей від групи контролю, але він був вірогідно нижчим у групі С порівняно із групами СШ та ТС (p < 0,05 та p < 0,001 відповідно). Також ми не знайшли вірогідних відмінностей ТЗЛК між досліджуваними групами та порівняно із контролем (p > 0,05). У всіх обстежених групах КДР та ІКДО були вірогідно меншими, ніж у контролі (p < 0,01 та p < 0,001). Між досліджуваними групами вірогідних відмінностей цих показників ми не спостерігали (p > 0,05).
Показник КДО був вірогідно меншим порівняно з контролем у групі ТС (p < 0,05) і не мав вірогідних відмінностей між досліджуваними групами та контролем (p > 0,05). Показники КСР, КСО та ІЗПСО у досліджуваних групах та порівняно із контролем не мали вірогідних відмінностей (p > 0,05) (табл. 4). Отже, зважаючи на вірогідне зменшення об’ємних показників переднавантаження ЛШ та відсутність вірогідних відмінностей показників тиску заповнення камер серця, мусимо дійти попередньої гіпотези щодо імовірної ролі зміни діастолічної функції серця при септичних станах у дітей.
/105.jpg)
Серцевий викид оцінювався за показниками УО, УІ, ФВ та СІ. Аналіз отриманих даних свідчить, що показник УО у групах С, ТС та СШ був вірогідно меншим, ніж у групі контролю (p < 0,05, p < 0,01 та p < 0,001 відповідно). У групі СШ він також був вірогідно нижчим порівняно із групою С (p < 0,05). УІ у групах С, ТС та СШ також був вірогідно меншим, ніж у групі контролю (p < 0,001). Доцільно звернути увагу на те, що в групі СШ він був також вірогідно нижчим, ніж у групах С та ТС (p < 0,001). У групах С та ТС СІ не зазнавав вірогідних змін порівняно із контролем та не мав вірогідних відмінностей між групами (p > 0,05). Натомість у групі СШ СІ був вірогідно меншим, ніж у контролі та групах С і ТС (p < 0,05 та p < 0,01 відповідно). ФВ ЛШ у групах С, ТС та СШ була вірогідно меншою порівняно із контролем (p < 0,01, p < 0,05 та p < 0,001 відповідно). У групі СШ вона також була вірогідно меншою, ніж у групах С та ТС (p < 0,05). При цьому необхідно відзначити, що середні значення ФВ не сягали загрозливо критичного рівня (менше від 45 %), але у групі С вона була нижче за 45 % у 1 (1 ± 1 %), у групі ТС — у 3 (5 ± 3 %), а у групі СШ — у 6 (18 ± 7 %) хворих. Отже, у групі СШ кількість хворих із критично зниженою ФВ ЛШ була вірогідно більшою, ніж у групі С, і не відрізнялася вірогідно від групи ТС (p < 0,05 та p > 0,05 відповідно) (табл. 5).
Отже, зниження серцевого викиду відбувається паралельно з прогресуванням септичного стану й стає загрозливим при СШ. Провідну роль у розвитку СШ у дітей відіграє саме погіршення переднавантаження.
Діастолічну функцію ЛШ було вивчено у 92 хворих середнім віком 43,6 ± 5,7 міс., з масою тіла 15,7 ± 1,4 кг, довжиною тіла 97,8 ± 3,4 см. З них хлопчиків було 52 (57,0 ± 5,0 %), дівчаток — 40 (43,0 ± 5,0 %). Хворих на С було 37 (40,0 ± 5,0 %), ТС — 36 (39,0 ± 5,0 %) та СШ — 19 (21,0 ± 5,0 %). Дослідження проводилось лише за умов чіткого диференціювання хвиль Е та А трансмітрального кровотоку, адже при тахікардії це не завжди можливо.
Відомо, що існує перший тип ДД (порушення релаксації), який характеризується зниженням показника E/A < 1,0–1,3 та пролонгацією часу DT, другий тип ДД (псевдонормальний) — E/A у нормі (1,3–2,0), але DT менше за норму, та третій тип (рестриктивний) — E/A > 2,0 і DT менше за норму. Оскільки в контрольній групі хворих було отримано значення Е/А (Х ± σ) — 1,66 ± 0,13, що загалом відповідає літературним даним, усіх обстежених хворих із С, ТС та СШ за показником Е/А було розподілено саме на такі підгрупи: E/A < 1,3, Е/А = 1,3–2,0 та E/A > 2,0 та проаналізовано головні показники діастолічної функції ЛШ відповідно до змін співвідношення Е/А.
Перш за все привертає увагу віковий розподіл хворих, адже середній вік хворих у групі E/A < 1,3 був вірогідно нижчим, ніж у групах Е/А = 1,3–2,0 та E/A > 2,0 (p < 0,05 та p < 0,01 відповідно) (табл. 6).
/106.jpg)
Vmax Peak E не мала вірогідних відмінностей між групами E/A < 1,3 та Е/А = 1,3–2,0 (p > 0,05). Але у групі E/A > 2,0 Vmax Peak E була вірогідно вищою, ніж у групах E/A < 1,3 та Е/А = 1,3–2,0 (p < 0,001). Vmax Peak A у групі E/A < 1,3 була вірогідно більшою, ніж у інших групах, а в групі Е/А = 1,3–2,0 — вірогідно більшою, ніж у групі E/A > 2,0 (p < 0,001). ET Peak E у групі E/A < 1,3 не відрізнявся вірогідно від групи Е/А = 1,3–2,0 та був вірогідно коротшим, ніж у групі E/A > 2,0 (p > 0,05 та p < 0,001 відповідно). У групі Е/А = 1,3–2,0, у свою чергу, ET Peak E був вірогідно меншим, ніж у групі E/A > 2,0 (p < 0,001). ET Peak A був вірогідно меншим порівняно із іншими групами лише в групі E/A < 1,3 (p < 0,05). Показники Е/А та ФПН ЛШ у групі E/A < 1,3 були вірогідно меншими, ніж у групах Е/А = 1,3–2,0 та E/A > 2,0, а в групі Е/А = 1,3–2,0 меншими, ніж у групі E/A > 2,0 (p < 0,001). DT MK у групі E/A < 1,3 був вірогідно меншим, ніж у групі Е/А = 1,3–2,0 та E/A > 2,0 (p < 0,05 та p < 0,001 відповідно). У свою чергу, у групі E/A > 2,0 DT MK був вірогідно більшим, ніж у групі Е/А = 1,3–2,0 (p < 0,001). IVCT MK та IVRT МK не мали вірогідних відмінностей між групами (p > 0,05). Комплайєнс ЛШ ΔР/ΔV у групі E/A < 1,3 був вірогідно меншим, ніж у інших групах, а у групі Е/А = 1,3–2,0 — вірогідно меншим, ніж у групі E/A > 2,0 (p < 0,001) (табл. 6).
Вивчення показників діастолічної функції ЛШ при розподілі за групами С, ТС та СШ дало підстави констатувати, що Vmax Peak E у групі С була вірогідно вищою, ніж у контролі (p < 0,01). У групах ТС та СШ цей показник від контролю вірогідно не відрізнявся (p > 0,05). У групі СШ Vmax Peak E була вірогідно меншою, ніж у групі С (p < 0,01). Vmax Peak A у групах С, ТС та СШ була вірогідно вищою, ніж у групі контролю (p < 0,01, p < 0,001 та p < 0,05 відповідно). Vmin Peak E у групах С та ТС не мала вірогідних відмінностей від контролю, у групі СШ була вірогідно меншою, ніж у контрольній групі (відповідно p > 0,05 та p < 0,05). У групах С та ТС цей показник був вірогідно більший, ніж у групі СШ (p < 0,05). Vmin Peak A у всіх досліджуваних групах був вірогідно вищим, ніж у групі контролю (p < 0,001). Міжгрупових відмінностей цього показника не спостерігалося (p > 0,05). Показник ET Peak E у групах С та ТС не відрізнявся вірогідно ні між групами, ні з групою контролю (p > 0,05). Натомість у групі СШ він був вірогідно меншим, ніж у групі С та у групі контролю (p < 0,01 та p < 0,001 відповідно). ET Peak A у досліджуваних групах вірогідно не відрізнявся, а також не відрізнявся із контролем у групах С та ТС (p > 0,05). Але в групі СШ він був вірогідно меншим порівняно із контролем (p < 0,01). Співвідношення Е/А у групі С не відрізнялося від контролю (p > 0,05), а у групах ТС та СШ було вірогідно меншим, ніж у контролі (p < 0,01). Також у цих групах Е/А було вірогідно нижчим, ніж у групі С (p < 0,05). Аналогічних змін зазнав ФПН ЛШ. У групі С він не мав вірогідних відмінностей від норми, але був вірогідно меншим, ніж у групах ТС та СШ (p > 0,05 та p < 0,01 відповідно). У свою чергу, у групах ТС та СШ цей показник був вірогідно меншим, ніж у групі контролю (p < 0,001). Схожих змін зазнавав DT MK (табл. 7). У групі С він не мав вірогідних відмінностей від норми, але був вірогідно меншим, ніж у групах ТС та СШ (p > 0,05 та p < 0,01 і p < 0,001 відповідно). У групах ТС та СШ цей показник був вірогідно меншим, ніж у групі контролю (p < 0,001). Показник часу ізоволемічного скорочення IVCT MK не мав вірогідних відмінностей ні між групами С, ТС та СШ, ні між ними та групою контролю (p > 0,05).
Натомість показник IVRT МK у групах С, ТС та СШ був вірогідно меншим, ніж у групі контролю (p < 0,05, p < 0,001 та p < 0,01 відповідно). Показник ΔР/ΔV у групах С та СШ вірогідно від норми не відрізнявся (p > 0,05). У групі ТС він був вірогідно меншим, ніж у групі С та у групі контролю (p < 0,05 та p < 0,01 відповідно) (табл. 7).
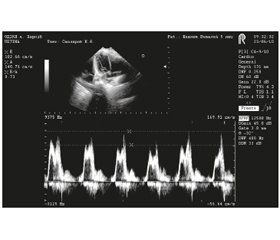
Отже, при септичних станах у дітей найбільш часто зустрічається тип ДД, що характеризується зменшенням співвідношення Е/А, скороченням часу DT та IVRT, зниженням комплайєнсу ЛШ. Цей тип ДД асоційований із тяжкістю стану та раннім віком дитини. Його наявність негативно впливає на ефективність венозного повернення під час діастоли та може знижувати серцевий викид. Імовірним наслідком цього типу ДД може бути зниження ефективності інфузійної терапії, розвиток капілярного витоку та рідинно-рефрактерного шоку. Приклад допплерограми трансмітрального кровотоку при ТС продемонстровано на рис. 1.
Ретроспективний аналіз показав, що у групі з Е/А < 1,3 симпатоміметики отримували 27 з 49 (54,0 ± 7,0 %) хворих, у групі з Е/А = 1,3–2,0 — 6 з 26 (23,0 ± 8,0 %), а в групі з Е/А > 2,0 — 5 з 17 (29,0 ± 11,0 %) хворих. При порівнянні частоти призначення симпатоміметиків з’ясувалось, що у групі з Е/А < 1,3 вони призначались вірогідно частіше, ніж у групах з Е/А = 1,3–2,0 та Е/А > 2,0 (p < 0,001).
У доросліших хворих з меншою тяжкістю септичного стану превалюють псевдонормальний тип ДД та третій тип ДД. Дані типи ДД при септичних станах у дітей можна вважати більш сприятливими порівняно з першим типом, адже вони супроводжуються меншими розладами серцевого викиду та вірогідно рідше потребують призначення симпатоміметичної підтримки. При цих типах ДД спостерігається більш сприятливий прогноз для життя. У групі з Е/А = 1,3–2,0 померло 2 з 26 (8,0 ± 5,0 %) хворих, у групі з Е/А > 2,0 — 1 з 17 (6,0 ± 6,0 %) хворих, натомість у групі з Е/А < 1,3 — 7 з 49 (14,0 ± 5,0 %). Показники летальності між групами з Е/А = 1,3–2,0 та Е/А < 1,3 та Е/А > 2,0 і Е/А < 1,3 вірогідно відрізнялись (p < 0,05 та p < 0,01 відповідно).
Стан діастолічної функції ЛШ становить інтерес не лише через вплив на серцевий викид та систолічну функцію, а й тому, що, як відомо, кровопостачання ЛШ здійснюється лише під час діастоли, у напрямку від ендокарду до епікарду, а отже, скорочення діастоли та збільшення діастолічного тиску в ЛШ можуть викликати ішемію міокарда, яка, у свою чергу, погіршує енергозалежну релаксацію ЛШ.
Зважаючи на існуючі дані щодо наявності структурного ушкодження міокарда ЛШ при септичних станах (підвищення рівня тропоніну та креатинфосфокінази), викликає інтерес стан коронарного кровообігу [11]. Отже, було проведено дослідження показників, що відбивають стан коронарної перфузії та кисневого забезпечення міокарда. Tsist у досліджуваних групах не мав вірогідної відмінності від групи контролю (p > 0,05). Але в групі С він був вірогідно тривалішим, ніж у групі ТС (p < 0,01). ІНЧ у групах С, ТС та СШ також не мав вірогідних відмінностей із контролем (p > 0,05). При цьому у групах ТС та СШ він був вірогідно меншим, ніж у групі С (p < 0,05 та p < 0,001 відповідно). У групах С, ТС та СШ Тdiаst був вірогідно меншим, ніж у контролі (p < 0,05, p < 0,001 та p < 0,001 відповідно). У групах ТС та СШ він також був коротшим, ніж у групі С (p < 0,05). ІДТЧ у групах С, ТС та СШ також був вірогідно меншим, ніж у групі контролю (p < 0,05, p < 0,001 та p < 0,001 відповідно). У групі СШ ІДТЧ також був вірогідно меншим, ніж у групах С та ТС (p < 0,05 та p < 0,001 відповідно). ІЖМ у нормі має становити від 0,7 до 1,0 [12]. За нашими спостереженнями, у здорових дітей він дорівнював 0,72 ± 0,06 ум.од. ІЖМ у групах С, ТС та СШ був вірогідно меншим, ніж у групі контролю (p < 0,001, p < 0,01 та p < 0,001 відповідно). У групі СШ цей показник був також вірогідно меншим, ніж у групах ТС та С (p < 0,05 та p < 0,01 відповідно). КДТЛШ у групах С, ТС та СШ був вірогідно підвищеним порівняно із групою контролю (p < 0,05, p < 0,001 та p < 0,001 відповідно). У групі СШ та ТС він також був вірогідно більшим, ніж у групі С (p < 0,01). У свою чергу, КПТ порівняно із групою контролю також вірогідно знижувався у всіх досліджуваних групах хворих — С, ТС та СШ (p < 0,05, p < 0,001 та p < 0,001 відповідно). У групі СШ він був вірогідно нижчим, ніж у групах С та ТС (p < 0,01 та p < 0,001 відповідно). А у групі ТС — вірогідно нижчим, ніж у групі С (p < 0,05) (табл. 8).
Отже, ДД при септичних станах у дітей безпосередньо впливає на коронарну перфузію та кисневе забезпечення міокарда. Погіршення кисневого забезпечення міокарда прогресує паралельно ступеню тяжкості септичного стану: С — ТС — СШ. Імовірно, що гемодинамічний фактор є важливим чинником структурного ушкодження міокарда ЛШ і сприяє погіршенню як енергозалежних діастолічних процесів, так і систолічної функції ЛШ.
Як зазначалося, ДД ЛШ має несприятливий вплив на перебіг СШ у дорослих, проте її вплив на перебіг септичних станів у дітей не вивчено. З метою з’ясування можливого впливу ДД на результат при септичних станах у дітей було вивчено стан її показників у пацієнтів, які вижили, та в померлих. Серед обстежених хворих сприятливий результат (одужання) спостерігався у 144 дітей, несприятливий — у 26 хворих. Аналіз отриманих даних дає підстави вважати, що за віком та антропометричними характеристиками хворі, які одужали, та померлі хворі вірогідно не відрізнялись (р > 0,05). У групі хворих із несприятливим результатом захворювання спостерігалися вірогідно нижчі показники ІКДО ЛШ, УІ ЛШ та СІ ЛШ (р < 0,05 та р < 0,01 відповідно). Показники САТ, ЧСС, ФВ та Vmax Peak A не мали вірогідних відмінностей (р > 0,05). Натомість Vmax Peak Е у групі хворих із несприятливим результатом захворювання був вірогідно меншим, ніж у групі із сприятливим результатом захворювання (р < 0,05). Внаслідок зменшення швидкості раннього діастолічного току крові в групі хворих із несприятливим наслідком септичного стану спостерігались вірогідно нижчі співвідношення Е/А (р < 0,01) та ΔР/ΔV (р < 0,05) та вірогідно більший КДТЛШ (р < 0,05). DT Е MK у групі хворих із несприятливим наслідком септичного стану також був вірогідно коротшим, ніж у групі із сприятливим результатом септичного стану (р < 0,01) (табл. 9).
/108.jpg)
Отже, отримані дані свідчать, що ДД першого типу при септичних станах у дітей може вважатися прогностично несприятливим типом розладу трансмітрального кровотоку. Наявність даного варіанту ДД супроводжується високим ризиком розвитку синдрому поліорганної недостатності, високою летальністю, негативно впливає на показники серцевого викиду при септичних станах у дітей і потребує своєчасної діагностики та корекції.
Висновки
1. Центральна гемодинаміка у великому колі кровообігу при септичних станах характеризується збільшенням ЧСС, що відбувається на тлі погіршення переднавантаження, яке прогресує відповідно до ступеня тяжкості септичного стану (С — ТС — СШ).
2. Зниження показників артеріального тиску за відсутності вірогідних змін ІЗПСО обумовлені переважно зменшенням серцевого викиду, що відбувається як за рахунок обмеженого переднавантаження, так і за рахунок погіршення систолічної функції лівого шлуночка, що спостерігається переважно у хворих на СШ.
3. При септичних станах у дітей відбувається розвиток діастолічної дисфункції лівого шлуночка, що обумовлена як розладами релаксації, так і рестриктивними порушеннями. Найбільш несприятливим типом діастолічної дисфункції є перший її тип із зменшенням співвідношення Е/А < 1,3.
4. Погіршення комплайєнсу лівого шлуночка при септичних станах поряд із гіповолемією може бути важливим чинником обмеження переднавантаження та формування рідинно-рефрактерного шоку.
5. Низький комплайєнс лівого шлуночка та скорочення часу діастоли сприяють збільшенню кінцево-діастолічного тиску в ньому та призводять до погіршення коронарної перфузії під час діастоли, що може бути чинником розвитку структурного ушкодження міокарда.
/107.jpg)

/104.jpg)
/105.jpg)
/106.jpg)
/107_2.jpg)
/108.jpg)