Статтю опубліковано на с. 55-62
Вступ
Протягом останніх десятиріч відзначається загальносвітова тенденція до збільшення захворюваності як на функціональні, так і на органічні хвороби шлунково-кишкового тракту (ШКТ), в тому числі в ранньому дитячому віці. Досить часто затяжний або рецидивуючий перебіг гастроінтестинальних захворювань кишечника у дітей призводить до розвитку недостатності травлення, глибоких метаболічних порушень, затримки фізичного та психомоторного розвитку, формування полідефіцитних станів, зниження якості життя дитини [15, 24]. Функціональні захворювання є предиктором формування хронічної патології ШКТ у подальші періоди життя, що визначає необхідність удосконалення методів їх лікування.
У наш час алергічну або неалергічну гіперчутливість до їжі розглядають як один із найчастіших станів, що призводить до функціональних та органічних змін ШКТ. Епідеміологічні дослідження показали, що від 30 до 90 % населення земної кулі не переносять один або більше харчовий продукт. У той час як поширеність справжніх алергічних реакцій на продукти харчування серед дитячого населення становить 4–5 %, дорослого населення — близько 2 %, неалергічну харчову непереносимість, тобто будь-які негативні реакції на продукти харчування, обумовлені нездатністю організму засвоювати деякі продукти або їх складові, що не супроводжуються асоційованими з алергією механізмами, мають близько 80 % населення розвинутих країн [10, 13, 20]. У дітей раннього віку в етіології неалергічної харчової непереносимості найбільш значущими факторами вважають кишкові інфекції, хронічний постінфекційний ентероколіт, функціональні розлади верхніх відділів ШКТ, ферментопатії (дисахаридазна, в тому числі лактазна недостатність, целіакія та ін.), дисбіоз кишечника, функціональні та запальні захворювання гепатобіліарної системи, гельмінтози, лямбліоз.
Гастроінтестинальні розлади при харчовій непереносимості, як правило, мають неспецифічний характер, в багатьох випадках характеризуються нечіткою клінічною картиною, хвилеподібним перебігом, коли періоди загострення змінюють досить тривалі періоди ремісії [7, 17].
У дітей раннього віку харчова непереносимість може проявлятись клінічною картиною гастроезофагеального рефлюксу, афтозного стоматиту, езофагіту, гастроентериту, ентероколіту, проктоколіту, функціональних розладів кишечника. Для цих дітей характерні такі прояви з боку ШКТ, як абдомінальні болі, нудота, зригування або блювання, метеоризм, діарея або запори, гемоколіт, кишкові кольки.
У патогенезі функціональних та органічних гастроінтестинальних розладів травного тракту при гастроінтестинальній харчовій алергії (ГХА) та неалергічній харчовій непереносимості (НАХН) важливу роль відіграють такі складові, як розвиток алергічного або неалергічного запалення, розлади моторики гладких м’язів травного та біліарного трактів і роботи сфінктерного апарату ШКТ, порушення кровопостачання та іннервації органів травлення, негативні зміни в системі мікробіоценозу ШКТ.
Згідно з сучасними уявленнями, захворювання ШКТ рідко залишаються ізольованими, особливо в дитячому віці, поступово в патологічний процес залучаються інші органи травлення. За даними різних авторів, поєднана патологія ШКТ становить від 50 до 100 % [12, 17]. Так, клінічні дослідження показали, що захворювання кишечника, особливо його верхніх відділів, найчастіше перебігають із залученням у патологічний процес гепатобіліарної системи та підшлункової залози (ПЗ). У наш час більшість гастроентерологів розглядають функціонування цих органів як єдину дигестивну гастрогепатопанкреатодуоденальну систему, центральною ланкою якої вважають підшлункову залозу [2, 9, 26].
Дослідження останніх років показали, що в патогенезі вторинної недостатності ПЗ при харчовій непереносимості найбільш важливу роль відіграє синдром надмірного бактеріального росту в тонкій кишці, що розвивається насамперед при хронічному запальному процесі в кишечнику інфекційного або алергічного ґенезу, гострих інфекціях кишечника, дисбактеріозах товстої кишки, гельмінтозах. Доведено, що надмірне заселення бактеріями гепатопанкреатодуоденальної зони супроводжується інактивацією та дефіцитом панкреатичних ферментів через зміну рН, руйнування ферментів бактеріями, зниження їх концентрації в результаті розведення кишкового вмісту, розладів моторики дванадцятипалої кишки та сфінктерного апарату ПЗ внаслідок дії подразнюючих субстанцій у кишці [3, 12, 26].
Встановлено, що каскад патогенетичних механізмів при харчовій непереносимості, який характеризується механічним ушкодженням і набряком слизової оболонки протоків, цитотоксичною дією на ацинарні клітини, порушенням відтоку панкреатичного соку, рефлюксом жовчі в протоки залози, ініціює дестабілізацію функціонального стану ПЗ [2, 23].
У патогенезі недостатності ПЗ при харчовій непереносимості важливе місце займають також розлади моторики ШКТ. За результатами досліджень останніх років встановлено, що при харчовій непереносимості внаслідок негативної дії компонентів їжі на стінку кишечника порушуються процеси центральної та вегетативної (на рівні аферентно-еферентних механізмів) регуляції, що призводить до порушення роботи гладких м’язів та сфінктерів травного тракту [23]. Внаслідок таких функціональних розладів ШКТ, особливо його верхніх відділів та біліарного тракту, уповільнюється або прискорюється просування їжі по травному тракту, що призводить до закислення вмісту дванадцятипалої кишки, недостатньої тривалості перебування їжі в дванадцятипалій кишці або, навпаки, дуоденостазу. Крім того, внаслідок функціональних розладів біліарного тракту порушується виділення жовчі, через що зменшується активність панкреатичної ліпази, погіршуються умови для відтоку панкреатичного соку, збільшується ризик дуоденопанкреатичного рефлюксу, який запускає механізми запалення ПЗ [9, 17]. Всі вищеназвані функціональні розлади призводять до порушень виділення панкреатичного соку, недостатньої активації панкреатичних ферментів у дванадцятипалій кишці та безпосередньо недостатності процесів перетравлення їжі.
Виявлено, що підвищення тиску в порожнині кишечника внаслідок підвищеного газоутворення, особливо при лактазній недостатності, призводить до погіршення відтоку секрету ПЗ та порушення продукції секретину, холецистокініну, панкреозиміну [12, 15].
Важливим механізмом розвитку вторинної недостатності ПЗ при ГХА та НАХН можна вважати також патологічні зміни венозного та артеріального кровообігу в даному органі, які розвиваються внаслідок запального процесу в травному тракті, алергічної реакції, розладів роботи вегетативної нервової системи. Як відомо, ПЗ має тісний анатомо-фізіологічний зв’язок із великими судинами, тому будь-яке підвищення внутрішньочеревного тиску призводить до набряку ПЗ, що сприяє стисканню інтрапанкреатичних судин і виникненню елементів ішемії в паренхімі залози з подальшою атрофією її структур.
Розлади роботи ПЗ у дітей при харчовій непереносимості, як правило, не супроводжуються запальною реакцією, але мають певну клінічну симптоматику. До клінічних проявів недостатності ПЗ належать такі, як больовий абдомінальний синдром, зниження апетиту до його повної відсутності, вибірковість апетиту, нудота та блювання, метеоризм, зміна характеру випорожнень (рідке, частково неперетравлене), загальна слабкість та зниження фізичної активності, при тяжких формах недостатності ПЗ — відставання у фізичному розвитку.
Діагностика екзокринної недостатності ПЗ у педіатричній практиці, особливо в дітей раннього віку, досить часто має значні труднощі, в першу чергу внаслідок нечіткої клінічної симптоматики, особливо в умовах ураження декількох органів ШКТ, а також незначних змін при ультразвуковому обстеженні, вікових обмежень і складності проведення більшості інструментальних методів дослідження. Тому на практиці діагноз вторинної недостатності екзокринної функції ПЗ, як правило, базується на виявленні відповідної клінічної симптоматики та результатах копрологічних досліджень, які дотепер не втратили своєї актуальності. Копрологію можна вважати стандартним, найбільш фізіологічним і досить інформативним методом, який у більшості випадків дозволяє оцінити ступінь недостатності травлення та ефективність її лікування. При оцінці результатів копрограми необхідно звертати увагу на такі патологічні ознаки: виявлення в копрофільтратах нейтрального жиру (стеаторея 1-го типу), виявлення жирних кислот і мил (стеаторея 2-го типу), поєднання вищезазначеного (стеаторея 3-го типу), велика кількість м’язових волокон (креаторея), велика кількість крохмальних зерен (амілорея).
Вторинна недостатність ПЗ, особливо в дітей раннього віку, швидко призводить до порушення процесів перетравлення харчових компонентів (синдром мальдигестії), поступово порушуються також процеси всмоктування нутрієнтів у кишечнику (формується синдром мальабсорбції). На підставі сучасних відомостей про патогенез вторинної недостатності ПЗ розроблено алгоритм її лікування, що включає своєчасне виявлення та адекватне лікування основного захворювання, нутритивну підтримку базової регуляторної системи, оптимальний спосіб терапії щодо панкреатичної недостатності, корекцію дисбіотичних порушень тонкої та товстої кишок.
Отримано переконливі дані про те, що екзокринна недостатність ПЗ вторинного характеру на перших етапах захворювання в більшості випадків пов’язана з порушеннями екскреції панкреатичних ферментів та їх активації в порожнині тонкої кишки. Тільки поступово патологічні процеси поглиблюються через ушкодження та/або перенапруження ацинарних клітин, що призводить до зниження секреції панкреатичних ферментів.
Для всіх залоз травного тракту, в тому числі ПЗ, доведена саморегуляція секреції за принципом від’ємного зворотного зв’язку. Проявом саморегуляції ПЗ можна вважати те, що інтрадуоденальне введення панкреатичних ферментів, з одного боку, зменшує секрецію того з них, який опинився в надмірній кількості щодо перетравлюваного субстрату, з іншого боку — знижує реактивність клітин, що вивільняють секретин і холецистокінін [16, 18].
Це обґрунтовує необхідність своєчасного лікування недостатності ПЗ і доцільність застосування ферментних препаратів як замісної терапії функціональних розладів ПЗ незалежно від етіології.
Згідно з сучасними рекомендаціями щодо ферментотерапії вторинної недостатності екзокринної функції ПЗ, вона повинна починатись якомога раніше для попередження виникнення порушень секреторної функції ПЗ на фоні порушень її екскреторної функції, проводитись із застосуванням достатньо високих доз ферментів, які забезпечують клінічний ефект, бути досить тривалою та поєднуватись із лікуванням основного захворювання, що дає змогу відновлення функціонального стану ПЗ та усунення етіологічних факторів [4, 8, 26]. Існуючий у практичній медицині міф про небезпеку формування «лінивої» ПЗ на фоні тривалої ферментотерапії та застосування високих доз ферментних препаратів вважають однією з причин недостатніх ефектів у лікуванні захворювань ПЗ.
Для успішного лікування вторинної недостатності ПЗ важливого значення набуває правильний вибір ферментного препарату. Стандартними міжнародними вимогами до препаратів на основі панкреатичних ферментів є:
— стійкість до дії соляної кислоти та пепсину;
— оптимум фармакологічної дії в діапазоні рН 4–7;
— вміст достатньої кількості ферментів, що забезпечує повний гідроліз нутрієнтів у дванадцятипалій кишці;
— ферменти повинні бути тваринного (свинячого) походження;
— рівномірне та швидке перемішування з хімусом;
— одночасний пасаж із хімусом через воротар — розмір таблеток або гранул не повинен перевищувати 2 мм;
— швидке вивільнення ферментів у порожнині дванадцятипалої кишки;
— відсутність жовчних кислот у складі препарату;
— доведена безпечність і відсутність токсичності.
До препаратів для застосування в ранньому дитячому віці висуваються також додаткові вимоги:
— можливість і зручність точного індивідуального дозування препарату залежно від віку, маси тіла, ступеня недостатності ПЗ;
— зручність прийому дітьми найменшого віку;
— ферменти в будь-якій необхідній дозі повинні потрапляти в організм у захисній кислотостійкій оболонці, яка швидко розчиняється в лужному середовищі, та бути досить подрібненими (мультидозовий принцип застосування ферментів) для рівномірного перемішування та одночасного транспортування з хімусом;
— внаслідок малих розмірів внутрішнього отвору воротаря у дітей розміри гранул або таблеток повинні бути меншими, ніж при застосуванні у дорослих.
За формою ферментні препарати на основі панкреатину І.М. Захарова та співавт. (2009) поділяють на 4 групи: капсули з міні-мікросферами (d = 0,8–1,2 мм); капсули з мікрогранулами або мікропелетами (d = 1,4–1,6 мм); капсули з мікротаблетками (d = 1,7–2,0 мм); міні-таблетки (d = 3,0–5,0 мм), таблетки (d > 5,0 мм) [3].
На підставі експериментальних, біохімічних, клінічних досліджень більшість науковців надають перевагу ферментним препаратам, які захищені від дії соляної кислоти. Вивчення фармакокінетики показало, що застосування даних препаратів як замісної ферментотерапії фізіологічне та дозволяє нормалізувати процеси перетравлення їжі в тонкій кишці — в шлунку мікротаблетки або міні-мікросфери швидко вивільняються з желатинової капсули та рівномірно перемішуються з їжею, легко та одночасно з хімусом порційно, міні-дозами потрапляють у дванадцятипалу кишку і починають працювати вже в проксимальному відділі тонкого кишечника [3, 8, 21].
Ферментні препарати у формі капсул із мікротаблетками, що вкриті ентеросолюбільною оболонкою, повною мірою відповідають вимогам до препаратів для застосування у дітей раннього віку, містять малу кількість допоміжних речовин, зокрема компонентів оболонки. Рандомізованими дослідженнями доведена безпека застосування мікротаблеток у педіатрії, в тому числі у немовлят від 6-місячного віку [25]. До даної групи препаратів належить Ерміталь (виробник: «Нордмарк Арцнайміттель ГмбХ та Ко.КГ», Німеччина) — сучасний ферментний препарат, діючою речовиною якого є панкреатин із ПЗ свиней, що випускається у формі капсул із мікротаблетками в трьох дозуваннях (за активністю ліпази) — 10 000 ОД, 25 000 ОД, 36 000 ОД. Кожна мікротаблетка вкрита плівковою кислотостійкою оболонкою, що дозволяє не ковтати капсулу цілком, а приймати препарат безпосередньо в мікротаблетках, що є особливо важливим у педіатрії. Мікротаблетована форма дає можливість точного титрування дози препарату на кожний прийом їжі дитиною. Важливою характеристикою препарату Ерміталь 10 000 є рівна кількість активних компонентів у кожній мікротаблетці (1 мікротаблетка = 450–500 ОД ліпази). Мікротаблетки, завдяки своєму малому розміру (d = 1,7 мм), легко проходять через воротар разом із хімусом, що забезпечує синхронне потрапляння їжі та панкреатину в дванадцятипалу кишку, їх легко можуть проковтнути діти раннього віку, в тому числі немовлята. Оболонка мікротаблетки завдяки своїм властивостям не розчиняється в шлунку і починає швидко розчинятись тільки в порожнині дванадцятипалої кишки (при рН > 5,0), що забезпечує збереження ферментів неушкодженими, з максимальною ферментативною активністю в кислому середовищі шлунка та швидке їх вивільнення і включення в процеси розщеплення жирів, вуглеводів і білків у проксимальних відділах тонкої кишки. Ці механізми дозволяють відтворювати фізіологічні процеси травлення.
Ряд науковців наголошують на таких важливих властивостях препарату, як низький порівняно з іншими ферментними препаратами пороговий рівень рН, при якому відбувається розчинення оболонки мікротаблетки (рН ≥ 5,0), що забезпечує ранню активацію ферментів, у тому числі трипсину, в термінальному відділі дванадцятипалої кишки, інактивацію релізинг-пептидів, а також високий вміст протеаз [19, 21]. Клінічними дослідженнями доведено, що такі властивості препарату Ерміталь 10 000 забезпечують високу ефективність його застосування не тільки для нормалізації процесів перетравлення в кишечнику, а й для усунення больового абдомінального синдрому [6, 22]. Розчинення кислотостійкої оболонки при менших значеннях рН забезпечує більший діапазон рН, у межах якого відзначається висока активність ферментів [5, 21], що розширює можливості ферментотерапії за умов патологічних змін рН у порожнинах травного тракту, в тому числі при закисленні проксимальних відділів тонкої кишки.
Метою роботи було вивчення стану травлення та ефективності корекції його порушень у дітей раннього віку з харчовою непереносимістю.
Матеріали та методи
Обстежено 40 дітей раннього віку (від 6 міс. до 3 років життя) з харчовою непереносимістю. Розподіл дітей за віком був такий: діти першого року життя (від 6 до 12 місяців) — 14 (35,0 %), діти другого року життя — 17 (42,5 %), третього року життя — 9 (22,5 %) дітей.
Діагноз харчової непереносимості встановлювали на підставі детального вивчення анамнезу, аналізу харчового щоденника дітей, клінічного, параклінічного обстеження із застосуванням лабораторних загальноклінічних, алергологічних, генетичних, інструментальних (УЗД органів черевної порожнини, за показаннями — фіброгастроскопія, ректороманоскопія) методів дослідження. За даними клінічного обстеження, ультразвукового дослідження, копрології, визначення еластази калу (за показаннями), у всіх хворих діагностовано екзокринну недостатність ПЗ.
Після встановлення діагнозу всі хворі отримували лікування згідно з протоколами МОЗ України. Для корекції недостатності ПЗ обстежених хворих у комплекс терапії було включено ферментний препарат Ерміталь 10 000. Дозу препарату добирали індивідуально. Початкова добова доза для всіх дітей становила 1000 ОД/кг маси тіла (за активністю ліпази). При необхідності на підставі клінічних (характер випорожнень) та лабораторних (кількість нейтрального жиру в копрограмі) обстежень на 5-ту добу лікування добову дозу препарату збільшували до досягнення терапевтичного ефекту. Протягом всього періоду спостережень початкову добову дозу препарату (1000 ОД ліпази/кг
маси тіла) отримували 28 дітей. У 9 пацієнтів добова доза препарату під час лікування була збільшена до 1500 ОД/кг маси тіла, у 3 пацієнтів — до 2000 ОД/кг маси тіла.
Ефективність терапії оцінювали на підставі динаміки основних клінічних симптомів недостатності травлення (больовий абдомінальний синдром, метеоризм, порушення частоти та характеру випорожнень), загального стану, апетиту, темпів прибавки маси тіла дитини, результатів копрологічного обстеження. Для уніфікації визначення проявів клінічних симптомів реєстрація суб’єктивних скарг та об’єктивних даних проводилась у бальній системі з урахуванням їх ступеня вираженості: 0 балів — відсутність прояву (ознаки) симптому; 1 бал — слабкий ступінь прояву (ознаки) симптому; 2 бали — помірний ступінь, 3 бали — значний ступінь прояву (ознаки) симптому. Для оцінки динаміки клінічних проявів вираховували показник середнього бала.
Обробку отриманих результатів проводили загальноприйнятими математичними методами варіаційної статистики.
Результати та обговорення
Вивчення анамнезу захворювання, особливостей індивідуальної реакції дитини на продукти харчування, результатів клініко-параклінічного обстеження (гастроінтестинальні симптоми та наявність у дитини патології з боку інших органів) дозволило встановити у 14 (35,0 %) дітей різні форми ГХА (у 7 дітей — алергічний гастроентерит або ентероколіт, у 4 дітей — гастроезофагеальна рефлюксна хвороба з еозинофільним езофагітом, у 3 дітей — індукований харчовими білками алергічний проктоколіт), у 26 (65,0 %) дітей — НАХН, причинами якої у 11 пацієнтів був хронічний ентероколіт, у 7 — функціональні розлади верхніх відділів ШКТ та біліарного тракту, 5 дітей мали дисбактеріоз кишечника тяжкого ступеня, 3 дитини — лямбліоз та аскаридоз.
Серед усіх хворих у більшості (29 – 72,5 %) дітей були відзначені негативні реакції на коров’яче молоко, молочні суміші або інші продукти на його основі, що співпадає із висновками інших дослідників про роль коров’ячого молока та продуктів на його основі у формуванні харчової непереносимості серед дітей раннього віку [10, 11, 23]. У 10 дітей гіперчутливість до коров’ячого молока була пов’язана з алергічними реакціями, у 9 дітей — із непереносимістю лактози, у 10 дітей — із реалізацією інших механізмів неалергічної гіперчутливості до їжі.
Крім того, результати обстеження показали, що 14 дітей (35,0 %) мали негативні реакції на крупи, 12 дітей (30,0 %) — на картоплю або інші овочі. У 17 (42,5 %) дітей в анамнезі захворювання були негативні реакції на введення в раціон фруктів і фруктових соків, 9 (22,5 %) — на м’ясо (яловичина, курятина), 10 (25,0 %) — на курине яйце, 7 (17,5 %) — на рибу, 11 (27,5 %) — на вироби з пшениці та інші продукти, що містять глютен. У третини хворих (12 дітей — 30,0 %) спостерігалась гіперчутливість до двох або більше продуктів харчування.
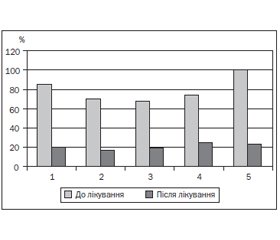
При обстеженні дітей із харчовою непереносимістю диспептичні симптоми нами були виявлені в усіх пацієнтів, у тому числі: абдомінальний біль — у 28 (70 %) дітей, збільшення частоти випорожнень — 33 (82,5 %), розріджене, частково неперетравлене випорожнення — у 34 (85,0 %), нудота або блювання — у 17 (42,5 %), метеоризм — у 27 (67,5 %) пацієнтів (рис. 1). Батьки 75 % дітей відзначали зниження або вибірковість апетиту, 40 % батьків — загальну слабкість та зниження фізичної активності дитини, прибавка маси тіла більше ніж у половини дітей була зниженою.
При копрологічному обстеженні на старті лікування ознаки мальдигестії мали всі пацієнти (рис. 2), в тому числі: стеаторею — 40 (100 %) дітей (середня інтенсивність — 2,28 ± 0,30 бала), креаторею — 25 (62,5 %) дітей (середня інтенсивність — 1,95 ± 0,15 бала), амілорею — 28 (70,0 %) дітей (середня інтенсивність — 2,06 ± 0,20 бала).
УЗД органів черевної порожнини показало, що більшість пацієнтів (29 дітей — 72,5 %) мали зміни розмірів і/або структури ПЗ, у тому числі збільшення розмірів ПЗ виявлено у 22 дітей, підвищення ехогенності та/або неоднорідність паренхіми ПЗ із гіперехогенними включеннями — у 26 дітей.
Виявлені порушення процесів перетравлення (мальдигестії) за даними копрологічного обстеження в поєднанні з клінічними ознаками (диспептичні симптоми) та структурними змінами ПЗ (за результатами УЗД) дають підставу вважати порушення екзокринної функції ПЗ важливою причиною недостатності травлення в обстежених дітей із харчовою непереносимістю.
Включення ферментів у терапію хворих на харчову непереносимість в більшості випадків сприяло швидкій нормалізації частоти та характеру випорожнень. Так, вже на 3–5-й день лікування зменшення частоти дефекації до нормальних вікових показників відзначили 10 (25,9 %) батьків, покращення характеру випорожнення — батьки 18 (45 %) дітей, зменшення метеоризму — 15 (37,5 %) батьків. У більшості дітей спостерігалось покращення показників копрограми (це стосувалось насамперед стеатореї, інтенсивність якої протягом 1-го тижня лікування зменшилась від 2,28 ± 0,30 бала до 1,40 ± 0,18 бала (Р < 0,05), та креатореї, інтенсивність якої зменшилась від 1,95 ± 0,15 бала до 1,52 ± 0,12 бала (Р < 0,05)). Інтенсивність амілореї протягом 1-го тижня лікування також мала тенденцію до зменшення — від 2,08 ± 0,20 бала до 1,83 ± 0,14 бала, але відмінності не були вірогідними (Р > 0,05).
У 12 (30 %) пацієнтів застосування панкреатину в початковій дозі (1000 ОД/кг маси тіла) не дало очікуваного клінічного результату (у дітей зберігались досить інтенсивні клінічні прояви недостатності ПЗ і зміни в копрограмі). Цим дітям була проведена корекція ферментотерапії зі збільшенням дози препарату до 1500 ОД/кг маси тіла (9 пацієнтів), а при значних клінічних проявах недостатності ПЗ доза препарату була збільшена до 2000 ОД/кг маси тіла (3 пацієнти). Це співпадає з літературними даними про необхідність індивідуального добору дози ферментів не стільки відповідно віку та масі тіла дитини, скільки залежно від ступеня недостатності ПЗ, характеру основного захворювання, особливостей раціону харчування, динаміки клінічної симптоматики на фоні лікування та інших факторів [1, 5, 14].
Динамічне спостереження дітей після корекції дози ферментного препарату показало позитивний клінічний ефект у переважної більшості пацієнтів (95,0 %). Тільки в двох випадках ми не отримали значного клінічного ефекту, що при аналізі перебігу основного захворювання було пов’язано з наявністю значних порушень гепатобіліарної cистеми та вираженого синдрому надмірного бактеріального росту в тонкій кишці.
За результатами обстеження дітей на 14-й день лікування виявлено суттєве зменшення частоти клінічних симптомів недостатності травлення (рис. 1), в тому числі нормальну частоту та характер випорожнень мали 32 (80,0 %) дитини, відсутність больового синдрому та метеоризму — 34 (85,0 %) пацієнти. Покращення процесів травлення, зникнення або зменшення інтенсивності больового синдрому та метеоризму позитивно позначились на таких загальноклінічних показниках, як апетит (у результаті лікування нормалізувався у 20 дітей), загальна активність, настрій, тривалість та глибина сну дитини (за оцінкою батьків, значно покращились у 28 дітей), показники фізичного розвитку (прибавка маси тіла нормалізувалась у 17 дітей).
На рис. 2 наведено результати копрологічного обстеження дітей у динаміці лікування, згідно з якими включення в комплекс терапії дітей із харчовою непереносимістю панкреатину в мікротаблетках сприяло зменшенню проявів мальдигестії, про що свідчило суттєве зменшення частоти виявлення та інтенсивності як стеатореї, так і креатореї й амілореї. На 14-й день лікування нормальні показники копрограми мала більшість обстежених дітей (31 дитина — 77,5 %).
На 14-й день лікування дітям було проведено контрольне УЗД органів черевної порожнини, яке показало у 14 дітей тенденцію до зменшення розмірів ПЗ, у 17 пацієнтів відзначено зменшення патологічних змін ехогенності паренхіми ПЗ, що свідчить про покращення її морфологічного стану в динаміці лікування. Однак повна нормалізація ультразвукових характеристик ПЗ встановлена тільки у 8 (20,0 %) дітей, що, на нашу думку, вказує на необхідність більш тривалого курсу ферментотерапії у дітей із харчовою непереносимістю.
Висновки
Детальне обстеження дітей раннього віку з негативними реакціями на продукти харчування (вивчення анамнезу захворювання, особливостей індивідуальної реакції дитини на продукти харчування, результати клініко-параклінічного обстеження) дозволило встановити у 14 (35,0 %) дітей різні форми гастроінтестинальної харчової алергії, у 26 (65,0 %) дітей — неалергічну харчову непереносимість. У більшості пацієнтів (29 дітей — 72,5 %) були відзначені негативні реакції на коров’яче молоко, молочні суміші або інші продукти на його основі, що підтверджує їх роль у формуванні харчової непереносимості серед дітей раннього віку.
У всіх дітей із харчовою непереносимістю виявлені клінічні прояви недостатності травлення: діарейний синдром (85 %), метеоризм (67,5 %), абдомінальний больовий синдром (70 %), зниження або вибірковість апетиту (75 %), симптоми мальдигестії за даними копрограми (стеаторея — у 100 %, креаторея — у 62,5 %, амілорея — у 70 % хворих). Прибавка маси тіла була зниженою більше ніж у 50 % дітей, загальну слабкість і зниження фізичної активності дитини відзначали 40 % батьків.
Недостатність травлення у дітей із харчовою непереносимістю значною мірою визначається формуванням функціональних розладів роботи ПЗ, у патогенезі яких беруть участь механізми алергічного та неалергічного запалення, негативні ефекти надмірного бактеріального росту в тонкій кишці, порушення моторики гладкої мускулатури та сфінктерів верхніх відділів травного і біліарного трактів, зміни венозного та артеріального кровообігу в даному органі. Це обґрунтовує необхідність включення препаратів на основі ферментів ПЗ у комплекс лікування дітей із харчовою непереносимістю.
Застосування в комплексі лікування дітей із гастроінтестинальною харчовою алергією та неалергічною харчовою непереносимістю як замісної терапії ферментного препарату Ерміталь 10 000, діючою речовиною якого є панкреатин із ПЗ свиней (активність ферментів: ліпаза — 10 000 ОД, амілаза — 9000 ОД, протеаза — 500 ОД), має виражений клінічний ефект: зникнення або значне зменшення проявів екзокринної недостатності підшлункової залози, відновлення функцій ШКТ, покращення загального стану та апетиту дитини, показників її фізичного розвитку відзначено майже у 90 % дітей. У 77,5 % дітей показники копрограми на 14-й день лікування повністю нормалізувались. За результатами проведених клінічних досліджень, препарат переноситься добре, відмови пацієнтів від його застосування не було, побічної дії від прийому препарату Ерміталь 10 000 не відзнчено, що дає можливість рекомендувати його для застосування у дітей раннього віку.
Для дітей раннього віку достатньо ефективною є початкова доза панкреатину 1000 ОД ліпази на 1 кг маси тіла. При необхідності на підставі клінічних (характер випорожнень) та лабораторних (кількість нейтрального жиру в копрограмі) обстежень добову дозу збільшують до досягнення терапевтичного ефекту. В даному дослідженні початкову добову дозу препарату (1000 ОД ліпази/кг маси тіла) протягом всього періоду спостережень отримували 70 % дітей. У 22,5 % пацієнтів добова доза препарату під час лікування була збільшена до 1500 ОД ліпази/кг маси тіла, у 7,5 % пацієнтів (3 дитини) — до 2000 ОД ліпази/кг маси тіла.
Список литературы
1. Белоусова Е.А., Никитина Н.В., Цодиков Г.В. Оптимизация схем лечения хронического панкреатита ферментными препаратами // Фарматека. — 2008. — Т. 13. — С. 103-108.
2. Гасилина Т.В., Бельмер С.В. Болезни поджелудочной железы у детей. Первичная и вторичная экзокринная панкреатическая недостаточность // Лечащий врач. — 2010. — № 6. — С. 6-10.
3. Захарова И.Н., Коровина Н,А., Зайденварг Г.Е., Еремеева А.В., Катаева Л.А. Коррекция относительной панкреатической недостаточности у детей c синдромом избыточного бактериального роста в тонкой кишке // Вопросы практической педиатрии. — 2009. — Т. 4, № 2. — С. 28-33.
4. Казак С.С. Вторинна екзокринна недостатність підшлункової залози у дітей та підлітків // Мистецтво лікування. — 2008. — № 3. — С. 14-16.
5. Маев И.В., Кучерявый Ю.А. Желудочное кислотообразование и хронический панкреатит: насколько сильна взаимо–связь? // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2008. — № 3. — C. 4-14.
6. Охлобыстин А.В. Боль при панкреатите: проблема и пути ее решения // Рос. журнал гастроэнтерол., гепатол., колопроктол. — 2012. — Т. 22, № 1. — С. 64-70.
7. Самур П.К., Кінг К. Харчування в педіатрії. — Львів: Медицина світу, 2012. — 562 с.
8. Сенаторова А.С., Омельченко Е.В. Поджелудочная железа и энзимология в педиатрии // Дитячий лікар. — 2013. — № 4. — С. 25-30.
9. Урсова Н.И. Функциональные нарушения билиарного тракта у детей: причины, диагностика, терапия // Фарматека. — 2013. — № 1. — С. 26-32.
10. Шапошникова Ю.Н. Пищевая аллергия и пищевая непереносимость: современный взгляд на проблему // Сучасна гастроентерологія. — 2008. — № 4(42). — С. 90-101.
11. Шумилов П.В., Дубровская М.И., Юдина О.В. и др. Поражения желудочно-кишечного тракта у детей с пищевой аллергией // Трудный пациент.— 2007.— № 10.— С. 19-25.
12. Ammoury R., Croffie J. Malabsorptive Disorders of Childhood // Pediatrics in Review. — 2010. — Vol. 31, № 10. — P. 407-416.
13. Bohn L., Storsrud S., Tornblom H., Bengtsson U., Simren M. Self-reported food-related gastrointestinal symptoms in IBS are common and associated with more severe symptoms and reduced quality of life // Am. J. Gastroenterol. — 2013. — Vol. 108. — P. 634-641.
14. Caras S., Boyd D., Zipfel L., Sader-Struckmeier S. Evaluation of stool collections to measure efficacy of PERT in subjects with exocrine pancreatic insufficiency // J. Pediatr. Gastroenterol. Nutr. — 2011. — Vol. 53, № 6. — P. 634-640.
15. Carlson M.J., Moore C.E., Tsai C.M., Shulman R.J., Chumpitazi B.P. Child and parent perceived food-induced gastrointestinal symptoms and quality of life in children with functional gastrointestinal disorders // J. Acad. Nutr. Diet. — 2014. — Vol. 114. — P. 403-413.
16. Ewald N., Raspe A., Kaufmann C. Determinants of exocrine pancreatic function as measured by fecal elastase-1 concentrations (FEC) in patients with diabetes mellitus // Eur. J. Med. Res. — 2009. — Vol. 14(3). — P. 118-122.
17. Hill R.J. The role of food intolerance in functional gastrointestinal disorders in children // Reprinted from Australian Family Phisician. — 2014. — Vol. 43, № 10. — P. 686-689.
18. Huml M., Kobr J., Siala K. Gut peptide hormones and paediatric type 1 diabetes mellitus // Physiol. Res. — 2011, Мay 16 [Epub ahead of print]. PubMed PMID: 21574763.
19. Kuhn R.J., Eyting S., Henniges F., Potthoff A. In vitro comparison of physical parameters, enzyme activity, acid resistance, and pH dissolution characteristics of enteric-coated pancreatic enzyme preparations: Implications for clinical variability and pharmacy substitution // Pediatr. Pharmacol. Ther. — 2007. — Vol. 12. — P. 115-128.
20. Kurowski K., Boxer W.R. Food allergies: detection and management // Am. Fam. Physician. — 2008. — Vol. 77(12). — P. 1678-1686.
21. Lohr J.M., Hummel F.M., Pirilis K.T., Steinkamp G., Kor–ner A., Henniges F. Properties of different pancreatin preparations used in pancreatic exocrine insufficiency // Eur. J. Gastroenterol. Hepatol. — 2009. — Vol. 21. — P. 1024-1031.
22. Mossner J., Keim V. Treatment with pancreatic enzymes // Dtsch. Arzteblatt. Int. — 2011. — Vol. 108. — P. 578-582.
23. Pasqui F., Poli C., Colecchia A., Marasco G., Festi D. Adverse Food Reaction and Functional Gastrointestinal Disorders: Role of the Dietetic // Approach. J. Gastrointestin. Liver Dis. — 2015. — Vol. 24, № 3. — P. 319-327.
24. Spee L.A., Lisman-Van L.Y., Benninga M.A., Bierma-Zeinstra S.M., Berger M.Y. Prevalence, characteristics, and management of childhood functional abdominal pain in general practice // Scand. J. Prim. Health Care. — 2013. — Vol. 31. — P. 197-202.
25. Spomer N., Klingmann V., Lerch C., Stoltenberg I., Meissner T., Breitkreutz J. Multi-particulates — the solution for children? // Arch. Dis. Child. — 2012. — Vol. 97. — P. 283-286.
26. Us A. Chronic pancreatitis in children: Current knowledge in diagnosis and treatment // J. of Pediatric Sciences. — 2011. — Vol. 3, № 4. — P. 98-112.

/60.jpg)