Журнал «Здоровье ребенка» 1 (69) 2016
Вернуться к номеру
Ассоциация вариаций генов POMP, FLG, MTOR и ATG5 с риском развития бронхиальной астмы у детей
Авторы: Волосовец А.П., Кривопустов С.П., Павлик Е.В., Емец О.В., Строй Д.А., Досенко В.Е. - Национальный медицинский университет имени А.А. Богомольца, г. Киев
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Метою даного дослідження було визначити зв’язок однонуклеотидних поліморфізмів у гені білка дозрівання протеасоми (POMP), філагрину (FLG), білка-мішені рапаміцину (MTOR) та автофагії (ATG5) із розвитком бронхіальної астми в дітей.
Методи: клінічні, генетичні — визначення генотипу хворих і здорових дітей за допомогою полімеразної ланцюгової реакції в реальному часі; статистичні.
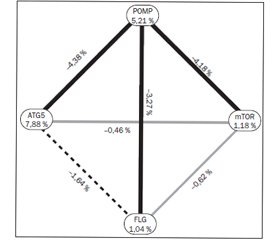
Результати. Установлено, що розподіл генотипів у досліджених групах вірогідно відрізняється при аналізі поліморфізму POMP: GG-варіант виявлений у 9 здорових дітей та відсутній у групі хворих, 32 пацієнти і 37 здорових дітей мали AG-варіант, 62 і 52 відповідно — мали алельний варіант AA, до того ж мінорний варіант взагалі не зустрічався у хворих на бронхіальну астму (р < 0,05 за χ2-критерієм). Варіанти з мінорним генотипом гена FLG виявилися у 2,5 раза частіше у хворих, ніж у контрольній групі: у 5 пацієнтів і у 2 здорових дітей був наявний алельний варіант AA, 27 і 36 — відповідно мали гетерозиготний варіант GА, 67 і 61 — відповідно мали варіант GG. Варіанти з мінорним генотипом у гені MTOR виявилися у 2,4 раза частіше в контрольній групі, ніж серед хворих: у 50 пацієнтів і 43 здорових дітей наявний мажорний алельний варіант ТТ, 36 пацієнтів і 32 здорові дитини мали варіант ТС, 5 і 12 — відповідно мали варіант СС. Отримано статистично вірогідну різницю в розподілі генотипів поліморфізму гена ATG5: у 51 хворої дитини та 43 здорових дітей був гетерозиготний варіант СТ, у 29 та 21 відповідно — мінорний варіант ТТ, у 18 та 33 відповідно — мажорний варіант СС (р < 0,05 за χ2-критерієм). Мінорний генотип поліморфізму гена ATG5 асоціюється з підвищеним ризиком ранньої маніфестації бронхіальної астми (до 3 років життя) (р < 0,05 за χ2-критерієм). За результатами MDR-аналізу виявлено, що поліморфізм гена ATG5 виявився найбільш сильним предиктором розвитку бронхіальної астми, оскільки зменшує рівень ентропії на 7,88 %. При цьому поліморфізм гена POMP зменшує рівень ентропії на 5,21 %, поліморфізм гена MTOR — на 1,18 %, поліморфізм гена FLG — на 1,04 %.
Висновки. Досліджені поліморфізми можуть бути використані як прогностичні маркери розвитку бронхіальної астми в дітей.
Целью данного исследования было определить связь однонуклеотидных полиморфизмов в гене белка созревания протеасомы (POMP), филаггрина (FLG), белка-мишени рапамицина (MTOR) и аутофагии (ATG5) с развитием бронхиальной астмы у детей.
Методы: клинические, генетические — определение генотипа больных и здоровых детей с помощью полимеразной цепной реакции в реальном времени; статистические.
Результаты. Установлено, что распределение генотипов в исследованных группах достоверно отличается при анализе полиморфизма POMP: GG-вариант обнаружен у 9 здоровых детей и отсутствует в группе больных, 32 пациента и 37 здоровых детей имели AG-вариант, 62 и 52 — соответственно имели аллельный вариант AA, при этом минорный вариант не встречался у больных бронхиальной астмой (р < 0,05 по χ2-критерию). Варианты с минорным генотипом гена FLG отмечались в 2,5 раза чаще у больных, чем в контрольной группе: у 5 пациентов и у 2 здоровых детей наблюдался аллельный вариант AA, 27 и 36 соответственно — имели гетерозиготный вариант GА, 67 и 61 соответственно — вариант GG. Варианты с минорным генотипом в гене MTOR отмечались в 2,4 раза чаще в контрольной группе, чем среди больных: 50 пациентов и 43 здоровых ребенка имели мажорный аллельный вариант ТТ, 36 и 32 соответственно — имели вариант ТС, 5 и 12 соответственно — вариант СС. Получена статистически достоверная разница в распределении генотипов полиморфизма гена ATG5: у 51 больного ребенка и 43 здоровых детей был гетерозиготный вариант (СТ), у 29 и 21 соответственно — минорный вариант ТТ, 18 и 33 соответственно — мажорный вариант СС (р < 0,05 по χ2-критерию). Минорный генотип полиморфизма гена ATG5 ассоциируется с повышенным риском ранней манифестации бронхиальной астмы (до 3 лет жизни) (р < 0,05 по χ2-критерию). По результатам MDR-анализа выявлено, что полиморфизм гена ATG5 оказался наиболее сильным предиктором развития бронхиальной астмы, поскольку уменьшает уровень энтропии на 7,88 %. При этом полиморфизм в гене POMP уменьшает уровень энтропии на 5,21 %, полиморфизм в гене MTOR — на 1,18 %, полиморфизм в гене FLG — на 1,04 %.
Выводы. Исследованные полиморфизмы могут быть использованы в качестве прогностических маркеров развития бронхиальной астмы у детей.
The aim of this study was to determine the correlation between single-nucleotide polymorphisms in the proteasome maturation protein gene (POMP), filaggrin gene (FLG), mammalian target of rapamycin gene (MTOR) and autophagy gene (ATG5) and the development of asthma in children.
Methods: clinical, genetic — determining the genotype of patients and healthy children using real-time polymerase chain reaction; statistical ones.
Results. It was found that the distribution of genotypes in the studied groups was significantly different when analysing polymorphism in POMP gene: GG variant was detected in 9 healthy children and was absent in ill people, 32 patients and 37 healthy children had AG variant, 62 and 52 — allelic AA variant, while minor variant wasn’t detected in patients with asthma at all (p < 0.05 by the χ2 criterion). Variants with the minor genotype of the FLG were found to be 2.5 times more frequent among patients than in control group: 5 patients and 2 healthy children had allelic variant AA, 27 and 36 — heterozygous variant GA, 67 and 61 — GG. Variants with minor genotype in MTOR gene were 2.4 times more often in the control group than in patients: 50 patients and 43 healthy children had major allelic variant TT, 36 patients and 32 healthy children had TC variant, 5 and 12 — CC variant. There was found a statistically significant difference in the distribution of genotypes of polymorphism in ATG5 gene: 51 patients and 43 healthy children were heterozygous (CT), 29 and 21 — had minor variant TT, 18 and 33 — major variant CC (p < 0.05 by the χ2). Minor polymorphism of ATG5 gene was associated with increased risk of early manifestation of the asthma (up to 3 years of life) (p < 0.05 by χ2). MDR-analysis has showed that polymorphism in ATG5 gene was the strongest predictor of asthma as it reduced entropy level by 7.88 %. Polymorphism in the POMP gene reduces entropy level by 5.21 %, polymorphism in the MTOR gene — by 1.18 %, polymorphism in the FLG gene — by 1.04 %.
Conclusions. These polymorphisms may serve as prognostic markers for the development of asthma in children.
однонуклеотидний поліморфізм, філагрин, протеасомний протеоліз, автофагія, MTOR, бронхіальна астма, педіатрія.
однонуклеотидный полиморфизм, филаггрин, аутофагия, MTOR, протеасомный протеолиз, бронхиальная астма, педиатрия.
single-nucleotide polymorphism, filaggrin, proteasome proteolysis, autophagy, MTOR, asthma, pediatrics.
Статтю опубліковано на с. 18-24
Вступ
Матеріали та методи
Вибір SNP
Виділення ДНК
Полімеразна ланцюгова реакція
Статистичний аналіз
Результати
/22.jpg)
Обговорення
Висновок
1. Lin Ko-Wei, Li Jinghong, Finn P. Emerging pathways in asthma: Innate and adaptive interactions // Biochimica et Biophysica Acta. — 2011. — 1810. — 1052-1058.
2. Hansel T.T., Johnston S.L., Openshaw P.J. Microbes and mucosal immune responses in asthma // Lancet. — 2013. — 381. — 861-73.
3. Hussey S., Travassos L.H., Jones N.L. Autophagy as an emerging dimension to adaptive and innate immunity // Semin. Immunol. — 2009. — 21. — 233-241.
4. Li C. Autophagy is induced in CD4+ T cells and important for the growth factor-withdrawal cell death // J. Immunol. — 2006. — 177. — 5163-5168.
5. Macian F. Autophagy and the regulation of the immune response // Pharmacological Research. — 2012. — 66. — 475-483.
6. Nakano H., Ushio H. An unexpected role for autophagy in degranulation of mast cells // Autophagy. — 2011 Jun. — 7(6). — 657-9.
7. Mizushima N., Ohsumi Y., Yoshimori T. Autophagosome formation in mammalian cells // Cell. Struct. Funct. — 2002 Dec. — 27(6). — 421-9.
8. Delgoffe G.M., Pollizzi K.M., Waickman A.D., Heikamp E., Meyers D.J., Horton M.R., Bo Xiao, Worley P.F., Powell J.D. The mammalian Target of Rapamycin (MTOR) regulates T helper cell differentiation through the selective activation of MTORC1 and MTORC2 signaling // Nature immunology. — 2011. — 12(4). — 295-303.
9. Venuprasad K., Elly C., Gao M., Salek-Ardakani S., Harada Y., Luo J.L., Yang C., Croft M., Inoue K., Karin M., Liu Y.C. Convergence of Itch-induced ubiquitination with MEKK1-JNK signaling in Th2 tolerance and airway inflammation // J. Clin. Invest. — 2006 Apr. — 116(4). — 1117-26.
10. Moutzouris J.P., Che W., Ramsay E.E., Manetsch M., Alkhouri H., Bjorkman A.M., Schuster F., Ge Q., Ammit A.J. Proteasomal inhibition upregulates the endogenous MAPK deactivator –MKP-1 in human airway smooth muscle: mechanism of action and effect on cytokine secretion // Biochim. Biophys. Acta. — 2010 Mar. — 1803(3). — 416-23.
11. Mudnakudu Nagaraju K.K., Babina M., Worm M. Opposing effects on immune function and skin barrier regulation by the proteasome inhibitor bortezomib in an allergen-induced eczema model // Exp. Dermatol. — 2013 Nov. — 22(11). — 742-7.
12. Dahlqvist J., Törmä H., Badhai J., Dahl N. siRNA Silencing of Proteasome Maturation Protein (POMP) Activates the Unfolded Protein Response and Constitutes a Model for KLICK Genodermatosis // PLoS ONE. — 2012. — 7(1). — e29471.
13. De Benedetto A., Qualia C.M., Baroody F.M. Filaggrin expression in oral, nasal, and esophagealmucos // J. Invest. Dermatol. — 2008. — 128. — 1594-7.
14. Weidinger S., O’Sullivan M., Illig T. Filaggrin mutations, atopic eczema, hay fever, and asthma inchildren // J. Allergy Clin. Immunol. — 2008. — 121. — 1203-9.
15. Tao Zheng, Jinho Yu, Min Hee Oh, Zhou Zhu The Atopic March: Progression from Atopic Dermatitis to Allergic Rhinitis and Asthma // Allergy Asthma Immunol. Res. — 2011 April. — 3(2). — 67-73.
16. Herrick C.A., Xu L., McKenzie A.N. IL-13 is necessary, not simply sufficient, for epicutaneously induced Th2 responses to soluble protein antigen // J. Immunol. — 2003. — 170. — 2488-95.
17. Akei H.S., Brandt E.B., Mishra A. Epicutaneous aeroallergen exposure induces systemic TH2 immunity that predisposes to allergic nasal responses // J. Allergy Clin. Immunol. — 2006. — 118. — 62-9.
18. Ritchie M.D., Hahn L.W., Roodi N., Bailey L.R., Dupont W.D., Parl F.F., Moore J.H. Multifactor-dimensionality reduction reveals high-order interactions among estrogen-metabolism genes in sporadic breast cancer // Am. J. Hum. Genet. — 2001 Jul. — 69(1). — 138-47.
19. Fredriksson K., Fielhaber J.A., Lam J.K., Yao X., Me–yer K.S. Paradoxical Effects of Rapamycin on Experimental House Dust Mite-Induced Asthma // PLoS ONE. — 2012. — e33984.
20. Martin L.J., Gupta J., Jyothula S.S., Butsch Kovacic M., Biagini Myers J.M., Patterson T.L., Ericksen M.B., He H., Gibson A.M., Baye T.M., Amirisetty S., Tsoras A.M., Sha Y., Eissa N.T., Hershey G.K. Functional variant in the autophagy-related 5 gene promotor is associated with childhood asthma // PLoS One. — 2012. — 7(4). — e33454.
21. Heink S., Ludwig D., Kloetzel P-M, Krüger E. IFN-γ-induced immune adaptation of the proteasome system is an accelerated and transient response Proc. Natl Acad. Sci USA. — 2005, June 28. — 102(26). — 9241-9246.
22. Wegmann M., Lunding L., Orinska Z., Wong D.M., Manz R.A., Fehrenbach H. Long-term bortezomib treatment reduces allergen-specific IgE but fails to ameliorate chronic asthma in mice // Int. Arch. Allergy Immunol. — 2012. — 158(1). — 43-53.

/21.jpg)
/22_2.jpg)