Резюме
Углубление ожоговых ран — малоизученный процесс, посредством которого некоторые «пограничные» поверхностные ожоги спонтанно прогрессируют в глубокие поражения. В этой статье рассматриваются современные знания о патогенезе и лечении состояний, связанных с факторами конверсии ожогов. Цель работы заключается в уточнении патогенеза углубления ожоговой раны и оценке тактических подходов, используемых для его профилактики.
Материал и методы. 115 ожоговых больных были госпитализированы и случайным образом разделены на две группы: основная группа, в которой локально использован гепарин, и контрольная группа без его применения. «Пограничные» ожоги после дермабразии закрывали ксенотрансплантатами и повязками гепарина, в то время как в группе сравнения гепарин не применяли. Было высказано предположение, что конечная глубина ожогового некроза может быть сведена к минимуму путем предотвращения или разрешения прогрессивного застоя в системе микроциркуляции в первые послеожоговые часы. Время заживления было короче в группе больных, лечившихся гепарином.
Выводы. Прогрессирование некроза ожоговой раны является сложным процессом и обусловлено гипоперфузией тканей и системными изменениями. Хотя исследования продолжаются, в настоящее время лечение должно включать адекватную инфузионную терапию, нутритивную поддержку, а местное лечение ран — раннюю хирургию ожогов и биологические повязки.
Поглиблення опікових ран — маловивчений процес, за допомогою якого деякі частково поверхневі опіки спонтанно прогресують у глибокі ураження. У цій статті розглядаються сучасні знання про патогенез та лікування станів, пов’язаних із факторами конверсії опіків. Мета роботи полягає в уточненні патогенезу поглиблення опікової рани та оцінці тактичних підходів, що використовуються для його профілактики.
Матеріал і методи. 115 опікових хворих було госпіталізовано та випадковим чином розділено на дві групи: основна группа, у якій локально використаний гепарин, і контрольна група без його застосування. Частково глибокі опіки після дермабразії закривали ксенотрансплантатами і пов’язками гепарину, тоді як у групі порівняння гепарин не застосовували. Було висловлено припущення, що кінцева глибина опікового некрозу може бути зведена до мінімуму шляхом запобігання або вирішення прогресивного застою в системі мікроциркуляції в перші післяопікові години. Час загоєння був коротшим у групі хворих, які лікувалися гепарином.
Висновки. Прогресування некрозу опікової рани є складним процесом і обумовлено гіпоперфузією тканин та системними змінами. Хоча дослідження тривають, тепер лікування повинно включати адекватну інфузійну терапію, нутритивну підтримку, а місцеве лікування ран — ранню хірургію опіків і біологічні пов’язки.
Burn wound progression — poorly studied process, by which some superficial partial thickness burns spontaneously progress into the deep lesions. This article reviews current knowledge on the pathogenesis and treatment of conditions associated with factors of burn conversion. The objective of the work is to clarify the pathogenesis of burn wound progression and to evaluate approaches used for its prevention.
Material and methods. 115 burn patients were hospitalized and randomly divided into two groups: the main group, in which heparin is used locally, and the control group without its application. Partial thickness burns after dermabrasion were closed using xenografts and heparin dressings, while in the comparison group heparin wasn’t used. It has been suggested that the final depth of the burn necrosis can be minimized by the prevention or reversal of the progressive capillary stasis in the early post-burn period. Healing time was shorter in the group of patients treated with heparin.
Conclusions. The progression of the burn wound necrosis is a complex process and is caused by hypoperfusion of tissues and systemic changes. Although the researches are ongoing, currently treatment should include adequate fluid therapy, nutritional support, and local treatment of wounds — early burn surgery and biological dressings.
Статья опубликована на с. 26-30
Актуальность проблемы
Глубина ожога не является понятием статическим с точки зрения морфологии [1]. Первичное повреждение тканей в результате ожога является следствием денатурации белка и гибели клеток дермы на различной глубине. Регенерация эпидермиса в значительной степени зависит от функции дермы, содержащихся в ней макрофагов, способности производства факторов роста фибробластов и воспроизводства внеклеточного матрикса. Существует ряд разнонаправленных по патофизиологическому механизму факторов, приводящих к углублению ожоговой раны [2]. Этот процесс прогрессивного повреждения изначально уцелевших жизнеспособных тканей называют конверсией (углублением) ожоговой раны, который остается не только клинически значимым, но недостаточно изученным явлением.
Во всех классификациях ожогов существует понятие глубины, которая изначально оценивается как поверхностное или частичной толщины поражение и способное прогрессировать в ожог на полную толщину кожи [3]. Этот феномен впервые описан Джексоном как 3 концентрические зоны повреждения тканей вследствие ожога: необратимо поврежденных тканей в зоне коагуляции, гипоперфузируемых тканей в зоне застоя и отечной ткани в зоне гиперемии. Согласно его теории, хотя ткани в зоне стаза и гиперемии и подвержены риску некроза, это потенциально жизнеспособные участки, которые при оптимальном лечении удерживает сохранность перфузии и реэпителизационный потенциал. С другой стороны, в условиях неоптимального лечения ожоги частичной толщины могут легко увеличить свою площадь за счет конверсии ожоговой раны или некротизации на всю толщу в зоне стаза [4]. Прогрессирование глубины ожоговой раны клинически значимо не только методологически при постановке диагноза, но и потому, что это имеет кардинальное влияние на тяжесть течения ожога и тактику лечения.
Современные технологические достижения, такие как лазерная допплеровская флоуметрия, термография и др., помогают в оценке глубины ожоговой раны и даже в какой-то мере объема конверсии, но при одном условии — они должны оцениваться в динамике, а сама задача — как предотвратить углубление ожоговой раны — остается нерешенной проблемой.
Цель работы заключается в уточнении патогенеза углубления ожоговой раны и оценке тактических подходов, используемых для его профилактики.
Материал и методы
Представлен анализ проспективного клинического исследования, проведенного в период с 2010 по май 2015 года на базе отдела термических поражений и пластической хирургии ИНВХ им. Гусака (г. Донецк, Украина) и городской клинической больницы № 3 (г. Краматорск, Украина). На лечении находились 115 пациентов в возрасте от 12 до 68 лет, имевших ожоги частичной толщины 2А–2Б степени менее 30 % поверхности тела. Всем больным в первые 24–48 ч под общим обезболиванием проводилась дермабразия ран; 57 пациентам проведено закрытие раны ксенодермотрансплантатами в сочетании с местным использованием гепарина (1400 Ед гепарина на каждый 1 % поверхности тела ожога) в растворе с димексидом 1 : 5; 58 пациентам антисептик использовали без гепарина.
Средняя площадь «пограничного» ожога составила в основной группе 11,9 ± 7,1 %, а в группе сравнения — 12,8 ± 7,4 % поверхности тела. Некрэктомия и аутодермопластика проводились на участки глубоких ожоговых ран после 14 дней. Глубина и степень поражения фиксировались с помощью скиц Ланда и Браудера и фотографии каждый 5-й день, а также в день выписки с компьютерной оценкой изображения по визуальной шкале при помощи Программного комплекса регистрации и анализа фотоизображения. Скорость заживления раны (СЗР), выраженную в процентах, рассчитывали следующим образом: СЗР = (S – Sn) × 100/S × t. При этом S — величина площади раны при предшествующем измерении, Sn — величина площади в настоящий момент, t — число дней между первым и последующим измерением [5]. Уровень эндогенной интоксикации оценивали по содержанию молекул средней массы в плазме больных при длине волны 254 нм в условных единицах (МСМ 254, усл. ед.), лейкоцитарному индексу интоксикации (ЛИИ) по Кальф-Калифу (1941) и токсической зернистости нейтрофилов (ТЗН, %), содержанию лейкоцитов в периферической крови.
Для статистической обработки полученных данных использовалась компьютерная программа Statistica 6.0. Для оценки статистической значимости различий при сравнении в парах распределений применяли точный метод Фишера, при сравнении групп по количественному признаку — критерий Манна — Уитни для независимых выборок. За критическое значение уровня значимости принимали 5 % (р ≤ 0,05).
Результаты и обсуждение
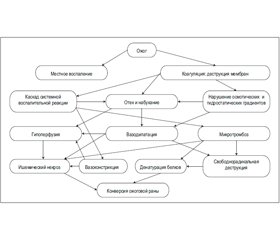
Конверсию ожоговой раны относим к вторичным последствиям ожоговой травмы. Процесс формирования некроза вследствие ожога сопровождается активацией токсических медиаторов воспаления, особенно при нарушении перфузии в шоке, сопровождающейся дальнейшим повреждением кожи и клеток эндотелия капилляров, которые, в свою очередь, потенцируют ишемический некроз ткани. Отек, инфекция и измененная перфузия с повреждением клеточных мембран приводят к динамическому запуску каскада воспалительных медиаторов, которые усугубляют состояние уже травмированных клеток, их проницаемость, ухудшают регулирование обмена жидкости, активируют свободнорадикальное окисление и микротромбообразование (рис. 1).
/27.jpg)
Выделяют местные и общие факторы конверсии. К локальным факторам конверсии ожоговой раны относят инфекцию, высыхание ткани, отек и компрессионный синдром вследствие наличия циркулярного струпа на конечностях. Среди системных факторов можно рассматривать: 1 — те, которые ухудшают кровоснабжение раны; 2 — предрасполагают к инфекции; 3 — связаны с метаболическими расстройствами и 4 — связаны с состоянием общего здоровья пострадавшего.
Риск прогрессирования конверсии связан с общей площадью поверхности кожи тела пациента, утраченной вследствие ожога. Исходя из клинических наблюдений, ожоги большей площади имеют большую тенденцию к углублению по сравнению с локальными ожогами. Например, пациент, который имеет поражение 40 % поверхности тела и глубину ран на толщу кожи, будет иметь большую вероятность их углубления по сравнению с пациентом, который имеет всего 5 % ожога одинаковой глубины. Не подлежит сомнению и связь конверсии с адекватностью проводимой инфузионной терапии.
В широком смысле цель лечения ожогов частичной толщины — предотвращение конверсии и создание условий заживления при минимизации осложнений и последствий. Стандартом лечения ожоговых ран частичной толщины считаем адекватную инфузионную терапию, нутритивную поддержку, местное лечение под контролем методов визуализации и прогнозирования глубины с акцентом на современные антимикробные и биологические покрытия. Считаем патогенетически обоснованным проведение уже в первые сутки после травмы адекватной хирургической дермабразии, за счет которой удаляем поверхностный некроз, снижаем активность активных радикалов и протеаз, способных инактивировать местные факторы роста. Ожоги частичной толщины локально изолируем окклюзирующими повязками и биологическими покрытиями для поддержания влажной раневой среды. Биологическая стратегия использования временных заменителей кожи обеспечивает контакт между раной и дермальным матриксом. Эпителиальные клетки, как известно, мигрируют вдоль матричных белков, и этот подход доказал свою эффективность для поверхностных ожогов и ожогов неопределенной глубины.
Раны вели в условиях «влажной камеры» путем наложения изолирующей повязки с использованием пищевой пленки. Повязки фиксировали несколькими турами бинта. В случае наложения изолирующего пленочного покрытия или при наличии обильного отделяемого проводили перевязки ежедневно. В среднем общая доза гепарина составила около 100 000 МЕ на 15 % поверхности тела в течение 5 дней. Та же доза использована при перевязке на 2-й день. Если перевязка проводилась на 3-й или 4-й день, доза гепарина была 75 %, а при повторной перевязке на 5-й день дозу снижали до 50 % от первоначальной, и в последующие дни гепарин локально больше не использовали. Участки глубокого дермального ожога вели под многослойными повязками с кремом сульфадиазина серебра. В случае с одномоментной с иссечением аутодермопластикой участков ран с пересаженными кожными аутотрансплантатами в обеих группах использовали описанный комплекс димексида с антикоагулянтом. Использование принципа «влажной камеры» предупреждает обезвоживание ран, лишенных эпидермиса, после вскрытия пузырей, тангенциального иссечения некроза. Возможно, самым объективным аргументом в пользу выбора патогенетически обоснованной общей и местной регидратации являются субъективные ощущения самого пациента.
Реже (у 9 обожженных — 15,7 %) в основной группе использовали окклюзирующие повязки с локальным отрицательным давлением (аппарат вакуумной терапии «Агат-Днепр») в течение 6 часов после дермабаразии или на участки проведенной декомпрессивной некротомии при отсутствии клиники ожогового шока. Динамика раневого отека достоверно сократилась у пациентов основной группы и составила в среднем 2,9 ± 0,7 суток, тогда как в группе сравнения — 5,4 ± 1,1 суток (p < 0,05). Проводимое лечение оказало позитивное влияние на подготовку ран к оперативному лечению глубоких ожогов и в какой-то мере на сокращение ожидаемой площади аутопластического закрытия ран в основной группе на 1,7 ± 0,6 % поверхности тела в сравнении с контрольной группой, где при аналогичном ожоговом поражении требовалось закрытие 3,6 ± 1,3 % поверхности тела. Однако однозначного вывода в пользу предотвращения конверсии ожога использованием VAC-терапии мы пока сделать не можем из-за ограниченного числа наблюдений.
У больных обеих групп к 5-м суткам наблюдалась динамика снижения уровня эндогенной интоксикации, причем достоверно отличаясь в основной группе от группы сравнения (p < 0,05), что свидетельствовало об эффективности выполнения раннего оперативного лечения и отсутствии прогрессирующей конверсии (табл. 1).
Обожженная кожа на ее частичную толщину, первично бледная в шоке (капиллярный стаз), после 24–72 часов после дермабразии под прозрачной пленкой, ксено- или аутотрансплантатом, принимала розовую окраску в результате восстановления капиллярной микроциркуляции. Большинство «пограничных» ожоговых ран ІІ степени в контрольной группе (65,5 % больных) нуждались в выполнения аутодермопластики, тогда как в основной группе она потребовалась меньше чем у половины (43,9 % больных).
Показатель СЗР при оценке течения раневого процесса как в целом, так и на этапе принятия решения о необходимости проведения свободной аутодермотрансплантации для закрытия ран в изучаемых группах также характеризовался статистически значимыми различиями (табл. 2).
Выводы
Прогрессирование ожога по глубине при «пограничном» поражении является сложной, но клинически важной проблемой, пути решения которой лежат в плоскости реализации воздействия на несколько потенциально основных механизмов патогенеза. Вероятно, на эффекты недостаточной перфузии тканей, активизации свободных радикалов и системных изменений в цитокинах ожоговых больных.
Предложены разные подходы и методы лечения для предотвращения прогрессирования ожогового некроза, но по-прежнему нет абсолютного метода, предотвращающего это явление.
Основой лечения «пограничных» ожоговых ран являются адекватная инфузионная терапия, нутритивная поддержка, местное лечение с акцентом на раннее оперативное очищение и закрытие ран современными биологическими и синтетическими покрытиями.
Список литературы
1. Алексеев А.А. Лечение поверхностных и пограничных ожоговых ран с применением современных раневых покрытий / А.А. Алексеев, А.Э. Бобровников, С.Н. Хунафин // Медицинский вестник Башкортостана. 2013. — Т. 8, № 3. — С. 25-30.
2. Singh V. The Pathogenesis of Burn Wound Conversion / V. Singh, L. Devgan, S. Bhat, S.M. Milner // Ann. Plast. Surg. — 2007. — 59. — Р. 109-115.
3. Фісталь Е.Я., Козинець Г.П., Самойленко Г.Є. та ін. Комбустіологія: Підручник. — К.: Інтерлінк, 2004. —184 с.
4. Мунтян С.О. Дослідження гемодинаміки в артеріях верхніх кінцівок у хворих з термічною травмою кисті / С.О. Мунтян, С.В. Слєсаренко, Н.М. Нор та ін. // Медицина транспорту України. — 2008. — № 3. — С. 35-38.
5. Оказание медицинской помощи пострадавшим с термической травмой в чрезвычайной ситуации: клинические рекомендации / Алексеев А.А., Крутиков М.Г., Бобровников А.Э. — М., 2015. — 26 с.
6. Попова Л.Н. Как изменяются границы вновь образующегося эпидермиса при заживлении ран: Автореф. дис... канд. мед. наук. — Воронеж, 1942. — 18 с. (Цит. по Измайлову С.Г. Новые технологии в комплексном лечении гнойных ран мягких тканей / С.Г. Измайлов, А.Ю.Жаринов, А.А. Ботяков // Кремлевская медицина. Клинический вестник. — 2009. — № 2. — С. 81-84.)

/27.jpg)
/28.jpg)
/29.jpg)