Статья опубликована на с. 5-9
Введение
Изучение рака гастроэзофагеальной зоны является одной из важнейших проблем современной онкологии, что объясняется запоздалой диагностикой заболеваний, анатомо-топографическими особенностями поражаемых опухолью органов и низкой результативностью существующих методов лечения [1, 2]. Гастральный (GC), гастроэзофагеальный (GEC) и эзофагеальный рак (EC) остаются одними из наиболее распространенных злокачественных новообразований [3]. В настоящее время GC занимает второе место в структуре онкологической смертности [4], а ЕС и GEC находятся на шестой позиции [5–7].
Сегодня в лечении опухолей данной локализации приоритет отдается комплексному лечению, включающему хирургический, лучевой и медикаментозный компоненты [8]. Поскольку эти заболевания зачастую диагностируются в крайне запущенных стадиях патологического процесса, системная химиотерапия является основой лечения у таких пациентов [3, 9, 10].
Цель и задачи работы: оценить эффективность использования отдельных химиотерапевтических средств у больных раком гастроэзофагеальной зоны (GC, GEC, ЕС) после проведенной хирургической операции по поводу опухоли, установить факторы, влияющие на результаты лечебных мероприятий, определить противопоказания к использованию препаратов.
Материал и методы
Под наблюдением находились 455 больных раком желудочно-пищеводной зоны (77 % мужчин и 23 % женщин), у которых в 63 % случаев диагностирован GC, в 27 % — GEC, в 10 % — EC. Возраст мужчин составил 61,10 ± 0,53 года, а женщин — 64,00 ± 0,74 года. Аденокарцинома отмечена в 76 % наблюдений, плоскоклеточный рак — в 13 %, перстневидноклеточный — в 7 %, недифференцированный — в 4 %. Соотношение частоты IA : IB : IIА : IIВ : IIIА : IIIВ : IV стадий опухолевого процесса — 1 : 1 : 8 : 22 : 33 : 37 : 48. Высокая степень дифференцировки опухоли обнаружена у 21 % от числа больных, умеренная — у 35 %, низкая — у 18 %, недифференцированная опухоль — у 9 %, невыясненная — у 17 %.
Метастазы выявлены в 24 % наблюдений рака желудочно-пищеводной зоны: при GC — в 22 % случаев, при GEC — в 18 % и при EC — в 48 %. Среди всех больных метастазы в печень установлены у 13 %, канцероматоз брюшины — у 5 %, метастазы в яичники — у 3 % от общего количества больных и у 13 % от числа женщин, в легкое — у 3 %, в плевру и надключичные вирховые лимфатические узлы — у 2 %, в кости, головной мозг и надпочечник — соответственно у 1 %. Помимо стадии опухоли (StT) и степени дифференцировки (DDT), определяли индекс тяжести опухолевого процесса (iWT) по формуле: iWT = T + N2 + (ΣM2), где Т — международный показатель распространенности первичной опухоли, N — международный показатель поражения лимфатических узлов, ΣМ — суммарная локализация отдаленных метастазов. Параметры DDT составили 1,460 ± 0,039 балла, iWT — 5,910 ± 0,263 о.е.
Для диагностики заболевания использовали методы рентгенографии, компьютерной или магнитно-резонансной томографии пищевода и желудка (аппараты Multix Compact, Siеmens, Германия; Somatom-Emotion-6, Siemens, Германия; Gyroscan Intera, Philips, Нидерланды), фиброэзофагогастроскопию (аппарат Olympus, GIF-Q20, Япония) и сонографию внутренних органов (аппарат Envisor, Philips, Нидерланды). С помощью иммуноферментного анализа (ридер PR2100-Sanofi Diagnostic Pasteur, Франция, наборы Immundiagnostik, Германия) изучали уровень в сыворотке крови сосудистого эндотелиального фактора роста (VEGF) — маркера опухолевого ангиогенеза. При этом обследовано 30 практически здоровых людей контрольной группы (17 мужчин и 13 женщин в возрасте 41,10 ± 6,14 года).
Среднюю дозу того или иного химиотерапевтического препарата (q) оценивали в 1 балл, q + SD (средняя доза + стандартное отклонение) — в 2 балла, q + 2SD — в 3 балла, q + 3SD — в 4 балла. Высчитывали интегральную дозу (Q, о.е.) на одного больного по формуле: Q = (а + 2b + 3c + 4d) : (a + b + c + d + e), где а, b, c, d — число больных соответственно с 1, 2, 3 и 4 баллами, e — число больных с отсутствием использованного лечебного средства.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (m) и отклонения (SD), коэффициенты корреляции (r), критерии дисперсии (D), Стьюдента (t), Уилкоксона — Рао (WR) и достоверность статистических показателей (p).
Результаты и обсуждение
Хирургическое лечение рака (гастрэктомия, резекции желудка и пищевода в разных модификациях с доступами по Гэрлоку и Льюису) было выполнено 78 % от числа обследованных больных с последующей адъювантной полихимиотерапией (в остальных случаях проведено изолированное медикаментозное и лучевое воздействие на опухоль). Продолжительность жизни умерших больных от начала лечения составила 11,8 ± 0,9 месяца (при GEC — 11,30 ± 1,35 месяца, при GC — 11,70 ± 1,49 месяца, при EC — 12,40 ± 1,99 месяца). На этот показатель оказывают влияние параметры StT (D = 4,02; p < 0,001) и iWT (D = 1,95; p = 0,048), с которыми также существуют обратные корреляционные связи (соответственно r = –0,305; p = 0,003 и r = –0,249; p = 0,016). Продолжительность жизни не зависит от изолированного применения медикаментозного лечения и химиотерапии в сочетании с лучевой. По данным многофакторного дисперсионного анализа Уилкоксона — Рао, на выживаемость больных оказывают высокодостоверное (p < 0,001) влияние морфологическая форма рака (WR = 5,75) и характер хирургического вмешательства (WR = 4,96).
/6.jpg)
Лечение 5-фторурацилом (5ФУ) (флуороурацилом) получали 44 % от числа больных, 20 % — цисплатином, 5 % — паклитакселом и этопозидом, 4 % — доксорубицином, 3 % — винкристином и циклофосфаном, 2 % — доцетакселом, гемцитабином (гемзаром, гемцибином), метотрексатом, эпирубицином (фарморубицином) и митомицином (митотаксом), 1 % — иринотеканом. Эти данные представлены на рисунке 1. Использовали от 1 до 5 препаратов у одного пациента (в среднем 2,50 ± 0,10), а мощность адъювантной химиотерапии составила 1,80 ± 0,10 о.е. Средняя доза лучевой терапии, в случае ее использования, составила 49,00 ± 4,32 Гр, а ее мощность — 1,60 ± 0,13 о.е.
Нужно подчеркнуть, что у 42 % больных, получавших химиотерапию, введение препаратов осуществлялось эндолимфально. Установлен несколько неожиданный факт, что способ введения химиотерапевтического препарата (внутривенный или эндолимфатический) не оказывал достоверного влияния на продолжительность жизни больных, как, впрочем, и мощность суммарной химиолучевой терапии на одного больного.
По данным литературы, в качестве средств адъювантной химиотерапии после хирургического лечения GC ведущая роль принадлежит цисплатину, 5-фторурацилу и эпирубицину [11]. В случаях EC рекомендуется схема, «цисплатин + 5-фторурацил + телегамматерапия» [12, 13]. Имеются данные по эффективности лечения рака желудочно-пищеводной зоны цисплатином + паклитакселом [14]. Предложено лечение ЕС по схеме «цисплатин + 5-фторурацил» с последующим подключением доцетаксела [15]. В целом особая позитивная значимость при гастроэзофагеальных злокачественных опухолях отводится цисплатину [16].
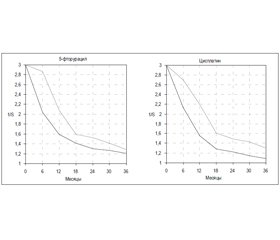
Мы проанализировали выживаемость больных на фоне двух наиболее часто используемых препаратов — 5-фторурацила (флуороурацила) и цисплатина (рис. 2), средние суммарные дозы которых на одного пациента составили 10,30 ± 0,59 г и 544,10 ± 114,98 мг. Первый препарат относится к группе антиметаболитов, структурных аналогов пиримидина, второй — алкилант, содержащий платину, который подавляет синтез дезоксирибонуклеиновой кислоты. 5ФУ и цисплатин повышают выживаемость пациентов в эти сроки, хотя достоверность результатов касается только цисплатина (D = 2,62; p = 0,001), увеличивающего трехлетнюю выживаемость на 15 %.
Таким образом, среди средств химиотерапии больных раком желудочно-пищеводной зоны препаратом выбора является цисплатин. Как известно, к побочным действиям цисплатина относятся острые нарушения функции почек и печени, ухудшение зрения и слуха. Мы таких осложнений у пациентов с GC, GEC и ЕС, у которых в схемах лечения использовался этот препарат, ни разу не наблюдали.
Прогностическим критерием эффективности адъювантной химиотерапии при раке гастроэзофагеальной зоны может быть показатель в крови неоангиоонкогенеза VEGF [5, 17], которому придается определенное значение как прогностическому маркеру выживаемости больных GC, GEC и ЕС [4, 18, 19]. По нашим данным, уровень VEGF в сыворотке здоровых людей составляет 89,80 ± 5,24 пг/мл, а усредненные исходные параметры у обследованных больных раком желудочно-пищеводной зоны — 108,40 ± 4,33 пг/мл (t = 2,64; p = 0,010), что > M + SD здоровых на 21 %.
По сравнению с больными GC при ЕС обнаружено достоверное повышение (на 22 %) показателя VEGF (t = 2,46; p = 0,017). Как демонстрирует дисперсионный анализ, содержание VEGF тесно связано с поражением антрального отдела желудка (D = 4,69; p < 0,001) и наличием метастазов в печень (D = 2,67; p = 0,011). Необходимо подчеркнуть, что исходный показатель VEGF прямо соотносится с параметрами StT (r = +0,366; p = 0,006) и существует обратная корреляция значений VEGF с продолжительностью жизни больных (r = –0,304; p = 0,023). С учетом полученных результатов исследования сделано заключение, имеющее практическую направленность: содержание в крови VEGF < 75 пг/мл (< M-SD больных) является прогнозпозитивным признаком дальнейшей эффективности лечения рака гастроэзофагеальной зоны.
Выводы
1. У больных раком гастроэзофагеальной зоны после оперативного лечения опухолевого процесса (хирургические вмешательства в объеме гастрэктомии, дистальной и проксимальной резекции желудка и резекции пищевода с доступами по Гэрлоку и Льюису) адъювантная химиотерапия повышает эффективность лечебных мероприятий.
2. Препаратом выбора при GC, GEC и ЕС является цисплатин, который хорошо переносится больными и существенно увеличивает трехлетнюю выживаемость больных.
3. Низкое содержание в крови ангиоонкомаркера VEGF является прогнозпозитивным признаком дальнейшей эффективности лечения рака желудочно-пищеводной зоны.
4. Представленные данные исследования позволят повысить эффективность лечения больных раком данной локализации, в частности качество послеоперационной (адъювантной) химиотерапии, разработать медицинскую технологию лечения пациентов с разным течением GC, GEC и ЕС.
Список литературы
1. Jang R. Multimodality approaches for the curative treatment of esophageal cancer / R. Jang, G. Darling, R.K. Wong // J. Natl. Compr. Canc. Netw. — 2015. — Vol. 13, № 2. — P. 229-238.
2. Olefson S. Obesity and related risk factors in gastric cardia adenocarcinoma / S. Olefson, S.F. Moss // Gastric. Cancer. — 2015. — Vol. 18, № 1. — P. 23-32.
3. Bilici A. Treatment options in patients with metastatic gastric cancer: current status and future perspectives / A. Bilici // World J. Gastroenterol. — 2014. — Vol. 20, № 14. — P. 3905-3915.
4. Aprile G. Angiogenic inhibitors in gastric cancers and gastroesophageal junction carcinomas: A critical insight / G. Aprile, E. Ongaro, M. Del Re [et al.] // Crit. Rev. Oncol. Hematol. — 2015. — Vol. 95, № 2. — P. 165-178.
5. Napier K.J. Esophageal cancer: A Review of epidemiology, pathogenesis, staging workup and treatment modalities / K.J. Napier, M. Scheerer, S. Misra // World J. Gastrointest. Oncol. — 2014. — Vol. 6, № 5. — P. 112-120.
6. Vidovic V. Unusual metastasis of esophageal cancer / V. Vidovic, I. Nikolic, J. Vukojevic [et al.] // Vojnosanit. Pregl. — 2014. — Vol. 71, № 10. — P. 975-977.
7. Domper Arnal M.J. Esophageal cancer: Risk factors, screening and endoscopic treatment in Western and Eastern countries / M.J. Domper Arnal, A. Ferrández Arenas, A. Lanas Arbeloa // World J. Gastroenterol. — 2015. — Vol. 21, № 26. — P. 7933-7943.
8. Wang L. Cord blood-derived cytokine-induced killer cellular therapy plus radiation therapy for esophageal cancer: a case report / L. Wang, S. Huang, Y. Dang [et al.] // Medicine. — 2014. — Vol. 93, № 28. — E. 340.
9. Cappellesso R. HER2 status in gastroesophageal cancer: a tissue microarray study of 1040 cases / R. Cappellesso, M. Fassan, E. Hanspeter [et al.] // Hum. Pathol. — 2015. — Vol. 46, № 5. — P. 665-672.
10. Roviello G. Angiogenesis inhibitors in gastric and gastro–esophageal junction cancer / G. Roviello, R. Petrioli, L. Marano [et al.] // Gastric Cancer. — 2015. — Vol. 22, № 6. — P. 134-139.
11. Leong T. TOPGEAR: a randomised phase III trial of perioperative ECF chemotherapy versus preoperative chemoradiation plus perioperative ECF chemotherapy for resectable gastric cancer (an international, intergroup trial of the AGITG/TROG/EORTC/NCIC CTG) / T. Leong, B.M. Smithers, M. Michael [et al.] // BMC Cancer. — 2015. — Vol. 21, № 15. — P. 532-542.
12. Nishimura Y. Clinical outcomes of radiotherapy for esophageal cancer between 2004 and 2008: the second survey of the Japanese radiation oncology study group (JROSG) / Y. Nishimura, K. Jingu, S. Itasaka [et al.] // Int. J. Clin. Oncol. — 2015. — Vol. 16, № 7. — P. 172-178.
13. Otowa Y. Successful treatment of quintuple primary cancer, including esophageal cancer: A case report / Y. Otowa, T. Nakamura, G. Takiguchi [et al.] // Oncol. Lett. — 2015. — Vol. 9, № 6. — P. 2583-2585.
14. Nabavizadeh N., Shukla R., Elliott D.A., Mitin T., Vaccaro G.M., Dolan J.P., Maggiore R.J. Preoperative carboplatin and paclitaxel-based chemoradiotherapy for esophageal carcinoma: results of a modified CROSS regimen utili–zing radiation doses greater than 41.4 Gy / N. Nabavizadeh, R. Shukla, D.A. Elliott [et al.] // Dis. Esophagus. — 2015. — Vol. 15, № 6. — P. 133-138.
15. Haba Y., Okamoto K., Watanabe T., Tsukada T., Kinoshita J., Makino I., Nakamura K., Oyama K., Ninomiya I., Fushida S., Fujimura T., Ohta T. A case of advanced esophageal cancer with direct bronchial invasion successfully treated by multidisciplinary therapy // Gan To Kagaku Ryoho. — 2014. — Vol. 41, № 12. — P. 2019-2020.
16. Katayanagi S. Evaluation of esophageal cancer treatment for patients aged over 80 years / S. Katayanagi, K. Iwasaki, T. Sumi [et al.] // Gan To Kagaku Ryoho. — 2014. — Vol. 41, № 12. — P. 2390-2302.
17. Kothari N. Current status of novel agents in advanced gastroesophageal adenocarcinoma / N. Kothari, K. Almhanna // J. Gastrointest. Oncol. — 2015. — Vol. 6, № 1. — P. 60-74.
18. Yang L.P. Expression of vascular endothelial growth factor C correlates with lymphatic vessel density and prognosis in human gastroesophageal junction carcinoma / L.P. Yang, L.C. Fu, H. Guo, L.X. Xie // Onkologie. — 2012. — Vol. 35, № 3. — P. 88-93.
19. Cheng J.C. High serum levels of vascular endothelial growth factor-A and transforming growth factor-β1 before neoadjuvant chemoradiotherapy predict poor outcomes in patients with esophageal squamous cell carcinoma receiving combined modality therapy / J.C. Cheng, M.S. Graber, F.M. Hsu [et al.] // Ann. Surg. Oncol. — 2014. — Vol. 21, № 7. — P. 2361-2368.

/6.jpg)
/7.jpg)